Opracowanie wyników:
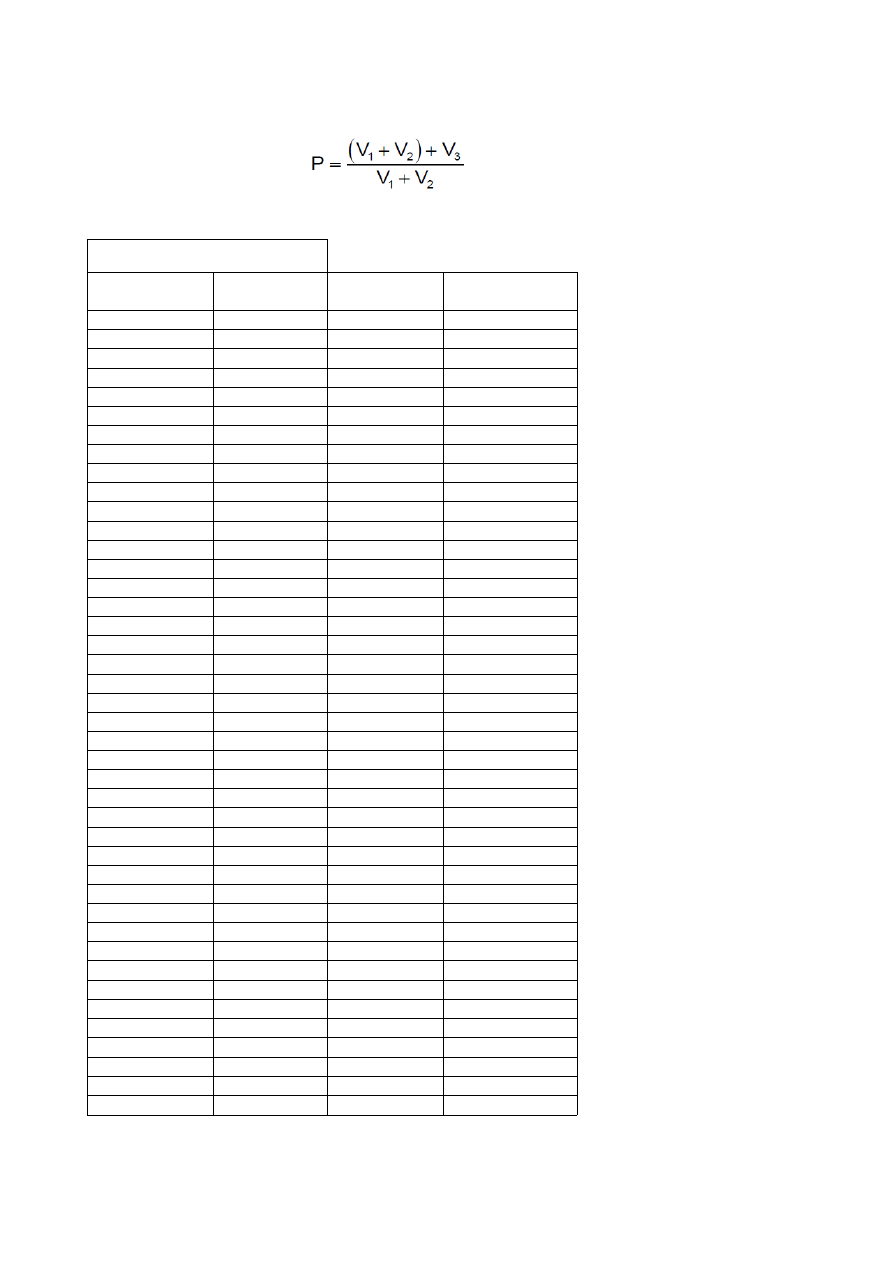
Obliczenie poprawki (P) dla każdej objętości dodanego titrant ze wzoru
V
1
= 20ml
V
2
= 80 ml
Kwas octowy + amoniak
Poprawka (P)
0,1
26,14
1,001
26,166
0,2
25,92
1,002
25,972
0,3
25,60
1,003
25,677
0,4
25,16
1,004
25,261
0,5
24,69
1,005
24,813
0,6
24,24
1,006
24,385
0,7
23,88
1,007
24,047
0,8
23,68
1,008
23,869
0,9
23,58
1,009
23,792
1,0
23,62
1,010
23,856
1,1
23,80
1,011
24,062
1,2
24,09
1,012
24,379
1,3
24,46
1,013
24,778
1,4
24,93
1,014
25,279
1,5
25,47
1,015
25,852
2,0
27,15
1,020
27,693
2,5
30,92
1,025
31,693
3,0
35,16
1,030
36,215
3,5
39,74
1,035
41,131
4,0
44,44
1,040
46,218
4,5
48,73
1,045
50,923
5,0
53,49
1,050
56,165
5,5
58,81
1,055
62,045
6,0
62,56
1,060
66,314
6,5
69,01
1,065
73,496
7,0
72,90
1,070
78,003
7,5
78,63
1,075
84,527
8,0
82,60
1,080
89,208
8,5
88,37
1,085
95,881
9,0
92,39
1,090
100,705
9,5
97,32
1,095
106,565
10,0
101,93
1,100
112,123
10,5
106,57
1,105
117,760
11,0
111,02
1,110
123,232
11,5
116,16
1,115
129,518
12,0
120,48
1,120
134,938
12,5
125,17
1,125
140,816
13,0
129,42
1,130
146,245
13,5
133,99
1,135
152,079
14,0
138,35
1,140
157,719
14,5
142,55
1,145
163,220
15,0
146,62
1,150
168,613
Objętość titranta
[ml]
Przewodnictwo
[μS/cm]
Przewodnictwo
·
P
[μS/cm]
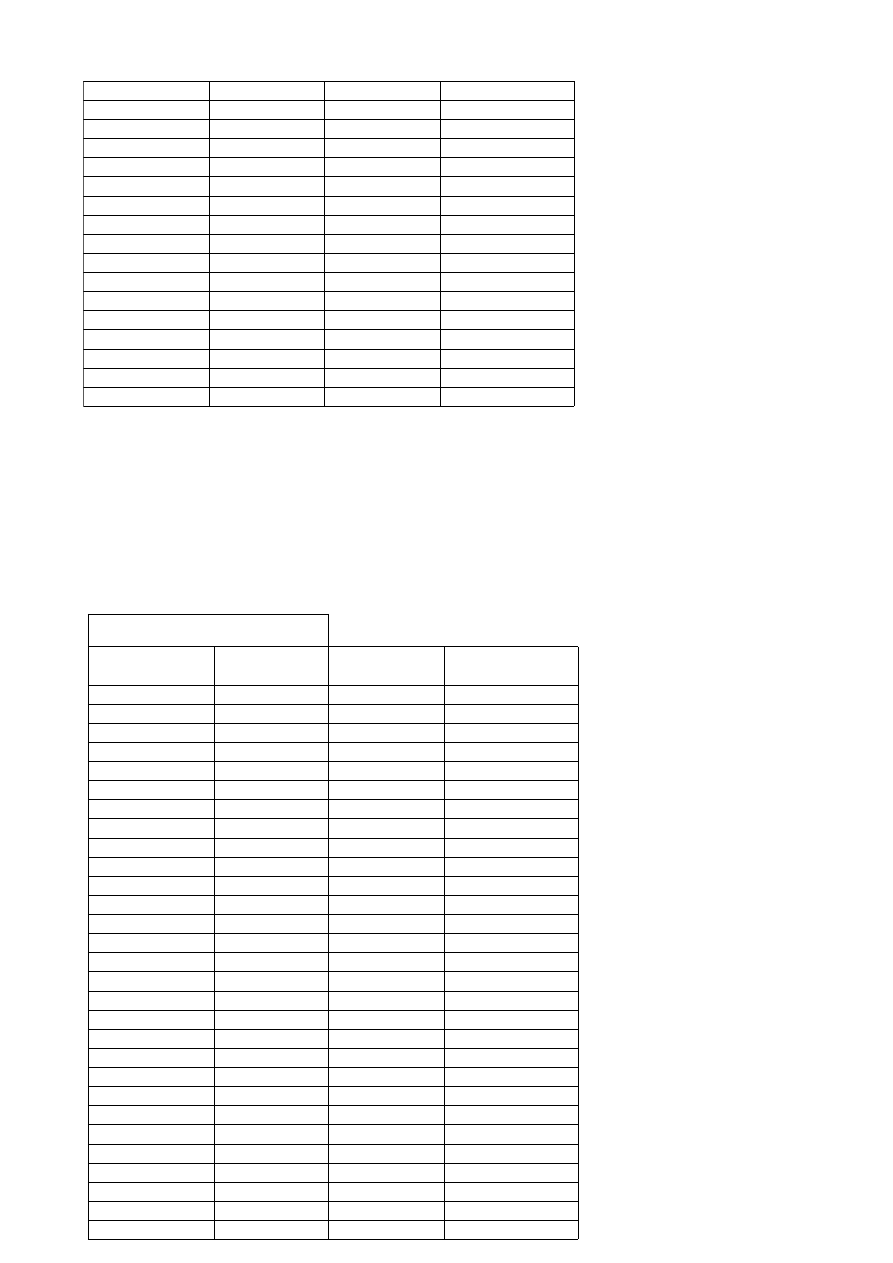
CH
3
COOH + NH
3
↔ CH
3
COO
-
+ NH
4
+
PK = 21,2 ml
M
CH3COOH
= 60 g/mol
C
CH3COOH
= 0,1M
V
CH3COOH
= 0,02 l
m
teoretyczna
= V
CH3COOH
* C
CH3COOH
* M
CH3COOH
= 0,1 * 0,02 *60 = 0,12g
m
rzeczywista
= PK * C
CH3COOH
* M
CH3COOH
=0,0212 * 0,1 * 60 = 0,1272g ≈ 0,12g
15,5
151,25
1,155
174,694
16,0
155,96
1,160
180,914
16,5
159,53
1,165
185,852
17,0
163,82
1,170
191,669
17,5
168,18
1,175
197,612
18,0
171,84
1,180
202,771
18,5
176,62
1,185
209,295
19,0
180,43
1,190
214,712
19,5
185,19
1,195
221,302
20,0
188,29
1,200
225,948
20,5
192,82
1,205
232,348
21,0
196,24
1,210
237,450
21,5
197,18
1,215
239,574
22,0
196,91
1,220
240,230
23,0
196,06
1,230
241,154
24,0
194,82
1,240
241,577
25,0
193,58
1,250
241,975
Kwas szczawiowy + amoniak
Poprawka (P)
0,0
662,0
1,000
662,000
0,5
637,7
1,005
640,889
1,0
608,7
1,010
614,787
1,5
584,5
1,015
593,268
2,0
564,5
1,020
575,790
2,5
535,5
1,025
548,888
3,0
510,8
1,030
526,124
3,5
485,6
1,035
502,596
4,0
463,9
1,040
482,456
4,5
440,1
1,045
459,905
5,0
419,4
1,050
440,370
5,5
395,1
1,055
416,831
6,0
377,5
1,060
400,150
6,5
354,1
1,065
377,117
7,0
332,8
1,070
356,096
7,5
315,3
1,075
338,948
8,0
295,2
1,080
318,816
8,5
282,5
1,085
306,513
9,0
269,5
1,090
293,755
9,5
259,3
1,095
283,934
10,0
255,8
1,100
281,380
10,5
256,8
1,105
283,764
11,0
261,6
1,110
290,376
11,5
269,1
1,115
300,047
12,0
277,5
1,120
310,800
12,5
288,6
1,125
324,675
13,0
298,2
1,130
336,966
13,5
310,3
1,135
352,191
14,0
320,0
1,140
364,800
Objętość titranta
[ml]
Przewodnictwo
[μS/cm]
Przewodnictwo
·
P
[μS/cm]

H
2
C
2
O
4
+ NH
3
↔ NH
4
+
+HC
2
O
4
-
HC
2
O
4
- + NH
3
↔ NH
4
+
+C
2
O
4
2-
n
całkowite
= n
H2C2O4
+n
HC2O4-
→
n
H2C2O4
= n
HC2O4-
C
H2C2O4
= 0,1 M
C
H2C2O4
= C
HC2O4-
V
całkowite
= 20 ml
PK
1
= 10,00 ml
PK
2
=19,60 – 10,00 = 9,60 ml
M
H2C2O4
= 78 g/mol
n
H2C2O4
= 1/2*V
całkowite
* C
H2C2O4
= 0,01 * 0,1 = 0,001mola
m
H2C2O4
= n
H2C2O4
* M
H2C2O4
=0,001 * 78 = 0,078g
m
rzeczywista
= PK
1
* M
H2C2O4
* C
H2C2O4
= 0,01*78 * 0,1 = 0,078g
M
HC2O4-
= 77 g/mol
n
HC2O4-
= C
H2C2O4
* 1/2*
Vcałkowite
= 0,1 * 0,01 = 0,001mola
m
HC2O4-
= n
HC2O4-
* M
HC2O4-
= 0,001 * 77 = 0,077g
m
rzeczywista
= PK
2
*M
HC2O4-
* C
H2C2O4
= 0,0096 * 77 * 0,1 = 0,0739 ≈ 0,074g
Pomiary konduktometryczne pozwalają dokładnie wyznaczyć punkt końcowy miareczkowania ze
względu na prawie liniowa zależność przewodnictwa właściwego od objętości titranta. Krzywa
miareczkowa składa się z przecinających się odcinków liniowych wyznaczając PK.
Kwas octowy jest słabym kwasem, a amoniak słaba zasada. Podczas miareczkowania początkowo
przewodnictwo spada, ponieważ kwas jest w pewnym stopniu zdysocjowany i następuje reakcja
zobojętniania, jony H
+
wiążą się z NH
3
. Jednocześnie w roztworze pojawiają się jony CH
3
COO
-
cofając dysocjacje słabego kwasu i przewodnictwo wzrasta. Od PK przewodnictwo spada w wyniku
wymiany jonów H
+
na NH
4
+
, po punkcie końcowym przewodnictwo roztworu pozostaje bez zmian
przez cofnięta dysocjacje amoniaku, przez obecne w roztworze jony amonowe.
NH
3
+ H
2
O ↔ NH
4
+
+ OH
-
CH
3
COO
-
+ H
+
+ NH
3
↔ NH
4
+
+ CH
3
COO
-
18,5
421,8
1,185
499,833
19,0
430,7
1,190
512,533
19,5
436,9
1,195
522,096
20,0
435,9
1,200
523,080
20,5
434,3
1,205
523,332
21,0
433,0
1,210
523,930
22,0
430,3
1,220
524,966
23,0
427,4
1,230
525,702
24,0
427,4
1,240
529,976
25,0
421,9
1,250
527,375
14,5
331,9
1,145
380,026
15,0
342,7
1,150
394,105
15,5
353,1
1,155
407,831
16,0
363,3
1,160
421,428
16,5
378,0
1,165
440,370
17,0
387,3
1,170
453,141
17,5
397,7
1,175
467,298
18,0
409,5
1,180
483,210

NH
4
+
+ H
2
O ↔ NH
3
+ H
3
O
+
Konduktometrycznie można także miareczkować kwasy dwu protonowe jak kwas szczawiowy,
który można traktować jako równomolową mieszaninę dwóch kwasów – mocnego i słabego, więc
miareczkowanie przebiega dwustopniowo. Do pierwszego punktu końcowego następuje dysocjacja
mocnego kwasu H
2
C
2
O
4
, przyłączenie protonu H
+
i powstanie jonów NH
4
+
. Drugi stopień
miareczkowania to proces zobojętniania HC
2
O
4
-
. Następuje wymiana pojedynczego jonu na dwa –
C
2
O
4
2-
i NH
4
+
- przewodnictwo rośnie. Po osiągnięciu drugiego punktu końcowego krzywa nie ulega
zmianie podobnie jak przy miareczkowaniu kwasu octowego, ponieważ następuje cofniecie
dysocjacji amoniaku przez jony NH
4
+
.
NH
3
+ H
2
O ↔ NH
4
+
+ OH
-
H
2
C
2
O
4
+ NH
3
↔ HC
2
O
4
-
+ NH4
+
HC
2
O
4
-
+ NH
3
↔ C
2
O
4
2-
+ NH
4
+
NH
4
+
+ H
2
O ↔ NH
3
+ H
3
O
+
Wyszukiwarka
Podobne podstrony:
sprawozdanie (20)
tabele, Labolatoria fizyka-sprawozdania, !!!LABORKI - sprawozdania, Lab, !!!LABORKI - sprawozdania,
M24 SPRAWOZDANIE, 20
Sprawozdanie 20, Laboratorium Podstaw Fizyki
Sprawozdanie 20, Budownictwo, Budownictwo - 2 rok, Budownictwo - 2 rok, 4 sem, Geodezja, Geodezja, G
EMAGNE1, Labolatoria fizyka-sprawozdania, !!!LABORKI - sprawozdania, Lab, !!!LABORKI - sprawozdania,
Sprawozdanie (20)
Sprawozdanie 20 a doc
Sprawozdanie 20
sprawozdanie 20 Damian
Sprawozdanie 20 c doc
20'', Politechnika Lubelska, Studia, semestr 5, Sem V, Sprawozdania, sprawozdania, Sprawozdania, Lab
Skalowanie termopary (20), Sprawolki
fizyczna 20, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
20. Oznaczanie zawartosci wody w cialach stalych i cieczach, materiały naukowe do szkół i na studia,
20, Jak ma wyglądać sprawozdanie.
więcej podobnych podstron