
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Marcin Januszewski
Posługiwanie się pojęciami z zakresu termodynamiki
314[03]O1.05
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr inż. Michał Sylwestrzak
mgr inż. Andrzej Zych
Opracowanie redakcyjne:
mgr inż. Marcin Januszewski
Konsultacja:
mgr inż. Andrzej Zych
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 314[03]O1.05
„Posługiwanie się pojęciami z zakresu termodynamiki”, zawartego w modułowym programie
nauczania dla zawodu technik mechanik okrętowy.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1.
Wprowadzenie
3
2.
Wymagania wstępne
5
3.
Cele kształcenia
6
4.
Materiał nauczania
7
4.1. Podstawy termodynamiki
7
4.1.1. Materiał nauczania
7
4.1.2. Pytania sprawdzające
16
4.1.3. Ćwiczenia
17
4.1.4. Sprawdzian postępów
18
4.2. Gazy doskonałe i rzeczywiste (pary)
19
4.2.1. Materiał nauczania
19
4.2.2. Pytania sprawdzające
25
4.2.3. Ćwiczenia
26
4.2.4. Sprawdzian postępów
27
4.3. II zasada termodynamiki. Obiegi termodynamiczne
28
4.3.1. Materiał nauczania
28
4.3.2. Pytania sprawdzające
34
4.3.3. Ćwiczenia
35
4.3.4. Sprawdzian postępów
36
4.4. Sprężarki, gazy wilgotne, silniki i procesy spalania
37
4.4.1. Materiał nauczania
37
4.4.2. Pytania sprawdzające
45
4.4.3. Ćwiczenia
45
4.4.4. Sprawdzian postępów
46
5.
Sprawdzian osiągnięć
47
6. Literatura
52

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Poradnik ten będzie Ci pomocny w przyswajaniu wiedzy związanej z posługiwaniem się
pojęciami z zakresu termodynamiki, a także w kształtowaniu umiejętności stosowania jej
w obsłudze silników okrętowych, siłowni okrętowych, maszyn i urządzeń okrętowych.
W poradniku zamieszczono:
−
wymagania wstępne, czyli wykaz umiejętności, jakie powinieneś mieć już ukształtowane,
aby bez problemów opanować treści nauczania w ramach jednostki modułowej
„Posługiwanie się pojęciami z zakresu termodynamiki”,
−
cele kształcenia, czyli wykaz umiejętności, jakie powinieneś nabyć podczas zajęć
w ramach tej jednostki modułowej,
−
materiał nauczania, czyli niezbędne minimum wiadomości teoretycznych, wymaganych
do opanowania treści jednostki modułowej,
−
zestaw pytań przydatnych do sprawdzenia, czy już opanowałeś wymagane treści
nauczania,
−
ćwiczenia, podczas których będziesz doskonalił umiejętności praktyczne w oparciu
o
wiedzę teoretyczną, zaczerpniętą z poradnika i innych źródeł,
−
sprawdzian osiągnięć, czyli przykładowy zestaw zadań i pytań. Pozytywny wynik
sprawdzianu potwierdzi, że dobrze wykorzystałeś zajęcia i uzyskałeś niezbędną wiedzę
i umiejętności z zakresu tej jednostki modułowej,
−
wykaz literatury uzupełniającej.
Poradnik zawiera materiał nauczania składający się z 4 rozdziałów:
−
Podstawy termodynamiki,
−
Gazy doskonałe i rzeczywiste (pary),
−
II zasada termodynamiki. Obiegi termodynamiczne,
−
Sprężarki, gazy wilgotne, silniki i procesy spalania.
Podczas wykonywania ćwiczeń korzystaj zarówno z niniejszego poradnika jak i innej
literatury dostępnej w szkole.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
Schemat układu jednostek modułowych
314[03]O1
Podstawy konstrukcji maszyn
314[03]O1.01
Stosowanie przepisów bezpieczeństwa
i higieny pracy oraz ochrony
środowiska
314[03]O1.02
Stosowanie materiałów
konstrukcyjnych oraz eksploatacyjnych
314[03]O1.05
Posługiwanie się pojęciami
z zakresu termodynamiki
314[03]O1.03
Konstruowanie elementów maszyn
314[03]O1.04
Wytwarzanie elementów maszyn

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej powinieneś umieć:
−
korzystać z różnych źródeł informacji,
−
stosować podstawowe zagadnienia z zakresu matematyki,
−
stosować podstawowe zagadnienia z zakresu fizyki,
−
stosować podstawowe zagadnienia zakresu chemii,
−
korzystać z dokumentacji technicznej urządzeń technicznych,
−
czytać i interpretować wykresy w układzie kartezjańskim,
−
organizować stanowisko pracy,
−
korzystać z różnych źródeł informacji,
−
wyszukiwać, selekcjonować i przetwarzać informacje potrzebne do wykonywania zadań,
−
planować działania,
−
pracować w zespole,
−
oceniać swoje postępy.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej powinieneś umieć:
−
posłużyć
się
podstawowymi
pojęciami
z
zakresu
termodynamiki
(układ
termodynamiczny, otoczenie, parametr, przemiana termodynamiczna, energia układu,
praca, ciepło, moc),
−
przeliczyć podstawowe jednostki wielkości fizycznych na jednostki układu SI,
−
zinterpretować
procesy
termodynamiczne
z
udziałem
gazów
doskonałych,
półdoskonałych i rzeczywistych,
−
scharakteryzować układ termodynamiczny,
−
określić parametry termodynamiczne,
−
zinterpretować prawa gazowe dla gazów doskonałych, półdoskonałych i mieszanin
gazów,
−
wyjaśnić zjawisko przejmowania, przenikania i przewodzenia ciepła,
−
wyjaśnić pojęcie pracy zewnętrznej, użytecznej i technicznej,
−
rozróżnić obiegi termodynamiczne,
−
wyjaśnić procesy spalania,
−
określić rodzaj spalania,
−
wyjaśnić na podstawie wykresów zasadę pracy sprężarek jedno- i wielostopniowych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. MATERIAŁ NAUCZANIA
4.1.
Podstawy termodynamiki
4.1.1. Materiał nauczania
Termodynamika to nauka, która zajmuje się zagadnieniami przemian energetycznych
w szczególności zjawiskami cieplnymi. Do niej należy nie tylko badanie, ale
i wyjaśnianie zjawisk, w których występują głównie ciepło i praca. Rozwój tej dziedziny
nauki opierał się na ilościowym i jakościowym badaniu zjawisk związanych z wydzielaniem
lub pochłanianiem ciepła.
Zjawiska te rozpatrywane w kontekście technicznym dotyczą termodynamiki technicznej.
W życiu codziennym rola termodynamiki technicznej jest ogromna, jej rozwój spowodował,
że ma ona wpływ zarówno na podstawowe wygody życia codziennego, jak i na projektowanie
pojazdów międzyplanetarnych. Dlatego niemożliwe jest, aby zagadnienia termodynamiki nie
były znane mechanikom okrętowym, którzy w swej pracy stykać się będą na co dzień ze
zjawiskami cieplnymi. Znajomość termodynamiki jest konieczna podczas obsługi silników
okrętowych, a także siłowni, maszyn czy innych urządzeń znajdujących się na statku
(grzejnych, chłodniczych).
Jednostki i miary
Cechę ciała lub zjawiska nazywa się wielkością o ile można ją wyznaczyć jakościowo
i ilościowo. Wartością tej wielkości jest iloczyn wartości liczbowej i jednostki miary – jest to
opis ilościowy konkretnego stanu danej wielkości. W rzeczywistości dla każdej wielkości
stosuje się wiele jednostek miar co może być przyczyną powstawania błędów. Aby tego
uniknąć, zgodnie z uchwałą Generalnej Konferencji Miar, został ustalony i zalecony do
stosowania międzynarodowy układ jednostek miar określany jako układ SI (franc. Système
International d'Unités). Opiera się on na siedmiu podstawowych jednostkach przedstawionych
w tabeli 1.
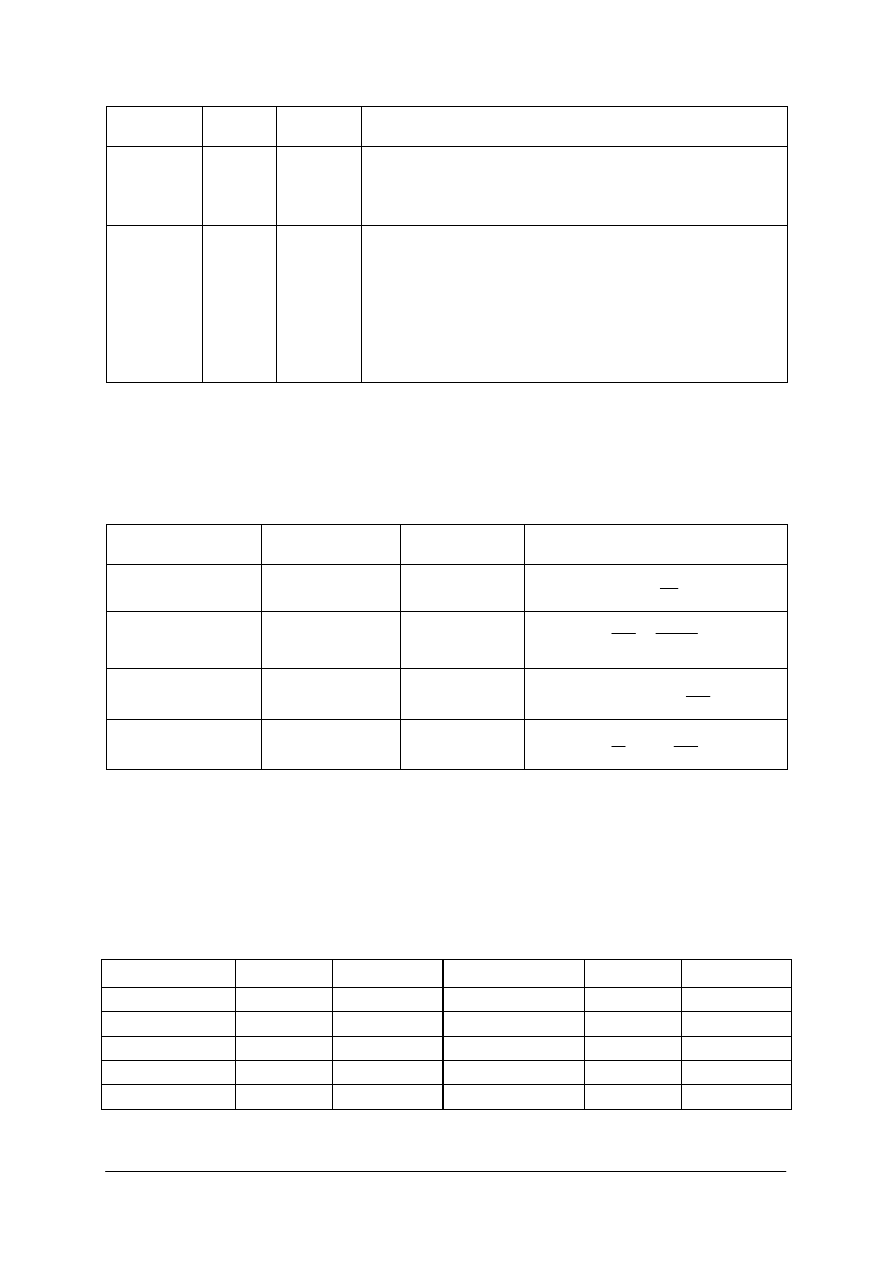
Tabela 1.
Podstawowe jednostki układu SI [9]
Jednostka
Nazwa
wielkości
fizycznej
Nazwa Oznaczenie
Definicja
Długość
metr
m
metr jest to droga, jaką światło przebywa w próżni w czasie
1/299792458 sekundy
Masa
kilogram
kg
kilogram jest to masa wzorca kilograma, wykonanego ze
stopu platyny (90%) z irydem (10%) w kształcie walca
o średnicy podstawy równej jego wysokości tj. 39 mm
Czas
sekunda
s
sekunda jest to czas równy 9192631770 okresów
promieniowania odpowiadającego przejściu między dwoma
nadsubtelnymi poziomami stanu podstawowego cezu
133
Cs
Prąd
elektryczny
amper
A
amper to natężenie prądu elektrycznego stałego, który płynąc
w dwóch równoległych, prostoliniowych, nieskończenie
długich przewodach o znikomo małym okrągłym przekroju,
znajdujących się w próżni w odległości 1 m od siebie;
powoduje powstanie między tymi przewodami siły równej
2x10
–7
N na każdy metr długości tych przewodów
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Temperatura
kelwin
K
kelwin jest to 1/273,16 część temperatury termodynamicznej
punktu potrójnego wody
Ilość
substancji
(liczność
materii)
mol
mol
mol jest to ilość substancji występująca wtedy, gdy liczba
cząsteczek jest równa liczbie atomów zawartych w masie
0,012 kg izotopu węgla
12
C, tj. 6,022169x10
23
cząstek
Światłość
kandela
cd
kandela to światłość, jaką ma w określonym kierunku
źródło
emitujące
promieniowanie
monochromatyczne
o częstotliwości 5,4x10
14
Hz i wydajności energetycznej
w tym kierunku równej 1/683 W/sr.
kandela to również światłość, jaką ma w kierunku
prostopadłym powierzchnia 1/600000m
2
ciała doskonale
czarnego w temperaturze krzepnięcia platyny pod ciśnieniem
101325 Pa
Zestawione jednostki są jednostkami podstawowymi, oprócz nich, stosuje się też
w
termodynamice
jednostki
pochodne,
spójne
z
jednostkami
podstawowymi
i uzupełniającymi – część z nich, niezbędna do dalszej lektury tego poradnika, przedstawiona
jest w tabeli 2.
Tabela 2.
Wybrane jednostki pochodne układu SI [9]
Nazwa wielkości
fizycznej
Nazwa
Oznaczenie
Jednostka wymiarowa
Siła
niuton
N
2
s
m
kg
⋅
Ciśnienie
paskal
Pa
2
2
s
m
kg
m
N
⋅
=
Praca, ciepło,
energia
dżul
J
2
2
s
m
kg
m
N
⋅
=
⋅
Moc
wat
W
3
2
s
m
kg
s
J
⋅
=
Korzystając ze wzorów w obliczeniach należy pamiętać, iż wszystkie równania muszą
spełniać podstawowy warunek tzn. prawidłowo napisane równanie charakteryzuje się tym,
że wymiary (miana) jego lewej jak i prawej strony są jednakowe.
Nazwy i symbole wielokrotnych i podwielokrotnych jednostek miar tworzy się dodając do
nazw i jednostek odpowiedni przedrostek bądź jego oznaczenie, np.
,
10
GW
1
9
=
co można zapisać jako 1000 MW.
Tabela 3.
Najważniejsze wielokrotności i podwielokrotności [3]
Przedrostek
Symbol
Mnożnik
Przedrostek
Symbol
Mnożnik
Decy
d
10
–1
Giga
G
10
9
Centy
c
10
–2
Mega
M
10
6
Mili
m
10
–3
Kilo
k
10
3
Mikro
µ
10
–6
Hekto
h
10
2
Nano
n
10
–9
Deka
da
10
1

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Przykład przeliczania jednostek:
Ciśnienie atmosferyczne mierzy się w milimetrach słupa rtęci [mmHg] Przelicz ciśnienie
wyrażone w tych jednostkach, np. 760 mmHg na paskale.
Rozwiązanie:
Ciśnienie hydrostatyczne (tj. ciśnienie panujące w cieczy będącej w spoczynku), jakie
wywiera słup cieczy o wysokości h i gęstości
,
ρ
wynosi
.
g
h
p
⋅
⋅
=
ρ
Zatem:
hPa
1013
Pa
10
1,013
m
N
10
1,013
s
m
9,8
m
kg
10
13,6
m
0,76
5
2
5
2
3
3
=
⋅
=
⋅
=
⋅
⋅
⋅
Ci
ś
nienie 760 mmHg to warto
ść
1 atmosfery fizycznej, nazywa si
ę
je tak
ż
e ci
ś
nieniem
normalnym.
Stany skupienia substancji – energia potrzebna do ich zmian
Tradycyjny podział wyró
ż
nia trzy stany skupienia: stały, ciekły i gazowy. Prawie
wszystkie substancje mog
ą
przechodzi
ć
z jednego stanu skupienia w inny. Rozró
ż
nia si
ę
przy
tym nast
ę
puj
ą
ce przej
ś
cia fazowe: ze stanu stałego w ciekły – topnienie, ze stanu ciekłego
w stały – krzepni
ę
cie, ze stanu ciekłego w gazowy – parowanie, ze stanu gazowego w ciekły –
skraplanie, ze stanu stałego w gazowy – sublimacja, ze stanu gazowego w stały –
resublimacja.
Topnienie
Punktem topnienia lub temperatur
ą
topnienia nazywamy stał
ą
temperatur
ę
, w której
odbywa si
ę
topnienie i krzepni
ę
cie substancji pod normalnym ci
ś
nieniem.
Ś
ci
ś
le okre
ś
lon
ą
temperatur
ę
topnienia maj
ą
ciała o budowie krystalicznej.
Kiedy ogrzejemy lód do temperatury 0°C to zacznie on stopniowo topi
ć
si
ę
. Tak
ż
e je
ż
eli
ochłodzimy wod
ę
i osi
ą
gnie ona temperatur
ę
0°C to ona zamarza. Dla temperatury 0°C
wyst
ę
puje wi
ę
c lód i woda. Rozró
ż
nia te stany energia wewn
ę
trzna substancji. By lód roztopił
si
ę
do postaci wody nie tylko wystarczy go ogrza
ć
do temperatury 0°C i nagle stanie si
ę
wod
ą
,
lecz kiedy osi
ą
gnie temperatur
ę
topnienia, nale
ż
y dostarczy
ć
mu odpowiedniej ilo
ś
ci energii
by si
ę
roztopił i otrzymujemy wod
ę
o temperaturze 0°C. Nale
ż
y pami
ę
ta
ć
,
ż
e woda i lód maj
ą
inne ciepło wła
ś
ciwe. Tak samo jest z innymi substancjami. Ka
ż
da substancja ma inne ciepło
wła
ś
ciwe w ró
ż
nych stanach skupienia.
Ilo
ść
ciepła Q pobierana przy topnieniu jest wprost proporcjonalna do masy m topionego
ciała i zale
ż
na od jego rodzaju:
m
c
Q
t
⋅
=
t
c
kg
J
– współczynnik proporcjonalno
ś
ci, zwany ciepłem topnienia – okre
ś
la ilo
ść
energii cieplnej niezb
ę
dnej do stopienia 1 kg danego materiału, uprzednio doprowadzonego
do temperatury topnienia.
Parowanie
Stał
ą
temperatur
ę
, w której odbywa si
ę
wrzenie cieczy pod normalnym ci
ś
nieniem
atmosferycznym, nazywamy temperatur
ą
lub punktem wrzenia. Kiedy wod
ę
ogrzejemy do
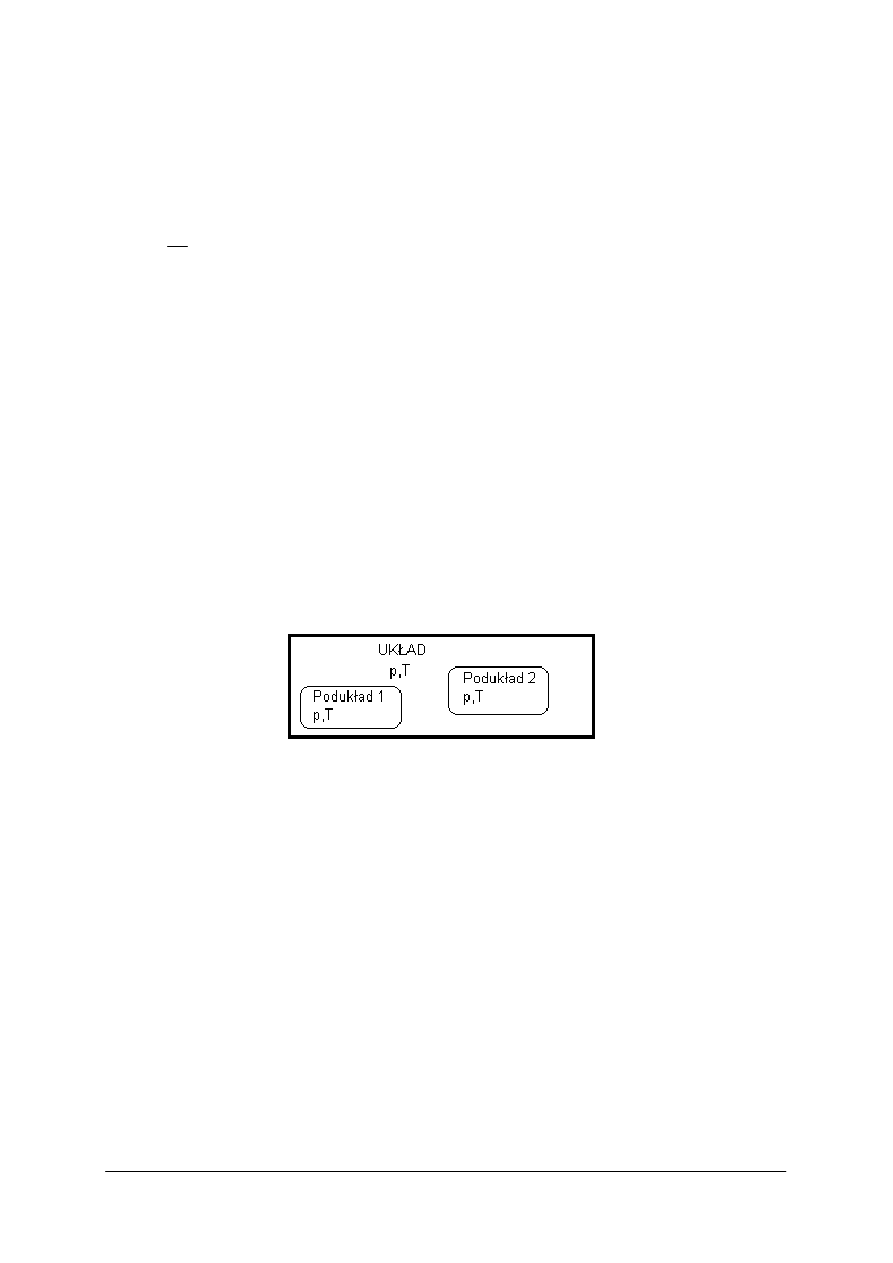
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
temperatury 100°C to przechodzi ona w stan pary. Podczas parowania zachodzi podobny
proces jak przy topnieniu.
Ilość ciepła Q potrzebna do odparowania cieczy znajdującej się w temperaturze wrzenia
jest wprost proporcjonalna do jej masy m, a ponadto jest zależna od rodzaju cieczy i ciśnienia:
m
c
Q
p
⋅
=
p
c
kg
J
– współczynnik proporcjonalności, zwany ciepłem parowania – określa ilość
energii cieplnej pobieranej przez 1 kg cieczy przy przejściu jej w parę.
Energia cieplna przechodzi zawsze z ciała cieplejszego do chłodniejszego. Zjawisko to
rozpatruje się w bilansie cieplnym.
Układ termodynamiczny
Układ termodynamiczny (system) – jest to dowolnie wybrana część fizycznego
wszechświata. Ta część przestrzeni materialnej jest przedmiotem określonego rozważania,
a ogranicza ją powierzchnia materialna bądź abstrakcyjna. Jeżeli przez powierzchnię
ograniczającą możliwy jest przepływ substancji materialnej, to układ taki nosi nazwę układu
otwartego. Natomiast w sytuacji, gdy wymiana masy z otoczeniem jest niemożliwa, to układ
jest układem zamkniętym. W układach izolowanych nie dochodzi do wymiany ani energii ani
masy. Typowe układy termodynamiczne to, np. wnętrze silnika, naczynie z gazem lub cieczą,
w którym zachodzi rozpatrywana w danej chwili przemiana.
Niekiedy układy termodynamiczne bywają bardziej skomplikowane i mogą składać się z kilku
podukładów (rysunek 1) albo mogą zawierać wewnętrzne ograniczenia.
Rys. 1.
Układ termodynamiczny składający się z dwóch podukładów:
p – ciśnienie, T – temperatura [2]
Ograniczenia układu – stanowią powierzchnie materialne lub abstrakcyjne (zwane
osłonami, ściankami). Przypisuje się im właściwości zależnie od rozważań jakie rozpatrywane
są w danym układzie. I tak ścianki mogą być:
−
nieprzepuszczalne – uniemożliwiają przepływ substancji materialnej,
−
półprzepuszczalne – pozwalają na przepływ jedynie określonego składnika,
−
diatermiczne – pozwalają na przepływ jedynie ciepła,
−
adiabatyczne – uniemożliwiają przepływ substancji i wymianę ciepła.
Otoczenie układu termodynamicznego – jest to pozostała część przestrzeni poza
wyodrębnionym układem, której zmiany powodują mierzalne zmiany w układzie
termodynamicznym. Mogą zatem występować w otoczeniu inne układy poza rozpatrywanym.
Parametr fizyczny układu – to każda obserwowalna wielkość charakterystyczna układu,
która nie wymaga jej znajomości zarówno przed, jak i po skończonej obserwacji, np. objętość,
ciśnienie, temperatura. Dlatego też wartość parametru fizycznego nie zależy od przemian
układu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
Parametr termodynamiczny układu – to parametr fizyczny układu, którego zmiana jest
istotna w określonym zjawisku termodynamicznym. Parametry mogą być:
−
intensywne – jeśli ich wartość nie zależy od ilości substancji ciała, np. temperatura lub
ciśnienie,
−
ekstensywne – jeśli ich wartość zależy od ilości substancji, np. energia lub objętość
układu. Parametry te w odniesieniu do jednostki ilości substancji stają się parametrami
intensywnymi, np. objętość właściwa.
Stan układu – to stan, określony w sposób jednoznaczny przez wartości wszystkich
parametrów termodynamicznych układu.
Proces termodynamiczny (przemiana) – to zjawisko stanowiące ciągłą zmianę stanów
układu między stanem początkowym i końcowym, czyli przejście między dwoma stanami
równowagi. W termodynamice rozważa się procesy odwracalne i nieodwracalne.
Równowaga termodynamiczna układu – to stan, który ustala się samorzutnie w czasie,
w układzie odizolowanym od oddziaływań zewnętrznych i pozostaje niezmienny, o ile nie
występują oddziaływania zewnętrzne. Oznacza to, że w stanie tym parametry układu nie
zależą od czasu. Podobnie do równowagi mechanicznej, równowaga termodynamiczna może
być trwała, obojętna, chwiejna lub metastabilna.
Zmiany stanu układu – pozwalają na pełny opis układu termodynamicznego. Poprzez
zmianę stanu rozumiemy przemianę, która spełnia trzy warunki:
−
pozostaje w zgodzie z ograniczeniami nałożonymi na układ,
−
nie narusza ogólnych praw fizyki, które powinny być spełnione,
−
nie jest ograniczona przez opory.
Zasada zachowania energii
W miarę wzrostu temperatury substancji wzrasta energia kinetyczna jej atomów lub
cząsteczek oraz zwiększa się jej objętość – zachodzi wzrost energii potencjalnej
oddziaływania atomów lub cząsteczek. Całkowitą energią, tj. sumą energii kinetycznych
i potencjalnych wszystkich atomów lub cząsteczek danej substancji nazywamy jej energią
wewnętrzną U. W termodynamice daną substancję, której energię wewnętrzną rozważamy,
nazywamy często układem termodynamicznym.
Zmiana energii wewnętrznej układu
U
∆
może nastąpić podczas dwóch różnych
procesów:
−
w wyniku wykonania określonej pracy W nad układem przez siły zewnętrzne,
−
w wyniku dostarczenia do układu ciepła Q.
W przypadku gdy układ wykonuje pracę lub oddaje ciepło do otoczenia, wielkości W i Q
są ujemne.
Przyrost energii wewnętrznej układu termodynamicznego w dowolnym procesie jest
równy sumie pracy wykonanej nad układem przez siły zewnętrzne i dostarczonego do układu
ciepła:
Q
W
U
+
=
∆
Podane prawo nazywa się I zasadą termodynamiki i wyraża zasadę zachowania energii
z uwzględnieniem jej przekazywania w formie pracy i ciepła.
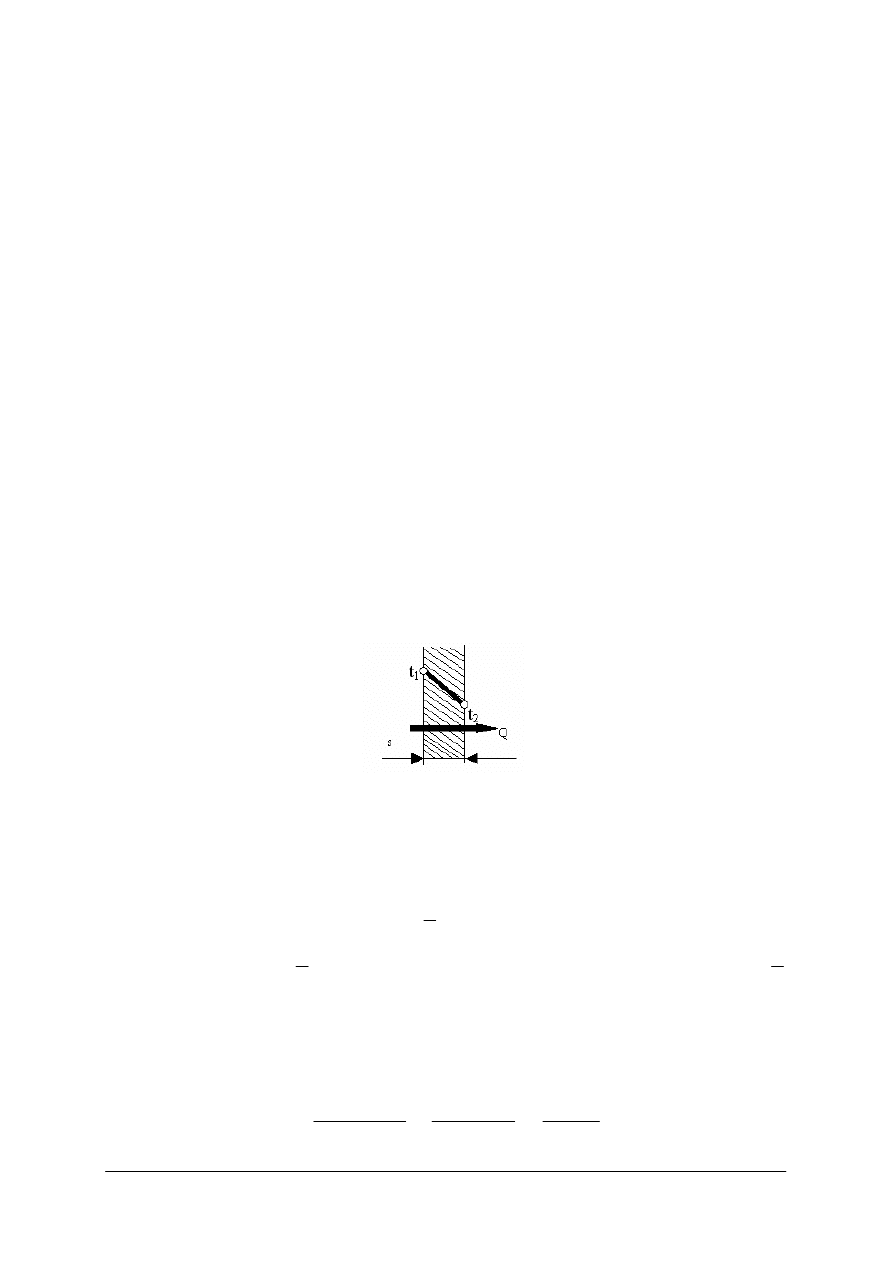
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
Wymiana ciepła
Wymiana ciepła to zjawisko występujące w przypadku istnienia różnicy temperatur
wewnątrz badanego układu lub między kilkoma wzajemnie na siebie oddziałującymi
układami. Dochodzi wówczas do wymiany energii – układ o temperaturze wyższej oddaje
energię układowi o temperaturze niższej.
Wymiana może odbywać się na kilka sposobów:
−
w wyniku zetknięcia się ze sobą co najmniej dwóch ciał o różnych temperaturach, i tu
występują dwa przypadki:
a)
wymiana ciepła zachodzi między stykającymi się ciałami: przejmowanie
i przenikanie ciepła,
b)
wymiana ciepła zachodzi w obrębie tego samego ciała, w którym istnieją różne
temperatury: przewodzenie lub konwekcja (unoszenie),
−
w wyniku zjawiska promieniowania, które polega na przemianie energii cieplnej danego
ciała na energię promienistą występującą pod postacią fal elektromagnetycznych, które po
zetknięciu z innym ciałem ponownie zamieniają się na energię cieplną.
Przewodzenie ciepła w obrębie tego samego ciała polega na przekazaniu energii
cząsteczek o większej energii kinetycznej cząsteczkom sąsiednim o mniejszej energii – bez
przesunięcia cząsteczek ciała. Przy czym cząsteczki o większej energii kinetycznej znajdują
się w tej części ciała, która ma wyższą temperaturę. Ten sposób wymiany ciepła zachodzi
w cieczach i gazach jednak na ogół ma on miejsce w ciałach stałych.
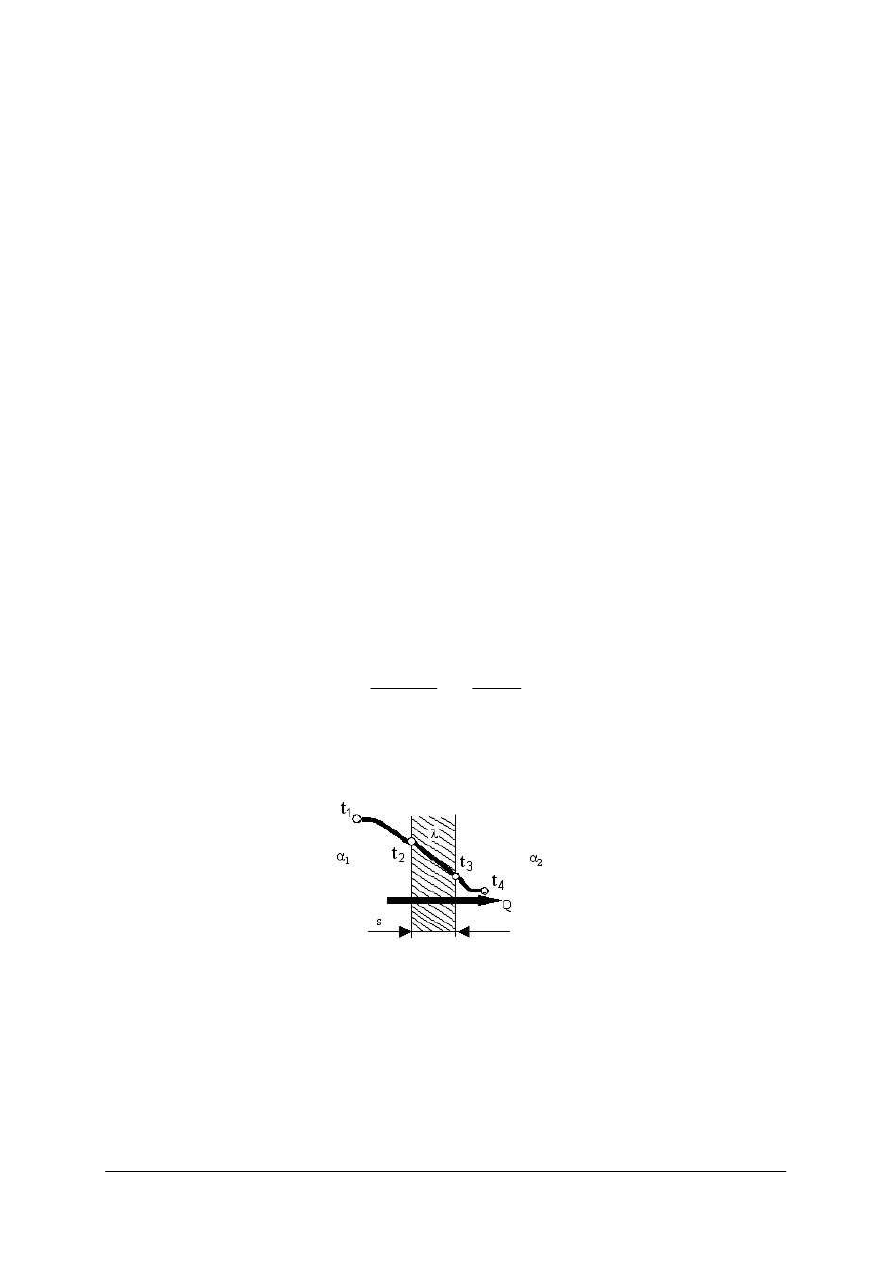
Na rysunku poniżej można zaobserwować przebieg zmian temperatury podczas
przepływu ciepła przez jednowarstwową ściankę płaską.
Rys. 2.
Przewodzenie ciepła przez jednowarstwową ściankę płaską [7]
Ilość przepływającego ciepła przez ściankę o grubości s jest wprost proporcjonalna do
różnicy temperatur t
1
–t
2
, czasu τ, powierzchni ścianki A, współczynnika przewodzenia ciepła
λ, a odwrotnie proporcjonalna do grubości ścianki. Przy czym t
1
i t
2
to temperatura na
powierzchniach zewnętrznych ścianki. Opisuje to prawo Fouriera:
τ
⋅
−
⋅
λ
=
)
(
2
1
t
t
A
s
Q
Przy czym współczynnik
s
λ
nazywamy przewodno
ś
ci
ą
ciepln
ą
ś
cianki, a jego odwrotno
ść
λ
s
oporem cieplnym
ś
cianki.
Po odpowiednim przekształceniu powy
ż
szego równania oraz zało
ż
eniu,
ż
e powierzchnia
ś
cianki
1
=
A
m
2
, ró
ż
nica temperatur (t
1
–t
2
) wynosi 1 K, czas
1
=
τ
h, a grubo
ść
ś
cianki
1
=
s
m, otrzymamy wzór na współczynnik przewodzenia ciepła
λ
, zale
ż
ny przede wszystkim
od temperatury ciała:
⋅
⋅
=
⋅
⋅
⋅
=
−
⋅
⋅
⋅
=
K
h
m
J
K
h
m
m
J
t
t
A
s
Q
1
1
1
1
1
1
)
(
2
2
1
τ
λ
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Przyjmując, że czas
1
=
τ
s, otrzymamy jednostk
ę
współczynnika przewodzenia ciepła
(przykładowe warto
ś
ci wybranych materiałów zawiera tabela 4):
⋅
=
⋅
⋅
K
m
W
K
s
m
J
Je
ż
eli
ś
cianka składa si
ę
z n warstw to ilo
ść
przewodzonego ciepła nale
ż
y wyliczy
ć
ze wzoru:
τ
λ
+
+
λ
+
λ
−
=
n
n
n
s
s
s
t
t
A
Q
...
2
2
1
1
1
Tabela 4.
Wartość współczynnika przewodzenia ciepła niektórych materiałów w temperaturze ok. 20°C [11]
Materiał
K
m
W
⋅
Materiał
K
m
W
⋅
Srebro czyste
419
Materiały ogniotrwałe w temp. 900°C
0,7÷1,5
Miedź czysta
395
Ziemia
0,5÷1,3
Aluminium
220
Węgiel kamienny
0,26
Duraluminium
165
Płyta korkowa
0,05
Stal węglowa
46÷58
Woda
0,6
śeliwo
40÷47
Oleje
0,12÷0,18
Nikiel techniczny
70
Powietrze 20°C
0,0256
Stal niklowa 20% Ni
90
Powietrze 300°C
0,0429
Mosiądz
80÷120
Para wodna przegrzana 300°C
0,0427
Beton
06, ÷1,4
H
2
20°C
0,196
Kamień kotłowy
0,08÷2,3
CO
2
0,0157
Najlepiej przewodz
ą
ciepło czyste metale, a najgorzej gazy. Dobre przewodniki
elektryczno
ś
ci s
ą
tak
ż
e dobrymi przewodnikami ciepła, znacznie gorzej ni
ż
czyste metale
przewodz
ą
ciepło ich stopy. Materiały szczególnie
ź
le przewodz
ą
ce ciepło nazywa si
ę
izolatorami cieplnymi lub materiałami izolacyjnymi.
Konwekcja
jest procesem unoszenia ciepła. Polega na tym,
ż
e b
ę
d
ą
cy w ruchu gaz lub
ciecz przekazuje ciepło zimniejszemu ciału stałemu lub przeciwnie – odbiera ciepło od ciała
stałego i unosi ze sob
ą
pozyskan
ą
tym sposobem energi
ę
. Konwekcja ma równie
ż
miejsce
wówczas, gdy wymiana ciepła zachodzi bez udziału ciała stałego tj. wtedy, gdy unoszenie
wyst
ę
puje jedynie przy udziale cieczy i gazu.
Przebieg tego zjawiska zachodzi tym szybciej im szybciej przemieszcza si
ę
płyn. Dlatego
te
ż
, stosuje si
ę
, np. odpowiednie mieszadła w zbiornikach, co wpływa na powstawanie wirów,
dzi
ę
ki którym mo
ż
na znacznie skróci
ć
czas ogrzewania lub chłodzenia czynnika. Poprzez
konwekcj
ę
ciepło znacznie szybciej przenosi si
ę
ni
ż
ma to miejsce podczas przewodzenia.
Przykładem konwekcji mo
ż
e by
ć
woda w kotle centralnego ogrzewania.
W zale
ż
no
ś
ci od przyczyn wywołuj
ą
cych ruch cz
ą
steczek cieczy wyró
ż
niamy konwekcj
ę
:
−
swobodn
ą
,
−
wymuszon
ą
.
Przy jednoczesnym wyst
ę
powaniu obu tych konwekcji, wpływ konwekcji swobodnej jest
tym mniejszy im wi
ę
ksza jest pr
ę
dko
ść
ruchu płynu, dlatego przy du
ż
ych pr
ę
dko
ś
ciach mo
ż
na
wpływ konwekcji swobodnej całkowicie pomin
ąć
.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Przejmowanie ciepła jest zjawiskiem polegającym na przechodzeniu ciepła od ścianki do
cieczy (gazu) do niej przylegającej będącej w ruchu lub odwrotnie. Do wymiany ciepła
dochodzi w sytuacji, gdy wzdłuż nieruchomej ścianki o pewnej temperaturze t
1
przepływa
płyn o innej temperaturze t
2
. Przy czym wyższą temperaturę może mieć ścianka lub czynnik
opływający ją – w zależności od temperatury ścianka będzie przejmować lub oddawać ciepło.
Ten sposób wymiany ciepła ma miejsce, np. w kotłach parowych, gdzie stanowi on jedynie
część bardziej ogólnego przypadku przechodzenia ciepła od jednego płynu, którym są gorące
spaliny do drugiego, który stanowi woda w rurkach. W tym przypadku wyższą temperaturę
mają spaliny, w związku z czym, to woda będzie przejmować ciepło.
Do wyznaczenia ilości ciepła Q jaka zostaje wymieniona (oddana lub przyjęta) między
dwoma ciałami w wyniku zjawiska przejmowania ciepła, należy posłużyć się wzorem
Newtona:
)
(
2
1
t
t
A
Q
−
⋅
⋅
⋅
=
τ
α
gdzie:
α – współczynnik przejmowanego ciepła,
A – powierzchnia ścianki przejmująca ciepło [m
2
],
τ – czas trwania wymiany ciepła [h],
(t
1
–t
2
) – uskok temperatury tj. różnica temperatur powierzchni ścianki i płynu [K]
Współczynnik przejmowania ciepła α określa ilość ciepła jaka przechodzi w ciągu jednostki
czasu od czynnika do 1 m
2
powierzchni ścianki przy różnicy temperatur między czynnikiem
a ścianką 1 K. Współczynnik ten nie zależy od materiału z jakiego została wykonana ścianka
tylko od właściwości fizycznych płynu stykającego się ze ścianką, od kształtu ścianki, stanu
jej powierzchni, a także od rodzaju i prędkości płynu, który znajduje się w ruchu. Jednostką
miary współczynnika przejmowania ciepła α jest:
⋅
=
⋅
⋅
K
m
W
K
s
m
J
2
2
Przenikanie ciepła jest zjawiskiem polegającym na przechodzeniu od jednego płynu do
drugiego przez rozdzielającą je ściankę. Łatwo więc zauważyć, że przenikanie ciepła zawiera
zjawisko przewodzenia i przejmowania ciepła omówione już wcześniej.
Rys. 3.
Przenikanie ciepła z dwóch różnych płynów poprzez dzielącą je ściankę [7]
Aby wyznaczyć ilość ciepła przenikającego z jednego płynu do drugiego poprzez
oddzielającą je ściankę należy podzielić proces przenikania na 3 etapy:
−
Q
1
przejmowanie ciepła przez ściankę od płynu o temperaturze t
1
,
−
Q
2
przewodzenie ciepła przez ściankę,
−
Q
3
przejmowanie ciepła przez płyn o temperaturze t
4
od ścianki.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
Korzystając z wcześniej poznanych wzorów:
)
(
);
(
);
(
4
3
2
3
3
2
2
2
1
1
1
t
t
A
Q
t
t
A
s
Q
t
t
A
Q
−
τ
⋅
⋅
α
=
−
τ
⋅
⋅
λ
=
−
τ
⋅
⋅
α
=
oraz przyjmuj
ą
c,
ż
e temperatury t
1,
t
2,
t
3 ,
t
4
s
ą
stałe to
3
2
1
Q
Q
Q
Q
=
=
=
.
Po przeprowadzeniu odpowiednich przekształce
ń
i uproszczeniu otrzymamy:
τ
α
+
λ
+
α
−
=
2
1
4
1
1
1
s
t
t
A
Q
lub
)
(
4
1
t
t
k
Q
−
τ
⋅
α
⋅
=
, gdzie
k
s
1
1
1
2
1
=
α
+
λ
+
α
Współczynnik k wyst
ę
puj
ą
cy we wzorze jest współczynnikiem przenikania ciepła i podobnie
jak w przypadku współczynnika przejmowania jego wymiar to
⋅
K
m
W
2
. Mo
ż
e si
ę
zdarzy
ć
,
ż
e ciepło b
ę
dzie przenikało przez n
ś
cianek (
ś
cianka wielowarstwowa), wówczas
współczynnik przenikania ciepła k nale
ż
y wyliczy
ć
ze wzoru:
∑
=
=
α
+
λ
+
α
=
n
i
i
i
i
s
k
1
2
1
1
1
1
Tabela 5.
Orientacyjne wartości współczynnika przenikania ciepła k [7]
Płyn
k
⋅
K
m
W
2
Powietrze
3÷100
Olej, smar
45÷700
Woda niewrząca
100÷12000
Woda wrząca
1000÷50000
Kondensująca para
5000÷130000
Promieniowanie
temperaturowe (cieplne)
to
wymiana ciepła dwóch ciał, polegaj
ą
ca na
wysyłaniu i pochłanianiu energii promienistej (od jednego ciała do drugiego) przez warstw
ę
przezroczystego
ś
rodowiska. Wyst
ę
puj
ą
tutaj dwa przekształcenia energii, mianowicie:
−
gdy pierwsze ciało wysyła na zewn
ą
trz swoje promienie trac
ą
c energi
ę
ciepln
ą
(jej cz
ęść
),
−
gdy drugie ciało otrzymuje energi
ę
promienist
ą
wysłan
ą
przez ciało pierwsze i dochodzi
do zamiany energii promienistej ponownie na energi
ę
ciepln
ą
.
Energia promienista wyst
ę
puje w postaci fal elektromagnetycznych, które rozchodz
ą
si
ę
w przestrzeni prostoliniowo we wszystkich kierunkach ze stał
ą
pr
ę
dko
ś
ci
ą
300000 km/s
w pró
ż
ni.
Podstawowym prawem dotycz
ą
cym promieniowania cieplnego jest prawo Prevosta, które
mówi,
ż
e wszystkie ciała stałe i ciekłe oraz niektóre gazy emituj
ą
(wysyłaj
ą
) energi
ę
promienist
ą
, przy czym zdolno
ść
emisji zale
ż
y od ich własno
ś
ci fizycznych i chemicznych,
od chropowato
ś
ci powierzchni i od temperatury.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
Gdy wiązka promieni emitowana przez jedno ciało pada na powierzchnię ciała drugiego
to część tych promieni zostaje pochłonięta, część przenika, a część zostaje odbita. I tak:
−
stosunek energii pochłoniętej przez ciało do całkowitej energii promienistej padającej na
powierzchnię tego ciała nosi nazwę współczynnika pochłaniania lub absorpcji,
−
stosunek energii odbitej od powierzchni ciała do całkowitej ilości energii nazywa się
współczynnikiem odbicia,
−
stosunek energii przepuszczonej przez ciało do całkowitej energii promienistej padającej
na powierzchnię tego ciała to współczynnik przepuszczania.
Jeżeli energia promienista jaka pada na powierzchnię ciała byłaby pochłonięta przez to
ciało całkowicie to ciało takie byłoby doskonale czarne, natomiast w sytuacji odwrotnej,
gdyby padająca na powierzchnię ciała energia została całkowicie od niej odbita, to
mielibyśmy do czynienia z ciałem doskonale białym. W sytuacji, gdy energia padająca na
ciało zostałaby całkowicie przepuszczona moglibyśmy mówić o ciele doskonale
przezroczystym.
Wymienniki ciepła są urządzeniami służącymi do wymiany energii cieplnej pomiędzy
dwoma płynami bez konieczności mieszania ich. Mogą mieć różną konstrukcję lecz zwykle
składają się z długiej rury wykonanej z tworzywa będącego dobrym przewodnikiem ciepła.
W celu powiększenia powierzchni wymiany ciepła wymiennik może być wyposażony
w ożebrowanie.
Ogólnie wymienniki ciepła możemy podzielić na bezpośrednie, w których czynnik
cieplejszy miesza się bezpośrednio z czynnikiem zimniejszym powodując jego podgrzanie
oraz na wymienniki pośrednie, w których czynniki wymieniające ciepło nie stykają się ze sobą
(wymienniki powierzchniowe, regeneratory).
Jeśli celem wymiennika ciepła jest schłodzenie płynu roboczego, nazywa się go
chłodnicą, jeśli zaś celem jest ogrzanie płynu roboczego to mówimy o nagrzewnicy.
W związku z koniecznością wymiany ciepła pomiędzy różnymi czynnikami na statku
znajduje się wiele urządzeń służących temu celowi. Spowodowane jest to stosowaniem
różnorodnych czynników, jak:
−
woda słodka i kotłowa,
−
woda morska (zaburtowa),
−
olej smarowy,
−
para wodna: mokra, przegrzana, nasycona,
−
paliwa lekkie i ciężkie,
−
spaliny z kotłów i silników spalinowych,
−
powietrze.
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jakie są podstawowe jednostki układu SI?
2.
Jakie inne jednostki pochodne układu SI stosuje się w termodynamice?
3.
Jakie rozróżniamy podstawowe stany skupienia substancji?
4.
Od czego zależy ilość ciepła pobierana podczas topnienia?
5.
Co to jest układ i podukład termodynamiczny?
6.
Jakimi parametrami charakteryzują się układy termodynamiczne?
7.
Jaka jest treść I zasady termodynamiki?
8.
Na czym polega wymiana ciepła?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
4.1.3. Ćwiczenia
Ćwiczenie 1
Oblicz jaką pracę wykona silnik spalinowy jeśli podniesie na wysokość 20 m kontener
o wadze 10 ton? Oblicz moc tego silnika, jeśli wykonałby tę pracę w ciągu 2 minut? Wartość
pracy oraz mocy wyraź w układach jednostek SI. (Przyspieszenie ziemskie wynosi 9,81 m/s
2
).
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
odszukać w tablicach matematyczno-fizycznych tabelę zawierającą układ jednostek miar
SI,
2)
odszukać w literaturze odpowiednie definicje i wzory na pracę i moc,
3)
dokonać obliczeń zgodnie z wymaganiami zawartymi w treści zadania,
4)
zapisać odpowiedź wyrażoną za pomocą jednostek układu SI.
Wyposażenie stanowiska pracy:
−
tablice matematyczno-fizyczne,
−
papier, przyrządy do pisania,
−
kalkulator.
Ćwiczenie 2
Oblicz ile dżuli ciepła przewodzi ściana płaska o wysokości 1 m, długości 5 m i grubości
45 cm w czasie 3 h. Powierzchnia cieplejsza tej ściany ma temperaturę 120
C
°
, zaś
temperatura zimniejszej strony jest o 80
C
°
niższa. Przyjmij, że współczynnik przewodzenia
ciepła materiału, z którego zbudowana jest ściana wynosi
.
1
⋅
=
K
m
W
λ
Sposób wykonania
ć
wiczenia
Aby wykona
ć
ć
wiczenie, powiniene
ś
:
1)
dokona
ć
oblicze
ń
zgodnie z wymaganiami zawartymi w tre
ś
ci zadania,
2)
zapisa
ć
odpowied
ź
wyra
ż
on
ą
w odpowiednich jednostkach,
3)
odszuka
ć
w tablicach termodynamicznych warto
ś
ci współczynnika przewodzenia ciepła
dla ró
ż
nych materiałów,
4)
wyja
ś
ni
ć
, które materiały s
ą
dobrymi przewodnikami i dlaczego,
5)
zastanowi
ć
si
ę
, jakie znaczenie ma dla oblicze
ń
rodzaj
ś
ciany (płaska, przegroda rurowa).
Wyposa
ż
enie stanowiska pracy:
−
tablice termodynamiczne,
−
papier, przyrz
ą
dy do pisania,
−
kalkulator.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
Ćwiczenie 3
Podaj przykłady układów termodynamicznych i określ ich najważniejsze parametry.
Zanim przystąpisz do ćwiczenia zapoznaj się z układami termodynamicznymi
zgromadzonymi w sali.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
zastanowić się co determinuje układ termodynamiczny,
2)
wymienić co najmniej dwa przykłady układów termodynamicznych – określić jakie są ich
ograniczenia – jakie jest otoczenie tych układów,
3)
omówić stan każdego układu – określić wartości parametrów termodynamicznych tych
układów (od czego zależą),
4)
wyjaśnić na czym polega zmiana stanu układu,
5)
wyszukać w sieci Internet informacji na temat silnika spalinowego, jako przykładu układu
termodynamicznego.
Wyposażenie stanowiska pracy:
−
przykładowe układy termodynamiczne, np. naczynie z cieczą lub gazem,
−
karty informacyjne opisujące prezentowane przez nauczyciela układy,
−
komputer klasy PC z dostępem do sieci Internet,
−
papier, przyrządy do pisania.
4.1.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
przeliczyć podstawowe jednostki wielkości fizycznych na jednostki
układu SI?
2)
omówić przejścia fazowe substancji z różnych stanów skupienia?
3)
omówić układ termodynamiczny i pojęcia z nim związane?
4)
omówić I zasadę termodynamiki?
5)
określić sposoby rozprzestrzeniania się ciepła?
6)
określić współczynnik przenikania ciepła?
7)
podać przykłady urządzeń służących do wymiany energii cieplnej?
8)
wymienić jakie czynniki biorą udział podczas wymiany ciepła na
statku?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
4.2.
Gazy doskonałe i rzeczywiste (pary)
4.2.1. Materiał nauczania
Gaz doskonały, gaz półdoskonały
Gaz doskonały – hipotetyczny gaz, którego drobiny nie przyciągają się wzajemnie,
są nieskończenie małe i sztywne (brak drgań wewnątrz drobin).
Gaz półdoskonały – różni się od doskonałego tym, że atomy w drobinach powiązane
są sprężyście, więc występują drgania wewnątrz drobin.
Związek pomiędzy trzema głównymi parametrami stanu: ciśnieniem, objętością
i temperaturą określa równanie stanu gazu doskonałego, które podał Clapeyron. Równania
te oparte są na prawach zmiany stanu gazów, wykrytych przez Gay-Lussaca, Boyle’a-
Mariotte’a oraz Charlesa, mianowicie:
−
zgodnie z prawem Boyle’a-Mariotte’a w stałej temperaturze, przy wszelkich zmianach
ciśnienia i objętości danej masy gazu, iloczyn ciśnienia i objętości jest wielkością stałą,
tzn.
const.
m
oraz
const.
T
przy
2
2
1
1
=
=
⋅
=
⋅
V
p
V
p
Wskaźnik 1 i 2 to stan początkowy
i końcowy gazu.
−
zgodnie z prawem Gay–Lussaca przy wszelkich zmianach stanu gazu pod stałym
ciśnieniem objętość danej masy gazu jest wprost proporcjonalna do jego temperatury
bezwzględnej:
2
1
2
1
T
T
V
V
=
, gdzie V
1
i T
1
oraz V
2
i T
2
to odpowiednio objętość i temperatura
gazu w stanie początkowym i końcowym.
−
zgodnie z prawem Charlesa, przy stałej objętości gazu stosunek ciśnienia i temperatury
danej masy gazu jest stały
=
T
p
const.
Równanie Clapeyrona tj. równanie stanu gazu doskonałego
Z połączenia tych praw, po dokonaniu odpowiednich przekształceń, otrzymujemy
zależność:
.
const
T
V
p
=
⋅
, a poniewa
ż
m
V
v
=
to mo
ż
na napisa
ć
R
const
T
v
p
=
=
⋅
.
, przy
czym masa gazu nie ulega zmianie.
Wielko
ść
R nazywa si
ę
indywidualn
ą
stał
ą
gazow
ą
– jest ona charakterystyczna dla danego
gazu i jest ró
ż
na dla ró
ż
nych gazów. Wyra
ż
amy j
ą
w
K
kg
J
⋅
.
Stała gazowa R oznacza prac
ę
wykonan
ą
przez 1kg gazu przy podwy
ż
szeniu jego temperatury
o jeden stopie
ń
przy stałym ci
ś
nieniu.
Równanie Clapeyrona mo
ż
na zapisa
ć
nast
ę
puj
ą
co:
T
R
v
p
⋅
=
⋅
. Je
ż
eli przyjmiemy,
ż
e masa gazu wynosi m to równanie przyjmie posta
ć
:
,
T
R
m
V
p
⋅
⋅
=
⋅
gdy
ż
.
V
m
v
=
⋅
Do gazu doskonałego stosuje si
ę
równie
ż
prawo Avogadra, które mówi,
ż
e je
ż
eli w kilku
zbiornikach o równych obj
ę
to
ś
ciach panuje jednakowe ci
ś
nienie i taka sama temperatura,
to w ka
ż
dym z tych zbiorników znajduje si
ę
taka sama ilo
ść
cz
ą
steczek gazu, pomimo,
ż
e w ka
ż
dym zbiorniku jest inny gaz.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
Ciepło właściwe
Ciepło właściwe zależy od rodzaju przemiany, dla gazów najbardziej istotne są dwa
rodzaje ciepła właściwego:
−
ciepło właściwe przy stałej objętości
dT
dq
c
v
v
=
,
−
ciepło właściwe przy stałym ciśnieniu
dT
dq
c
p
p
=
,
gdzie
p
v
dq
dq ,
oznaczaj
ą
ilo
ść
dostarczonego ciepła przy stałej obj
ę
to
ś
ci lub stałym ci
ś
nieniu,
natomiast dT oznacza odpowiadaj
ą
cy tej ilo
ś
ci ciepła przyrost temperatury ciała.
Ciepło wła
ś
ciwe c
v
i c
p
jest dla gazów doskonałych stałe i nie zale
ż
y od warto
ś
ci
parametrów termodynamicznych, zachodzi mi
ę
dzy nimi zale
ż
no
ść
:
R
c
c
v
p
=
−
Je
ś
li ciepło odniesiemy do 1 kilomola to zale
ż
no
ść
t
ą
mo
ż
na zapisa
ć
w postaci:
,
B
Mc
Mc
v
p
=
−
gdzie Mc
p
i Mc
v
s
ą
warto
ś
ciami ciepła wła
ś
ciwego odniesionymi do
1 kilomola, za
ś
B nazywa si
ę
stał
ą
gazow
ą
bezwzgl
ę
dn
ą
:
K
kmol
kJ
K
kmol
kcal
K
kmol
m
kG
B
⋅
=
⋅
=
⋅
⋅
=
3147
,
8
958
,
1
848
Energia wewnętrzna i entalpia
Energia wewn
ę
trzna gazu doskonałego i półdoskonałego zale
ż
y tylko od jego
temperatury, a nie zale
ż
y od jego ci
ś
nienia i obj
ę
to
ś
ci:
.
dT
c
dU
v
⋅
=
Dla gazu doskonałego ciepło wła
ś
ciwe c
v
jest stałe, dlatego wyra
ż
enie na dU mo
ż
na
scałkowa
ć
i otrzymamy
,
C
t
c
U
v
+
=
gdzie C oznacza warto
ść
energii wewn
ę
trznej gazu
w temperaturze
.
0 C
t
°
=
Je
ż
eli zało
ż
ymy,
ż
e energia wewn
ę
trzna gazu w temperaturze
C
°
0
wynosi zero, tzn. C=0, to energia wewn
ę
trzna gazu doskonałego mo
ż
e by
ć
wyra
ż
ona wzorem:
.
t
c
U
v
⋅
=
Dla gazu półdoskonałego c
v
trzeba zast
ą
pi
ć
ś
rednim ciepłem wła
ś
ciwym, i tak
t
c
U
v
⋅
=
Entalpia jest sum
ą
energii wewn
ę
trznej U układu oraz energii przetłaczania (równej
iloczynowi ci
ś
nienia bezwzgl
ę
dnego i obj
ę
to
ś
ci czynnika):
V
p
U
I
⋅
+
=
Entalpia gazu doskonałego wynosi
,
dT
c
di
p
⋅
=
co po scałkowaniu i zało
ż
eniu,
ż
e warto
ść
entalpii gazu w temperaturze
C
°
0
wynosi 0 daje
,
t
c
i
p
⋅
=
natomiast warto
ść
entalpii dla gazu
półdoskonałego ma posta
ć
.
t
c
i
p
⋅
=
Energia oraz entalpia gazu doskonałego jest jedynie funkcj
ą
temperatury, nie zale
ż
y od
ci
ś
nienia i obj
ę
to
ś
ci – wła
ś
ciwo
ść
ta nie jest słuszna dla gazów rzeczywistych.
Mieszaniny gazów
Mieszanin
ą
gazów jest, np. powietrze zawieraj
ą
ce wiele gazów jednorodnych b
ą
d
ź
te
ż
spaliny otrzymywane przy spalaniu paliw. Po dostatecznie długim czasie mieszanina jest
w stanie równowagi tzn. jej skład jest jednorodny w całej masie. Zachowanie mieszanin
gazów doskonałych opisuje prawo Daltona:
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
Każdy ze składników mieszaniny gazów doskonałych zachowuje się tak, jakby sam zajmował
całą objętość, i wywiera przy tym ciśnienie zwane ciśnieniem cząsteczkowym.
Całkowite ciśnienie mieszaniny gazów p
i
równe jest sumie ciśnień cząsteczkowych p:
∑
=
i
i
p
p
Skład roztworu gazowego (mieszaniny gazów) można określić za pomocą udziałów:
−
kilomolowych:
n
n
z
i
i
=
, gdzie z
i
– udział kilomolowy składnika i w roztworze; n
i
– liczba
kilomoli składnika i; n – liczba kilomoli całego roztworu,
−
kilogramowych:
m
m
g
i
i
=
, gdzie m
i
to liczba kilogramów składnika zaś m całego
roztworu,
−
objętościowych:
T
p
i
i
V
V
r
,
=
, gdzie V
i
oraz V to objętości składnika i całego roztworu,
natomiast ciśnienie p oraz temperatura T poszczególnych gazów jest jednakowa.
Należy zaznaczyć, że zagadnienie mieszaniny gazów jest obszernym tematem, dlatego
uczeń powinien skorzystać z fachowej literatury, by poszerzyć wiadomości w tym temacie.
Procesy termodynamiczne (przemiany)
Przemiany termodynamiczne dzieli się na:
−
otwarte – podczas których czynnik dopływa lub odpływa z urządzenia, np. cylindra,
ponieważ przynajmniej jeden z zaworów jest otwarty,
−
zamknięte – podczas których obydwa zawory są zamknięte i czynnik ani nie dopływa do
urządzenia ani z niego nie odpływa.
W zależności od sposobu doprowadzania lub odprowadzania ciepła można zrealizować
wiele przemian, jednak w technice szczególnie duże znaczenie i zastosowanie ma kilka
z nich:
−
przemiana izochoryczna, przebiega przy stałej objętości V=const.,
−
przemiana izobaryczna, przebiega pod stałym ciśnieniem p=const.,
−
przemiana izotermiczna, przebiega w stałej temperaturze T=const.,
−
przemiana adiabatyczna, przebiega bez wymiany ciepła,
−
przemiana politropowa, przebiega przy niezmiennej wartości ciepła właściwego.
Do badania przemian termodynamicznych stosuje się metodę graficzną, która polega na
sporządzaniu wykresów przedstawiających te zmiany. Najczęściej stosowanym układem jest
układ pracy zwany układem p–v. Oś pionowa wykresu zawiera podziałkę ciśnienia
bezwzględnego zaś oś pozioma podziałkę objętości. Podobnie jak gaz doskonały również para
wodna może podlegać wielu przemianom termodynamicznym, z tą różnicą, że w czasie tych
przemian może zmieniać swój stan skupienia. Przemiany pary wodnej omawia się na
wykresach p–v, T–s i i–s.
Wykresy p–v dla odwracalnych przemian gazów
−
Przemiana izochoryczna zachodzi przy stałej objętości
,
2
1
const
V
V
V
=
=
=
tylko T i p są
zmienne, gdyż masa czynnika
.
const
m
=
i stała gazowa
.
const
R
=
Na wykresie
(rys. 4) linia łą
cz
ą
ca punkt 1 z 2 to izochora, jej równanie ma posta
ć
.
const
V
=
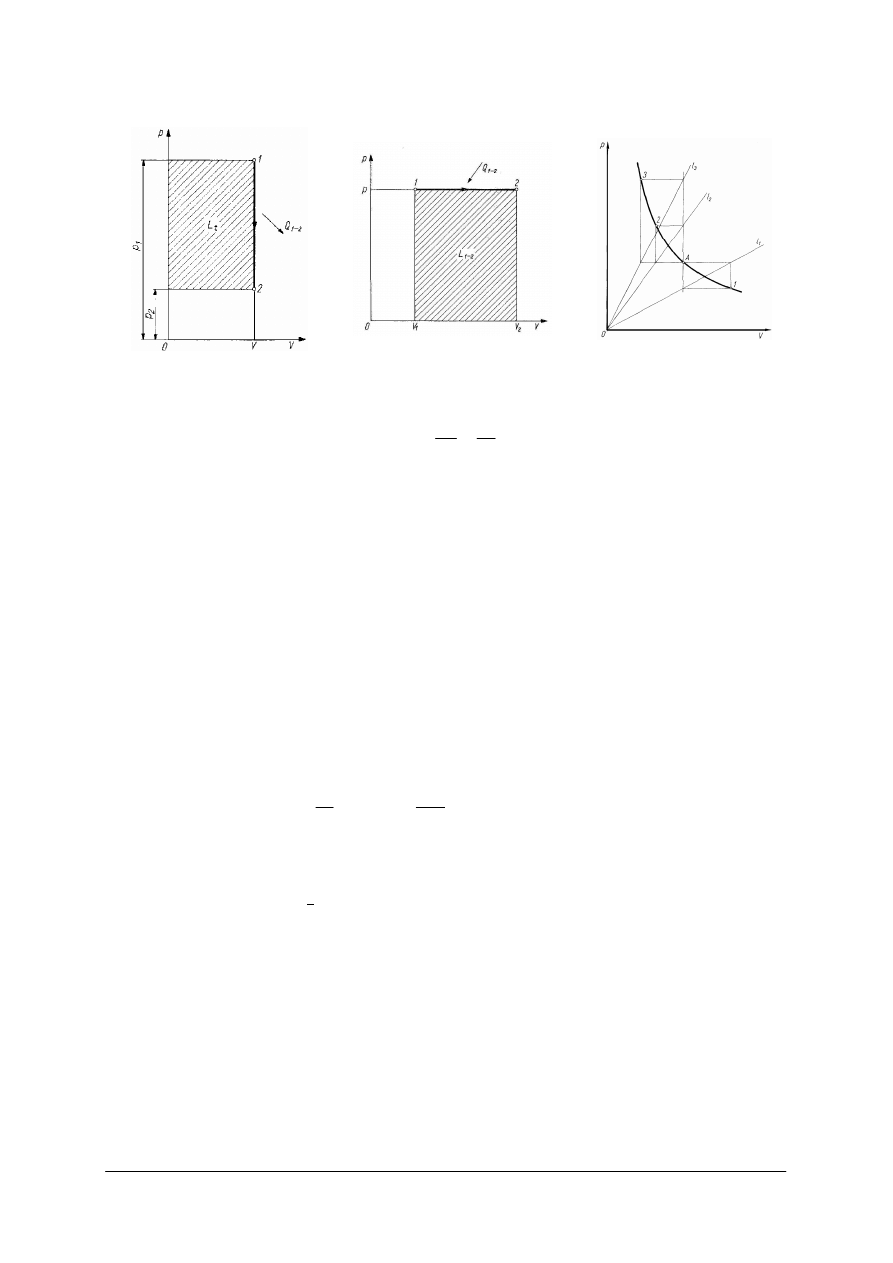
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
Rys. 4.
Przemiana izochoryczna [11] Rys. 5.
Przemiana izobaryczna [11] Rys. 6.
Przemiana izotermiczna [11]
Stosując dla dwóch dowolnych stanów równanie Clapeyrona
T
R
m
V
p
⋅
⋅
=
⋅
można uzyskać
matematyczną postać prawa Charlesa:
.
2
1
2
1
T
T
p
p
=
Podczas tej przemiany ci
ś
nienie
bezwzgl
ę
dne na pocz
ą
tku i na ko
ń
cu przemiany maj
ą
si
ę
tak do siebie jak temperatury
bezwzgl
ę
dne. Dla stałej obj
ę
to
ś
ci praca wykonana przez gaz wynosi zero:
.
0
2
1
=
−
L
Zatem równanie I zasady termodynamiki b
ę
dzie miało w tym przypadku posta
ć
:
.
1
2
2
1
U
U
U
Q
−
=
∆
=
−
Oznacza to,
ż
e całkowita ilo
ść
ciepła dostarczona czynnikowi podczas tej przemiany
wywołuje tylko zmian
ę
jego energii. Ten sam wzór dla gazów doskonałych b
ę
dzie miał
posta
ć
:
)
(
)
(
1
2
1
2
2
1
T
T
Mc
n
T
T
c
m
Q
v
v
−
⋅
⋅
=
−
⋅
⋅
=
−
Praca techniczna przemiany izochorycznej wynosi:
)
(
2
1
p
p
V
L
t
−
⋅
=
.
Przykład
Obliczy
ć
prac
ę
techniczn
ą
przemiany izochorycznej je
ś
li: w naczyniu o obj
ę
to
ś
ci 2m
3
znajduje si
ę
gaz doskonały i który został podgrzany izochorycznie do temperatury 607 C
°
.
Jego parametry pocz
ą
tkowe T
1
=2 C
°
, p
1
=0,3MPa.
Rozwi
ą
zanie:
Pa
T
T
p
p
960000
275
880
300000
2
1
1
2
=
⋅
=
⋅
=
(
)
(
)
J
p
p
V
L
t
660000
960000
300000
2
2
1
−
=
−
⋅
=
−
⋅
=
−
Przemiana izobaryczna to przemiana, podczas której ci
ś
nienie czynnika nie zmienia si
ę
p=const. Przemian
ę
t
ę
(rys. 5) przedstawia odcinek prostej równoległej do osi V.
W czasie tej przemiany zale
ż
no
ść
mi
ę
dzy obj
ę
to
ś
ci
ą
a temperatur
ą
okre
ś
la prawo Gay–
Lussaca.
Praca bezwzgl
ę
dna przemiany izobarycznej wynosi:
(
)
1
2
2
1
V
V
p
L
−
⋅
=
−
, natomiast praca
techniczna
.
0
=
t
L
Ilo
ść
ciepła jak
ą
nale
ż
y doprowadzi
ć
do gazu doskonałego podczas tej
przemiany obliczamy ze wzoru:
)
(
)
(
1
2
1
2
2
1
T
T
Mc
n
T
T
c
m
Q
p
p
−
⋅
⋅
=
−
⋅
⋅
=
−
.
−
Przemiana izotermiczna to przemiana, podczas której temperatura czynnika nie ulega
zmianie T=const. Przemian
ę
t
ę
(rys. 6) dla gazu doskonałego i półdoskonałego
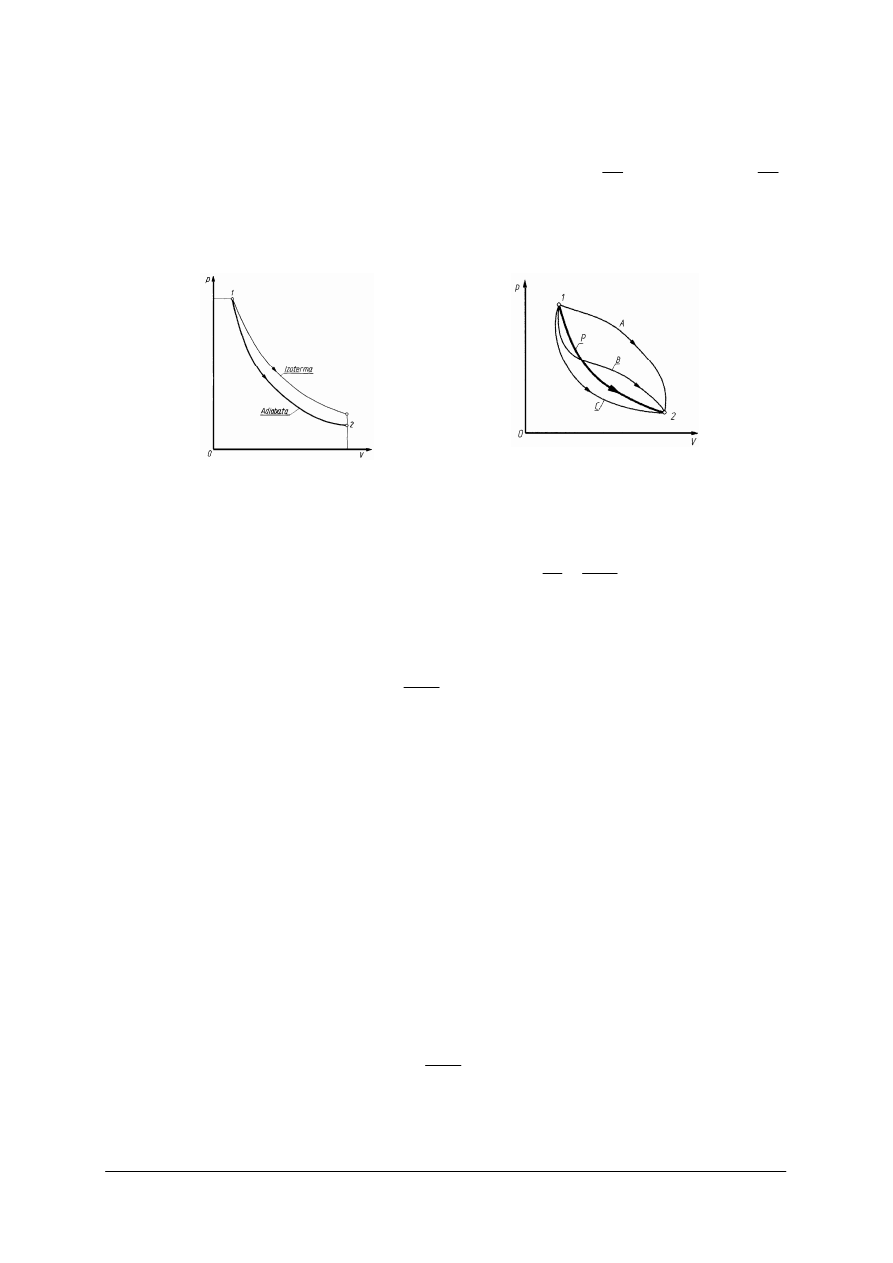
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
przedstawia odcinek hiperboli, gdzie asymptotami są osie układu p–v. Do opisu tej
przemiany stosuje się prawo Boyle’a i Mariotte’a.
Praca bezwzględna tej przemiany wynosi:
2
1
1
1
2
1
1
1
2
1
lg
303
,
2
ln
p
p
V
p
p
p
V
p
L
⋅
⋅
⋅
=
⋅
⋅
=
−
,
natomiast praca techniczna
2
1
−
=
L
L
t
. Ilo
ść
ciepła jak
ą
nale
ż
y doprowadzi
ć
do gazu
doskonałego lub półdoskonałego podczas tej przemiany obliczamy ze wzoru:
2
1
2
1
−
−
=
L
Q
.
Rys. 7.
Przemiana adiabatyczna [11]
Rys. 8.
Przemiana politropowa p [11]
−
Przemiana adiabatyczna to przemiana, podczas której nie wyst
ę
puje wymiana ciepła
.
0
2
1
=
−
Q
Zale
ż
no
ść
mi
ę
dzy ci
ś
nieniem i obj
ę
to
ś
ci
ą
czynnika w czasie tej przemiany
wyra
ż
a równanie Poissona
.
const
V
p
=
⋅
χ
, gdzie
v
p
v
p
Mc
Mc
c
c
=
=
χ
.
Przemian
ę
t
ę
(rys. 7) przedstawia hiperbola podobna do izotermy, lecz jest ona bardziej
stroma, a jej asymptotami s
ą
równie
ż
osie układu p–v.
Praca bezwzgl
ę
dna tej przemiany, po odpowiednich wyliczeniach wynosi:
(
)
2
2
1
1
2
1
1
1
V
p
V
p
L
⋅
−
⋅
⋅
−
χ
=
−
W czasie przemiany adiabatycznej czynnik termodynamiczny wykonuje prac
ę
jedynie
kosztem swojej energii wewn
ę
trznej. Charakterystyczn
ą
własno
ś
ci
ą
tej przemiany jest fakt,
ż
e
ciepło wła
ś
ciwe wynosi tutaj 0. Znajomo
ść
przemiany adiabatycznej pozwala na dokładne
zrozumienie zasady działania silników spalinowych.
−
Przemiana politropowa to przemiana, podczas której zale
ż
no
ść
mi
ę
dzy ci
ś
nieniem
bezwzgl
ę
dnym i obj
ę
to
ś
ci
ą
czynnika mo
ż
na wyrazi
ć
wzorem
.
const
V
p
=
⋅
υ
We wzorze
tym wykładnik politropy
υ
jest liczb
ą
stał
ą
dla danej przemiany. Omówione ju
ż
wcze
ś
niej
odwracalne przemiany gazów doskonałych s
ą
politropami o wykładnikach: adiabata
χ
υ
=
, izoterma
1
=
υ
, izobara
0
=
υ
, izochora
.
∞
=
υ
Poza wymienionymi warto
ś
ciami
wykładnik
υ
mo
ż
e mie
ć
jeszcze wiele innych warto
ś
ci, dlatego te
ż
istnieje du
ż
o przemian
politropowych o ró
ż
nych wykładnikach.
Znaj
ą
c poło
ż
enie dwóch punktów przemiany politropowej mo
ż
na narysowa
ć
w układzie
p–v lini
ę
przedstawiaj
ą
c
ą
t
ę
przemian
ę
(rys. 8):
Praca przy tej przemianie ma posta
ć
:
(
)
2
2
1
1
2
1
1
1
V
p
V
p
L
⋅
−
⋅
⋅
−
υ
=
−
.
Natomiast prac
ę
techniczn
ą
wyra
ż
a si
ę
wzorem:
2
1
−
⋅
υ
=
L
L
t
.
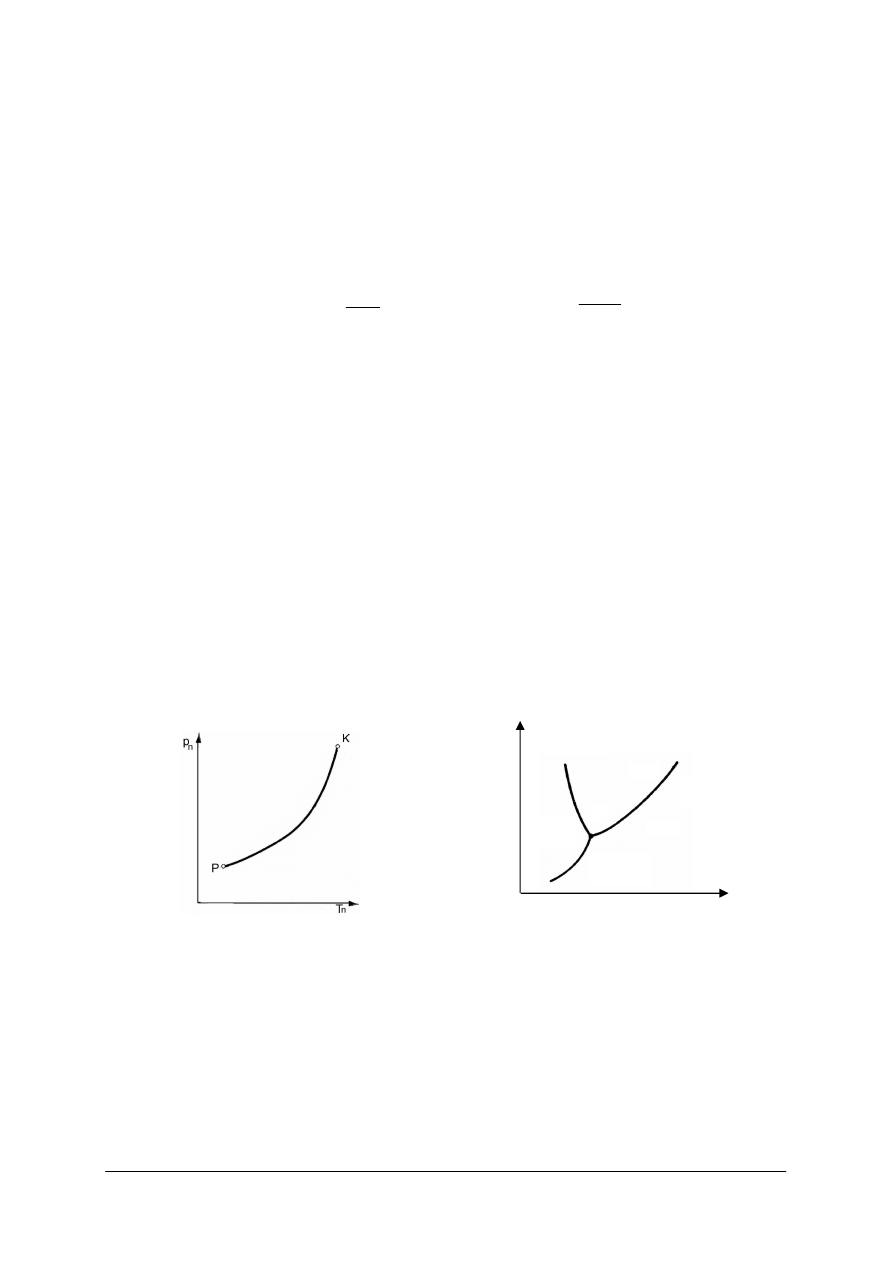
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
Ilość ciepła, jaką należy doprowadzić do czynnika podczas przemiany politropowej,
oblicza się przy użyciu jednego z dwóch wzorów:
)
(
1
2
2
1
T
T
c
m
Q
−
⋅
⋅
=
−
lub
)
(
1
2
2
1
T
T
Mc
n
Q
−
⋅
⋅
=
−
Podczas przemiany politropowej najczęściej ulega zmianie objętość i ciśnienie czynnika,
dlatego symbole c i Mc podane we wzorach oznaczają ciepło właściwe politropy – nie jest to
ciepło właściwe w stałej objętości ani też ciepło właściwe pod stałym ciśnieniem, a oblicza się
je ze wzoru:
1
−
υ
χ
−
υ
⋅
=
v
c
c
lub
1
−
−
⋅
=
υ
χ
υ
v
Mc
Mc
Mo
ż
na zatem zauwa
ż
y
ć
,
ż
e warto
ść
ciepła wła
ś
ciwego politropy zale
ż
y równie
ż
od jego
wykładnika.
Para (gaz rzeczywisty)
Para wodna to okre
ś
lony stan gazowy wody. Powstaje w wyniku parowania wody lub
sublimacji lodu. Podczas tego procesu cz
ą
steczka wody odrywa si
ę
od cieczy lub ciała stałego
i przechodzi do gazu.
Je
ś
li w naczyniu umie
ś
cimy czyst
ą
ciecz w postaci wody i zaczniemy j
ą
ogrzewa
ć
pod
stałym ci
ś
nieniem, to w pewnej temperaturze nast
ą
pi zjawisko zmiany stanu skupienia. Polega
ono na powstawaniu fazy gazowej w całej obj
ę
to
ś
ci cieczy (w postaci p
ę
cherzyków
parowych) i nazywa si
ę
je wrzeniem. Je
ś
li po osi
ą
gni
ę
ciu temperatury wrzenia naczynie
b
ę
dzie wci
ąż
podgrzewane to temperatura nie b
ę
dzie ju
ż
wzrasta
ć
, b
ę
dzie natomiast
powstawało coraz wi
ę
cej pary. Dopiero po odparowaniu całej cieczy doprowadzanie ciepła
spowoduje dalszy wzrost temperatury.
Znajduj
ą
ca si
ę
w naczyniu faza gazowa o temperaturze równej temperaturze wrzenia
w kontakcie z wrz
ą
c
ą
ciecz
ą
nazywa si
ę
par
ą
nasycon
ą
. Zatem para nasycona to para
w równowadze z ciecz
ą
, z której powstała – ma najwi
ę
ksze mo
ż
liwe dla danej temperatury
ci
ś
nienie i g
ę
sto
ść
.
Rys. 9.
Krzywa zależności ciśnienia nasycenia p
n
od
temperatury nasycenia T
n
[7]
Rys. 10.
Punkt potrójny w układzie p–t [7]
Na rys. 9 wida
ć
krzyw
ą
nasycenia przedstawion
ą
dla wody, która obrazuje przej
ś
cie ze
stanu ciekłego w stan lotny. Zaczyna si
ę
ona w punkcie P, który odpowiada stanowi
równowagi trwałej fazy ciekłej, stałej i gazowej. Jest to punkt potrójny. Krzywa ta ko
ń
czy si
ę
w punkcie krytycznym K, powy
ż
ej którego niemo
ż
liwe jest istnienie stanu ciekłego.
Je
ż
eli oddzielona para nasycona zostanie podgrzana powy
ż
ej temperatury nasycenia to stanie
si
ę
par
ą
przegrzan
ą
.
Przy temperaturach ni
ż
szych od tych, które wyst
ę
puj
ą
w punkcie P ciecz nie mo
ż
e istnie
ć
,
zachodzi tu sublimacja, czyli przej
ś
cie do stanu lotnego bezpo
ś
rednio ze stanu stałego.
krzywa
topnienia
ciecz
krzywa
wrzenia
P
para
ciało
stałe
krzywa
sublimacji
t
p
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
Zjawisko to podobne jest do zjawiska wrzenia, gdyż każdemu ciśnieniu odpowiada określona
temperatura sublimacji, a wykorzystuje się je, np. do przewożenia żywności „na suchy lód”.
Krzywa określająca zależność ciśnienia sublimacji od temperatury nazywa się krzywą
sublimacji (rys. 10).
Para mokra – składa się z pary nasyconej suchej i cieczy w punkcie pęcherzyków
o jednakowych temperaturach (temp. nasycenia). Parametry odnoszące się do cieczy
w punkcie pęcherzyków oznaczane będą pojedynczym apostrofem, zaś parametry pary
nasyconej suchej – podwójnym (np. v’’).
Stopień suchości x pary mokrej to stosunek masy m’’ pary nasyconej suchej zawartej
w parze mokrej, do całej masy m pary mokrej:
m
m
x
''
=
.
Natomiast jej objętość właściwa wynosi:
(
)
[
]
kg
m
v
v
x
v
v
x
/
'
'
'
'
3
−
⋅
+
=
Tablice termodynamiczne par
Kiedy obliczamy parametry par nasyconych czy przegrzanych musimy zna
ć
wiele danych,
jest to, np. temperatura nasycenia, ci
ś
nienie nasycenia, obj
ę
to
ś
ci wła
ś
ciwe wrz
ą
cej cieczy
i pary suchej nasyconej oraz wiele innych, zale
ż
nych od oblicze
ń
. Rozwi
ą
zywanie tych
zagadnie
ń
mo
ż
liwe jest przy wykorzystaniu równania stanu gazu rzeczywistego, jednak
wymaga to du
ż
ej dokładno
ś
ci i wielu czasochłonnych oblicze
ń
. Dlatego w praktyce obliczenia
te prowadzi si
ę
w oparciu o do
ś
wiadczalnie wyznaczone zwi
ą
zki mi
ę
dzy wspomnianymi
wcze
ś
niej parametrami. Znaj
ą
c warto
ś
ci tych parametrów mo
ż
na posługiwa
ć
si
ę
ogólnymi
zale
ż
no
ś
ciami termodynamicznymi. Dane do
ś
wiadczalne przedstawia si
ę
w postaci tablic,
wykresów i zale
ż
no
ś
ci aproksymacyjnych.
Tabela 6.
Wybrane parametry cieczy w punkcie pęcherzyków i pary nasyconej suchej dla H
2
O [11]
p
t
v’
v’’
i’
i’’
r
s’
s’’
u’
u’’
MPa
C
°
kg
m
3
kg
m
3
kg
kJ
kg
kJ
kg
kJ
K
kg
kJ
⋅
K
kg
kJ
⋅
kg
kJ
kg
kJ
1
2
3
4
5
6
7
8
9
10
11
0,0006108
0,01
0,0010002
206,3
0
2501
2501
0
9,1544
0
2375
0,012335
50
0,0010121
12,04
209,3
2592
2383
0,7038
8,0752
209,3
2445
0,015
54
0,0010140
10,02
226,1
2599
2373
0,7550
8,007
226,1
2449
0,015740
55
0,0010145
9,578
230,2
2600
2370
0,7679
7,9901
230,2
2499
0,10132
100
0,0010435
1,673
419,1
2676
2257
1,3071
7,3547
419,0
2508
1,5551
200
0,0011565 0,1272
852,4
2793
1941
2,2308
6,4318
850,6
2595
4.2.2. Pytania sprawdzające
Odpowiadaj
ą
c na pytania, sprawdzisz, czy jeste
ś
przygotowany do wykonania
ć
wicze
ń
.
1.
Czym s
ą
gazy doskonałe, półdoskonałe oraz mieszaniny gazów?
2.
W jaki sposób mo
ż
na okre
ś
li
ć
skład roztworu gazowego (mieszaniny gazów)?
3.
Jaka jest definicja pary wodnej?
4.
Jakie s
ą
sposoby obliczania parametrów termodynamicznych par?
5.
Jakie informacje (dane) zawieraj
ą
tablice termodynamiczne?
6.
Jakie s
ą
sposoby wymiany ciepła i pracy w termodynamice?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
4.2.3. Ćwiczenia
Ćwiczenie 1
Oblicz udziały objętościowe składników roztworu, który powstanie ze zmieszania gazów
z dwóch pojemników. W pierwszym o objętości V
1
=2 m
3
znajduje się azot o temperaturze
T
2
=480 K pod ciśnieniem p
1
=0,25 MPa. W drugim o objętości V
2
=4 m
3
znajduje się wodór
o temperaturze T
2
=300 K pod ciśnieniem p
2
=0,1 MPa.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
dokonać obliczeń zgodnie z wymaganiami zawartymi w treści zadania,
2)
obliczyć objętość, którą musiałby mieć zbiornik drugi, aby zawarty w nim wodór miał
takie samo ciśnienie i temperaturę co azot w pierwszym,
3)
skorzystać ze wzoru podanego w rozdziale 2 tego poradnika określającego objętościowy
udział składnika mieszaniny gazów,
4)
wyrazić wynik procentowo.
Wyposażenie stanowiska pracy:
−
tablice matematyczno-fizyczne zawierające równanie Clapeyrona lub niniejszy poradnik,
−
papier, przyrządy do pisania,
−
kalkulator.
Ćwiczenie 2
Odczytaj w tablicach parowych, ile wynosi ciśnienie w kotle, jeśli temperatura wrzącej
wody wynosi odpowiednio 10
C
°
, 25
C
°
, 50
C
°
, 100
C
°
, 200
C
°
i 300
C
°
. Powiedz jaki
wpływ ma wzrastająca temperatura na ciśnienie. Następnie odczytaj temperaturę wrzenia
wody pod ciśnieniem 0,005 MPa, 0,03 MPa, 0,1 MPa oraz 1,00 MPa.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
znaleźć w Internecie odpowiednie tablice termodynamiczne, które pozwolą na
bezpośredni odczyt szukanych parametrów lub skorzystać z tablic udostępnionych przez
nauczyciela,
2)
zapisać wynik w formie tabeli,
3)
zastanowić się czy istnieje inny sposób na rozwiązanie tego zadania, bez użycia tablic,
4)
uzasadnić odpowiedź zawartą pkt 3.
Wyposażenie stanowiska pracy:
−
tablice termodynamiczne parametrów cieczy w punkcie pęcherzyków i pary nasyconej
suchej dla H
2
O,
−
komputer klasy PC z dostępem do sieci Internet,
−
papier, przyrządy do pisania.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
Ćwiczenie 3
Wyszukaj w Internecie informacje na temat przebiegu wymiany ciepła poprzez
podgrzewanie i chłodzenie oraz wymiany pracy przez rozprężanie i sprężanie.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
wyszukać w Internecie informacje przedstawione w treści zadania, dotyczące wymiany
ciepła i pracy,
2)
zapisać i omówić na forum grupy poruszone zagadnienia,
3)
podać kilka przykładów wymiany ciepła przez podgrzewanie i chłodzenie,
4)
podać kilka przykładów wymiany pracy przez rozprężanie i sprężanie.
Wyposażenie stanowiska pracy:
−
komputer klasy PC z dostępem do sieci Internet,
−
papier, przyrządy do pisania.
4.2.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
omówić gazy doskonałe, półdoskonałe oraz mieszaniny gazów?
2)
zinterpretować
prawa
gazowe
dla
gazów
doskonałych,
półdoskonałych i mieszanin gazów?
3)
podać definicje entalpii i energii wewnętrznej?
4)
wyjaśnić czym jest punkt potrójny i punkt krytyczny?
5)
wyjaśnić na czym polega zjawisko sublimacji?
6)
zinterpretować procesy termodynamiczne z udziałem gazów
doskonałych?
7)
korzystać w sposób właściwy z tablic termodynamicznych?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
4.3.
II zasada termodynamiki. Obiegi termodynamiczne
4.3.1.
Materiał nauczania
Praca bezwzględna
W termodynamice wyróżniamy dwa sposoby zmiany zasobu energii: przez wymianę
pracy i wymianę ciepła.
Jeśli czynnik ulega rozprężaniu tzn. zwiększa się jego objętość, to wykonuje on pracę,
która może być oddana na zewnątrz. Natomiast w sytuacji odwrotnej, aby sprężyć czynnik,
czyli zmniejszyć jego objętość, trzeba doprowadzić do niego pracę z zewnątrz. Należy
zaznaczyć, że ta zewnętrzna praca mechaniczna, którą oddaje bądź pobiera czynnik jest jedną
z najważniejszych wielkości występujących w termodynamice technicznej.
Zależności jakie zachodzą między wartością wykonanej pracy a zmianami ciśnienia
i objętości czynnika w bardzo dokładny sposób opisuje układ: cylinder i poruszający się
wewnątrz niego bez tarcia tłok.
Jeśli przyjmiemy, że wewnątrz cylindra o przekroju A [m
2
] znajduje się m [kg] gazu
o objętości V [m
3
]
to siła, którą wywiera czynnik gazowy o ciśnieniu p [Pa] na tłok, jest
równoważona siłą zewnętrzną F [N] działającą na tłoczysko, a jej wartość wynosi:
]
[
2
2
N
A
p
m
m
N
A
p
F
⋅
=
⋅
⋅
=
Je
ś
li tłok przesunie si
ę
o odcinek
∆
s pod wpływem rozszerzaj
ą
cego si
ę
gazu, to zostanie
wykonana praca równa iloczynowi siły F i drogi tłoka
∆
s, a oznacza si
ę
j
ą
symbolem
∆
L.
Wyra
ż
amy j
ą
nast
ę
puj
ą
co:
]
[J
s
A
p
s
F
L
∆
⋅
⋅
=
∆
⋅
=
∆
lub
]
[J
V
p
L
∆
⋅
=
∆
, gdzie
s
A
V
∆
⋅
=
∆
oznacza przyrost obj
ę
to
ś
ci czynnika.
Praca techniczna
Parowe silniki tłokowe, turbiny parowe, pompy, spr
ęż
arki s
ą
maszynami przepływowymi,
których cech
ą
charakterystyczn
ą
jest to,
ż
e czynnik stale lub okresowo do nich dopływa
i w ten sam sposób z nich wypływa. Idealna maszyna przepływowa działa
w nast
ę
puj
ą
cy sposób (rys. 11):
Kiedy tłok jest w poło
ż
eniu A, otwiera si
ę
zawór dolotowy, przez który dopływa czynnik
o stałym ci
ś
nieniu p
1
. Przy poło
ż
eniu tłoka w punkcie 1 nast
ę
puje zamkni
ę
cie zaworu
dolotowego – od tej chwili nast
ę
puje rozpr
ęż
anie czynnika. Pod jego wpływem tłok przesuwa
si
ę
do punktu 2, w tym czasie czynnik nie dopływa do cylindra, dlatego rozszerzaniu si
ę
czynnika towarzyszy spadek jego ci
ś
nienia w cylindrze (krzywa 1–2 na rys. 11).
W punkcie 2 otwiera si
ę
zawór wylotowy, przez niego czynnik zostaje wypchni
ę
ty na
zewn
ą
trz, ruch tłoka trwa a
ż
do punktu B. W tym czasie ci
ś
nienie w cylindrze jest stałe
i wynosi p
2
. W czasie ruchu tłoka od punktu A do punktu 1 i od 1 do 2 obj
ę
to
ść
zajmowana
przez czynnik powi
ę
ksza si
ę
, wi
ę
c prace ich (dodatnie) wynosz
ą
odpowiednio:
1
1
V
p
L
A
⋅
=
−
oraz
.
2
1
2
1
∑
∆
⋅
=
−
V
V
V
p
L
W przypadku ruchu tłoka od punktu 2 do B obj
ę
to
ść
zajmowana przez czynnik maleje
tzn. wykonana praca ma warto
ść
ujemn
ą
i wynosi:
2
2
2
V
p
L
B
⋅
−
=
−
.
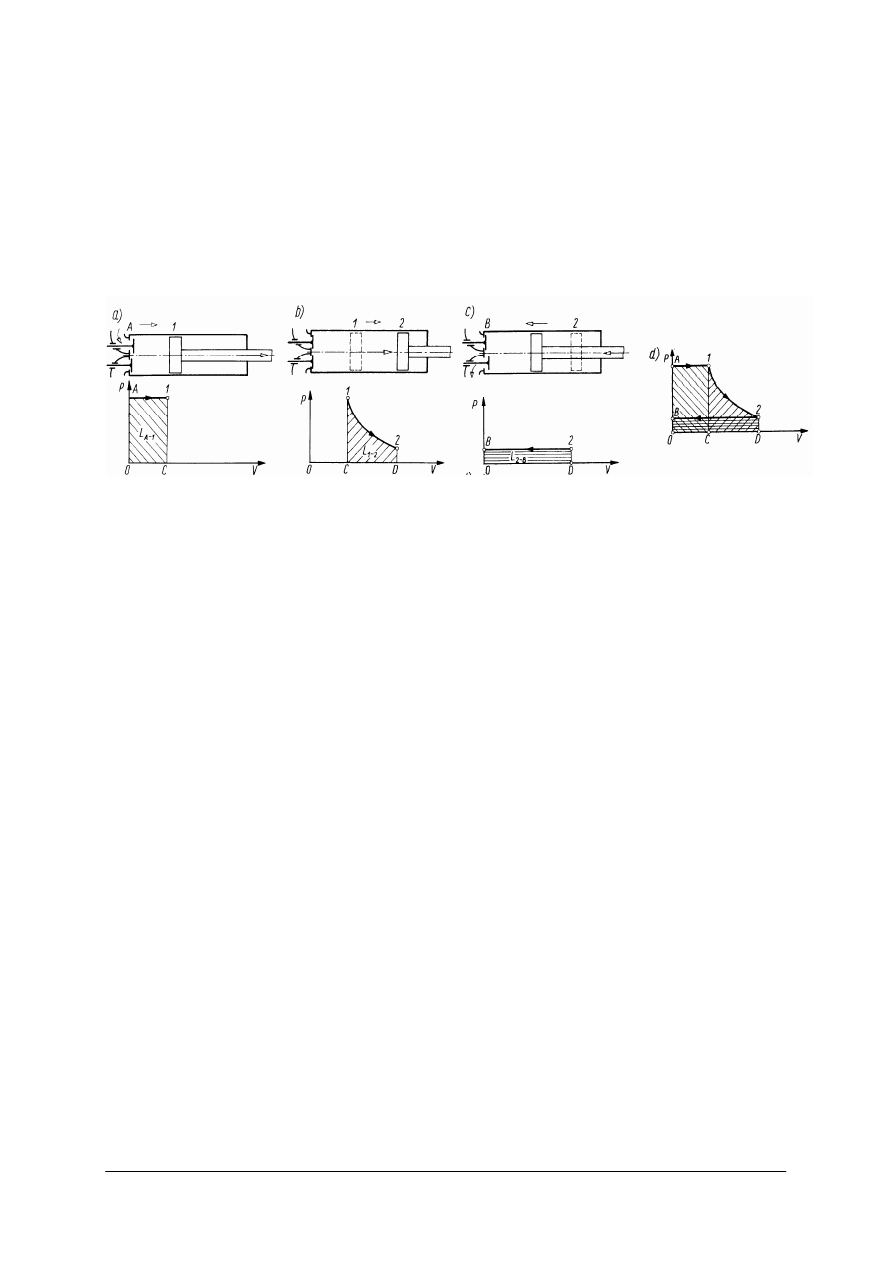
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
Praca techniczna jest więc sumą algebraiczną trzech prac bezwzględnych tj. pracy
napełniania, pracy rozprężania oraz pracy wydmuchu. Praca techniczna, którą wykonał
czynnik w idealnej maszynie przepływowej w czasie jednego cyklu pracy przedstawiona jest
polem (rys. 11):
A
B
A
B
D
B
C
D
A
C
A
L
F
L
L
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
=
−
+
2
1
0
2
1
2
1
0
1
Pomiędzy pracą techniczną a pracą bezwzględną zachodzi zależność:
2
2
2
1
1
1
V
p
L
V
p
L
t
⋅
−
+
⋅
=
−
Rys. 11.
Praca idealnego silnika przepływowego: a) napełnianie, b) ekspansja, c) wydmuch, d) praca jednego
cyklu [11]
II Zasada termodynamiki
Mogłoby się wydawać, że w każdym przypadku i bez żadnych ograniczeń istnieje
możliwość zamiany różnych rodzajów energii na jej inne rodzaje. Jednak na podstawie
doświadczeń widać, że tak nie jest. Można zamienić całkowicie energię mechaniczną za
pomocą tarcia w ciepło, ale uzyskanego ciepła nie da się już w całości zamienić z powrotem
w energię mechaniczną. Badania procesów przetwarzania energii doprowadziły do ustalenia II
zasady termodynamiki. Określa ona warunki, dla których to przetwarzanie jest w ogóle
możliwe.
Druga zasada termodynamiki mówi, że warunkiem koniecznym do zamiany ciepła na
pracę mechaniczną jest istnienie co najmniej dwóch źródeł ciepła o różnych temperaturach.
Według tej zasady nie można zbudować silnika, który pracowałby tylko z jednym źródłem
ciepła. Wyniki obserwacji i badań nad możliwością przechodzenia energii z jednej postaci
w inne, zebrano w kilka sformułowań noszących nazwę słownych definicji drugiej zasady
termodynamiki, wszystkie są równorzędne:
−
ciepło nie może samorzutnie przejść od ciała o temperaturze niższej do ciała
o temperaturze wyższej,
−
tarcie jest przemianą nieodwracalną,
−
niemożliwe jest konstruowanie perpetuum mobile II rodzaju (silnika pobierającego ciepło
z jednego źródła o stałej temperaturze, który w całości zamieniałby ciepło na pracę
mechaniczną nie powodując trwałych zmian w innych ciałach).
Pierwsza zasada termodynamiki ustala zatem równoważność ciepła i pracy nie określając
warunków panujących w trakcie ich wzajemnej przemiany. Natomiast druga zasada
termodynamiki określa warunki, w jakich możliwa jest przemiana energii cieplnej w pracę
mechaniczną.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
Entropia
Entropia jest termodynamicznym parametrem stanu układu, który nie ma odpowiednika
w postaci zjawiska fizycznego – jest pojęciem matematycznym. Określa kierunek przebiegu
procesów samorzutnych w odosobnionym układzie termodynamicznym. Oblicza się jedynie
jej przyrost, gdyż nie można obliczyć jej wartości bezwzględnej. Elementarny przyrost
entropii ciała jest ilorazem elementarnej ilości ciepła pochłoniętego przez to ciało, przez
bezwzględną temperaturę ciała jaką miało ono w chwili pochłaniania ciepła:
T
dQ
dS
=
W obliczeniach przyjmuje się zwykle, że entropia ciała jest równa zeru wtedy, gdy
to ciało ma temperaturę 0°C i znajduje się pod ciśnieniem 0,1MPa. Jeśli entropia ciała ma
wartość zero i ogrzejemy to ciało do dowolnego stanu 1 to wartość entropii tego ciała wzrasta.
Przybliżoną wartość entropii ciała w dowolnym punkcie 1 można obliczyć ogrzewając to
ciało w sposób odwracalny od stanu kiedy jego entropia wynosiła zero, do stanu 1, tworząc
sumę ułamków. W każdym ułamku porcja doprowadzonego ciepła jest dzielona przez
temperaturę ciała jakie miało ono w chwili doprowadzania tej porcji:
∑
δ
=
T
Q
S
1
.
Jednak, aby otrzymać dokładną wartość entropii ciała należy ilość doprowadzonego ciepła
podzielić na nieskończenie wiele małych porcji:
∫
=
T
T
dQ
S
273
1
.
Entropię właściwą ciał stałych i cieczy należy obliczać ze wzoru:
273
ln
T
c
s
⋅
=
,
za
ś
entropi
ę
wła
ś
ciw
ą
gazów doskonałych ze wzoru:
p
R
T
c
s
p
10
ln
273
ln
⋅
−
⋅
=
,
gdzie p – ci
ś
nienie bezwzgl
ę
dne wyra
ż
one w MPa.
Na ogół interesuje nas, o ile wzrosła lub o ile zmalała entropia badanego ciała. Obliczanie
przyrostu entropii ciał najłatwiejsze jest przy procesach, w których mimo doprowadzania
ciepła temperatura ciała nie zmienia si
ę
. Ciała, których temperatura pomimo doprowadzania
lub odprowadzania ciepła nie zmienia si
ę
nazywamy
ź
ródłami ciepła o stałej temperaturze.
Przy obliczaniu przyrostu entropii
∆
S
ź
ródła ciepła o stałej temperaturze wystarczy cał
ą
ilo
ść
doprowadzanego ciepła
∆
Q podzieli
ć
przez temperatur
ę
ź
ródła:
źr
źr
T
Q
S
∆
=
∆
. W praktyce
jednak przyrost entropii czynnika oblicza si
ę
jako ró
ż
nic
ę
pomi
ę
dzy entropi
ą
czynnika
w stanie ko
ń
cowym a entropi
ą
czynnika w stanie pocz
ą
tkowym:
1
2
S
S
S
−
=
∆
.
Obiegi termodynamiczne
Obiegiem nazywamy przemiany, które cyklicznie nast
ę
puj
ą
po sobie i po których
przej
ś
ciu czynnik wraca do stanu wyj
ś
ciowego. W tym czasie ciepło jest doprowadzane
i odprowadzane, praca jest wykonywana i oddawana, za
ś
ich warto
ś
ci s
ą
tak dobrane,
ż
e
czynnik wraca ostatecznie do stanu pocz
ą
tkowego. Obieg mo
ż
na zrealizowa
ć
w cylindrze je
ś
li
jego zawory b
ę
d
ą
stale zamkni
ę
te. Obraz obiegu przedstawia si
ę
w układzie pracy (na
wykresach p-v) – jest nim linia zamkni
ę
ta rys. 12.
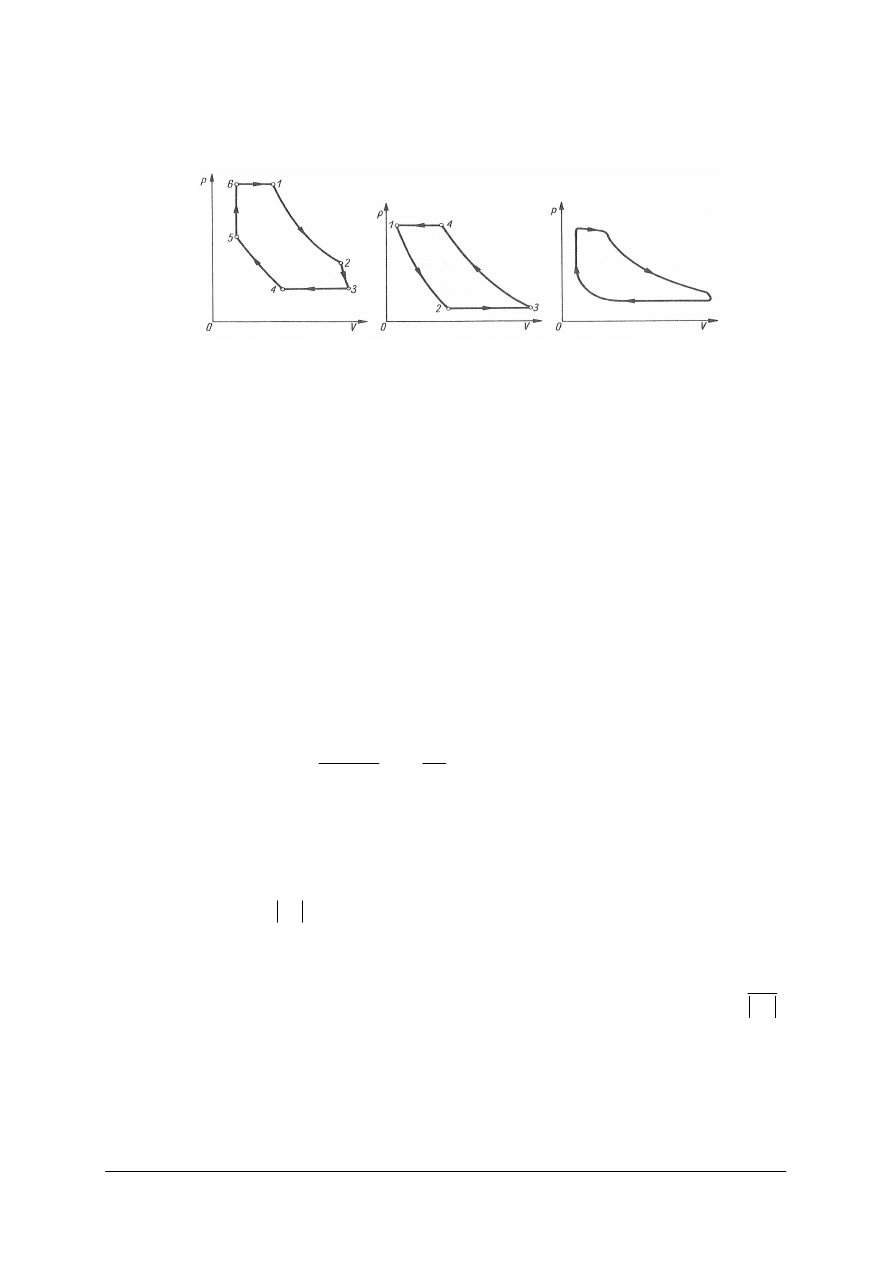
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
Ponieważ w każdym obiegu stan początkowy i końcowy pokrywają się ze sobą, dlatego
zasób energii wewnętrznej i czynnika po wykonaniu obiegu nie ulega zmianie; zatem przyrost
energii wewnętrznej układu wynosi ∆U = 0.
Rys. 12.
Przykładowe obiegi w układzie pracy [11]
Silnik cieplny to każde urządzenie, które wykonuje pracę kosztem energii dostarczonej
w postaci ciepła, natomiast maszyna robocza jest urządzeniem, które kosztem dostarczonej
z zewnątrz energii mechanicznej umożliwia osiągnięcie pewnych zamierzonych efektów
(np. sprężarka).
W obiegach termodynamicznych krzywa zmian w układach pracy dla maszyn roboczych
oraz silników cieplnych jest krzywą zamkniętą, niemniej jednak zmiany parametrów stanu
przebiegają dla tych urządzeń nieco inaczej:
−
w silnikach zgodnie z kierunkiem ruchu wskazówek zegara – praca dodatnia (otrzymana),
−
w maszynach roboczych w kierunku przeciwnym do ruchu wskazówek zegara – praca
ujemna (dostarczona).
Obiegi prawobieżne i lewobieżne
Urządzenia, w których realizowany jest obieg prawobieżny dostarczają energię
mechaniczną. Należy do nich silnik cieplny.
Jeśli silnik cieplny pobrał ciepło Q
d
ze źródła o temperaturze wyższej, to część tego ciepła
zostaje zamieniona na pracę mechaniczną L
ob
, zaś pozostałą część ciepła Q
z
oddaje do źródła
ciepła o temperaturze niższej. Zatem jego sprawność (zawsze mniejsza niż 1) wynosi:
d
z
d
z
d
Q
Q
Q
Q
Q
−
=
−
=
η
1
, gdy
ż
z
ob
d
Q
L
Q
+
=
.
Urz
ą
dzenia, w których realizowany jest obieg lewobie
ż
ny wymagaj
ą
doprowadzenia do
nich energii mechanicznej. S
ą
to urz
ą
dzenia chłodnicze oraz pompy ciepła.
Urz
ą
dzenia te po doprowadzeniu energii mechanicznej pobieraj
ą
ciepło Q
d
ze
ź
ródła
o temperaturze ni
ż
szej i oddaj
ą
ciepło Q
z
do
ź
ródła o temperaturze wy
ż
szej. W przypadku
urz
ą
dze
ń
idealnych, doprowadzana do nich energia mechaniczna równa jest bezwzgl
ę
dnej
warto
ś
ci pracy obiegu:
d
z
ob
Q
Q
L
−
=
W urz
ą
dzeniach chłodniczych
ź
ródłem ciepła o temperaturze ni
ż
szej jest pomieszczenie,
gdzie utrzymuje si
ę
sztucznie ni
ż
sz
ą
temperatur
ę
, natomiast
ź
ródłem ciepła o temperaturze
wy
ż
szej jest otoczenie. Wydajno
ść
wła
ś
ciw
ą
oblicza si
ę
w tym przypadku ze wzoru:
ob
d
L
Q
=
ε
.
Obieg Carnota
Jest to odwracalny obieg o najwi
ę
kszym znaczeniu w termodynamice (rys. 13).
W układzie p-v składa si
ę
on z dwóch odcinków izoterm i z dwóch odcinków adiabat
(4 przemiany), mianowicie:
−
rozpr
ęż
anie izotermiczne (czynnik pobiera ciepło ze
ź
ródła cieplejszego) 1–2,
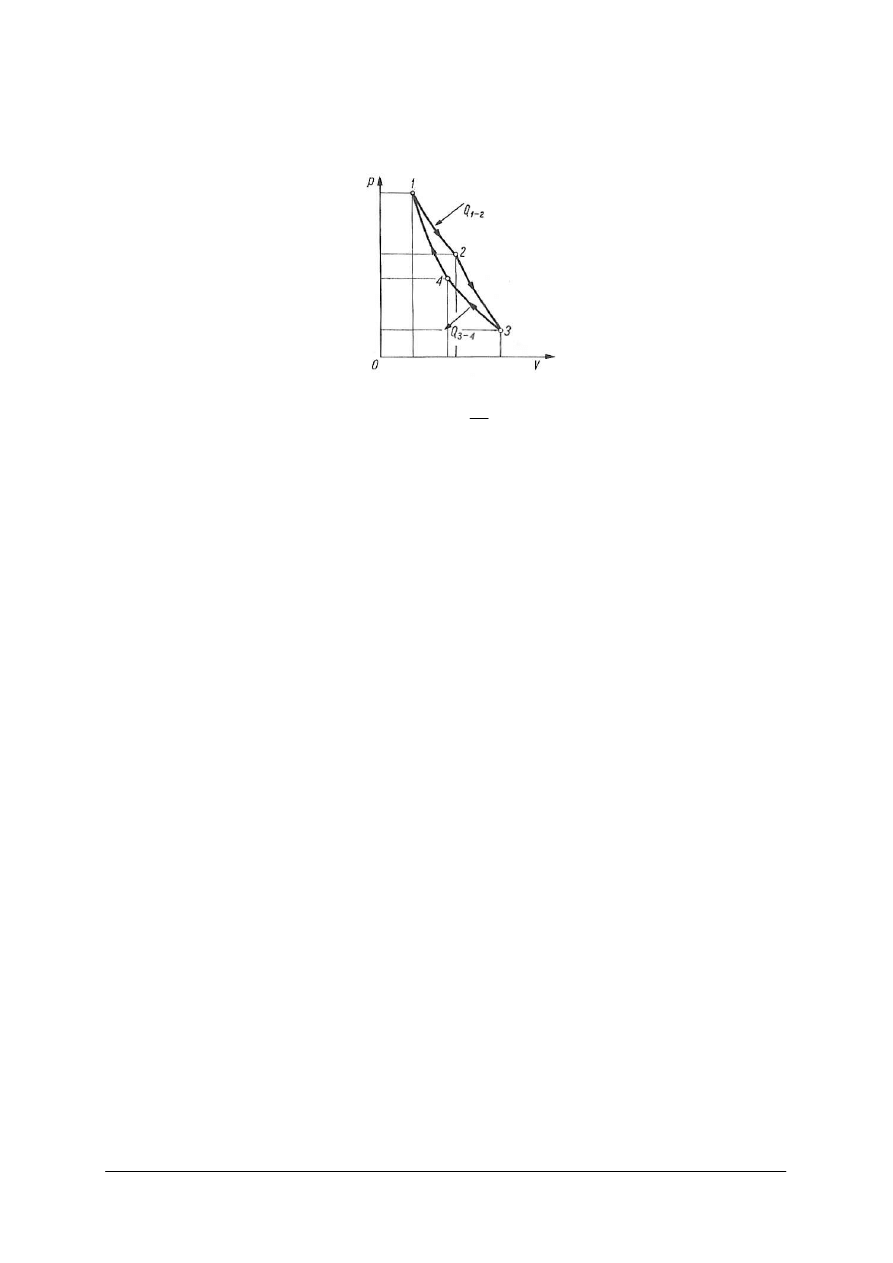
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
−
rozprężanie adiabatyczne 2–3,
−
sprężanie izotermiczne (czynnik oddaje ciepło do źródła o temperaturze niższej) 3–4,
−
sprężanie adiabatyczne 4–1.
Rys. 13.
Obieg Carnota [11]
Sprawność obiegu Carnota określa wzór:
1
2
1
T
T
c
−
=
η
,
gdzie T
1
i T
2
to odpowiednio temperatury
ź
ródła cieplejszego i zimniejszego.
Nale
ż
y zaznaczy
ć
,
ż
e nie mo
ż
na zbudowa
ć
idealnego silnika Carnota, ani innego silnika
cieplnego o jego sprawno
ś
ci. Dlatego konstruktorzy buduj
ą
c silniki traktuj
ą
silnik Carnota
jako wzorcowy model, do którego mo
ż
na si
ę
zbli
ż
y
ć
.
Analizuj
ą
c powy
ż
szy wzór na sprawno
ść
Carnota łatwo zauwa
ż
y
ć
,
ż
e chc
ą
c zwi
ę
kszy
ć
sprawno
ść
nale
ż
y podj
ąć
jedno z dwóch działa
ń
:
−
obni
ż
y
ć
temperatur
ę
ź
ródła zimniejszego (sposób mniej realny),
−
podwy
ż
szy
ć
temperatur
ę
ź
ródła cieplejszego (sposób bardziej realny, jednak stosowanie
wysokich temperatur w technice zale
ż
y nie tylko od rodzaju paliwa czy sposobu jego
spalania, ale te
ż
od materiałów konstrukcyjnych).
Obiegi porównawcze tłokowych silników spalinowych
Obieg porównawczy pracy silnika to uproszczony schemat obiegu termodynamicznego
uwzgl
ę
dniaj
ą
cy jedynie straty spowodowane konieczno
ś
ci
ą
odprowadzenia cz
ęś
ci ciepła
z obiegu do
ź
ródła dolnego przy przetwarzaniu energii cieplnej w prac
ę
mechaniczn
ą
(II zasada termodynamiki). Posiada on szereg zało
ż
e
ń
upraszczaj
ą
cych, tj.:
−
czynnikiem pracuj
ą
cym (roboczym) jest gaz doskonały o stałym cieple wła
ś
ciwym,
−
obieg porównawczy wykonuje stała ilo
ść
czynnika o stałym składzie chemicznym,
−
obieg porównawczy składa si
ę
wył
ą
cznie z typowych przemian odwracalnych,
−
pomija si
ę
tarcie,
−
nieodwracalne zjawiska spalania zast
ę
puje si
ę
doprowadzaniem ciepła z zewn
ą
trz,
−
usuwanie spalin z silnika zast
ę
puje si
ę
odprowadzaniem ciepła od nie zmieniaj
ą
cej si
ę
ilo
ś
ci czynnika przy stałej obj
ę
to
ś
ci.
Obiegi porównawcze spełniaj
ą
ogromn
ą
rol
ę
w doskonaleniu silników spalinowych –
przy ich badaniu i ulepszaniu, mimo
ż
e odbiegaj
ą
znacznie od rzeczywistego przebiegu
wyst
ę
puj
ą
cych tam zjawisk.
Ze wzgl
ę
du na sposób doprowadzania ciepła rozró
ż
nia si
ę
obiegi (rys. 14,15 i 16):
−
obieg Otta – z izochorycznym doprowadzaniem ciepła, gdzie V=const.,
−
obieg Diesla – z izobarycznym doprowadzaniem ciepła, gdzie p=const.,
−
obieg Sabathe’a – z mieszanym doprowadzaniem ciepła, gdzie V=const. i p=const.
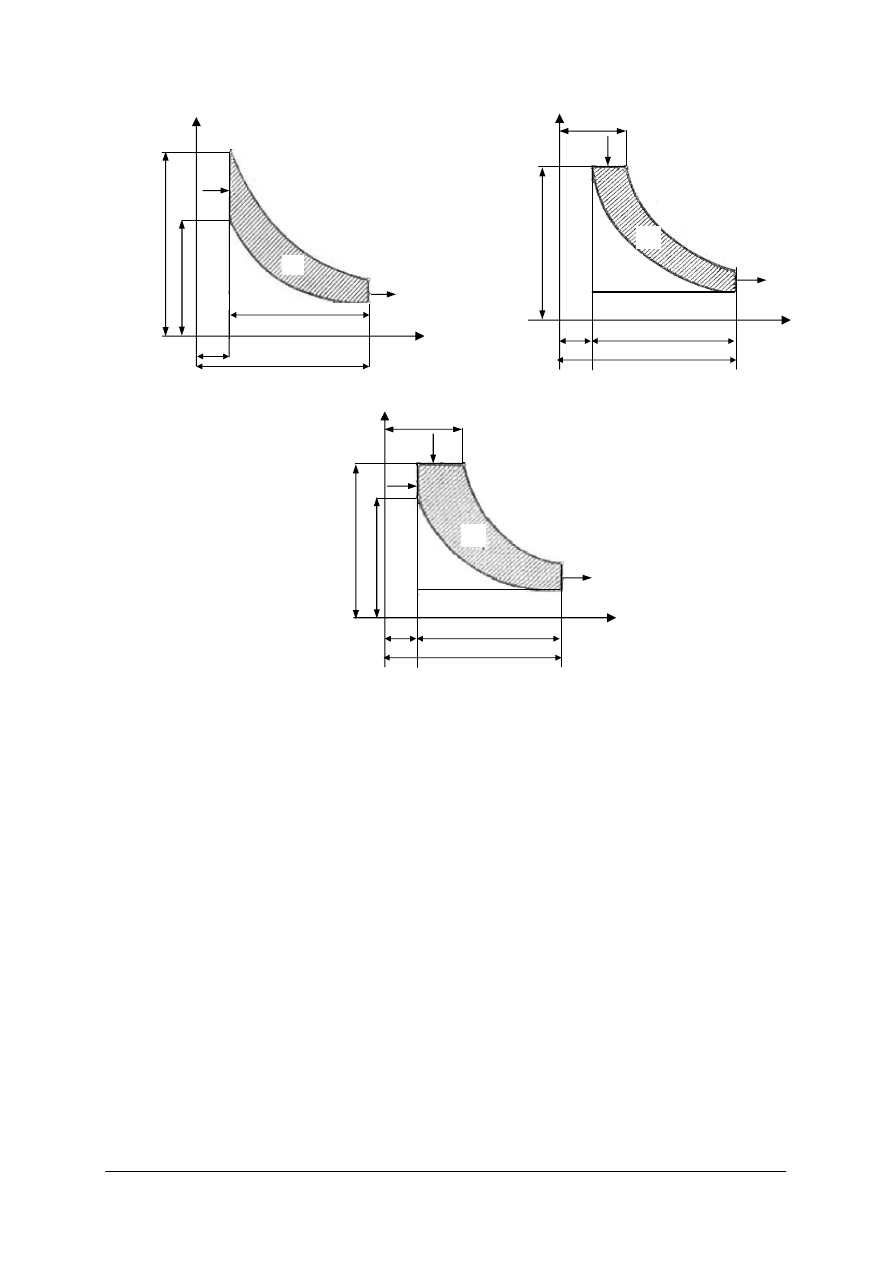
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
Rys. 14.
Wykres pracy obiegu Otta [3]
Rys. 15.
Wykres pracy obiegu Diesla [3]
Rys. 16.
Wykres pracy obiegu Sabathe’a [3]
Obieg Otta składa się z dwóch przemian adiabatycznych i dwóch przemian izochorycznych:
−
1–2 izobara przedstawiająca zasysanie mieszanki palnej do cylindra przy stałym ciśnieniu
atmosferycznym,
−
2–3 adiabata sprężania mieszanki w cylindrze,
−
w punkcie 3 następuje zapłon mieszanki paliwowo-powietrznej, która natychmiast ulega
spaleniu (przy stałej objętości i znacznym wzroście ciśnienia i temperatury),
−
3–4 izochora przedstawia zjawisko spalania mieszanki,
−
4–5 adiabata przedstawia przemianę rozprężania się gazów spalinowych w cylindrze
w czasie suwu pracy,
−
5–2 izochora przedstawia spadek ciśnienia w cylindrze po otwarciu zaworu wylotowego;
część spalin wydostaje się z cylindra do atmosfery unosząc ciepło,
−
2–1 izobara zamykająca obieg, odpowiada usuwaniu reszty spalin z cylindra w czasie
ruchu powrotnego tłoka w suwie wylotu.
V
0
– objętość komory sprężania w silniku spalinowym,
V
s
– objętość skokowa cylindra,
V
c
– objętość całkowita cylindra (V
0
+V
s
).
4
1
3
5
2
V
p
0
V
0
V
s
V
c
Q
1
Q
2
p
p
3
W
t
1
3
5
2
V
p
0
V
0
V
s
V
c
Q
1
Q
2
p
4
=p
4
W
t
V
1
1
3
6
2
V
p
0
V
0
V
s
V
c
Q’’
1
Q
2
p
4
W
t
V
s
5
4
P
3
Q’
1
5
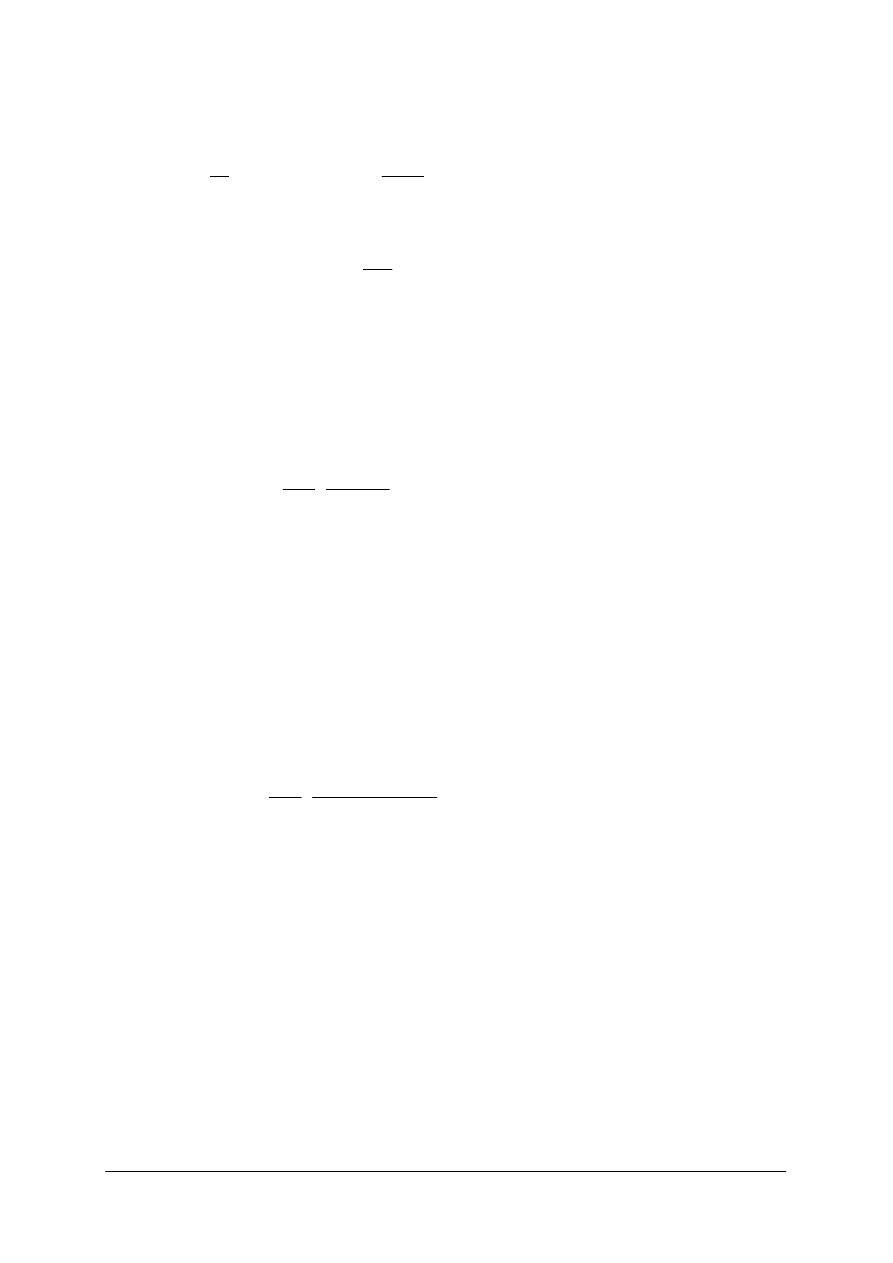
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
Stopniem sprężania
ε
nazywamy stosunek całkowitej objętości cylindra V
c
do objętości
komory sprężania V
0
, mianowicie:
0
V
V
c
=
ε
, przy czym
4
2
0
d
s
V
⋅
π
⋅
=
, gdzie d – średnica cylindra, s – skok tłoka,
Sprawność obiegu Otta zależy tylko od stopnia sprężania i wykładnika adiabaty, a nie
zależy od ilości doprowadzonego ciepła czy pracy obiegu:
1
1
1
−
χ
ε
−
=
η
t
, gdzie
χ
– wykładnik adiabaty
Obieg Diesla
składa si
ę
z dwóch przemian adiabatycznych oraz z izobary i izochory.
Spr
ęż
anie i rozpr
ęż
anie gazu oraz odprowadzanie ciepła odbywa si
ę
identycznie jak w obiegu
Otta, z t
ą
ró
ż
nic
ą
,
ż
e wyst
ę
puje tu izobaryczne doprowadzanie ciepła.
Sprawno
ść
obiegu Diesla zale
ż
y, podobnie jak w obiegu Otta, od stopnia spr
ęż
ania
i wykładnika adiabaty oraz dodatkowo od stopnia wst
ę
pnego rozpr
ęż
ania. Stopie
ń
wst
ę
pnego
rozpr
ęż
ania zale
ż
y od ilo
ś
ci dostarczonego ciepła przy stałym ci
ś
nieniu.
)
1
(
1
1
1
1
−
⋅
−
=
−
−
ρ
χ
ρ
ε
η
χ
χ
t
, gdzie
ρ
– stopie
ń
wst
ę
pnego rozpr
ęż
ania
Przy jednakowych stopniach spr
ęż
ania sprawno
ść
teoretyczna obiegu Diesla jest mniejsza
ni
ż
sprawno
ść
Otta. Natomiast przez odpowiednie podwy
ż
szenie stopnia spr
ęż
ania uzyskuje
si
ę
znacznie wi
ę
ksz
ą
sprawno
ść
obiegu Diesla ni
ż
obiegu Otta przy umiarkowanym stopniu
spr
ęż
ania.
Obieg Sabathe’a
składa si
ę
z dwóch przemian adiabatycznych, dwóch przemian
izochorycznych i jednej izobarycznej. Charakterystyczn
ą
cech
ą
tego obiegu jest dostarczenie
ciepła najpierw przy stałej obj
ę
to
ś
ci, a nast
ę
pnie przy stałym ci
ś
nieniu. Inne przemiany
odbywaj
ą
si
ę
podobnie jak w obiegu Otta lub Diesla.
Sprawno
ść
obiegu Sabathe’a zale
ż
y od stopnia spr
ęż
ania, wykładnika adiabaty i stopnia
wst
ę
pnego rozpr
ęż
ania oraz od stopnia przyrostu ci
ś
nienia, a okre
ś
la j
ą
zale
ż
no
ść
:
,
)
1
(
1
1
1
1
1
−
+
−
⋅
⋅
−
=
−
−
ρ
χλ
λ
ρ
λ
ε
η
χ
χ
t
gdzie
λ
– stopie
ń
przyrostu ci
ś
nienia
Indykatory
– s
ą
to urz
ą
dzenia, które sporz
ą
dzaj
ą
wykresy przedstawiaj
ą
ce rzeczywiste
przebiegi zmian ci
ś
nienia w cylindrze w zale
ż
no
ś
ci od poło
ż
enia tłoka b
ą
d
ź
k
ą
ta obrotu wału.
4.3.2. Pytania sprawdzające
Odpowiadaj
ą
c na pytania, sprawdzisz, czy jeste
ś
przygotowany do wykonania
ć
wicze
ń
.
1.
Jaka jest ró
ż
nica pomi
ę
dzy prac
ą
bezwzgl
ę
dna oraz prac
ą
techniczn
ą
?
2.
Jak brzmi II Zasada Termodynamiki?
3.
Co to jest entropia?
4.
Jakie obiegi porównawcze stosuje si
ę
w termodynamice w trakcie analizy pracy silników?
5.
Z jakich przemian składa si
ę
obieg Carnota?
6.
Z jakich przemian składaj
ą
si
ę
obiegi Otta, Diesla, Sabathe’a?
7.
Do czego słu
żą
indykatory?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
4.3.3. Ćwiczenia
Ćwiczenie 1
Porównaj (w układach pracy p-v) obiegi rzeczywistych silników z obiegiem Carnota oraz
wyjaśnij w jakim stopniu obiegi porównawcze wpływają na doskonalenie silników
spalinowych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
dokonać analizy otrzymanych wykresów obiegów na wykresach p-v,
2)
zapisać różnice i podobieństwa zauważone na wykresach,
3)
wyjaśnić dlaczego nie można zbudować idealnego silnika Carnota,
4)
wyjaśnić wpływ obiegów porównawczych na doskonalenie silników spalinowych.
Wyposażenie stanowiska pracy:
−
zestaw wykresów p-v przykładowych silników oraz idealnego obiegu Carnota,
−
papier, przyrządy do pisania.
Ćwiczenie 2
Zaprojektuj stanowisko do badania silnika spalinowego o zapłonie samoczynnym,
korzystając z literatury dostępnej w laboratorium, Internetu i wskazówek nauczyciela.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
wyszukać w Internecie i literaturze informacje nt. pomiarów zmian ciśnienia w cylindrze
w zależności od położenia tłoka bądź kąta obrotu wału,
2)
sporządzić listę potrzebnych „elementów” stanowiska do badań,
3)
zaproponować konkretny typ czujnika do pomiaru ciśnienia w cylindrze (wynotuj jego
dane techniczne),
4)
oszacować koszt budowy takiego stanowiska.
Wyposażenie stanowiska pracy:
−
fachowa literatura nt. pomiarów ciśnienia silników, katalogi firm produkujących czujniki
ciśnienia,
−
komputer klasy PC z dostępem do sieci Internet,
−
papier, przyrządy do pisania,
−
kalkulator.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
Ćwiczenie 3
Odszukaj przykłady prób zbudowania urządzeń perpetuum mobile korzystając z literatury
dostępnej w laboratorium oraz sieci Internet. Przeanalizuj odnalezione przykłady i wyjaśnij
dlaczego urządzenia te nie mogły zostać urządzeniami perpetuum mobile.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
odszukać w sieci Internet i literaturze informacje nt. prób zbudowania perpetuum mobile,
2)
sporządzić listę konkretnych przykładów takich urządzeń,
3)
wyjaśnić, na ich podstawie, jaki czynnik decydował o tym, że nigdy nie osiągnięto
założonego celu i nie zbudowano perpetuum mobile,
4)
wypisać w formie tabeli, jakie korzyści i skutki uboczne wiązałyby się z pozytywnym
ukończeniem tego typu urządzenia.
Wyposażenie stanowiska pracy:
−
komputer klasy PC z dostępem do sieci Internet,
−
książki i czasopisma dotyczące perpetuum mobile,
−
papier, przyrządy do pisania.
4.3.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
wyjaśnić pojęcie pracy zewnętrznej, użytecznej i technicznej?
2)
wymienić kilka sformułowań noszących nazwę słownych definicji
drugiej zasady termodynamiki?
3)
wyjaśnić pojęcie entropii?
4)
podać definicję silnika cieplnego?
5)
rozróżnić obiegi termodynamiczne?
6)
rozpoznać na wykresie rodzaj obiegu termodynamicznego?
7)
określić co ma wpływ na sprawność obiegu Diesla?
8)
podać zastosowanie indykatora?
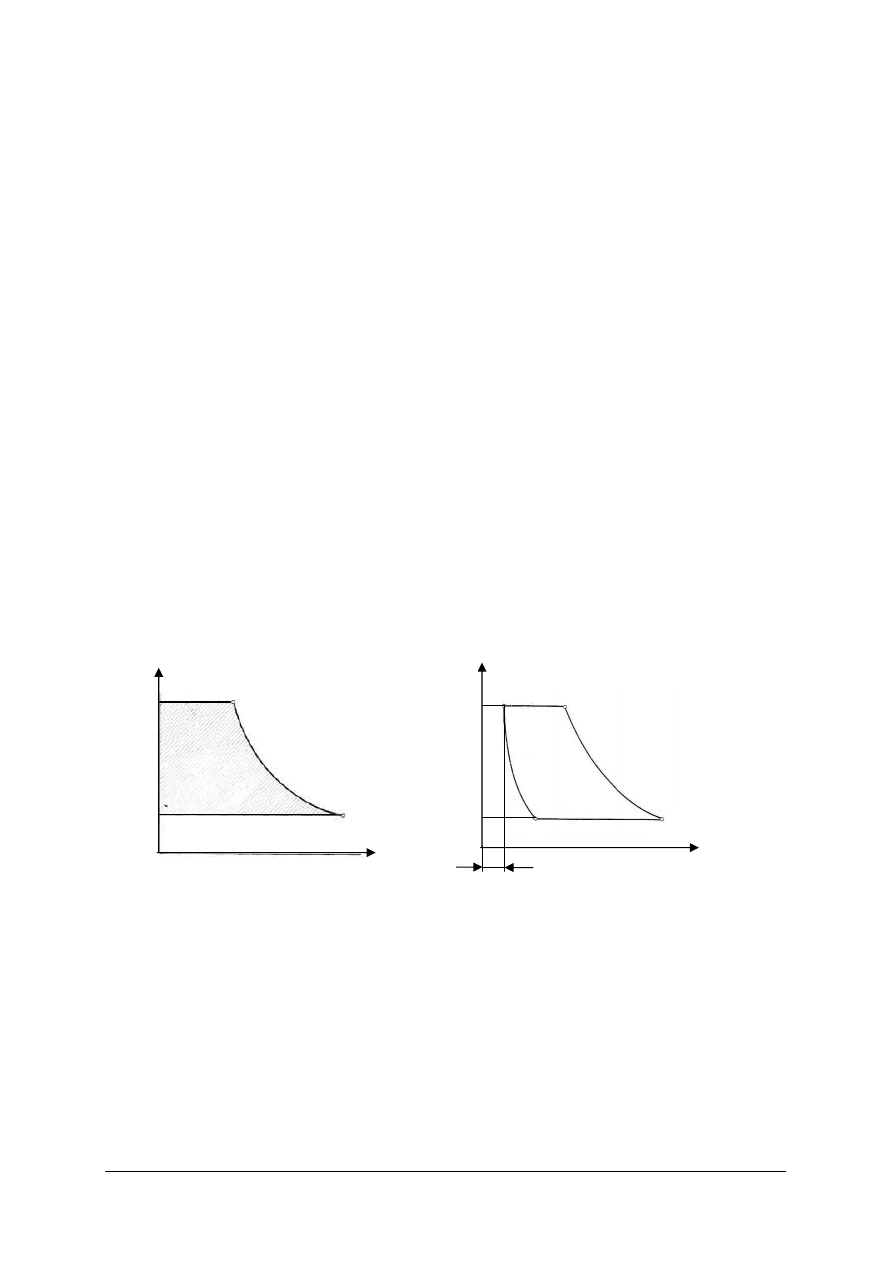
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
4.4.
Sprężarki, gazy wilgotne, silniki i procesy spalania
4.4.1. Materiał nauczania
Sprężarki
Powietrze sprężone wykorzystywane jest na statku do wielu celów, m.in.: do rozruchu
silników, do układów sterowania i automatyki siłowni, do celów przemysłowych, do
wentylacji pomieszczeń itd. Maszyny robocze służące do sprężania i przetłaczania powietrza,
gazów i pary, wykorzystywane na statkach to wentylatory, dmuchawy oraz sprężarki właściwe
o sprężu powyżej 2 (spręż – stopień sprężania, definiowany jako stosunek wielkości ciśnienia
za sprężarką do ciśnienia przed sprężarką).
W zależności od tego czy proces sprężania zachodzi w cylindrze, w którym porusza się
tłok czy w układzie łopatek, przez które przepływa w sposób ciągły gaz, sprężarki możemy
podzielić na:
−
tłokowe,
−
wirnikowe (osiowe, promieniowe).
Sprężarka tłokowa składa się z cylindra, w którym porusza się tłok za pomocą
mechanizmu korbowego silnika napędowego. W sprężarce idealnej przyjmuje się, że tłok
dochodzi aż do pokrywy cylindra, czyli między dnem tłoka a pokrywą cylindra nie ma żadnej
objętości gazu (punkt a na rys. 17).
Następuje zasysanie gazu do cylindra do czasu gdy tłok
osiągnie drugie skrajne położenie 1. Następnie zawór ssawny zamyka się i tłok zaczyna
poruszać się w kierunku powrotnym sprężając gaz (przemiana 1–2) do chwili gdy ciśnienie
osiągnie żądaną wartość p
2
. Następuje otwarcie zaworu wylotowego i gaz zostaje wytłoczony
z cylindra (2–b).
Rys. 17.
Przebieg sprężania w teoretycznej
sprężarce tłokowej [7]
Rys. 18.
Przebieg sprężania w rzeczywistej sprężarce
tłokowej; V
b
– przestrzeń szkodliwa [7]
W zależności od warunków pracy w jakich pracują sprężarki ich przebiegi sprężania
mogą różnie przebiegać. Gdy cylinder chłodzony jest wodą to jego ścianki nie nagrzewają się
nadmiernie, co wpływa pozytywnie na pracę. Dlatego im wolniej będzie przebiegało w tym
przypadku sprężanie tym silniej będzie chłodzony gaz. Zachodząca tu przemiana zbliża się do
izotermy. Jeśli natomiast sprężanie będzie przebiegało szybko to gaz będzie oddawał mało
ciepła, dlatego przemiana będzie w tej sytuacji zbliżona do adiabaty.
W wyniku analizy różnych przemian sprężania zauważono, że najmniejsza praca zostaje
wykonana przy sprężaniu izotermicznym, zaś największa przy adiabatycznym. Dlatego
w praktyce powinno się zmierzać w kierunku sprężania izotermicznego. W rzeczywistości
mamy do czynienia z przemianą pośrednią między izotermą a adiabatą, mianowicie przemianą
p
V
p
1
p
2
2
1
b
a
p
V
p
2
2
1
a
p
1
b
V
b
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
zbliżoną do politropy. Podczas sprężania praca jest do układu zawsze doprowadzana, dlatego
też w obliczeniach występuje znak minus.
Jeżeli na wyjściu sprężarki ciśnienie ma być duże, to aby uniknąć dużej temperatury
w końcu sprężania stosuje się sprężanie wielostopniowe – sprężanie następuje kolejno w kilku
cylindrach. W przypadku sprężarki trzystopniowej (trzycylindrowej) z międzystopniowym
chłodzeniem gaz zasysany jest najpierw do cylindra pierwszego, z którego po sprężeniu
przechodzi do chłodnicy. Następnie doprowadzany jest do drugiego cylindra i po sprężeniu
trafia do kolejnej chłodnicy, a stamtąd kierowany jest do trzeciego cylindra, gdzie następuje
sprężanie końcowe.
Praca sprężarek rzeczywistych charakteryzuje się tym, że występują straty, które
powodują, iż objętość cylindra jest gorzej wykorzystywana. W cylindrach sprężarek
rzeczywistych istnieje przestrzeń szkodliwa (rys. 18 –V
b
), którą określa współczynnik
zasysania (stosunek objętości gazu zassanego w rzeczywistości do cylindra do jego objętości
skokowej). Współczynnik ten określa sprawność objętościową sprężarek tłokowych. Jednakże
w celu określenia sprawności sprężarki wykorzystuje się również współczynnik
tłoczenia
.
i
λ
Jest on stosunkiem masy gazu wytłoczonej podczas jednego cyklu pracy do masy
gazu jaka może się zmieścić w objętości skokowej przy temperaturze i ciśnieniu zasysanego
gazu:
c
i
i
m
m
=
λ
.
Sprężarki wirnikowe na ogół wykonywane są jako wielostopniowe: na wale wirnika
umieszcza się od kilku do kilkunastu wieńców łopatek, zaś liczba kierownic odpowiada
liczbie wieńców łopatek wirnika. Działanie jej polega na przepływie sprężanego czynnika
między jej łopatkami na wirniku i łopatkami kierowniczymi umieszczonymi w kadłubie.
W wyniku przepływu czynnika przez odpowiednio ukształtowane kanały łopatkowe dochodzi
do zmiany kierunku i wielkości prędkości ruchu oraz następuje wzrost ciśnienia sprężanego
czynnika.
Z powodu trudności chłodzenia sprężarek wirnikowych przyjmuje się, że idealne
sprężarki realizują odwracalną przemianę adiabatyczną (przemiana izentropowa). Sprężanie
można przedstawić na wykresach p-v, i–s oraz T-s.
Rys. 19.
Przebieg sprężania w sprężarce wirnikowej, gdzie 1–2
t
przebieg idealnej
sprężarki, 1–2
r
– rzeczywistej [7]
Praca potrzebna do teoretycznego sprężania 1 kg czynnika przepływającego przez
sprężarkę od ciśnienia p
1
do p
2
równa jest pracy technicznej przemiany izentropowej. Praca
rzeczywistego sprężania równa jest różnicy entalpii na końcu i początku sprężania.
W okrętownictwie sprężarki wirnikowe stosowane są we współczesnych silnikach
turbinowych, np.: wielostopniowe sprężarki osiowe, jednostopniowe sprężarki promieniowe.
p
V
p
1
p
2
2
t
2
r
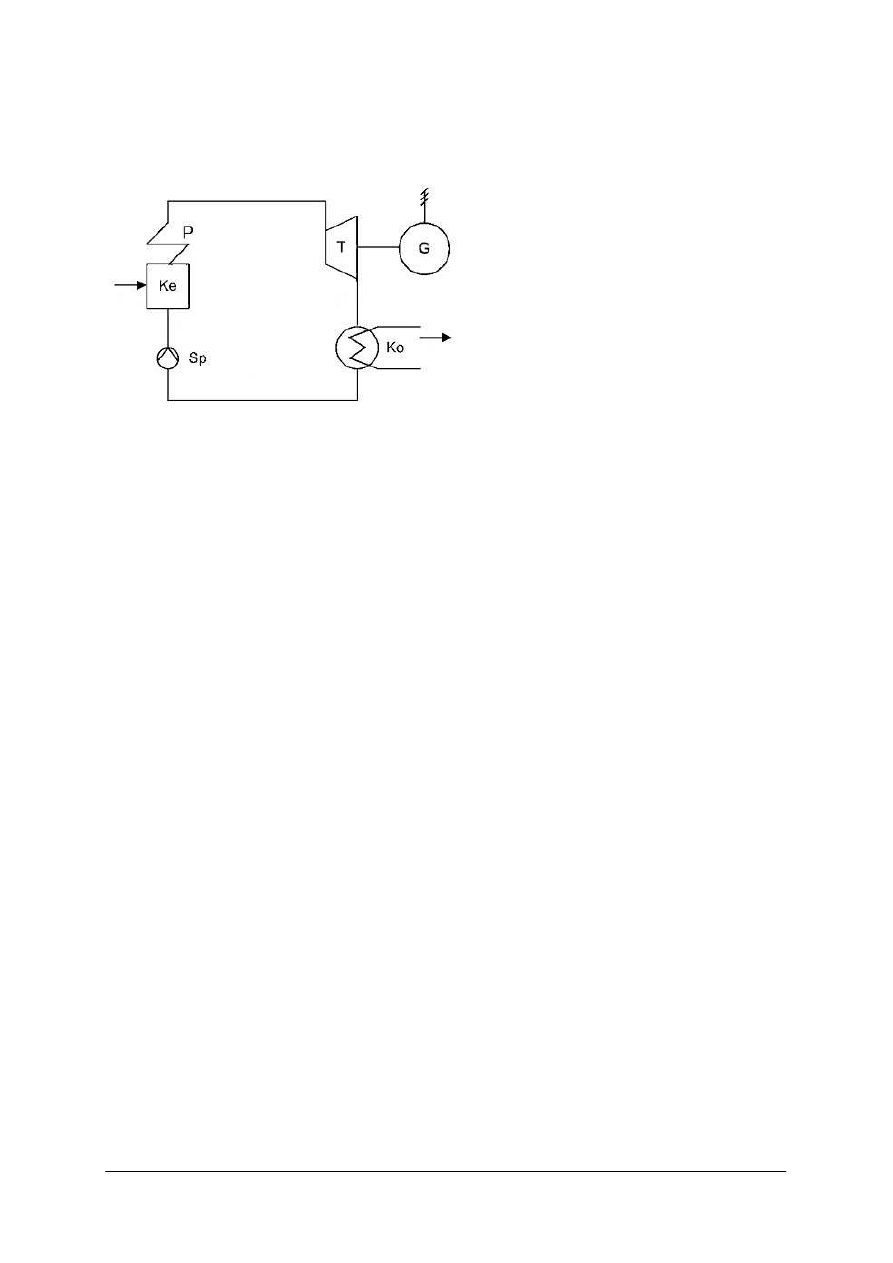
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
Obiegi parowe
Typowy obieg siłowni parowej zawiera czynnik chłodzący w postaci wody, który
przepływa przez kocioł, turbinę, skraplacz (kondensator) i pompę. Dalej cykl ten się powtarza.
Ke – kocioł parowy,
P – podgrzewacz
T – turbina,
G – generator,
Ko – skraplacz,
Sp – pompa wody zasilającej
Rys. 20.
Obieg siłowni parowej [3]
Obiegi Carnota i Clausiusa-Rankine'a
Za pośrednictwem pary wodnej w silniku parowym odbywa się zamiana ciepła w energię
mechaniczną. Kocioł parowy (wytwarzający parę wodną) i silnik stanowią główne części
układu siłowni parowej. Przebieg: W kotle parowym następuje przemiana wody w parę
nasyconą, która przechodzi do silnika parowego, gdzie ulega rozprężaniu wykonując pracę
mechaniczną. Rozprężona para o odpowiednio niskiej temperaturze i niskim ciśnieniu
przechodzi do chłodnicy skraplacza, skąd następuje odprowadzenie ciepła i skroplenie pary.
Pompa przetłacza do kotła parowego skropliny zamykając tym samym obieg czynnika.
W rozdziale III tego poradnika omówiono już gazowy obieg Carnota. Wynikało tam, iż
obieg ten jest obiegiem wzorcowym, do którego należało dążyć. Niemniej jednak
w przypadku silnika parowego nie został on przyjęty. Powodem stały się trudności w jego
realizacji od strony praktycznej, gdyż niemożliwe jest uzyskanie wody o temperaturze wrzenia
w chwili jej wtłaczania do kotła parowego, sprężając adiabatycznie parę wodną o pewnej
wilgotności. Dlatego jako obieg wzorcowy przyjmuje się obieg Rankine'a, który zawiera
zresztą, podobnie jak obieg Carnota, adiabatyczne rozprężanie doprowadzone do temperatury
źródła dolnego. Różni się zaś doprowadzaniem i odprowadzaniem ciepła, które odbywa się
tylko izobarycznie oraz tym, że w chłodnicy skrapla się cała para, a skroploną wodę
przepompowuje się do kotła za pomocą pompy.
Obieg Clausiusa-Rankine’a jest obiegiem porównawczym dla siłowni parowej, składa się
z następujących przemian (rys. 21):
−
1–2 – adiabatycznego rozprężania pary w turbinie parowej,
−
2–3 – izobarycznego skroplenia rozprężonej pary,
−
3–4 – izochorycznego pompowania kondensatu w pompie,
−
4–1 – izobarycznego podgrzewania cieczy, jej odparowania oraz przegrzewania powstałej
pary w kotle parowym bądź wytwornicy pary.
Sprawność obiegu Clausiusa-Rankine’a jest znacznie mniejsza od sprawności obiegu Carnota.
Dlatego też zmodyfikowano teoretyczny obieg siłowni parowej wprowadzając regenerację
ciepła.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
Sposoby zwiększania sprawności siłowni parowych
Regeneracja ciepła w obiegach termodynamicznych polega na tym, że pewna ilość ciepła
pozostaje zachowana wewnątrz obiegu. W tym celu część pary pobiera się z upustu turbiny
i wykorzystuje do podgrzania kondensatu, co z kolei pozwala zaoszczędzić paliwo.
Najprostszy obieg regeneracyjny zawiera mieszalnik, w którym dochodzi do zmieszania
kondensatu skroplonego w kondensatorze z parą upustową. W wyniku zmieszania powstaje
ciecz o temperaturze wyższej od temperatury kondensatu, który opuszczał skraplacz.
Sprawność siłowni parowych można zatem poprawiać dzięki parze pobieranej z upustu
turbiny. Jednak ilość pary, jaka może być wykorzystana do regeneracji jest ograniczona, gdyż
po zmieszaniu jej z kondensatem musi ona ulec całkowitemu skropleniu. Ponadto, upust
regeneracyjny należy umieścić w „odpowiednim miejscu” – umieszczony na końcu turbiny
dostarczałby parę o zbyt niskiej temperaturze (niewystarczającej do podgrzania kondensatu),
zaś umieszczony na jej początku powodowałby, że pobrana para wykonywałaby jedynie
niewielką pracę. Uzyskanie znacznie lepszych efektów w zwiększaniu sprawności siłowni
parowych daje zastosowanie kilku upustów regeneracyjnych. Wymusza to jednak stosowanie
przeponowych wymienników ciepła, gdyż bezpośrednie mieszanie pary wodnej w takiej
turbinie jest niepraktyczne (wymaga wielu pomp przetłaczających).
Przegrzew wtórny polega na tym, iż para po opuszczeniu wysokoprężnej części turbiny
ponownie kierowana jest do kotła w celu ponownego przegrzania. Zapobiega to skraplaniu się
pary we wnętrzu turbiny, zwiększając tym samym jej żywotność.
Rys. 21.
Cykl w układzie p-V
Rys. 22.
Cykl w układzie T-s
Gazy wilgotne
Powietrzem wilgotnym nazywa się mieszaninę powietrza suchego i pary wodnej.
W zależności od stanu pary wodnej w powietrzu, można wyróżnić:
−
powietrze nienasycone wilgocią, czyli powietrze zawierajęce parę przegrzaną,
−
powietrze nasycone wilgocią nie zamglone, czyli zawierające parę nasyconą suchą,
−
powietrze zamglone, czyli zawierające parę mokrą.
Podczas rozpatrywania powietrza wilgotnego stosuje się prawo Daltona. Pozwala ono na
oddzielenie rozpatrywanego powietrza suchego i pary wodnej. Traktuje się je wtedy jako dwa
składniki o tej samej temperaturze, znajdujące się w tym samym czasie w tej samej
przestrzeni:
p
g
p
p
p
+
=
,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
41
gdzie:
p – ciśnienie bezwzględne powietrza wilgotnego,
p
g
– bezwzględne ciśnienie cząsteczkowe powietrza suchego,
p
p
– bezwzględne ciśnienie cząsteczkowe pary wodnej.
Parametry określające powietrze wilgotne to wilgoć, wilgotność względna i współczynnik
wilgoci.
Wilgoć – to ilość kilogramów wody zawartych w 1 m
3
przestrzeni jaką zajmuje gaz wilgotny.
Para wodna występująca w powietrzu ma małe ciśnienie cząsteczkowe, dlatego powietrze
suche, parę przegrzaną, a także parę nasyconą suchą można traktować w trakcie obliczeń jako
gazy doskonałe; nie dotyczy to jednak pary mokrej.
Wilgotność względna (wilgotność powietrza) to stosunek gęstości pary wodnej
p
ρ
zawartej
w powietrzu wilgotnym (wilgoć) do gęstości pary nasyconej suchej
'
'
ρ
o tej samej
temperaturze:
t
p
=
'
'
ρ
ρ
ϕ
, gdzie:
ϕ
– wilgotno
ść
wzgl
ę
dna, indeks t – oznacza, i
ż
g
ę
sto
ść
pary nasyconej suchej musi by
ć
odczytana w tablicach dla temperatury jak
ą
posiada powietrze
wilgotne.
Badaj
ą
c ró
ż
ne rodzaje mieszanin powietrza suchego i pary wodnej mo
ż
na wysnu
ć
kilka
wniosków:
−
poniewa
ż
ci
ś
nienie pary przegrzanej p
p
jest zawsze ni
ż
sze od ci
ś
nienia pary nasyconej
suchej p
s
o tej samej temperaturze to wilgotno
ść
wzgl
ę
dna powietrza nie nasyconego
wilgoci
ą
jest zawsze mniejsza ni
ż
1,
−
wilgotno
ść
wzgl
ę
dna izobarycznie ogrzewanego powietrza bardzo maleje,
−
wilgotno
ść
wzgl
ę
dna nie zamglonego nasyconego wilgoci
ą
powietrza jest równa 1,
−
wilgotno
ść
wzgl
ę
dna powietrza zamglonego jest wi
ę
ksza ni
ż
1, za
ś
ci
ś
nienie cz
ą
stkowe
pary w powietrzu zamglonym jest równe ci
ś
nieniu nasycenia odczytanemu dla
temperatury powietrza zamglonego.
Współczynnik wilgoci powietrza wilgotnego to stosunek ilo
ś
ci kg pary wodnej zawartej
w powietrzu do ilo
ś
ci kg powietrza suchego. Współczynnik ten ma wymiar:
suchego
powietrza
kg
O
H
kg
m
m
X
g
p
2
=
.
Najwi
ę
kszy mo
ż
liwy współczynnik wilgoci, jaki mo
ż
e mie
ć
w danych warunkach
powietrze nie zamglone oznaczamy jako X’’, a mamy z nim do czynienia w przypadku nie
zamglonego powietrza nasyconego wilgoci
ą
. W przypadku powietrza nie nasyconego
wilgoci
ą
X<X’’, za
ś
dla powietrza zamglonego X>X’’.
Współczynnik wilgoci mo
ż
na te
ż
okre
ś
li
ć
jako stosunek g
ę
sto
ś
ci pary do g
ę
sto
ś
ci
powietrza suchego:
,
622
,
0
622
,
0
s
s
p
p
g
p
p
p
p
p
p
p
X
⋅
−
⋅
⋅
=
−
⋅
=
=
ϕ
ϕ
ρ
ρ
gdzie:
p
p
– para przegrzana,
p
s
– para nasycona sucha.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
42
Entalpia powietrza wilgotnego
Entalpię powietrza wilgotnego odnosi się do sumy 1 kg powietrza suchego i X kg wilgoci
przypadającej na 1 kg powietrza suchego:
p
g
X
i
X
i
I
⋅
+
=
+
)
1
(
gdzie:
i
g
– entalpia 1 kg powietrza suchego [kcal/mol],
i
p
– entalpia 1 kg pary wodnej [kcal/mol],
X – zawartość wilgoci [kg/kg].
Dla powietrza suchego i
g
wynosi:
t
c
i
p
g
⋅
=
gdzie:
c
p
– ciepło właściwe, w zakresie niskich temperatur c
p
=0,24 kcal/mol,
t – temperatura powietrza [°C]
stąd
t
i
g
⋅
=
24
,
0
, entalpia pary wodnej w niskich temperaturach:
t
i
p
47
,
0
595
+
=
.
Mo
ż
na wi
ę
c entalpi
ę
I zapisa
ć
:
X
t
X
t
I
⋅
+
+
=
47
,
0
595
24
,
0
Wykresy i–x powietrza wilgotnego
to wykresy w układzie entalpia – zawarto
ść
wilgoci.
Pozwalaj
ą
one w łatwy sposób interpretowa
ć
przeprowadzane rozwa
ż
ana i obliczenia
zwi
ą
zane z wilgotnym powietrzem, unikaj
ą
c wielu
ż
mudnych oblicze
ń
.
W praktyce mamy do czynienia na ogół z powietrzem o ci
ś
nieniu około 1 MPa. Rysunek
23 przedstawia wykres dla powietrza wilgotnego pod tym wła
ś
nie ci
ś
nieniem. Dlatego mo
ż
na
z niego korzysta
ć
tylko wtedy gdy ci
ś
nienie powietrza wilgotnego zawiera si
ę
w przedziale
0,097÷0,103 MPa.
Rys. 23.
Wykres i–x dla powietrza wilgotnego pod ciśnieniem 0,1MPa [11]
O
ś
rz
ę
dnych tego wykresu to skala entalpii wła
ś
ciwych, za
ś
o
ś
odci
ę
tych dotyczy
współczynników wilgoci. Linie jednakowych entalpii wła
ś
ciwych biegn
ą
na wykresie
uko
ś
nie, natomiast linie jednakowego współczynnika wilgoci to linie pionowe. Na wykresie
dwa obszary, mianowicie obszar mgły (obszar powietrza zamglonego) i obszar powietrza nie
nasyconego wilgoci
ą
oddzielone s
ą
od siebie krzyw
ą
1
=
ϕ
. Jest ona miejscem
geometrycznym punktów oznaczaj
ą
cych nasycone wilgoci
ą
powietrze nie zamglone.
Do typowych przemian izobarycznych powietrza wilgotnego zaliczy
ć
mo
ż
na:
a)
ogrzewanie lub chłodzenie przy stałym X,
b)
mieszanie strug powietrza,
c)
mieszanie gazu wilgotnego z wod
ą
ciekł
ą
lub par
ą
wodn
ą
.
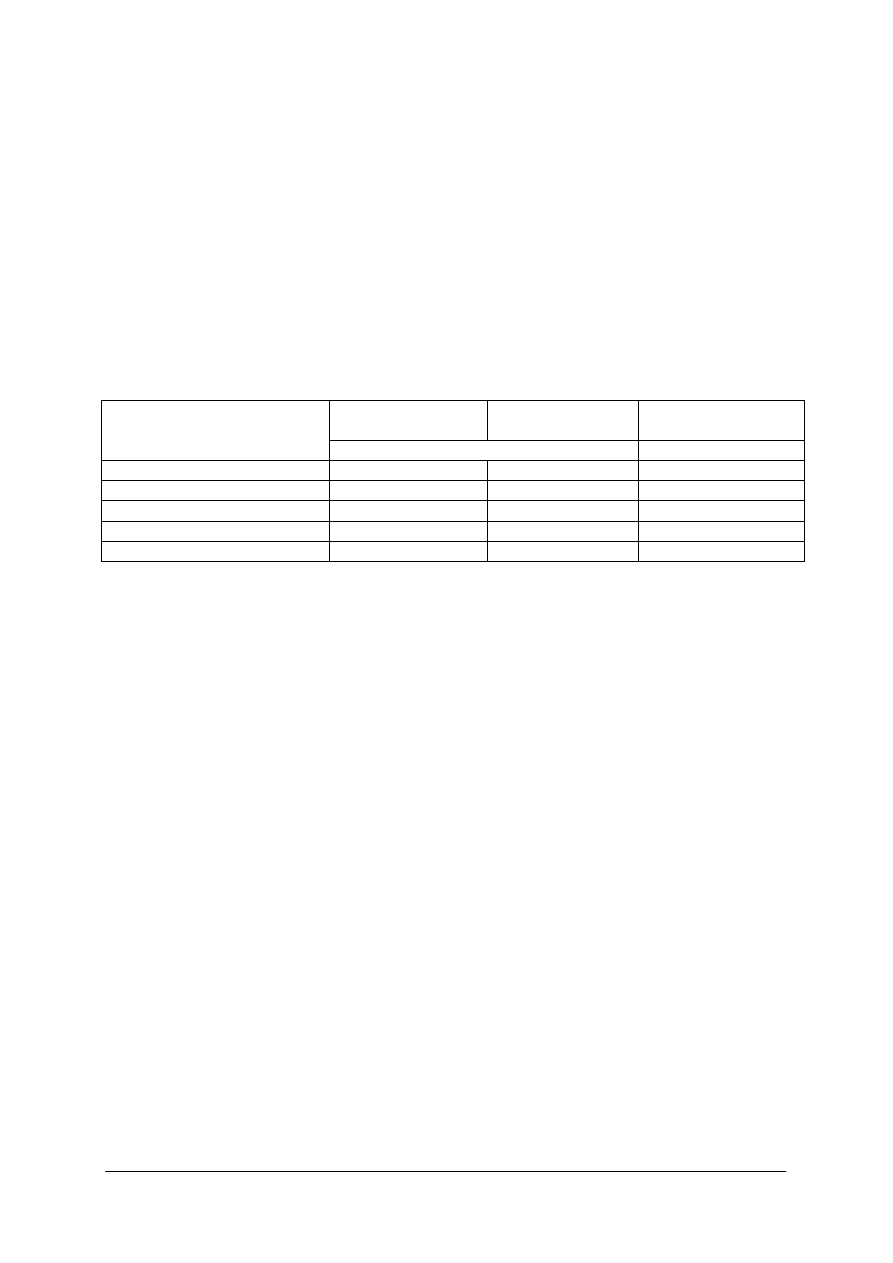
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
43
Teoretyczne podstawy procesów spalania
Surowcem wykorzystywanym w produkcji paliw dla silników okrętowych jest ropa
naftowa, która w zależności od pochodzenia ma różną zawartość składników, istotnych
z punktu widzenia przeznaczenia, a należą do nich m.in.: lepkość, gęstość, temperatura
krzepnięcia, zawartość siarki. W stanie surowym ropa praktycznie nie ma żadnego
zastosowania, dopiero proces rafinacji powoduje wydzielenie z niej wielu cennych
produktów, w tym paliw i olejów okrętowych. Najprostszym przykładem rafinacji jest
podgrzewanie ropy w wyniku czego dochodzi do odparowania najlżejszych frakcji
w pierwszej kolejności, a następnie coraz cięższych. Każda odparowana frakcja jest następnie
poddana kondensacji drogą schładzania. Proces taki jest przeprowadzany w wysokiej
kilkunastometrowej kolumnie w której najcięższe frakcje osadzają się na dole, najlżejsze zaś
na górze.
Tabela 7.
Charakterystyka podstawowych paliw do wysokoprężnych silników okrętowych [1]
Oleje gazowe
Okrętowe oleje
napędowe
Oleje ciężkie
Własności
wartości średnie
wartości maksym.
Gęstość przy 20°C [kg/dm
3
]
0,83÷0,86
0,84÷0,90
0,99 i więcej
Lepkość przy 20°C [cSt]
4,0÷6,0
5,0÷15,0
3000
Zawartość siarki [%]
0,3÷1,0
0,5÷1,5
4,0
Zawartość popiołu [%]
ślady
0,005–0,025
0,12
Zawartość wody [%]
ślady
0,1
2,0
Ogromne potrzeby otrzymywania jak największych ilości benzyn z ropy naftowej
powodują, że obecnie powszechnie stosuje się w rafineriach tzw. kraking termiczny i kraking
katalityczny. Dzięki tym procesom uzyskuje się więcej lepszych i droższych paliw, natomiast
jakość tzw. paliw pozostałościowych tj. ciężkich maleje m.in. ze względu na zanieczyszczenia
przedostające się do tego paliwa.
Wymagania dotyczące paliw zależą od typu i wielkości silnika, na ogół na statkach
stosowane są trzy podstawowe typy:
−
olej gazowy (Gas Oil), mają zastosowanie we wszystkich silnikach wysokoprężnych,
gdyż nie wymagają urządzeń oczyszczających (za wyjątkiem filtrów),
−
olej napędowy (Marine Diesel Oil), stosuje się go w większości silników
wysokoprężnych ze wskazaniem na dodatkowe oczyszczenie w wirówkach. Ponadto na
statku istnieje możliwość przedostawania się wody do paliwa, dlatego stosuje się
odwadnianie zbiorników paliwa, zwłaszcza zbiorników rozchodowych.
−
olej ciężki (Heavy Fuel Oil), musi być przygotowany do użycia na statku przez
sedymentację grawitacyjną (osadzanie), wirowanie i filtrowanie.
Ze względu na dużą ilość zanieczyszczeń, paliwa ciężkie wymagają dokładnego procesu
oczyszczania, a należą do nich takie procesy jak: podgrzewanie i odwadnianie zbiorników
osadowych, wirowanie w podwyższonej temperaturze 70÷98°C oraz podgrzanie paliwa
dostarczanego do silnika (90÷150°C), wszystko po to, aby osiągnąć optymalną lepkość paliwa
na dolocie do pomp wtryskowych.
Podstawowym kryterium charakteryzującym jakość paliwa jest lepkość. Jest to
właściwość ciał określająca wielkość siły oporu przy przesuwaniu względem siebie sąsiednich
warstw. W praktyce spotykane są zróżnicowane jednostki lepkości i różne sposoby jej
wyznaczania. Lepkość paliwa zależy w dużym stopniu od temperatury. Gdy jest zbyt mała

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
44
może spowodować zatarcie pomp wtryskowych, zaś zbyt duża uniemożliwia przepompowanie
paliwa. Zalecana wartość lepkości wynosi 10–15 cSt przed pompami wtryskowymi.
Ważnym parametrem paliwa ciekłego jest też wartość opałowa, która określa ilość ciepła
uzyskanego ze spalenia całkowitego i zupełnego 1 kg paliwa po ochłodzeniu spalin do
temperatury początkowej powietrza i paliwa, zakładając, że woda jako produkt spalania
wodoru pozostaje w postaci pary (nie odzyskujemy ciepła skraplania tej pary). Jednostkowe
zużycie paliwa podaje się dla typowej wartości opałowej paliwa, za którą przyjmuje się
42707 kJ/kg jest to standardowa wartość opałowa paliwa.
Wraz ze wzrostem gęstości paliwa maleje jego wartość opałowa, gdyż zmniejsza się
wówczas udział ilości atomów wodoru, a rośnie udział ilości atomów węgla
w węglowodorach zawartych w paliwie (wartość opałowa wodoru jest dużo większa od
wartości opałowej węgla).
Samo spalanie to zjawisko chemiczne, które polega na szybkim łączeniu się palnych
składników paliwa z tlenem pobieranym najczęściej z powietrza. Podczas tego procesu
wyzwala się duża ilości ciepła i ewentualnie światła. Składnikami palnymi paliw, które
utleniają się podczas spalania są: węgiel C, wodór H, siarka S oraz niektóre związki
chemiczne tych pierwiastków: metan CH
4
, tlenek węgla CO.
Przebieg spalania podstawowych składników paliwa można przedstawić następująco:
−
Podczas spalania węgla C jeden jego atom łączy się z dwoma atomami tlenu O, tworząc
cząsteczkę niepalnego dwutlenku węgla, wg równania C + O
2
= CO
2
,
−
W trakcie spalania wodoru dwie cząsteczki wodoru i jedna cząsteczka tlenu daje dwie
cząsteczki wody w postaci pary wodnej wg równania: 2H
2
+ O
2
= 2H
2
O,
−
Proces spalania siarki odbywa się wg równania: S + O
2
= SO
2
tworzy się przy tym
dwutlenek siarki.
−
Spalanie metanu ma przebieg: CH
4
+ 2O
2
= CO
2
+ 2H
2
O. Powstaje dwutlenek węgla
i para wodna.
Podczas każdej z podanych wyżej reakcji wydziela się ciepło.
W zależności od warunków, w których odbywa się spalanie, mamy do czynienia ze
spalaniem całkowitym, niecałkowitym, zupełnym lub niezupełnym.
−
spalanie całkowite polega na tym, że spalaniu ulega cala masa paliwa,
−
spalanie niecałkowite zachodzi wówczas, gdy w pozostałych po spaleniu ciałach stałych
znajdują się jeszcze nie związane chemicznie pierwiastki substancji palnej,
−
spalanie zupełne to spalanie, w wyniku którego zawarty w paliwie węgiel, wodór, siarka,
metan, spalają się na dwutlenek węgla, parę wodną i dwutlenek siarki.
−
spalanie niezupełne występuje wtedy, gdy w gazach spalinowych znajdują się jeszcze nie
spalone gazy palne, np. H
2
, CO.
Znajomość ilości oraz skład powstających spalin przy spalaniu paliwa o danym składzie
daje nam możliwość właściwego zaprojektowania urządzenia, w którym zachodzi proces
spalania.
Podczas procesu spalania bierze udział masa palna paliwa razem z zawartą w nim
wilgocią oraz użyta do spalania rzeczywista ilość powietrza (Paliwa ciekłe charakteryzują się
dużą wartością opałową oraz brakiem popiołu i wilgoci). Wspólna masa tych składników
przekłada się na ilość otrzymywanych spalin. W skład spalin nie wchodzą natomiast zawarte
w paliwie części niepalne.
Do pomiaru składu spalin wykorzystuje się zazwyczaj analizator chemiczny zwany
aparatem Osrata. Mierzy on objętościowy skład spalin suchych, czyli skład jaki miałyby
spaliny, gdyby usunięto z nich H
2
O.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
45
4.4.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jakie rodzaje sprężarek stosuje się w przemyśle?
2.
Jak jest zbudowana sprężarka wielostopniowa?
3.
Co rozumiemy pod pojęciem „gazy wilgotne”?
4.
Czym jest entalpia powietrza wilgotnego i w jaki sposób przedstawia się ją na
wykresach?
5.
Jakie parametry charakteryzują paliwa silników wysokoprężnych?
6.
Od czego zależy skład spalin?
4.4.3. Ćwiczenia
Ćwiczenie 1
Na podstawie otrzymanych foliogramów, instrukcji obsługi sprężarek tłokowych
i wirnikowych, a także ich dokumentacji technicznej rozróżnij rodzaje sprężarek oraz wyjaśnij
zasadę ich pracy. Podaj zastosowanie tego typu sprężarek w okrętownictwie.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
zapoznać się z otrzymaną dokumentacją techniczną oraz instrukcjami obsługi sprężarek,
2)
rozróżnić rodzaje sprężarek na podstawie ich budowy (foliogramy),
3)
wyjaśnić na podstawie wykresów zasadę pracy sprężarek jedno i wielostopniowych,
4)
wyjaśnić od czego zależy sprawność objętościowa sprężarek,
5)
podać kilka przykładów zastosowania sprężarek w okrętownictwie.
Wyposażenie stanowiska pracy:
−
foliogramy z różnymi typami sprężarek,
−
foliogramy z wykresami pracy sprężarek,
−
instrukcje obsługi sprężarek tłokowych i wirnikowych,
−
dokumentacja techniczna,
−
przybory do pisania.
Ćwiczenie 2
Posługując się wykresem Ramzina-Molliera (i–x) oraz wiedząc, że:
a)
powietrze w pomieszczeniu ma wilgotność względną 50% i temperaturę 35°C,
b)
entalpia powietrza wynosi 33 kcal/kg powietrza suchego, zaś zawartość wilgoci jest
równa 36g H
2
O/kg powietrza suchego,
c)
ciśnienie parcjalne pary wodnej w powietrzu to 50 mmHg, a entalpia tego powietrza
wynosi 40 kcal/kg powietrza suchego.
Znajdź wskazane dane.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
zapoznać się z konstrukcją wykresu i-x,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
46
2)
odczytać z wykresu brakujące dane, które wskaże Ci nauczyciel, mogą to być
(w zależności od treści zadania) parametry podane poniżej:
p
p
p
– ciśnienie cząstkowe pary w wilgotnym powietrzu [mmHg],
X – zawartość wilgoci w kg na kg suchego powietrza [kg/kg],
t – temperatura [°C],
I – entalpia powietrza suchego [kcal/kg],
ϕ
– wilgotność względna [%],
3)
zapisać odczytane wyniki.
Wyposażenie stanowiska pracy:
−
wykresy i–x powietrza wilgotnego (wykresy Ramzina-Molliera i-x),
−
arkusze papieru,
−
przybory do pisania.
Ćwiczenie 3
Korzystając z charakterystyk różnych paliw, wyjaśnij jakie jest zapotrzebowanie
powietrza podczas procesów spalania dla paliw ciekłych, stałych i gazowych. Porównaj ich
wartość opałową. Podczas omawiania zwróć szczególną uwagę na paliwa wysokoprężnych
silników okrętowych.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
dokładnie przejrzeć otrzymane tablice z charakterystykami różnych paliw,
2)
odszukać informacje nt. zapotrzebowania powietrza podczas procesu spalania oraz
wartości opałowe paliw,
3)
omówić (zinterpretować) na forum grupy wspomniane parametry w czasie 5÷10 minut.
Wyposażenie stanowiska pracy:
−
tablice parametrów różnych paliw: ciekłych, stałych i gazowych,
−
tablice charakterystyk paliw wysokoprężnych silników okrętowych,
−
tablica, przyrządy do pisania.
4.4.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
wyjaśnić zasadę pracy sprężarek tłokowych i wirnikowych?
2)
zinterpretować wykresy pracy sprężarek oraz podać ich zastosowanie
w okrętownictwie?
3)
omówić obieg siłowni parowej?
4)
podać sposoby zwiększania sprawności siłowni parowych?
5)
scharakteryzować parametry powietrza wilgotnego?
6)
odczytać informacje na wykresie i–x powietrza wilgotnego?
7)
wyjaśnić procesy spalania?
8)
podać informacje o paliwach stosowanych w siłowniach okrętowych?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
47
5. SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Zapoznaj się z zestawem zadań testowych.
4.
Test zawiera 20 zadań i sprawdza Twoje wiadomości dotyczące posługiwania się
pojęciami z zakresu termodynamiki. Tylko jedna odpowiedź do każdego zadania jest
prawidłowa.
5.
Udzielaj odpowiedzi tylko na załączonej karcie odpowiedzi. Zakreśl prawidłową
odpowiedź.
6.
Jeżeli się pomylisz, błędną odpowiedź weź w kółko i zakreśl odpowiedź prawidłową.
Jeżeli zakreślisz więcej niż jedną odpowiedź do jednego zadania, nie zostanie ono
ocenione.
7.
Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
8.
Kiedy udzielenie odpowiedzi będzie Ci sprawiało trudność, odłóż jego rozwiązanie
na później; wrócisz do niego, gdy zostanie Ci wolny czas.
9.
Na rozwiązanie testu masz 45 minut.
Powodzenia!
ZESTAW ZADAŃ TESTOWYCH
1. Ilość substancji, nazywana inaczej licznością materii, to jedna z podstawowych wielkości
fizycznych układu SI, której jednostkę wyrażamy jako
a)
mol.
b)
cd.
c)
kg.
d)
A.
2. Jednostka
⋅
2
s
m
kg
odnosi się bezpośrednio do
a)
ciśnienia [Pa].
b)
siły [N].
c)
pracy [J].
d)
mocy [W].
3. Prawie wszystkie substancje mogą przechodzić z jednego stanu skupienia w inny.
Przejście fazowe ze stanu stałego w gazowy to
a)
topnienie.
b)
sublimacja.
c)
resublimacja.
d)
parowanie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
48
4. Aby móc przeprowadzić określone rozważania dotyczące pewnej części przestrzeni
materialnej, ograniczonej pewną powierzchnią, należy posłużyć się w tej sytuacji
pojęciem
a)
gazów doskonałych.
b)
energii.
c)
układu termodynamicznego.
d)
parametru.
5. Jeżeli wymiana ciepła zachodzi w obrębie tego samego ciała, w którym istnieją dwie
różne temperatury to proces ten określa się w termodynamice jako
a)
przewodzenie lub konwekcja ciepła.
b)
promieniowanie ciepła.
c)
przejmowanie i przenikanie ciepła.
d)
nie jest możliwe, aby w obrębie tego samego ciała istniały dwie różne temperatury.
6. Czynnikiem biorącym udział podczas wymiany ciepła na statku jest
a)
woda słodka i kotłowa, woda morska.
b)
olej smarowy, paliwa lekkie i ciężkie.
c)
para wodna: mokra, przegrzana, nasycona.
d)
wszystkie czynniki wymienione wyżej łącznie ze spalinami z kotłów i silników
spalinowych.
7. Równanie stanu gazu doskonałego podane przez Clapeyron’a określa związek pomiędzy
następującymi parametrami stanu
a)
ciśnieniem i objętością.
b)
objętością i temperaturą.
c)
temperaturą i ciśnieniem.
d)
ciśnieniem, objętością i temperaturą.
8. Zgodnie z prawem Gay-Lussaca, przy wszelkich zmianach stanu gazu
a)
pod stałym ciśnieniem, objętość danej masy gazu jest wprost proporcjonalna do jego
temperatury bezwzględnej.
b)
przy stałej objętości gazu stosunek ciśnienia i temperatury danej masy gazu jest stały.
c)
w stałej temperaturze, przy wszelkich zmianach ciśnienia i objętości danej masy
gazu, iloczyn ciśnienia i objętości jest wielkością stałą.
d)
prawo Gay-Lussaca nie dotyczy gazów.
9. Energia wewnętrzna gazu doskonałego i półdoskonałego zależy
a)
tylko od jego temperatury, a nie zależy od jego ciśnienia i objętości.
b)
tylko od jego ciśnienia, a nie zależy od jego temperatury.
c)
od jego temperatury i ciśnienia.
d)
nie da się jednoznacznie określić.
10. Zachowanie mieszanin gazów, np. w postaci spalin otrzymywanych przy spalaniu paliw,
opisuje prawo
a)
Boyle’a.
b)
Mariotte’a.
c)
Charlesa.
d)
Daltona.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
49
11. Przedstawiony na wykresie proces termodynamiczny, zależny od sposobu doprowadzenia
lub odprowadzenia ciepła dotyczy
a)
przemiany izochorycznej.
b)
przemiany izobarycznej.
c)
przemiany izotermicznej.
d)
przemiany politropowej.
12. Podczas badania przemian termodynamicznych stosuje się często metodę graficzną,
polegającą na sporządzaniu wykresów. Najczęściej stosowany jest układ pracy określany
jako układ
a)
i-s.
b)
T-s.
c)
p-v.
d)
i-x.
13. Jeśli podczas podgrzewania czystej wody doprowadzimy do jej wrzenia i naczynie
będziemy wciąż podgrzewać to
a)
temperatura nie będzie już wzrastać.
b)
temperatura gwałtownie wzrośnie.
c)
nastąpi skraplanie.
d)
będzie powstawało coraz więcej pary, a po całkowitym odparowaniu cieczy nastąpi
dalszy wzrost temperatury.
14. Obliczając parametry par nasyconych i przegrzanych najmniej czasochłonnym
i najbardziej rozpowszechnionym sposobem jest
a)
wykorzystanie równania stanu gazu rzeczywistego.
b)
skorzystanie z zależności aproksymacyjnych.
c)
użycie tablic termodynamicznych.
d)
nie ma znaczenia, gdyż wszystkie sposoby wymagają czasu i precyzji.
15. Termodynamiczny parametr stanu układu, który w interpretacji statystycznej, określa
stopień nieuporządkowania układu tj. stopień jego wyjątkowości rozumiemy jako
a)
pracę techniczną.
b)
pracę zewnętrzną.
c)
entropię.
d)
entalpię.
16.
W
sytuacji, kiedy układ termodynamiczny, po cyklu kolejnych przemian czynnika, wraca
do stanu wyjściowego, mamy do czynienia
a)
z obiegiem termodynamicznym Diesla.
b)
z obiegiem termodynamicznym Carnota.
c)
z termodynamicznym obiegiem porównawczym.
d)
ogólnie z termodynamicznym obiegiem, który można przedstawić w układzie pracy.
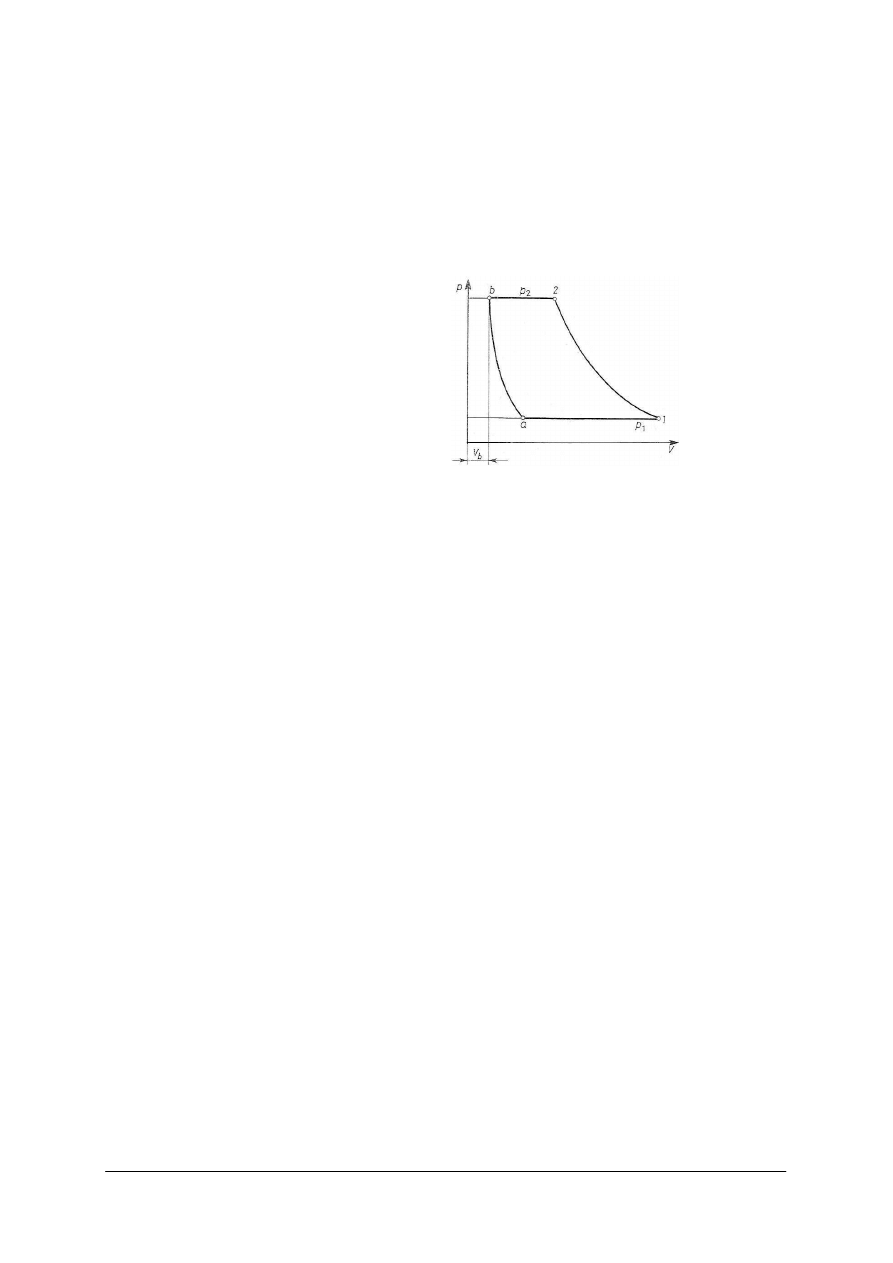
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
50
17. Odwracalny obieg o największym znaczeniu w termodynamice, który w układzie p-v
składa się z dwóch odcinków izoterm i z dwóch odcinków adiabat nazywamy obiegiem
a)
Sabathe’a.
b)
Carnota.
c)
Otta.
d)
Clapeyrona.
18. Przedstawiony na wykresie p-v przebieg sprężania dotyczy
a)
teoretycznej sprężarki tłokowej.
b)
teoretycznej sprężarki wirnikowej.
c)
rzeczywistej sprężarki tłokowej.
d)
rzeczywistej sprężarki wirnikowej.
19. Które z podanych niżej równań, dotyczące spalania metanu jest zapisane prawidłowo
a)
CH
4
+ 2O
2
= CO
2
+ 2H
2
O.
b)
2CH
4
+ 2O
2
= CO
2
+ 2H
2
O.
c)
2CH
4
+ O
2
= 2CO
2
+ H
2
O.
d)
2CH
4
+ 2O
2
= 2CO
2
+ 2H
2
O.
20. Spalanie zupełne to spalanie w wyniku, którego
a)
zawarty w paliwie węgiel, wodór, siarka, metan, spalają się na dwutlenek węgla, parę
wodną i dwutlenek siarki.
b)
po spaleniu, w pozostałych ciałach stałych znajdują się jeszcze nie związane
chemicznie pierwiastki substancji palnej.
c)
w gazach spalinowych znajdują się jeszcze nie spalone gazy palne, np. H
2
, CO.
d)
nie występuje w rzeczywistości ten rodzaj spalania.
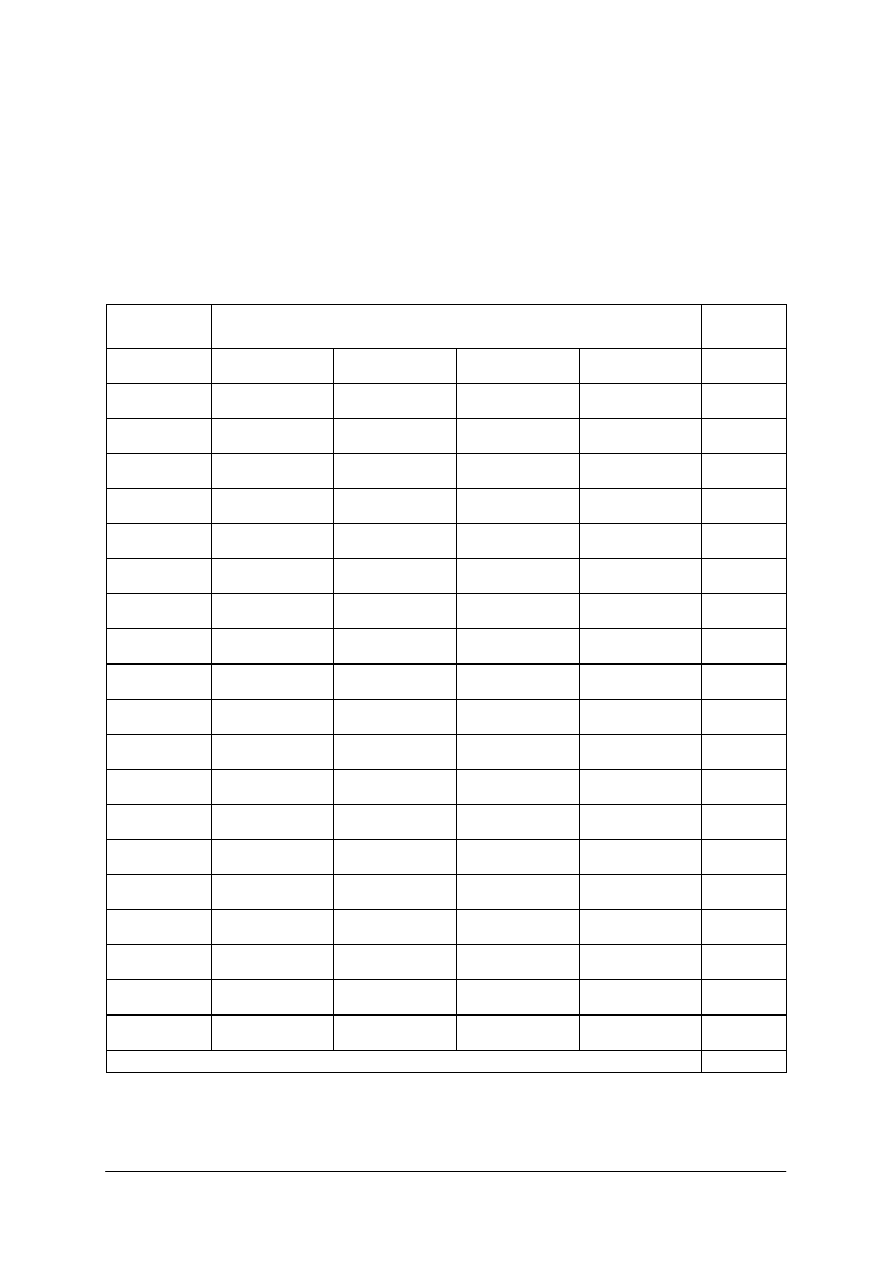
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
51
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Posługiwanie się pojęciami z zakresu termodynamiki
Zakreśl poprawną odpowiedź
.
Nr
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
a
b
c
d
3
a
b
c
d
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
a
b
c
d
9
a
b
c
d
10
a
b
c
d
11
a
b
c
d
12
a
b
c
d
13
a
b
c
d
14
a
b
c
d
15
a
b
c
d
16
a
b
c
d
17
a
b
c
d
18
a
b
c
d
19
a
b
c
d
20
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
52
6.
LITERATURA
1.
Herdzik J.: Poradnik motorzysty okrętowego. Trademar, Gdynia, 2007
2.
Hołyst R., Poniewierski A., Ciach A.: Termodynamika dla chemików, fizyków
i inżynierów. Instytut Chemii Fizycznej PAN i Szkoła Nauk Ścisłych, Warszawa 2003
3.
Mac S.: Termodynamika, WSiP, Warszawa 1980
4.
Madejski
J.,
Termodynamika
techniczna.
Oficyna
wydawnicza
Politechniki
Rzeszowskiej, Rzeszów 2000
5.
Siuta W.: Mechanika techniczna. WSiP, Warszawa 2000
6.
Siuta W., Rososiński S., Kozak B.: Zbiór zadań z mechaniki technicznej. WSiP,
Warszawa 2005
7.
Staniszewski B.: Termodynamika. PWN, Warszawa 1982
8.
Szargut J., Guzik A., Górniak H.: Zadania z termodynamiki technicznej. Wydawnictwo
Politechniki Śląskiej, Gliwice 2001
9.
Szymczyk T., Rabiej S., Pielesz A., Desselberger J.: Tablice matematyczne, fizyczne,
chemiczne i astronomiczne. Świat Książki, Warszawa 2003
10.
Teodorczyk A.: Termodynamika techniczna. WSiP, Warszawa 2005
11.
Wilk S.: Termodynamika techniczna. WSiP, Warszawa 2004
Wyszukiwarka
Podobne podstrony:
05 Posługiwanie się z pojęciami z zakresu ekologii
05 Poslugiwanie sie z pojeciami Nieznany (2)
09 Posługiwanie się pojęciami z zakresu chemii stosowanej
05 Posługiwanie się dokumentacją techniczną (2)
05 Posługiwanie się dokumentacją techniczną
05 Poslugiwanie sie dokumentacj Nieznany (2)
kłopotliwe, dyskryminacja, DYSKRYMINACJA: posługując się pojęciem "dyskryminacji" wrogowie
05 Posługiwanie się dokumentacją techniczną
05 Posługiwanie się dokumentacją techniczną (2)
05 Posługiwanie się dokumentacją techniczną
05 Posługiwanie się dokumentacją konstrukcyjną
05 Posługiwanie się dokumentacją techniczną
05 Posługiwanie się dokumentacją techniczną
Posługiwanie się podstawowymi pojęciami z zakresu budowy rurociągów
Pojęcie mnożenia i dzielenia w klasie pierwszej wprowadza się propedeutycznie w zakresie0x
05 Test sprawdzajacy posługiwanie sie Pismem św. - klasa V, konspekty scenariusze, testy
02 Posługiwanie się podstawowymi pojęciami
Posługiwanie się podstawowymi pojęciami fizykochemicznymi
02 Posługiwanie się podstawowymi pojęciami
więcej podobnych podstron