
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Jolanta Wąsikowska
Bartosz Wąsikowski
Wykonywanie pomiarów parametrów procesowych
311[02].Z1.04
Poradnik dla nauczyciela
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr Urszula Ciosk-Rawluk
mgr Barbara Przedlacka
Opracowanie redakcyjne:
mgr Jolanta Łagan
Konsultacja:
mgr inż. Gabriela Poloczek
Poradnik stanowi obudowę dydaktyczn
ą programu jednostki modułowej 311[02].Z1.04,
„Wykonywanie pomiarów parametrów procesowych”, zawartego w modułowym programie
nauczania dla zawodu technik analityk.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
3
2. Wymagania wstępne
5
3. Cele kształcenia
6
4. Przykładowe scenariusze zajęć
7
5. Ćwiczenia
12
5.1. Podstawy metrologii
12
5.1.1. Ćwiczenia
12
5.2. Wybrane pomiary w procesach technologicznych
14
5.2.1. Ćwiczenia
14
5.3. Wybrane zagadnienia analizy instrumentalnej
16
5.3.1. Ćwiczenia
16
5.4. Wybrane zagadnienia z kontroli procesów technologicznych
19
5.4.1. Ćwiczenia
19
6. Ewaluacja osiągnięć ucznia
23
7. Literatura
37

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Przekazujemy Państwu Poradnik dla nauczyciela „Wykonywanie pomiarów parametrów
procesowych”, który będzie pomocny w prowadzeniu zajęć dydaktycznych w szkole
kształcącej w zawodzie technik analityk 311[02].
Wskazane jest, aby zajęcia dydaktyczne były prowadzone różnymi metodami ze
szczególnym uwzględnieniem aktywizujących metod nauczania:
−
samokształcenia kierowanego,
−
tekstu przewodniego,
−
ćwiczeń laboratoryjnych,
−
gier dydaktycznych,
−
metody projektów,
−
dyskusji dydaktycznej.
Formy organizacyjne pracy uczniów mogą być zróżnicowane, począwszy od
samodzielnej pracy uczniów do pracy zespołowej.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
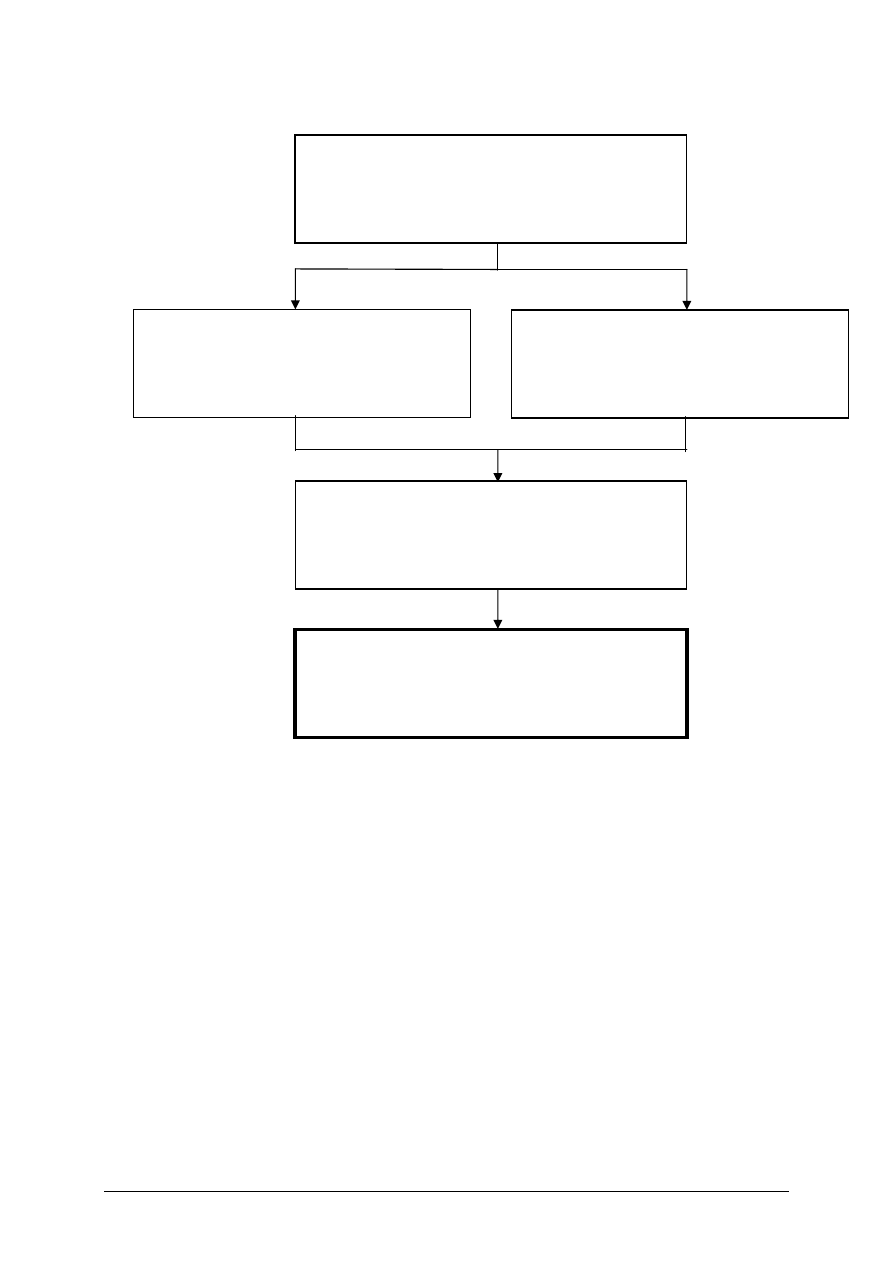
Schemat układu jednostek modułowych
311[02].Z1.01
Stosowanie zasad bezpiecznej pracy
w laboratorium
311[02].Z1
Podstawowe czynności preparatywne oraz pomiary
parametrów procesowych
311[02].Z1.02
Zastosowanie technik komputerowych
do obliczeń chemicznych
311[02].Z1.03
Zastosowanie technik laboratoryjnych do sporządzania
preparatów chemicznych
311[02].Z1.04
Wykonywanie pomiarów parametrów
procesowych

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej uczeń powinien umieć:
−
przestrzegać przepisów bezpieczeństwa i higieny pracy, ochrony przeciwpożarowej oraz
ochrony środowiska,
−
przestrzegać zasad dobrej techniki laboratoryjnej,
−
przestrzegać zasad bezpieczeństwa podczas badania analitycznego,
−
posługiwać się nomenklaturą związków nieorganicznych i organicznych,
−
określać właściwości fizyko-chemiczne substancji,
−
stosować stechiometrię do obliczeń chemicznych,
−
stosować obowiązujące jednostki układu SI,
−
sporządzać wykresy i interpretować wyniki,
−
sporządzać roztwory o określonym stężeniu,
−
przygotowywać próbki materiału do analizy,
−
przygotowywać sprzęt laboratoryjny, aparaturę, odczynniki,
−
korzystać z norm, przepisów, procedur i dostępnych instrukcji,
−
określać
sposoby
kontroli
procesów
technologicznych,
zastosować
kontrolę
międzyoperacyjną i finalną,
−
pobierać próbki analityczne w warunkach ciągłego procesu technologicznego.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej uczeń powinien umieć:
−
scharakteryzować parametry procesowe oraz wielkości fizyczne stosowane w technologii
chemicznej i analitycznej kontroli procesów technologicznych,
−
odczytać i sporządzić schematy aparatury pomiarowej stosowanej w technologii
chemicznej,
−
wyjaśnić budowę i działanie aparatury pomiarowej,
−
obsłużyć aparaturę pomiarową oraz dokonać jej konserwacji,
−
określić zastosowanie aparatury pomiarowej w analityce i procesach technologicznych,
−
dokonać
kontroli
analitycznej
charakterystycznej
dla
technologii
zakładów
przemysłowych,
−
dokonać pomiaru wartości wielkości fizycznych charakteryzujących materiały,
−
określić użytkowe właściwości substancji, jak: odporność na temperaturę i czynniki
chemiczne,
−
sporządzić dokumentację pomiarów i badań oraz zinterpretować uzyskane wyniki,
−
przedstawić wyniki w formie tabelarycznej i graficznej,
−
zinterpretować wyniki analiz ilościowych z zastosowaniem metod statystycznych,
−
zorganizować stanowisko pracy z uwzględnieniem przepisów bezpieczeństwa i higieny
pracy oraz ochrony przeciwpożarowej,
−
dokonać obserwacji przebiegu ćwiczeń, zapisać wartości mierzonych wielkości
i parametrów oraz istotne zjawiska i przemiany,
−
scharakteryzować procesy jednostkowe realizowane w węźle technologicznym oraz określić
poziom zagrożenia powodowanego ewentualną awarią,
−
dokonać analizy graficznego przedstawienia koncepcji procesowej i określić położenie
węzłów analitycznych,
−
zastosować zasady technologiczne do oceny organizacji systemu kontroli analitycznej,
−
określić
sposoby
kontroli
procesów
technologicznych,
zastosować
kontrolę
międzyoperacyjną i finalną,
−
pobrać próbki analityczne w warunkach ciągłego procesu technologicznego,
−
scharakteryzować proces technologiczny, maszyny i urządzenia techniczne oraz budowę
i działanie aparatury pomiarowej,
−
wykonać pomiary parametrów procesowych i wielkości stosowanych w analityce,
−
dokonać kontroli analitycznej charakterystycznej dla technologii zakładów regionalnych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. PRZYKŁADOWE SCENARIUSZE ZAJĘĆ
Scenariusz zajęć 1
Osoba prowadząca:
…………………………………
Modułowy program nauczania:
Technik analityk 311[02]
Moduł:
Podstawowe czynności preparatywne oraz pomiary
parametrów procesowych 311[02].Z1
Jednostka modułowa:
Wykonywanie
pomiarów
parametrów
procesowych
311[02].Z1.04
Temat: Metody chromatograficzne stosowane w analizie chemicznej.
Cel ogólny: Zapoznanie uczniów z podstawami chromatografii, stosowanych technik,
aparatury, zasad identyfikacji i rozdziału. Kształtowanie umiejętności wyboru
metody i interpretacji wyników pomiarów.
Po zakończeniu zajęć edukacyjnych uczeń powinien umieć:
−
wyjaśnić podstawy teoretyczne chromatografii,
−
dokonać podziałów metod chromatograficznych,
−
scharakteryzować stosowane techniki i aparaturę,
−
zorganizować stanowisko pracy,
−
dobrać metodę analizy chromatograficznej do konkretnego przypadku,
−
obserwować i wyciągnąć wnioski z przeprowadzanych eksperymentów,
−
zinterpretować otrzymane wyniki,
−
skonstruować logiczne wnioski,
−
skorzystać z różnych źródeł informacji.
Metody nauczania–uczenia się:
−
klasyczna metoda problemowa,
−
metoda projektów,
−
ćwiczenia praktyczne (przedmiotowe),
−
metody eksponujące: film, pokaz, prezentacja multimedialna.
Formy organizacyjne pracy uczniów:
−
praca w zespole,
−
praca indywidualna.
Czas: 270 minut dydaktycznych.
Uczestnicy:
−
uczniowie szkoły kształcącej w zawodzie technik analityk.
Środki dydaktyczne:
−
prezentacje,
−
foliogramy, fotografie, grafoskop,
−
zastaw zadań lub instrukcja do ćwiczeń,
−
prezentacje multimedialne przygotowane przez uczniów pod kierunkiem nauczyciela,
−
kalendarz chemiczny, literatura popularno-naukowa, Internet,
−
sprzęt laboratoryjny i odczynniki do badań.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
Etapy pracy
a)
Podział uczniów na grupy, Podanie tematów, planu pracy i terminów, przygotowanie
projektów:
gr. I – chromatografia gazowa,
gr. II – chromatografia bibułowa,
gr. III – chromatografia cienkowarstwowa,
gr. IV – chromatografia cieczowa kolumnowa klasyczna ciśnieniowa,
gr. V – chromatografia cieczowa adsorpcyjna, żelowa,
gr. VI – chromatografia rozdzielcza (podziałowa).
b)
Wskazanie źródeł poszukiwania materiałów oraz ich opracowanie według schematu:
podstawy teoretyczne, stosowana aparatura, metoda wykonania (w tym przeprowadzenie
prostego ćwiczenia lub interpretacja wyników), interpretacja wyników, zastosowanie
metody.
c)
Prezentacja poszczególnych projektów przygotowanych przez wyznaczone grupy
uczniów z wykorzystaniem zebranych materiałów, prezentacji multimedialnej oraz
prostych ćwiczeń.
d)
Opracowanie prezentacji w formie streszczenia (kompendium wiedzy).
Przebieg zajęć:
1.
Wprowadzenie. Zapoznanie uczniów z tematami zajęć.
2.
Omówienie celów zajęć, sposobu przeprowadzenia, ustalenie zasad pracy i ewaluacji.
3.
Sformułowanie problemów, które uczniowie powinni rozwiązać w celu przedstawienia
projektów.
4.
Prezentacja projektów. Prowadzenie przez wyznaczone grupy uczniów kolejnych etapów
zajęć. Nauczyciel nadzoruje i koordynuje pracę uczniów, poprawia ewentualne błędy, dba
o sprawne i rzeczowe przeprowadzenie prezentacji.
5.
Uczniowie prezentują swoje projekty według schematu, podanego w etapie wstępnym.
Wykonują proste doświadczenie (ćwiczenie) lub interpretują
wyniki analiz
chromatograficznych (przy chromatografii gazowej i ciśnieniowej). Omawiają sposób
analizy, wyciągają wnioski. Prezentują zakres stosowania metody oraz jej zalety i wady.
6.
Przekazują kompendium wiedzy ze swojej prezentacji pozostałym uczniom.
7.
Uczniowie – słuchacze – przedstawiają swoje propozycje oceny przygotowania
i przeprowadzenie prezentacji.
Zakończenie zajęć
−
Podsumowanie poznanych wiadomości.
−
Ocena projektów i prezentacji w tym: poprawność merytoryczna projektu, sposób
prezentacji, język prezentacji, przygotowanie kompendium wiedzy. Uzasadnienie oceny.
Praca domowa
−
Zaproponuj techniki identyfikacji aminokwasów lub witaminy C w produktach
spożywczych.
−
Przeanalizuj zalety i wady dwóch wybranych metod chromatograficznych.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
−
Sprawozdanie z pracy domowej.
−
Karta ewaluacyjna.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Scenariusz zajęć 2
Osoba prowadząca:
…………………………………
Modułowy program nauczania:
Technik analityk 311[02]
Moduł:
Podstawowe czynności preparatywne oraz pomiary
parametrów procesowych 311[02].Z1
Jednostka modułowa:
Wykonywanie pomiarów parametrów procesowych
311[02].Z1.04
Temat: Pomiary i ich błędy.
Cel ogólny: Zapoznanie uczniów z ogólną charakterystyką przyrządów pomiarowych.
Kształtowanie umiejętności obliczania wartości poprawnej wielkości
mierzonej i popełnionych błędów.
Po zakończeniu zajęć edukacyjnych uczeń powinien umieć:
−
zdefiniować podstawowe pojęcia związane z pomiarem,
−
wymienić najczęściej mierzone wielkości w procesach technologicznych,
−
wymienić scharakteryzować narzędzia oraz metody pomiarowe,
−
określić przyczyny błędów pomiaru,
−
obliczyć poprawną wartość wielkości mierzonej,
−
obliczyć błędy pomiarów,
−
przedstawić i opracować wyniki pomiarów,
−
skonstruować logiczne wnioski,
−
doskonalić własnych umiejętności i umiejętności pracy zespołowej,
−
skorzystać z różnych źródeł informacji.
Metody nauczania–uczenia się:
-
metoda przewodniego tekstu,
−
z użyciem komputera lub / i podręcznika,
−
ćwiczenie praktyczne (przedmiotowe).
Formy organizacyjne pracy uczniów:
−
praca zespołowa,
−
praca indywidualna.
Czas:
90 minut dydaktycznych.
Uczestnicy:
−
uczniowie szkoły kształcącej w zawodzie technik analityk.
Środki dydaktyczne:
−
prezentacja multimedialna, plansze i foliogramy, podręczniki,
−
modele przyrządów pomiarowych,
−
przykładowe wyniki pomiarów oraz zestawy zadań (ćwiczeń),
−
karta ewaluacyjna.
Przebieg zajęć:
1.
Zapoznanie uczniów z tematyką zajęć. Omówienie celu zajęć, przypomnienie zasad
pracy metodą tekstu przewodniego.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
2.
Analiza tekstu przewodniego według, którego uczeń poznaje podstawy pomiarów,
charakterystyki przyrządów pomiarowych i błędów. W tym celu korzysta z Internetu,
podręczników i innych źródeł informacji. Przygotowuje prezentację multimedialną.
3.
Wykonanie ćwiczeń praktycznych, w których uczeń oblicza błędy, wykonuje wykresy,
odczytuje z nich potrzebną wartość, dokonuje obliczeń.
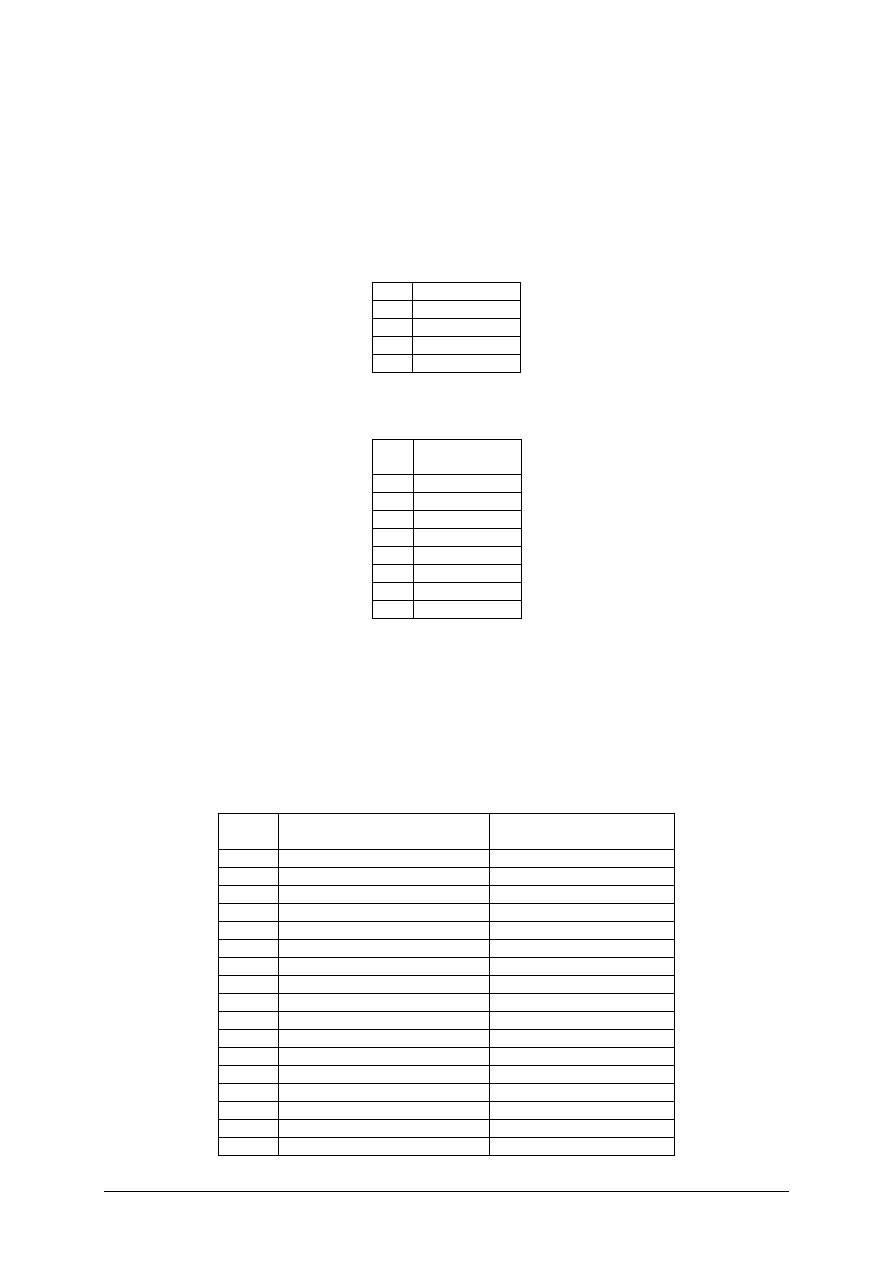
Ćwiczenie 1. Za pomocą refraktometru Abbego badano współczynnik załamania światła
[α] dla nieznanej substancji. Pomiar wykonano kilkukrotnie w temperaturze 25°C przy linii
światła sodowego D, wyniki zebrano w tabeli. Oblicz wartość średnią.
Lp.
[α]
1
1,5802
2
1,5794
3
1,5785
Śr.
Ćwiczenie 2. Oznaczono lepkość bezwzględną oleju w temperaturze 50°C.Badano czas
opadania kulki w aparacie Höpplera. Wyniki zebrano w tabeli pomiarowej:
Lp.
Czas opadania
τ [s]
1
34,48
2
34,24
3
34,00
4
34,24
5
34,48
6
34,48
7
34,24
Śr.
Oblicz średni czas opadania kulki a następnie lepkość bezwzględną w mPa·s tego oleju
w temperaturze 50°C,jeżeli pomiaru dokonano kulką o stałej K=0,0087 mPa·cm
3
/g i gęstości
2,43 g/cm
3
dla oleju o gęstości 0,891 g/cm
3
. Skorzystaj ze wzoru:
K
c
k
)
(
ρ
ρ
τ
η
−
=
Ćwiczenie 3. Metodą miareczkowania konduktometrycznego badano zawartość i stężenie
roztworu HCl. Do analizy pobrano 5 cm
3
badanego kwasu, rozcieńczono wodą
i miareczkowano 0,1molowym roztworem zasady sodowej. Wyniki zebrano w tabeli
pomiarowej:
Lp.
Objętość roztworu NaOH [cm
3
]
Kondunktancja
χ
[S]
1
0,3
2,96
2
0,5
2,89
3
1,0
2,68
4
1,5
2,45
5
2,0
2,25
6
2,5
2,05
7
3,0
1,85
8
3,5
1,64
9
4,0
1,42
10
4,5
1,20
11
5,0
1,01
12
5,5
1,10
13
6,0
1,22
14
6,5
1,35
15
7,0
1,45
16
7,5
1,51
17
8,0
1,60

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
Wykonaj wykres χ = f(v). Odczytaj objętość użytej do miareczkowania zasady. Oblicz
stężenie i masę kwasu na podstawie równania reakcji zobojętniania kwasu solnego zasadą
sodową.
4.
Nauczyciel nadzoruje i koordynuje pracę uczniów, poprawia ewentualne błędy, dba
o sprawność pracy uczniów.
5.
Dyskusja dydaktyczna. Liderzy grup omawiają sposób wykonania obliczeń, uzyskane
wyniki i interpretują je.
Zakończenie zajęć
−
zebranie wiadomości o pomiarach i błędach oznaczeń,
−
podsumowanie i ocena pracy uczniów,
−
wnioski końcowe.
Praca domowa
Oznaczano stężenie Fe
3+
metodą krzywej wzorcowej przy użyciu filtra zielonego na
spektrofotometrze SPEKOL. Badano transmitancję roztworów wzorcowych. Wyniki zebrano
w tabeli:
Numer próbki
Stężenie roztworu Fe
3+
[mg/cm
3
]
Transmitancja
[%]
1
0,0000
100,0
2
0,0008
98,5
3
0,0012
79,5
4
0,0016
74,1
5
0,0024
64,0
6
0,0040
48,2
7
0,0060
36,3
8
0,0080
29,0
9
0,0120
20,0
10
0,0200
12,5
11
0,0300
9,0
12
0,0400
7,4
Próbka 1
X
1
68,3
Próbka 2
X
2
42,0
Wykonaj wykres transmitancji w funkcji stężenia a następnie odczytaj stężenia próbek.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach:
−
Sprawozdanie z pracy domowej.
−
Karta ewaluacyjna.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
5. ĆWICZENIA
5.1. Podstawy metrologii
5.1.1. Ćwiczenia
Ćwiczenie 1
Określ
niedokładność
termostatu,
wykorzystywanego
w procesie
fermentacji
beztlenowej.
Pomiar niedokładności termostatu prowadzi poprzez pomiar temperatury dodatkowym
termometrem rtęciowym umieszczonym w termostacie.
Związki chemiczne: woda.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia. Ćwiczenie wykonujemy w grupach dwuosobowych.
Nauczyciel koordynuje pracę grup. Przewidywany czas trwania ćwiczenia 90 minut.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
napełnić termostat wodą, tak aby pokrywała ona pompę,
2)
ustawić za pomocą pokrętła na termometrze kontaktowym, umieszczonym w termostacie,
temperaturę 50ºC, w termostacie powinien być także termometr rtęciowy z podziałką
w skali 0,1% za pomocą którego należy kontrolować działanie procesu,
3)
włączyć termostat, mierzyć temperaturę i czas w momencie włączania się i wyłączania
grzałki (kontrola za pomocą żarówki i charakterystycznego odgłosu),
4)
prowadzić obserwację do momentu ustabilizowania się temperatury przez 45 minut,
5)
zestawić zebrane wyniki w tabeli,
6)
sporządzić wykres zależności temperatury od czasu czyli T(K)=f[t(s)],
7)
zinterpretować otrzymany wykres, obliczyć wariancję i odchylenie standardowe od
nastawionej temperatury w termostacie,
8)
określić niedokładność termostatu.
Zalecane metody nauczania–uczenia się:
−
instruktaż z opisem, wyjaśnieniem lub pokazem,
−
prezentacja z użyciem komputera lub film,
−
ćwiczenie laboratoryjne.
Środki dydaktyczne:
-
termostat z termometrem kontaktowym i rtęciowym,
-
stoper,
-
papier milimetrowy i przyrządy kreślarskie.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Ćwiczenie 2
Przeprowadź wzorcowanie rotametru, na przepływ powietrza przy użyciu anemometru,
wykorzystywanego w procesie spalania węgla w kotle pyłowym.
Związki chemiczne: powietrze.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia, wykorzystać prezentację komputerową lub film. Ćwiczenie
wykonuje się w grupach dwuosobowych.
Nauczyciel koordynuje pracę grup. Przewidywany czas trwania ćwiczenia 60 minut.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
podłączyć rotametr do sprężarki,
2)
skierować wylot powietrza rotametru na skrzydełka anemometru,
3)
przepuszczać sprężone powietrze tak, aby w rotametrze pływak utrzymywał się na
wybranym poziomie,
4)
zmierzyć anemometrem prędkość liniową powietrza oraz wysokość, na jakiej oscyluje
pływak,
5)
pomiar wykonać 3-krotnie dla różnych położeń pływaka,
6)
zanotować wyniki w tabeli,
7)
obliczyć natężenie przepływu powietrza,
Wzór tabeli do ćwiczenia 2
Lp.
Ilość podziałek
Prędkość liniowa
[m/min]
Natężenie przepływu
[dm
3
/h]
1
2
3
8)
wykonać wykres: natężenie przepływu powietrza V(m
3
/s)w funkcji położenia pływaka
h(mm) czyli V(m
3
/s)=f[h(mm)].
Zalecane metody nauczania–uczenia się:
−
instruktaż z opisem, wyjaśnieniem lub pokazem,
−
prezentacja z użyciem komputera lub film,
−
ćwiczenie laboratoryjne.
Środki dydaktyczne:
-
rotametr zamontowany w statywie,
-
anemometr skrzydełkowy,
-
sprężarka do powietrza,
-
przewody gumowe (węże) z zaworami,
-
papier milimetrowy i przyrządy kreślarskie.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
5.2. Wybrane pomiary w procesach technologicznych
5.2.1. Ćwiczenia
Ćwiczenie 1
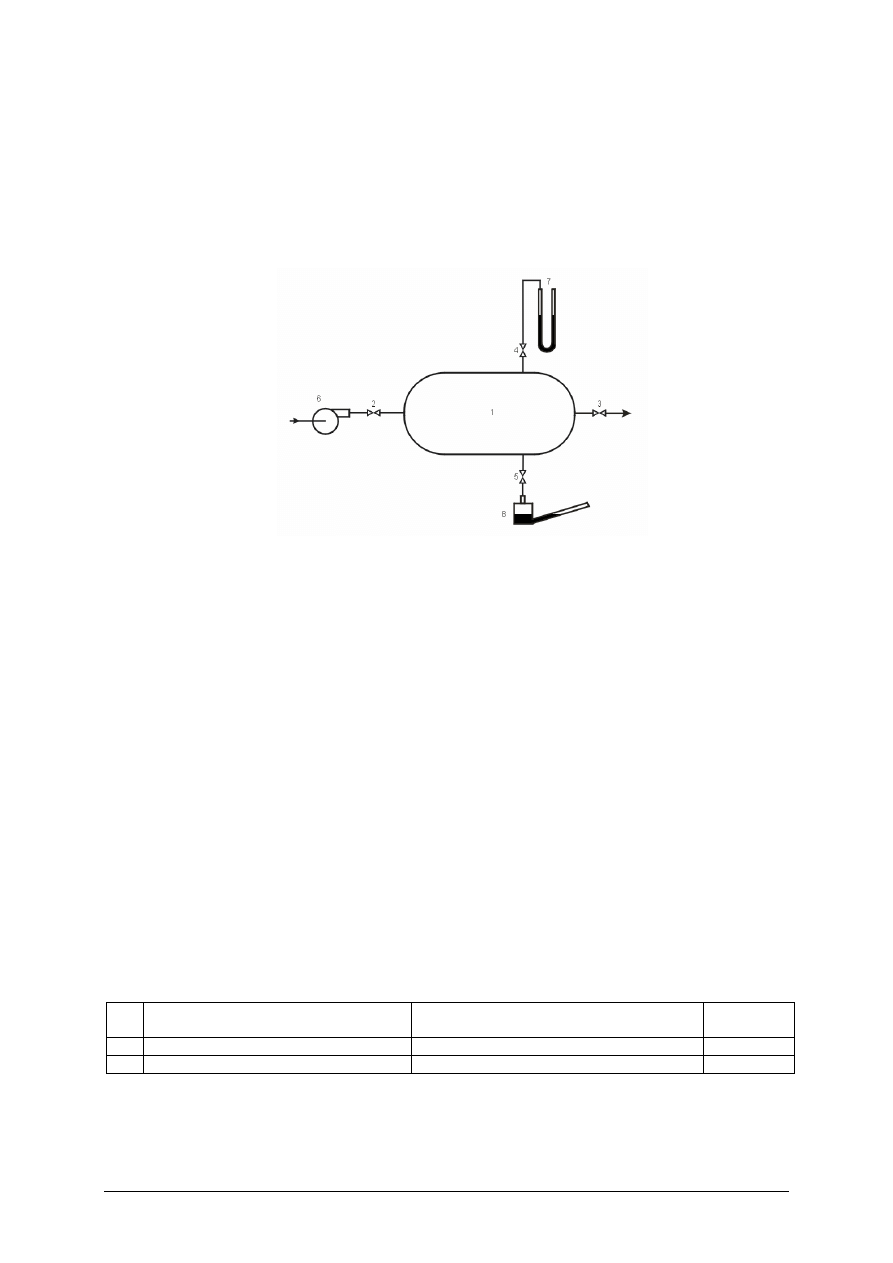
Dokonaj pomiaru ciśnienia ciśnieniomierzem naczyniowym z rurką pochyłą.
Związki chemiczne: powietrze.
Rysunek do ćwiczenia 1. Schemat układu do pomiaru ciśnienia: 1 – naczynie, 2, 3, 4, 5 – zawory,
6 – wentylator, 7 – ciśnieniomierz U-rurka, 8 – ciśnieniomierz naczyniowy z pochyłą rurką.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia, wykorzystać prezentację komputerową lub film. Ćwiczenie
wykonuje się w grupach dwuosobowych. Wskazana jest wycieczka do lokalnego zakładu
przemysłowego.
Nauczyciel koordynuje pracę grup. Przewidywany czas trwania ćwiczenia 60 minut.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
zestawić układ w sposób pokazany na rysunku (ciśnieniomierze połączyć z króćcami
naczynia za pomocą elastycznych przewodów),
2)
otworzyć zawory 2 i 3 i włączyć wentylator. Zawór 3 należy tak ustawić, żeby
wytworzone w naczyniu nadciśnienie nie przekraczało górnego zakresu pomiarowego
ciśnieniomierza z pochylą rurką (sprawdzić to za pomocą U-rurki),
3)
zmierzyć ciśnieniomierzami kilka wartości nadciśnienia. Nadciśnienie w zbiorniku
obniżyć otwierając zawór 3,
4)
uzupełnić tabelę. Porównać wskazania przyrządów. Zinterpretuj wyniki.
Tabela do ćwiczenia 1
Lp.
Ciśnienie odczytane z ciśnieniomierza z
U rurką [mm Hg]
Ciśnienie odczytane z ciśnieniomierza
z rurką pochyłą [mm Hg]
Różnica
wskazań
1.
2.
Zalecane metody nauczania–uczenia się:
–
instruktaż z opisem, wyjaśnieniem lub pokazem,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
–
prezentacja z użyciem komputera lub film,
–
ćwiczenie laboratoryjne.
Środki dydaktyczne:
–
naczynie (pojemność ok. 30 dm
3
) z czterema króćcami z zaworami odcinającymi,
–
wentylator,
–
ciśnieniomierze z U rurką i z pochyłą rurką.
Ćwiczenie 2
Określ wilgotność powietrza psychrometrem Assmanna.
Związki chemiczne: woda, powietrze w dwóch pomieszczeniach o różnej wilgotności.
Pomiar wilgotności powietrza prowadzi się psychrometrem aspiracyjnym Assmanna.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia, wykorzystać prezentację komputerową lub film. Ćwiczenie
wykonuje się w grupach dwuosobowych.
Nauczyciel koordynuje pracę grup. Przewidywany czas trwania ćwiczenia 60 minut.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
nasycić wodą gazę, którą owinięty jest termometr „mokry” przyrządu,
2)
nakręcić mechanizm sprężynowy, za pomocą klucza, który uruchamia wiatraczek
zasysający powietrze z przestrzeni wokół termometrów,
3)
odczytać temperatury z termometru „suchego” i „mokrego” w momencie, gdy wiatraczek
przestaje się obracać, obliczyć różnicę temperatur i z tabeli psychrometrycznej odczytać
wartość wilgotności względnej w procentach,
4)
wykonać 10 pomiarów wilgotności w różnych miejscach w laboratorium i innym
pomieszczeniu lub na powietrzu poza budynkiem, przedstawić wyniki w tabeli,
5)
podać średnią wilgotność względną w badanych miejscach.
Zalecane metody nauczania–uczenia się:
–
ćwiczenie laboratoryjne,
–
wykład problemowy, dyskusja dydaktyczna,
−
wykład informacyjny,
−
instruktaż z opisem, wyjaśnieniem lub pokazem.
Środki dydaktyczne:
–
psychrometr aspiracyjny Assmanna,
–
tabela psychrometryczna,
–
zlewka,
–
kalendarz chemiczny.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
5.3.
Wybrane zagadnienia analizy instrumentalnej
5.3.1. Ćwiczenia
Ćwiczenie 1
Oznacz elektrolityczne miedź, ołów i cynk w stopie.
Elektrolityczne oznaczanie miedzi i ołowiu może zachodzić równocześnie. Miedź wydziela
się z roztworu kwasu azotowego (V) na katodzie, a w tych samych warunkach ołów wydziela
się na anodzie w postaci dwutlenku ołowiu. Stężony kwas azotowy (V) wpływa korzystnie na
strukturę wydzielanego metalu, jednak zbyt duże stężenie kwasu może spowodować jej
rozpuszczenie. Pod koniec elektrolizy roztwór rozcieńcza się i częściowo zobojętnia
amoniakiem. Ołów oznacza się w ilościach 100–120
mg PbO
2,
gdyż
przy większych ilościach
osad może odpadać od elektrody. Cynk z roztworów kwaśnych nie wydziela się.
Po wydzieleniu miedzi i ołowiu można wydzielić cynk z roztworu zasadowego (azotany
i amoniak wpływają ujemnie na oznaczanie i dlatego usuwa się je). Wydzielony cynk może
spowodować zniszczenie elektrody platynowej, dlatego też stosuje się elektrodę platynową,
pokrytą elektrolitycznie miedzią lub srebrem.
Związki chemiczne; mosiądz, stężony kwas azotowy (V), stężony kwas siarkowy (VI),
granulowany wodorotlenek sodu, 25% wodny roztwór amoniaku, 10% roztwór siarczku
amonu, aceton, odczynniki do jakościowego sprawdzania oznaczanych kationów.
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia. Ćwiczenie wykonujemy w grupach dwuosobowych.
Nauczyciel koordynuje pracę grup. Przewidywany czas trwania ćwiczenia 135 minut.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
odważyć 0,5–0,7 g mosiądzu (bez cyny), przenieść odważkę do zlewki, dodać 15 cm
3
wody i 5–7
cm
3
kwasu azotowego (V),
2)
stop roztworzyć, ogrzewając roztwór aż do odpędzenia tlenków azotu i rozcieńczyć wodą
do objętości 30 cm
3
,
3)
umieścić zważone elektrody w roztworze, ogrzać do temperatury około 70°C
i przepuszczać prąd o napięciu 3–4 V i gęstości 2 A/100 cm
2
,
4)
po upływie pewnego czasu (zależnie od zawartości ołowiu), dodać 10 cm
3
wody,
(na nowo pokrytej roztworem części anody nie powinien wydzielać się tlenek ołowiu),
5)
roztwór po zakończeniu wydzielania ołowiu rozcieńczyć wodą do 100 cm
3
, częściowo
zobojętnić kwas azotowy (V) wodą amoniakalną (przyspieszasz wydzielenie się miedzi),
6)
sprawdzić, czy miedź wydzieliła się ilościowo, wyjąć elektrody ze zlewki, przemyć je
wodą (wodą z przemycia dołączyć do roztworu po elektrolizie) i acetonem,
7)
wysuszyć i zważyć elektrody. Gdy wydzielona miedź jest zanieczyszczona (barwa
brunatna), musisz ją rozpuścić w kwasie azotowym (V) i ponownie wykonać oznaczanie.
8)
po wydzieleniu miedzi i ołowiu zadać 5 cm
3
kwasu siarkowego (VI) i odparować w celu
usunięcia kwasu azotowego (V),
9)
rozcieńczyć roztwór do 100 cm
3
wodą, dodać 4–6 g wodorotlenku sodu (roztwór
powinien mieć odczyn zasadowy) i ogrzać w celu odparowania amoniaku (powstał on
w wyniku redukcji kwasu azotowego (V),
10)
zanurzyć elektrody do roztworu (katoda powinna być pokryta miedzią tak, aby
wydzielony cynk nie stykał się z platyną, katoda powinna być zważona),

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
11)
ustalić napięcie prądu, aby przez roztwór przepływał prąd o natężeniu 1 A; po upływie 10
minut zwiększyć natężenie prądu do 2 A,
12)
po upływie 30 minut, pobrać pipetką, kilka kropel roztworu dodać kroplę roztworu
siarczku amon; jeżeli cynk wydzielił się ilościowo, nie wytrąca się biały siarczek cynku,
13)
po wydzieleniu cynku przemyć elektrody wodą i acetonem, ostrożnie wysuszyć i zważyć,
14)
obliczyć procentową zawartość miedzi i cynku na podstawie przyrostu masy elektrody:
[%]
100
a
b
x
=
gdzie:
a
– odwa
ż
ka mosi
ą
dzu [g]
b
– masa wydzielonego metalu [g]
15)
obliczy
ć
procentow
ą
zawarto
ść
ołowiu na podstawie wzoru:
[%]
100
8662
,
0
a
b
x
⋅
=
gdzie:
a
– odwa
ż
ka mosi
ą
dzu [g]
b
– masa wydzielonego dwutlenku ołowiu [g]
0,8662
– mno
ż
nik analityczny do przeliczenia masy PbO
2
na Pb
Zalecane metody nauczania–uczenia si
ę
:
–
instrukta
ż
z opisem, wyja
ś
nieniem lub pokazem,
–
prezentacja z u
ż
yciem komputera lub film,
–
ć
wiczenie laboratoryjne.
Ś
rodki dydaktyczne:
−
elektrolizer z dwoma elektrodami platynowymi,
−
waga analityczna,
−
szkło: zlewka, pipety, naczynko wagowe, bagietka, tryskawka,
−
maszynka do ogrzewania z płytk
ą
izolacyjn
ą
,
−
suszarka,
−
kalendarz chemiczny.
Ćwiczenie 2
Rozdziel mieszanin
ę
jonów Mn
2+
, Co
2+
i Ni
2+
.
Stosuj
ą
c technik
ę
bibułow
ą
mo
ż
na rozdzieli
ć
mieszanin
ę
kationów b
ę
d
ą
c
ą
półproduktem
w technologii otrzymywania odczynników chemicznych. Rozdzielenie jonów i poło
ż
enie
plam na bibule zale
ż
y od składu eluentu. Jony manganu, kobaltu i niklu mo
ż
na po naniesieniu
na bibuł
ę
rozdzieli
ć
stosuj
ą
c alkohol n-butylowy. Otrzymane plamy s
ą
rozmyte.
Wprowadzenie kwasu solnego do alkoholu n-butylowego powoduje zmian
ę
warunków
adsorpcji kationów na bibule. Powstaj
ą
wówczas wyra
ź
ne i rozgraniczone plamy.
Zwi
ą
zki chemiczne: roztwór manganu, niklu i kobaltu: odwa
ż
y
ć
0,2025 g NiCl
2
·6H
2
O,
0,1801 g MnCl
2
·H
2
O i 0,2019 g CoCl
2
·H
2
O i rozpu
ś
ci
ć
w małej obj
ę
to
ś
ci wody, przenie
ść
do
kolby pomiarowej o pojemno
ś
ci 100 cm
3
doda
ć
1 cm
3
kwasu solnego i dopełni
ć
wod
ą
destylowan
ą
do kreski; roztwór wymiesza
ć
; w 1 cm
3
tego roztworu znajduje si
ę
0,5 mg
manganu, niklu i kobaltu, alkohol n-butylowy, st
ęż
ony kwas solny, 1% roztwór alkoholowy
dimetyloglioksymu, 1% roztwór alkoholowy tiocyjanianu amonu, 1% roztwór azotanu (V)
srebra, 6 mol/dm
3
wodny roztwór amoniaku.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia, wykorzystać prezentację komputerową lub film. Ćwiczenie
wykonuje się w grupach dwuosobowych.
Nauczyciel koordynuje pracę grup. Przewidywany czas trwania ćwiczenia 135 minut.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
wyciąć trzy paski bibuły chromatograficznej o wymiarach 3x30 cm,
2)
zaznaczyć linię startu w odległości 1,5 cm od brzegu i nanieść po kropli roztworu
manganu, niklu i kobaltu, a następnie wysuszyć,
3)
umieścić paski bibuły w cylindrach, w których na dnie znajduje się mieszanina alkoholu
n-butylowego i kwasu solnego w stosunku: a) 4:1, b) 4:1,7 i c) 4:2,5; paski zanurzyć
plamą do dołu tak, aby plama nie była zanurzona w rozpuszczalniku (linia startu musi
być powyżej poziomu rozpuszczalnika),
4)
przykryć cylindry szkłem (można zastosować wysoką zlewkę),
5)
przerwać wymywanie, gdy czoło rozpuszczalnika podniesie się na wysokość 25 cm;
wyjąć paski bibuły; wysuszyć je; spryskać je kolejno roztworem dimetyloglioksymu
(wywołuje plamę niklu), roztworem tiocyjanianu amonu (wywołuje plamę kobaltu),
roztworem azotanu (V) srebra, a następnie roztworem amoniaku (wywołuje plamę
manganu) spryskiwanie musisz wykonać pod wyciągiem.
Aby opracować wyniki uczeń powinien:
1)
zmierzyć odległość od linii startu do środka plamy każdego jonu i wyznaczyć
współczynnik R
f
,
2)
ocenić zarys plam i odległość między plamami, na tej podstawie wybrać najlepszy eluent
spośród stosowanych,
3)
zapisać spostrzeżenia i wnioski.
Zalecane metody nauczania–uczenia się:
−
instruktaż z opisem, wyjaśnieniem lub pokazem,
−
prezentacja z użyciem komputera lub film,
−
ćwiczenie laboratoryjne.
Środki dydaktyczne:
–
bibuła chromatograficzna,
–
cylindry miarowe lub komora chromatograficzna z pokrywą,
–
szkło laboratoryjne: zlewki, bagietka, naczynka wagowe, kolby miarowe na 100 cm
3
,
tryskawka, naczynia do nanoszenia wywoływaczy, pipety i wkraplacze,
–
waga analityczna,
–
suszarka do włosów,
–
kalendarz chemiczny.
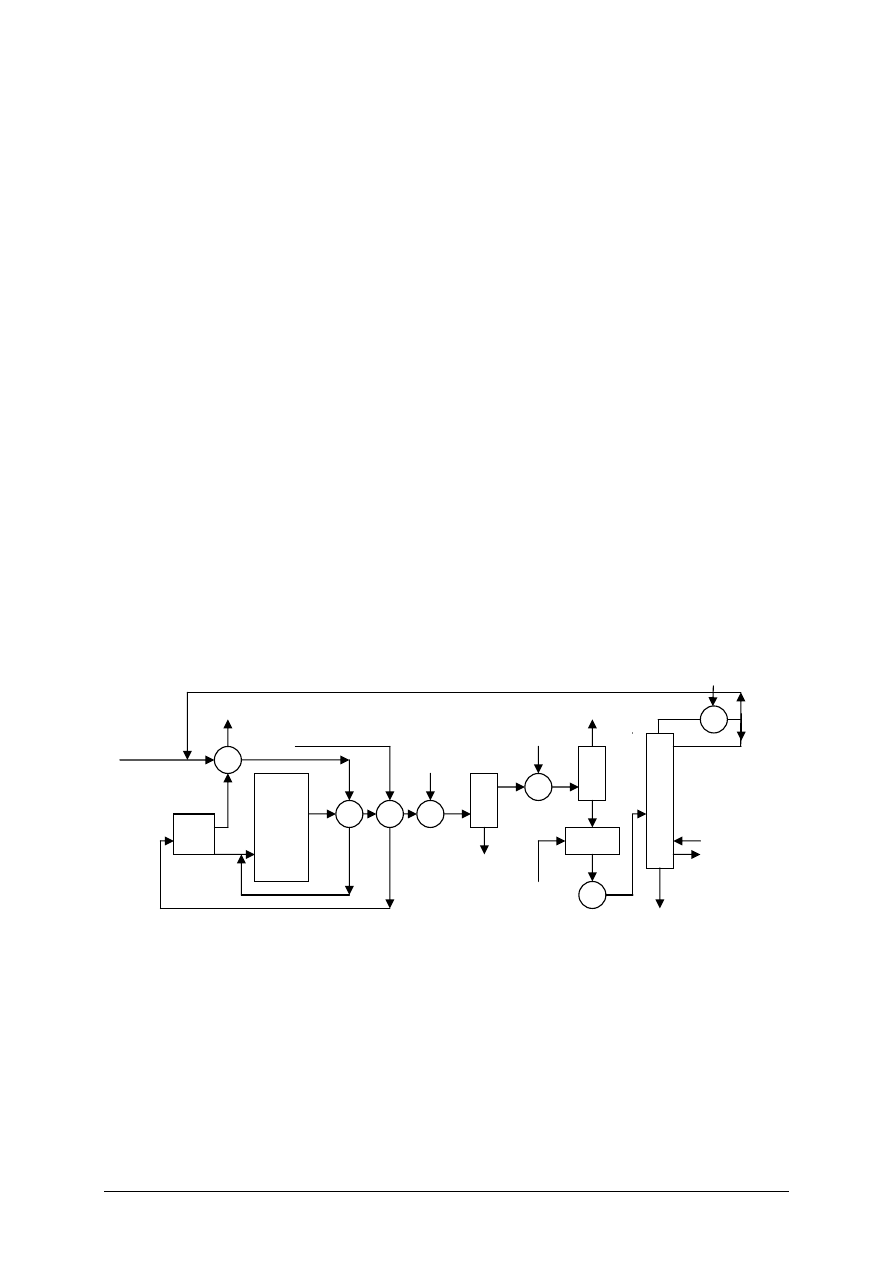
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
5.4. Wybrane zagadnienia z kontroli procesów technologicznych
5.4.1. Ćwiczenia
Ćwiczenie 1
Porównaj efektywność metod zmiękczania wody stosowanej jako chłodziwo
w technologii produkcji styrenu. Określ poziom zagrożenia spowodowany ewentualną awarią
podgrzewacza pary wynikającą z zastosowania wody twardej.
Celem ćwiczenia jest zbadanie skuteczności zmiękczania wody wodociągowej metodą
termiczną (gotowanie i destylowanie) i metodą wymiany jonitowej oraz określenie poziom
zagrożenia spowodowany ewentualną awarią podgrzewacza pary wynikającą z braku kontroli
stanu technicznego urządzenia.
Związki chemiczne: próbki wody do uzdatniania, 0,05 mol/dm
3
roztwór EDTA (wersenian
sodu), bufor amoniakalny pH = 10, czerń eriochromowa.
Styren produkuje się na skalę przemysłową, gdyż przerabiany jest na polistyren oraz
kauczuk butadienowo-styrenowy. Styren otrzymuje się przez odwodornienie etylobenzenu,
który produkuje się przez alkilowanie benzenu etylenem. Należy rygorystycznie przestrzegać
zasad kontrolowania stanu technicznego stosowanych urządzeń.
Przebieg procesu (rys. 2): etylobenzen odparowuje się w odparowalniku 2 ogrzewanych
ciepłem gazów spalinowych z pieca1.W wymiennikach ciepła 4 zostaje podgrzany do 700°C
i miesza z parami etylobenzenu przed aparatem kontaktowym 3, w którym następnie zachodzi
katalityczne uwodornienie etylobenzenu. Otrzymany styren schładza się w odbieralnikach 4
i 5. W oddzielaczu 6 skraplają się produkty smołowe. Po kolejnym schłodzeniu skropliny
styrenu oddziela się i gromadzi w zbiorniku 7. Przed rektyfikacją dodaje się siarkę, aby
zahamować proces polimeryzacji. Po rektyfikacji czysty styren przekazuje się do dalszego
przetwarzania, a zanieczyszczony zawraca do procesu.
.
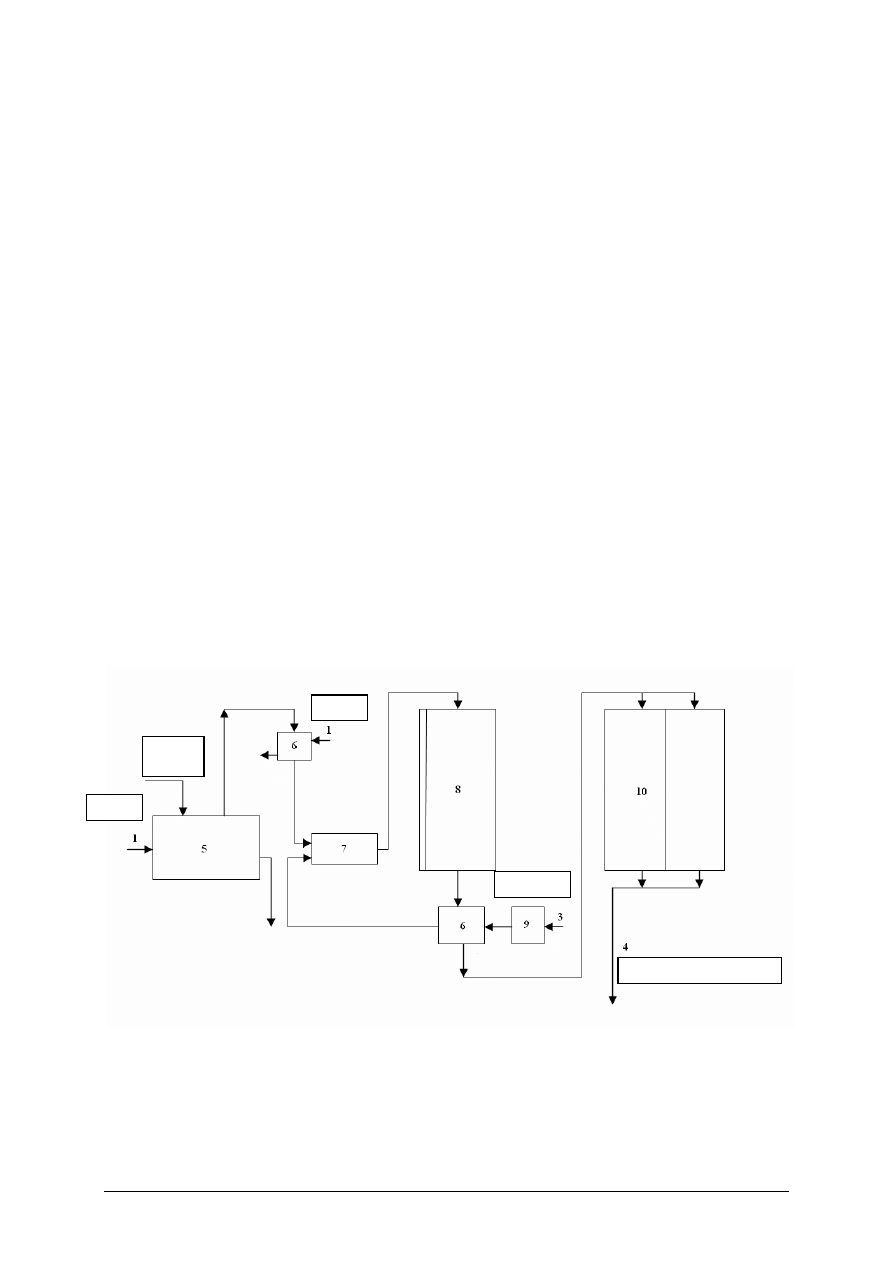
Rysunek do ćwiczenia 1. Schemat produkcji styrenu: 1 – podgrzewacz pary, 2 – odparowalnik etylobenzenu,
3 – aparat kontaktowy, 4 – wymienniki ciepła, 5 – chłodnice, 6 – oddzielacze, 7 – zbiornik styrenu surowego,
8 – pompa, 9 – kolumna rektyfikacyjna [5]
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia, wykorzystać prezentację komputerową lub film. Ćwiczenie
wykonuje się w grupach dwuosobowych.
Nauczyciel koordynuje pracę grup. Przewidywany czas trwania ćwiczenia 135 minut.
para
1
2
etylobenzen
3
4
4
5
5
6
6
7
8
9
styren
siarka
smoła
woda
woda
para
gazy odlotowe
4

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
pobrać 50 cm
3
badanej wody do kolbki stożkowej,
2)
dodać 5 cm
3
buforu o pH = 10,0 oraz szczyptę czerni eriochromowej,
3)
zmiareczkować próbkę 0,05 molowym roztworem wersenianu do momentu, gdy
fiołkowo-czerwona barwa zmieni się na niebieską,
Zawarte w wodzie jony Mg
+2
oraz Ca
+2
reagują z wersenianem sodu (EDTA) dając
połączenia kompleksowe. Wprowadzona we wstępnej fazie do wody czerń eriochromowa
daje również połączenia kompleksowe z jonami Mg
+2
, przy czym połączenie to jest
barwne, ale słabsze od połączenia z EDTA; na początku analizy roztwór jest więc
barwny. Podczas miareczkowania (dodawania roztworu EDTA) najpierw jony Ca
+2
,
a później jony Mg
+2
zostają związane przy pomocy EDTA. Gdy już cała ilość Mg
+2
zostanie związana z EDTA, zabarwienie roztworu zmieni się z powodu zniknięcia
połączenia czerni eriochromowej z Mg
+2
. Moment zmiany zabarwienia oznacza koniec
miareczkowania,
4)
obliczyć stężenie jonów Mg
+2
oraz Ca
+2
w badanym roztworze wiedząc, że na każdy jon
Mg
+2
lub Ca
+2
zużyto jedną cząsteczkę EDTA:
a.
V
M
V
M
M
EDTA
EDTA
⋅
⋅
=
⋅
⋅
=
20
50
1000
gdzie:
M
– szukana molowo
ść
roztworu (twardo
ść
wody) [mol/dm
3
]
M
EDTA
– molowo
ść
roztworu EDTA [mol/dm
3
]
V
– obj
ę
to
ść
(w cm
3
) roztworu EDTA zu
ż
ytego na zmiareczkowania próbki
5)
oznaczenie powiniene
ś
wykona
ć
trzykrotnie, za wynik przyj
ąć
ś
redni
ą
arytmetyczn
ą
pomiarów,
6)
doprowadzi
ć
do wrzenia 200 cm
3
wody, stan wrzenia utrzyma
ć
przez 10 min, ostudzi
ć
do
temperatury pokojowej, przefiltrowa
ć
przez s
ą
czek, ponownie oznaczy
ć
twardo
ść
wody
metod
ą
miareczkowania EDTA w sposób opisany powy
ż
ej,
7)
przes
ą
czy
ć
200 cm
3
wody surowej przez kolumny z anionitem, a nast
ę
pnie z kationitem
(poziom wody w kolumnach z jonitami powinien by
ć
zawsze wy
ż
szy, ni
ż
poziom
jonitów), powtórnie oznaczy
ć
twardo
ść
wody teraz tej zdemineralizowanej przez
miareczkowanie EDTA (trzykrotne miareczkowanie, wynik
ś
redni),
8)
oznaczy
ć
twardo
ść
wody wodoci
ą
gowej i destylowanej metod
ą
miareczkowania EDTA,
9)
porówna
ć
skuteczno
ść
stosowanych metod oczyszczania (zmi
ę
kczania i demineralizacji)
wody opieraj
ą
c si
ę
na wynikach miareczkowania,
10)
okre
ś
li
ć
poziom zagro
ż
enia ewentualn
ą
awari
ą
podgrzewacza pary wynikaj
ą
c
ą
z jego
zu
ż
ycia a spowodowany brakiem okresowej kontroli stanu technicznego urz
ą
dzenia.
Zalecane metody nauczania–uczenia si
ę
:
−
instrukta
ż
z opisem, wyja
ś
nieniem lub pokazem,
−
prezentacja z u
ż
yciem komputera lub film,
−
ć
wiczenie laboratoryjne.
Ś
rodki dydaktyczne:
–
kolumny z jonitem,
–
maszynka elektryczna, płytka izolacyjna,
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
–
szkło laboratoryjne: kolbka stożkowa 250 cm
3
(do grzania wody), szkiełko zegarkowe,
kolbki do miareczkowania 125 cm
3
(3 szt.), zlewki 100 cm
3
(2 szt.), zlewka 25 cm
3
,
pipeta 50 cm
3
, pipeta miarowa 10 cm
3
, biureta ze statywem, lejek, cylinder 10 cm
3
lub
25 cm
3
,
–
papierki uniwersalne, sączki,
–
statyw do sączenia,
–
łopatka metalowa,
–
kalendarz chemiczny.
Ćwiczenie 2
Wykonaj schemat wstępny otrzymywania bezwodnika ftalowego metodą utleniania
naftalenu na podstawie schematu ideowego i opisu przebiegu. Scharakteryzuj procesy
i operacje. Podaj stosowane podstawowe zasady technologiczne.
Bezwodnik kwasu ftalowego jest jednym z ważniejszych półproduktów w produkcji
barwników i tworzyw sztucznych. Otrzymuje się go przez katalityczne utlenianie naftalenu.
Czynnikiem utleniającym jest powietrze pod normalnym ciśnieniem w temperaturze 625–675 K.
Naftalen w stanie pary o temperaturze ok. 352 K jest mieszany ze strumieniem gorącego
powietrza w mieszalniku 7. Oczyszczone i sprężone w sprężarce 9 powietrze podgrzewane
jest w wymienniku ciepła 6 strumieniem produktów opuszczających reaktor 8. Reaktor,
aparat kontaktowy stanowi zespół pionowych rurek wypełnionych nieruchomym
katalizatorem, tlenkiem wanadu (V) V
2
O
5
osadzonym na nośniku krzemionkowym. Ziarna
katalizatora mogą stanowić złoże fluidalne w reaktorze fluidalnym. Proces prowadzony jest w
temperaturze 625–675 K pod normalnym ciśnieniem. Gazy poreakcyjne, oddając część ciepła
w wymienniku 2, kierowane są do komór kondensacyjnych 6, gdzie następuje kondensacja
i krystalizacja bezwodnika ftalowego w temperaturze około 405 K. Oczyszczanie surowego
bezwodnika odbywa się zwykle metodą destylacji próżniowej (temperatura wrzenia 557 K)
(Rys. 7)
Rysunek do ćwiczenia 2. Schemat ideowy otrzymywania bezwodnika ftalowego metodą utleniania naftalenu.
Strumienie: 1 – para, 2 – naftalen,3 – powietrze, 4 – bezwodnik kwasu ftalowego.
Aparaty: 5 – topielnik, 6 – wymiennik ciepła, podgrzewacz, 7 – mieszalnik gazów, par,
8 – reaktor katalityczny, 9 – sprężarka, 10 – zespół komór kondensacyjnych [10, s. 113,114]
para
para
naftalen
powietrze
bezwodnik kwasu ftalowego

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
Wskazówki do realizacji
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić zakres
i technikę wykonania ćwiczenia, wykorzystać prezentację komputerową lub film. Ćwiczenie
wykonuje się w grupach dwuosobowych.
Nauczyciel koordynuje pracę grup. Przewidywany czas trwania ćwiczenia 60 minut.
Sposób wykonania ćwiczenia
Uczeń powinien:
1)
zapoznać się zasadą prowadzenia procesu technologicznego otrzymywania bezwodnika
ftalowego metodą utleniania naftalenu,
2)
zapoznać się ze schematem ideowy otrzymywania bezwodnika ftalowego metodą
utleniania naftalenu,
3)
skorzystać z norm: branżowej BN-72/2200-01 podającej symbole schematu wstępnego,
normy PN-70/M-420007 podającej symbole graficzne i oznaczenia literowo-cyfrowe
układów pomiarowych i automatyki, normy PN-76/C01350 podającej nazwy pojęć,
symbole i określenia procesów podstawowych inżynierii chemicznej,
4)
sporządzić wstępny schemat technologiczny, przedstawiając proces za pomocą
odpowiednich symboli aparatów i urządzeń,
5)
scharakteryzować procesy i operacje przedstawione na schemacie oraz podstawowe
zasady prowadzenia procesu technologicznego,
6)
zaproponować sposób jakościowego oznaczenia czystości otrzymanych kryształów
bezwodnika ftalowego,
7)
scharakteryzować zasady bezpiecznego prowadzenia procesu i przewidzieć skutki
ewentualnego wybuchu spowodowanego zastosowaniem źle dobranego składu czynnika
utleniającego.
Zalecane metody nauczania–uczenia się:
−
instruktaż z opisem, wyjaśnieniem lub pokazem,
−
prezentacja z użyciem komputera lub film,
−
ćwiczenie laboratoryjne.
Środki dydaktyczne:
–
normy: PN-70/M-420007, PN-76/C01350, branżowa BN-72/2200-01,
–
instrukcja do ćwiczenia wraz ze schematem ideowym,
–
Internet, literatura techniczna,
–
arkusze papieru, przyrządy kreślarskie.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
6. EWALUACJA OSIĄGNIĘĆ UCZNIA
Przykłady narzędzi pomiaru dydaktycznego
Test 1
Test dwustopniowy do jednostki modułowej
„Wykonywanie pomiarów
parametrów procesowych”
Test składa się z 20 zadań wielokrotnego wyboru, z których:
−
zadania 1, 2, 3, 4, 5, 6,7, 9, 12, 13, 14, 15, 16, 18,19 są z poziomu podstawowego,
−
zadania 8, 10, 11, 17, 20 są z poziomu ponadpodstawowego.
Punktacja zadań: 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowiedź lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
−
dopuszczający – za rozwiązanie co najmniej 9 zadań z poziomu podstawowego,
−
dostateczny – za rozwiązanie co najmniej 11 zadań z poziomu podstawowego,
−
dobry – za rozwiązanie 14 zadań, w tym co najmniej 2 z poziomu ponadpodstawowego,
−
bardzo dobry – za rozwiązanie 18 zadań, w tym co najmniej 4 z poziomu
ponadpodstawowego.
Klucz odpowiedzi: 1. d, 2. a, 3. c, 4. c, 5. d, 6. c, 7. b, 8. c, 9. a, 10. c, 11.b,
12. c, 13. d, 14. a, 15. c, 16. b, 17. a, 18. b, 19. d, 20. a
Plan testu
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1
Wyjaśnić
na
czym
polega
legalizacja
przyrządów pomiarowych
B
P
d
2
Wybrać
prawidłową
definicję
błędu
bezwzględnego
B
P
a
3
Obliczyć błąd względny
C
P
c
4
Wybrać przyrząd do pomiaru ciśnienia
atmosferycznego
A
P
c
5
Wyjaśnić
zasadę
działania
przyrządów
hydrostatycznych
B
P
d
6
Wskazać proces który nie należy do grupy
procesów dyfuzyjnych
B
P
c
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
7
Określić
temperaturę
wrzenia
wody
w stopniach Kelwina
C
P
b
8
Ocenić
warunki
pracy
termometrów
oporowych
C
PP
c
9
Wybrać przepływomierz do pomiaru ilości
przepływającego płynu
C
P
a
10
Przewidzieć, jakich substancji nie można
oznaczyć polarograficznie
D
PP
c
11 Określić, od czego nie zależy potencjał półfali
C
PP
b
12
Przedstawić charakterystykę promieniowania
α
B
P
c
13
Wyjaśnić pojęcie plateau „plato”
funkcjonującego w pomiarach
radiometrycznych
B
P
d
14
Wybrać przyrząd, który nie służy do pomiaru
natężenia przepływu
C
P
a
15
Przewidzieć rodzaj produktów wydzielanych
na elektrodach w czasie elektrolizy
C
P
c
16 Wyjaśnić błąd w informacjach o elektrolizie
B
P
b
17
Obliczyć ilość wydzielonej substancji w czasie
elektrolizy
D
PP
a
18
Wybrać
urządzenie
do
mieszania
ciał
ciastowatych i plastycznych
C
P
b
19
Wymienić produkty, których nie można
otrzymać w procesie koksowania
A
P
d
20
Określić rodzaj produktów w procesie
polikondensacji
C
PP
a

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
Przebieg testowania
Instrukcja dla nauczyciela
1.
Ustal z uczniami termin przeprowadzenia sprawdzianu z wyprzedzeniem co najmniej
jednotygodniowym.
2.
Przygotuj odpowiednią liczbę testów.
3.
Zapewnij samodzielność podczas rozwiązywania zadań.
4.
Przed rozpoczęciem testu przeczytaj instrukcję dla ucznia.
5.
Zapytaj czy uczniowie wszystko zrozumieli.
6.
Nie przekraczaj przeznaczonego czasu na test.
Instrukcja dla ucznia
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Zapoznaj się z zestawem zadań testowych.
4.
Udzielaj odpowiedzi na załączonej karcie odpowiedzi, wstawiając w odpowiedniej
rubryce znak X. W przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem
a następnie ponownie zaznaczyć odpowiedź prawidłową.
5.
Test zawiera 20 zadań, w tym: 15 z poziomu podstawowego, 5 z poziomu
ponadpodstawowego.
6.
Do każdego zadania dołączone są 4 możliwe odpowiedzi. Tylko jedna jest prawdziwa.
7.
Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
8.
Kiedy udzielanie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci wolny czas.
9.
Na rozwiązanie testu masz 40 min.
Powodzenia
Materiały dla ucznia:
–
instrukcja,
–
zestaw zadań testowych,
–
karta odpowiedzi.
ZESTAW ZADAŃ TESTOWYCH
1.
Legalizacja przyrządu pomiarowego polega na
a)
sprawdzeniu go za pośrednictwem wzorca.
b)
sprawdzeniu jednej czynności przyrządem kontrolnym o znanej i większej
dokładności od dokładności przyrządu legalizowanego.
c)
znalezieniu jego właściwych cech w Dzienniku Urzędowym lub Polskich Normach.
d)
sprawdzeniu właściwości metrologicznych przyrządu i jego ocechowaniu lub wydaniu
świadectwa legalizacyjnego przez wyspecjalizowane instytucje.
2.
Błąd bezwzględny to
a)
różnica algebraiczna pomiędzy wynikiem pomiaru a wartością wielkości mierzonej.
b)
błąd powtarzający się przy kolejnych pomiarach pod wpływem zmieniających się
czynników zewnętrznych np. temperatury, ciśnienia, wilgotności itp.
c)
błąd powstający w wyniku działania na przyrząd nieuchwytnych zmian warunków
zewnętrznych.
d)
błąd wynikający z indywidualnych właściwości obserwatora i jego niedoskonałości.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
3.
Obliczony błąd względny ważenia, na wadze analitycznej, wykonanego z dokładnością do
0,0001 g dla próbki o masie 0,1549 wynosi
a)
– 0,060%.
b)
± 0,072%.
c)
± 0,065%.
d)
+ 0,060%.
4.
Do pomiaru ciśnienia atmosferycznego służą
a)
wakuometry.
b)
manometry.
c)
barometry.
d)
manowakuometry.
5.
W przyrządach hydrostatycznych, np. „U” rurce lub manometrze rtęciowym, do pomiaru
ciśnienia wykorzystywana jest zasada
a)
odkształcenia elementu sprężystego.
b)
zmiany ciśnienia powodującej przesunięcie tłoka.
c)
zmiany właściwości materiału pod wpływem zmiany ciśnienia.
d)
równoważenia mierzonego ciśnienia ciśnieniem hydrostatycznym słupa cieczy.
6.
Do grupy podstawowych procesów dyfuzyjnych, związanych z przemianami fizycznymi
i chemicznymi nie należy
a)
rektyfikacja.
b)
ekstrakcja
c)
przesiewanie
d)
sublimacja.
7.
Temperatura wrzenia wody, w warunkach normalnych, w skali Kelwina wynosi
a)
273 K.
b)
373 K.
c)
223 K.
d)
323 K.
8.
W termometrach oporowych metalowe uzwojenie czujnika powinno odpowiadać
warunkowi
a)
zmianom temperatury powinny towarzyszyć nieznaczne zmiany oporu elektrycznego.
b)
w zakresie stosowania powinny zmieniać się właściwości fizykochemiczne.
c)
zmiany oporu elektrycznego powinny być proporcjonalne do zmian temperatury.
d)
temperatura topnienia lub przemian alotropowych nie wpływa na zakres stosowalności
termometru.
9.
Do pomiaru ilości przepływającej cieczy przez rurociąg nie stosuje się
a)
przepływomierzy komorowych.
b)
przepływomierzy skrzydełkowych.
c)
przepływomierzy śrubowych.
d)
przepływomierzy wirnikowych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
10.
W analizie polarograficznej nie można oznaczyć
a)
stopów metali wysokiej czystości.
b)
związków organicznych, które ulegają reakcjom elektrodowych.
c)
węglowodorów.
d)
rud metali.
11.
Potencjał półfali nie zależy od
a)
rodzaju badanego jonu.
b)
stężenia badanego jonu.
c)
pH roztworu, w którym prowadzone jest badanie.
d)
obecności substancji kompleksujących.
12.
Promieniowanie α to
a)
strumień szybkich elektronów emitowanych z jądra atomu w wyniku zachodzących
w nim przemian.
b)
emisja promieniowania w postaci fali elektromagnetycznej.
c)
dodatnio naładowana cząstka, wyrzucona z jądra atomowego składająca się z dwóch
protonów i dwóch neutronów.
d)
emisja nowych neutronów wyrzuconych podczas tzw. rozszczepienia jądra przez
neutron pierwotny, znajdujący się w pobliżu tego jądra izotopu.
13.
Plateau licznika do pomiarów radiometrycznych to
a)
inna nazwa popularnego licznika Geigera-Müllera.
b)
zakres napięć, w którym liczba rejestrowanych impulsów zależy od przyłożonego
napięcia.
c)
wartość napięcia, przy którym układ pomiarowy rejestruje pierwszy impuls.
d)
zakres napięcia, przy którym liczba rejestrowanych impulsów nie zależy od
przyłożonego napięcia.
14.
Przyrządem do pomiaru natężenia przepływu nie jest
a)
pływakowy wskaźnik poziomu.
b)
zwężka znormalizowana.
c)
rotametr.
d)
przepływomierz komorowy.
15.
Podczas elektrolizy wodnego roztworu siarczanu (VI) miedzi (II) wydziela się
a)
na katodzie miedź na anodzie trójtlenek siarki.
b)
na katodzie wodór na anodzie tlen.
c)
na katodzie miedź na anodzie tlen.
d)
na katodzie miedź na anodzie siarka.
16.
Wskaż zdanie fałszywe
a)
na katodzie zachodzi proces redukcji np. wydzielanie się wodoru.
b)
elektrodę, która pobiera elektrony nazywamy katodą.
c)
w procesie elektrolizy na anodzie następuje utlenianie związków organicznych.
d)
w procesie elektrolizy po przyłożeniu źródła prądu stałego następuje wędrówka
kationów do katody a anionów do anody.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
17.
Elektrolizę prowadzono prądem o natężeniu 10 amperów. Podczas elektrolizy stopionego
chlorku ołowiu (II) w czasie 20 minut, przyjmując M
Pb
= 207,2 u, ołowiu wydzieliło się na
katodzie
a)
12,882 g.
b)
25,76 g.
c)
0,215 g.
d)
0,043 g.
18.
Urządzenia do mieszania ciał ciastowatych i plastycznych to
a)
mieszarki.
b)
zgniatarki.
c)
mieszalniki.
d)
separatory.
19.
W chemicznym procesie przetwarzania węgla (koksowania) nie otrzymuje się
a)
smoły.
b)
wody pogazowej.
c)
benzenu surowego.
d)
gazoliny.
20.W procesie polikondensacji nie otrzymuje się
a)
z kaprolaktamu – poliamidu.
b)
z związków krzemoorganicznych – polisiloksanów.
c)
z amin, mocznika i melaminy – aminoplastów.
d)
z formaldehydu i fenolu – fenoplastów.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Wykonywanie pomiarów parametrów procesowych
Zakreśl poprawną odpowiedź
.
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
a
b
c
d
18.
a
b
c
d
19.
a
b
c
d
20.
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
Test 2
Test dwustopniowy do jednostki modułowej
„Wykonywanie pomiarów
parametrów procesowych”
Test składa się z 20zadań wielokrotnego wyboru, z których:
−
zadania 1, 2, 3, 4, 6 7, 9, 10, 11, 12, 13, 14, 16, 18, 19, są z poziomu podstawowego,
−
zadania 5, 8, 15, 17, 20 są z poziomu ponadpodstawowego.
Punktacja zadań: 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowiedź lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
−
dopuszczający – za rozwiązanie co najmniej 9 zadań z poziomu podstawowego,
−
dostateczny – za rozwiązanie co najmniej 11 zadań z poziomu podstawowego,
−
dobry – za rozwiązanie 14 zadań, w tym co najmniej 2 z poziomu ponadpodstawowego,
−
bardzo dobry – za rozwiązanie 18 zadań, w tym co najmniej 4 z poziomu
ponadpodstawowego.
Klucz odpowiedzi: 1. c, 2. a, 3. b, 4. d, 5. d, 6. b, 7.c, 8. b, 9. a, 10. c, 11.a,
12. a, 13. d, 14. c, 15. a, 16. a, 17. b, 18. c, 19. a, 20. c.
Plan testu
Nr
zad.
Cel operacyjny
(mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1
Określić
zasady
instalowania
i uruchamiania przyrządów pomiarowych
C
P
c
2
Wyjaśnić
budowę
przyrządów
pomiarowych
B
P
a
3
Obliczyć błąd względny
C
P
b
4
Wybrać przyrząd do pomiaru różnicy
dwóch ciśnień
A
P
d
5
Scharakteryzować
zasadę
działania
ciśnieniomierza z rurką Bourdona
C
PP
d
6
Wybrać proces który nie należy do
procesów cieplnych
B
P
b
7
Obliczyć temperaturę krzepnięcia rtęci
w stopniach Kelwina
C
P
c
8
Ocenić warunki pracy termoelementów
w termometrach termicznych
D
PP
b

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
9
Wybrać przepływomierz, którego nie
można zastosować do pomiaru ilości
przepływającego gazu
C
P
a
10
Scharakteryzować sposób przedstawiania
wyników polarograficznych
B
P
c
11
Wskazać element, z którym nie pracuje
polarograf
B
P
a
12
Przedstawić
charakterystykę
promieniowania β
B
P
a
13
Wyjaśnić pojęcie tła funkcjonującego
w pomiarach radiometrycznych
B
P
d
14
Wybrać przyrząd, który nie służy do
pomiaru natężenia przepływu
B
P
c
15
Przewidzieć
rodzaj
produktów
wydzielanych na elektrodach w czasie
elektrolizy
C
PP
a
16
Wyjaśnić,
błąd
w
informacjach
o elektrolizie
B
P
a
17
Obliczyć ilość wydzielonej substancji
w czasie elektrolizy
D
PP
b
18
Wybrać urządzenie rozdrabniające do
najmniejszych rozmiarów
C
P
c
19
Wskazać produkty, których nie można
otrzymać w procesie rafinacji ropy
naftowej
A
P
a
20
Scharakteryzować
polimeryzację
suspensyjną
C
PP
c

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
Przebieg testowania
Instrukcja dla nauczyciela
1.
Ustal z uczniami termin przeprowadzenia sprawdzianu z wyprzedzeniem co najmniej
jednotygodniowym.
2.
Przygotuj odpowiednią liczbę testów.
3.
Zapewnij samodzielność podczas rozwiązywania zadań.
4.
Przed rozpoczęciem testu przeczytaj instrukcję dla ucznia.
5.
Zapytaj czy uczniowie wszystko zrozumieli.
6.
Nie przekraczaj przeznaczonego czasu na test.
Instrukcja dla ucznia
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Zapoznaj się z zestawem zadań testowych.
4.
Udzielaj odpowiedzi na załączonej karcie odpowiedzi, wstawiając w odpowiedniej
rubryce znak X. W przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem
a następnie ponownie zaznaczyć odpowiedź prawidłową.
5.
Test zawiera 20 zadania, w tym: 15 z poziomu podstawowego, 5 z poziomu
ponadpodstawowego.
6.
Do każdego zadania dołączone są 4 możliwe odpowiedzi. Tylko jedna jest prawdziwa.
7.
Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
8.
Kiedy udzielanie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie
na później i wróć do niego, gdy zostanie Ci wolny czas.
9.
Na rozwiązanie testu masz 40 min.
Powodzenia
Materiały dla ucznia:
–
instrukcja,
–
zestaw zadań testowych,
–
karta odpowiedzi.
ZESTAW ZADAŃ TESTOWYCH
1.
Do zainstalowania przyrządu pomiarowego i jego uruchomienia wolno przystąpić po
a)
przypomnieniu sobie zasad eksploatacji.
b)
spytaniu doświadczonego kolegi lub kierownika.
c)
zapoznaniu się z warunkami pracy podanymi w instrukcji eksploatacji.
d)
przypomnieniu sobie ogólnych zasad bezpieczeństwa higieny pracy, przeciw
pożarowych i ochrony środowiska.
2.
Przyrządy pomiarowe na ogół składają się z
a)
czujnika, linii przesyłowych, miernika.
b)
podziałki, wskaźnika, czujnika.
c)
wskaźnika, rejestratora, drukarki.
d)
sygnału pomiarowego, toru pomiarowego, rejestratora.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
3.
Błąd bezwzględny elektrolitycznego oznaczania miedzi w stopie wynosi 0,52%.
Obliczony błąd względny tego oznaczenia, przy zawartości miedzi w analizowanym
stopie 65%, wynosi
a)
– 0,052%.
b)
± 0,80%.
c)
± 0,080%.
d)
+ 0,74%.
4.
Do pomiaru różnicy dwóch ciśnień służą
a)
manowakuometry.
b)
barometry.
c)
manometry bezwzględne.
d)
manometry różnicowe.
5.
Zasada działania ciśnieniomierza z rurką Bourdona wykorzystuje odkształcenie sprężyste
a)
puszki.
b)
mieszka.
c)
rurki o przekroju kołowym.
d)
sprężyny rurkowej o przekroju eliptycznym, pod wpływem działającego na nie
ciśnienia.
6.
Do grupy podstawowych procesów cieplnych związanych z przemianami fizycznymi
i chemicznymi nie należy
a)
zatężanie.
b)
flotacja.
c)
kondensacja.
d)
odparowanie.
7.
Temperatura krzepnięcia rtęci (–39ºC) warunkuje zakres stosowania termometrów
rtęciowych. W skali Kelwina ta temperatura wynosi
a)
312 K.
b)
195 K.
c)
234 K.
d)
351 K.
8.
Materiał termoelementu w termometrach termoelektrycznych nie powinien odznaczać się
a)
możliwie dużą siłą termoelektryczną.
b)
brakiem odporności na działanie temperatury.
c)
niezależnością siły termoelektrycznej od czasu użytkowania i warunków ogrzewania.
d)
możliwie wysoką temperaturą topnienia.
9.
Do pomiaru ilości przepływającego gazu nie stosuje się
a)
przepływomierza śrubowego.
b)
przepływomierza bębnowego.
c)
przepływomierzy miechowego.
d)
przepływomierzy rotorowego.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
10.
W polarografii wyniki przedstawia się w postaci
a)
polarymetru.
b)
polaroidu.
c)
polarogramu.
d)
polaryzatora.
11.
W skład polarografu nie wchodzi
a)
źródło prądu o zmiennym napięciu ~ 230V.
b)
kapiąca elektroda rtęciowa.
c)
naczynko polarograficzne.
d)
elektroda platynowa w postaci siatki.
12.
Promieniowanie β to
a)
strumień szybkich elektronów emitowanych z jądra atomu w wyniku zachodzących
w nim przemian.
b)
emisja promieniowania w postaci fali elektromagnetycznej.
c)
dodatnio naładowana cząstka, wyrzucona z jądra atomowego składająca się z dwóch
protonów i dwóch neutronów.
d)
emisja nowych neutronów wyrzuconych podczas tzw. Rozszczepienia jądra przez
neutron pierwotny, znajdujący się w pobliżu tego jądra izotopu.
13.
W pomiarach radiometrycznych rejestruje się tło, czyli promieniowanie
a)
przechodzące przez materie i wywołujące jej zmianę w wyniku pojawienia się cząstek
naładowanych elektrycznie.
b)
rejestrowane przez przyrząd w postaci tzw. impulsów, czyli liczba cząstek, które
dotarły do przyrządu rejestrującego.
c)
które się zaabsorbowało w materiale próbki, czyli samoabsorpcja.
d)
spowodowane zanieczyszczeniami powietrza i innych materiałów w najbliższym
otoczeniu przyrządów pomiarowych oraz promieniowaniem kosmicznym.
14.
Przyrządem do pomiaru natężenia przepływu nie jest
a)
przepływomierz skrzydełkowy.
b)
dysza.
c)
skruber.
d)
kryza.
15.
Podczas elektrolizy wodnego roztworu azotanu (V) srebra wydziela się
a)
na katodzie srebro na anodzie tlen.
b)
na katodzie srebro na anodzie tlenek azotu (IV).
c)
na katodzie wodór na anodzie tlen.
d)
na katodzie srebro na anodzie azot gazowy.
16.
Wskaż zdanie fałszywe
a)
w procesie elektrolizy po przyłożeniu źródła prądu zmiennego następuje wędrówka
kationów do katody a anionów do anody.
b)
elektrodę, która oddaje elektrony nazywamy katodą.
c)
na anodzie następuje proces utleniania np. wydzielanie się chloru.
d)
na katodzie następuje redukcja związków nieorganicznych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
17.
Jeżeli przez elektrolizer przepływał prąd o natężeniu 0,5 ampera, to miedzi na katodzie
podczas elektrolizy roztworu siarczanu (VI) miedzi (II) w czasie 30 minut przyjmując
M
Cu
= 63,55 u wydzieliło się
a)
0,5926 g.
b)
0,2963 g.
c)
0,0050 g.
d)
0,0098 g.
18 Rozdrabnianie do najmniejszych rozmiarów prowadzone jest w
a)
rozdrabniaczach.
b)
łamaczach
c)
młynach.
d)
kruszarkach.
19 W procesie rafinacji ropy naftowej nie uzyskuje się
a)
prasmoły oraz półkoksu.
b)
polepszenia barwy i zapachu produktu.
c)
wyodrębnienia (usunięcia) substancji kwaśnych.
d)
wydzielenia związków siarki i substancji kwaśnych.
20.
Polimeryzacja suspensyjna to
a)
polimeryzacja prowadzona w rozpuszczalniku, w którym rozpuszcza się monomer
i polimer.
b)
polimeryzacja prowadzona w czystym, ciekłym monomerze i polegająca na ogrzaniu
monomeru z dodatkiem inicjatora.
c)
proces zachodzący wewnątrz kropel polegający na rozpuszczeniu w wodzie przez
mieszanie nierozpuszczalnego monomeru z inicjatorem.
d)
proces zachodzący w środowisku wodnym, w którym z monomeru, środka
powierzchniowo czynnego i inicjatora wytwarza się emulsja.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
KARTA ODPOWIEDZI
Imię i nazwisko..........................................................................................
Wykonywanie pomiarów parametrów procesowych
Zakreśl poprawną odpowiedź.
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
a
b
c
d
18.
a
b
c
d
19.
a
b
c
d
20.
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
7. LITERATURA
1.
Dramińska K., Różycki C., Tymiński B.: Pracownia pomiarów technicznych w przemyśle
chemicznym. WSiP, Warszawa 1987
2.
Jarosz M., Malinowska E.: Pracownia chemiczna. Analiza instrumentalna. WSiP,
Warszawa 1994
3.
Klepaczko-Filipiak B., Łoin J.: Pracownia chemiczna. Analiza techniczna, WSiP,
Warszawa 1994
4.
Łada Z. Różycki C.: Pracownia chemii analitycznej. Analiza techniczna i instrumentalna.
WSiP, Warszawa 1990
5.
Molenda J.: Technologia chemiczna. WSiP, Warszawa 1996
6.
Praca zbiorowa: Aparatura kontrolno-pomiarowa w przemyśle chemicznym. WSiP,
Warszawa 1993
7.
Szczepaniak W.: Metody instrumentalne w analizie chemicznej. PWN, Warszawa 2005
8.
Tuszyński K.: Pomiary i automatyka w przemyśle chemicznym. WSiP, Warszawa 1995
9.
Warych J.: Aparaty i urządzenia przemysłu chemicznego i przetwórczego. WSiP,
Warszawa 1996
10.
Warych J.: Podstawowe procesy przemysłu chemicznego i przetwórczego. WSiP,
Warszawa 1996
11.
Witkiewicz Z.: Podstawy chromatografii. WNT, Warszawa 1995
Literatura metodyczna:
1.
Baraniak B.: Treści kształcenia zawodowego – kryteria i metody doboru. IBE, Warszawa
1995
2.
Gange R. M., Brigs L.J., Wagner W. W.: Zasady projektowania dydaktycznego. WSiP,
Warszawa 1992
3.
Januszka U., Niemierko B.: Zastosowanie pomiaru sprawdzającego w kształceniu
zawodowym. MEN, Warszawa 1997
4.
Krogulec-Sobowiec M., Rudziński M.: Poradnik dla autorów pakietów edukacyjnych.
KOWEZiU, Warszawa 2003
5.
Niemierko B.: Pomiar wyników kształcenia zawodowego. BKKK, Warszawa 1997
6.
Niemierko B.: Dydaktyka edukacyjna. WUG, Gdańsk 1994
7.
Niemierko B.: Pomiar sprawdzający w dydaktyce. PWN, Warszawa 1990
8.
Nowicki T.: Podstawy dydaktyki zawodowej. PWN, Warszawa 1979
9.
Rubczak W.: Polityka Edukacyjna Unii Europejskiej na tle przemian w szkolnictwie
krajów członkowskich. IBE, Warszawa 1993
10.
Sołtys D., Szmigiel M. K.: Doskonalenie kompetencji nauczycieli w zakresie diagnozy
edukacyjnej. Wydawnictwo „Zamiast Korepetycji”, Kraków 1997
11.
Suchodolski B.: Edukacja przez pracę i dla pracy. PAN, Warszawa 2000
12.
Szlosek f.: Wstęp do dydaktyki przedmiotów zawodowych. Instytut Technologii
Eksploatacji, Radom 1998
13.
Wskazania metodyczne do oceny efektywności kształcenia zawodowego. IKZ, Warszawa
1987
Wyszukiwarka
Podobne podstrony:
04 Wykonywanie pomiarów parametrów procesowych
04 Wykonywanie pomiarow paramet Nieznany
04 Wykonywanie pomiarow paramet Nieznany
11 Wykonywanie pomiarów parametrów procesowych
Wykonywanie pomiarów parametrów procesowych
11 Wykonywanie pomiarów parametrów procesowych
16 Pomiary parametrów procesowych
11 Wykonywanie pomiarow paramet Nieznany (2)
04 Wykonywanie pomiarów
04 Wykonywanie pomiarów warsztatowych
04 Wykonywanie pomiarów
16 Pomiary parametrów procesowych
Wykonywanie pomiarów parametrów złożowych
04 Wykonywanie badan i pomiarow Nieznany (2)
04 Wykonywanie badań i pomiarów układów cyfrowych
711[04] Z2 04 Wykonywanie konse Nieznany (2)
więcej podobnych podstron