
M
IKROBIOLOGIA ŻYWNOŚCI
Ć
wiczenie 7
WTŻ II rok
___________________________________________________________________________
http://www.ar.krakow.pl/tz/ktfimt/
1
FIZJOLOGIA
DROŻDŻY
Aby określić rodzaj lub gatunek drożdży występujących w badanym środowisku,
należy przeprowadzić obserwacje makroskopowe i mikroskopowe kultury, a także zbadać
pewne cechy biochemiczne, które mogą stanowić podstawę klasyfikacji.
Badania makroskopowe
Badania te obejmują obserwacje badanych kultur na podłożu płynnym i stałym.
Na podłożu płynnym należy zwrócić uwagę na:
- występowanie osadu na dnie pożywki,
- gazowanie (obecność pęcherzyków gazu stwierdzamy przez ostrożne wstrząsanie płynu),
- tworzenie się kożuszka, błonki lub pierścienia na powierzchni płynu.
Na podłożu stałym po 1-2 miesiącach hodowli w temp. 20°C określa się:
- rodzaj wzrostu (jednolity nalot lub pojedyncze kolonie),
- powierzchnię wzrostu (matowa, błyszcząca) i strukturę kolonii (zwarta, mazista),
- zabarwienie i kształt kolonii.
Badania mikroskopowe
Badania te dotyczą obserwacji kształtu, wielkości, sposobu ułożenia oraz rozmnażania
komórek. Prowadzi się je wykonując preparaty przyżyciowe z jednodobowych kultur
hodowanych na podłożu płynnym, brzeczkowym, w temp. 30°C. Zastosowanie odpowiednich
metod barwienia pozwala określić żywotność kultury oraz obecność substancji zapasowych w
komórkach drożdży.
Test na żywotność
Na szkiełko podstawowe nanosimy kroplę błękitu
metylenowego, do niego dodajemy zawiesinę drożdży,
przykrywamy szkiełkiem nakrywkowym i oglądamy pod
ś
rednim powiększeniem. Komórki żywe nie wpuszczają
barwnika do wnętrza (trucizna). Komórki martwe łatwo
wpuszczają barwnik do wnętrza i barwią się na
niebiesko. Policzyć % martwych komórek (podać
wartość średnią z 3-5 pól widzenia).

M
IKROBIOLOGIA ŻYWNOŚCI
Ć
wiczenie 7
WTŻ II rok
___________________________________________________________________________
http://www.ar.krakow.pl/tz/ktfimt/
2
Test na odżywienie
Na szkiełko podstawowe nanosimy kroplę płynu Lugola, przenosimy drożdże, nakrywamy
szkiełkiem nakrywkowym i oglądamy pod średnim powiększeniem. Glikogen będący
materiałem zapasowym tworzy z płynem Lugola kompleks, co przejawia się brunatnym
zabarwieniem komórek dobrze odżywionych. Komórki słabo odżywione są prawie
przezroczyste (jasnożółte). Policzyć % komórek dobrze odżywionych (podać wartość średnią
z 3-5 pól widzenia).
Inne testy
badanie zdolności fermentacji cukrów
-
badają zdolność
drożdży w warunkach beztlenowych do wykorzystywania
różnych cukrów (glukoza, galaktoza, sacharoza, maltoza,
laktoza,
rafinoza)
poprzez
fermentację.
Wynikiem
pozytywnym jest powstanie CO
2
, który zbiera się w rurce
Durhama,
testy asymilacyjne
– badają zdolność drożdży w warunkach
tlenowych do wykorzystywania różnych źródeł węgla i
azotu. Wynikiem pozytywnym jest zmętnienie roztworu lub
pojawienie się kożuszka na jego powierzchni, co świadczy o
rozwoju mikroorganizmów,
badanie zarodnikowania
– drożdże dzielimy na zarodnikujące i niezarodnikujące, do
pobudzenia wytwarzania zarodników przez komórki drożdżowe używa się podłoży
sporulacyjnych o specyficznym składzie (agar octanowy, agar Gorodkowa), uzyskane w
ten sposób worki z zarodnikami barwi się metodą Schaeffera-Fultona, kształty
zarodników: kuliste, elipsoidalne, nerkowate, półkuliste, kapeluszowate, soczewkowate,
w kształcie Saturna, maczugowate, igiełkowate,
badanie obecności tłuszczu
–
z roztworem Sudanu III, krople tłuszczu barwią się na
czerwono, cytoplazma pozostaje bezbarwna,
badanie rozmnażania wegetatywnego
–
w hodowlach kropelkowych, w komorze
Lindnera co 15 minut przez kilka godzin obserwuje się komórki pod mikroskopem
(termostatowanym) oceniając sposób rozmnażania i typ pączkowania,
inne badania
– zdolność wzrostu w podwyższonej temperaturze, przy braku witamin,
przy wysokiej zawartości cukrów, zdolność do syntezy związków skrobiopodobnych,
zdolność do syntezy kwasu octowego, wytwarzania estrów, wytwarzania barwników itp.

M
IKROBIOLOGIA ŻYWNOŚCI
Ć
wiczenie 7
WTŻ II rok
___________________________________________________________________________
http://www.ar.krakow.pl/tz/ktfimt/
3
M
ETODY BEZPOŚREDNIE OZNACZANIA ILOŚCIOWEGO KOMÓREK
(
METODY
MIKROSKOPOWE
)
•
liczenie drobnoustrojów przy użyciu komór
Komory do liczenia drobnoustrojów pod mikroskopem mają postać szklanych płytek z
wyciętym wgłębieniem podzielonym na kwadraty lub prostokąty o znanej powierzchni.
Używane są komory Thoma (hemocytometr), Howarda, Bürkera, Fuch Rosenthala
i inne. Różnią się one wymiarami powierzchni, na których liczy się drobnoustroje. Dane
dotyczące powierzchni i głębokości podane są na komorach.
W komorach można zasadniczo liczyć tylko większe komórki drobnoustrojów, takie
jak drożdże, zarodniki i strzępki grzybów. Ograniczenia te wynikają po pierwsze stąd, że
grubość i głębokość komory nie pozwalają na użycie obiektywów o dużej sile powiększenia,
a więc tym samym o małej odległości roboczej i po drugie przy dużej głębokości komory
(100 mikrometrów = 0,1 mm) małe drobnoustroje, np. bakterie o średnicy 5 mikrometrów
(µm), mogą układać się w wielu płaszczyznach i przy użyciu silniejszych obiektywów o małej
głębi ostrości część komórek położona nad i pod płaszczyzną pola widzenia będzie
niewidoczna.
Komorę Thoma przedstawia rysunek poniżej. Jest to grube szkiełko przedmiotowe z
wyciętymi wgłębieniami o głębokości 0,1 mm (100 µm). Wgłębienia te widoczne są gołym
okiem po obydwu stronach środkowego kanalika jako równoramienne krzyże, powstałe
z przecięcia linii wyznaczających regularne, kwadratowe i prostokątne powierzchnie. Bok
małego kwadratu wynosi 1/20 mm (50 µm). Powierzchnia małego kwadracika wynosi więc
1/400 mm
2
(0,0025 mm
2
= 2500 µm
2
). W każdej siatce znajduje się 256 małych
kwadracików.
Po przykryciu komory szkiełkiem przykrywkowym nad każdym kwadracikiem powstaje
prostopadłościan o objętości 1/400 mm
2
x 0,1mm = 1/4000 mm
3
(2500 µm
2
x 100 µm =
250 000 µm
3
). Co piąty kwadrat w obu kierunkach podzielony jest na pół dodatkową linią, w
wyniku czego część kwadratów ma powierzchnię o połowę mniejszą, a cała komora
podzielona jest w ten sposób na 16 dużych kwadratów, z których każdy składa się z 16
małych kwadracików. Na przecięciu dodatkowych linii powstają maleńkie kwadraciki o
czterokrotnie mniejszej powierzchni równej 1/1600 mm
2
. Na powierzchni tej komory
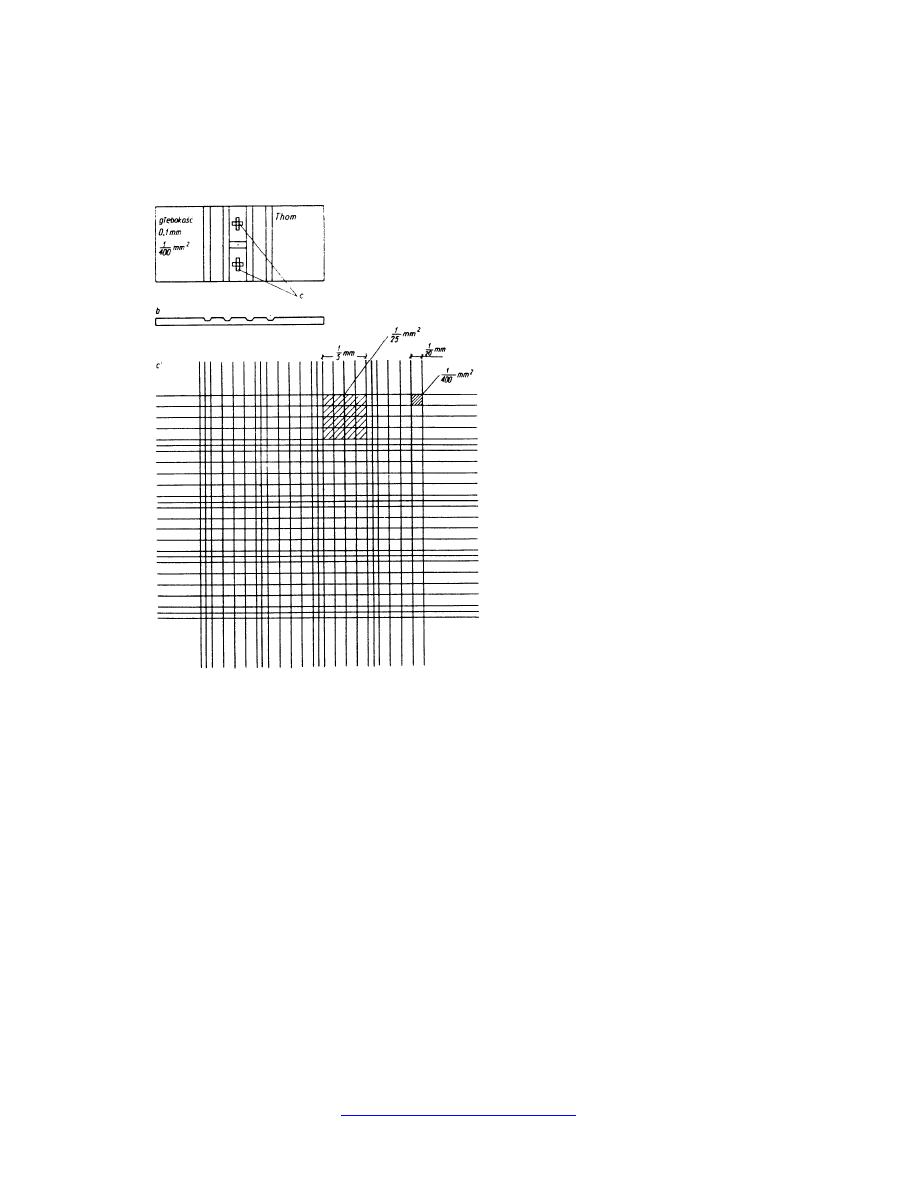
M
IKROBIOLOGIA ŻYWNOŚCI
Ć
wiczenie 7
WTŻ II rok
___________________________________________________________________________
http://www.ar.krakow.pl/tz/ktfimt/
4
wyżłobione są trzy kanaliki tworzące literę H, dwa poprzeczne i jeden środkowy, łączący je.
Mają one za zadanie zatrzymywać nadmiar płynu naniesionego na komorę.
Komora Thoma: a – widok z góry, b –
widok z boku, c– wgłębienie z naciętymi
kwadratami, c' – siatka kwadratów w
powiększeniu
Oznaczanie liczby drobnoustrojów przy użyciu komory Thoma wykonuje się
następująco. Zawiesinę komórek drożdży mających tendencję do zlepiania się rozcieńcza się,
biorąc 5 objętości zawiesiny i 1 objętość kwasu siarkowego rozcieńczonego wodą w stosunku
1:10, wytrząsa się kilka minut, przenosi szybko do komory Thoma, przykrywa szkiełkiem
przykrywkowym i przystępuje do liczenia. Po ustawieniu oświetlenia, należy znaleźć siatkę
komory najpierw przy obiektywie 10x, a następnie przy obiektywie 40x. Jeśli stwierdzi się
zbyt duże zagęszczenie drobnoustrojów, to należy próbę rozcieńczyć ilościowo, np. 10-
krotnie i powtórzyć oznaczenie. Oblicza się średnią liczbę drobnoustrojów z ok. 40 małych
kwadracików (o pow. 1/400 mm
2
). W sumie należy policzyć ok. 700 komórek, by błąd nie
przekroczył 10%. Komórki rozmieszczone są nierównomiernie, w jednych kwadracikach
może być ich kilka, a w innych - kilkanaście.
a

M
IKROBIOLOGIA ŻYWNOŚCI
Ć
wiczenie 7
WTŻ II rok
___________________________________________________________________________
http://www.ar.krakow.pl/tz/ktfimt/
5
Przy średniej liczbie komórek w jednym kwadraciku (a) i rozcieńczeniu zawiesiny
drobnoustrojów (n), zawartość komórek (L) w 1 cm
3
wynosi:
L = 4 • 10
6
• a • n
•
liczenie drobnoustrojów metodą Breeda w preparacie barwionym
Polega na wykonaniu równomiernego rozmazu określonej, niewielkiej ilości hodowli,
pobranej tzw. pipetą Breeda (0,01 cm
3
), na znanej powierzchni (A) szkiełka podstawowego,
wcześniej dokładnie odtłuszczonego. Po wykonaniu rozmazu, wysuszeniu i utrwaleniu,
preparat wybarwia się odpowiednim barwnikiem, a następnie liczy pod mikroskopem
średnią liczbę komórek z trzech preparatów.
•
metoda DEFT (Direct Epifluorescent Filter Technique)
Polega na liczeniu pod mikroskopem drobnoustrojów osadzonych na filtrze
membranowym, o porach 0,45 µm, po uprzednim ich wybarwieniu fluorochromami. Badane
próbki mogą być wstępnie poddane obróbce enzymatycznej, następnie wybarwiane
najczęściej oranżem akrydyny i liczone w mikroskopie fluorescencyjnym. Komórki żywe
fluoryzują na pomarańczowo lub żółto, natomiast martwe na zielono.
M
ETODY POMIARU WIELKOŚCI KOMÓREK
•
metoda pomiaru prostego komórek
Metoda polega na dokładnym narysowaniu komórki na papierze milimetrowym, w takiej
wielkości, w jakiej ją widzimy przy danym powiększeniu. W omawianej metodzie należy
zwrócić szczególną uwagę na zgodność wielkości obrazu oglądanego pod mikroskopem z
rysunkiem. Z rysunku odczytujemy wymiary w milimetrach, a wielkość rzeczywistą w
mikrometrach obliczamy ze wzoru:
b
a
a
rzeczywist
wielkosc
1000
×
=
gdzie:
a – wielkość komórki (mm),
b – powiększenie mikroskopu.
M
IKROBIOLOGIA ŻYWNOŚCI
Ć
wiczenie 7
WTŻ II rok
___________________________________________________________________________
http://www.ar.krakow.pl/tz/ktfimt/
6
•
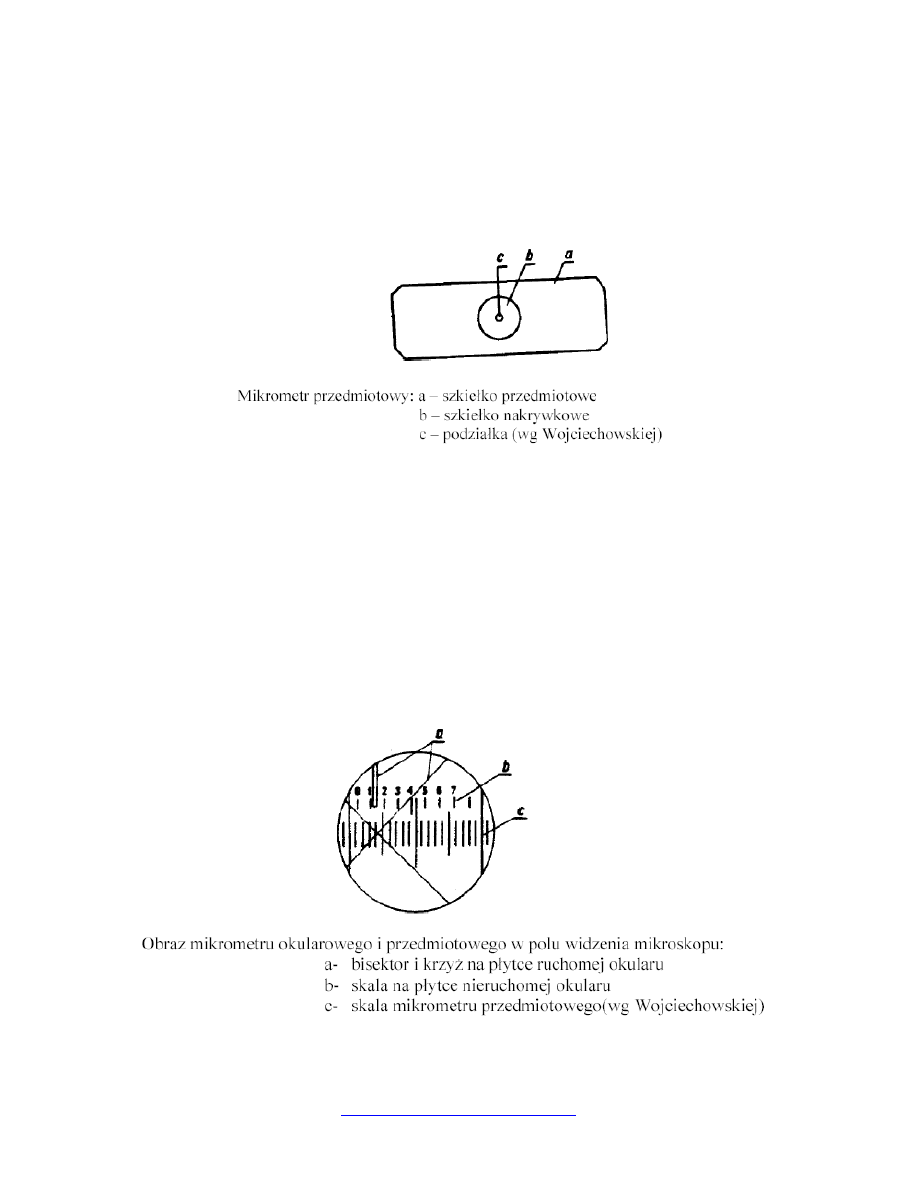
pomiar wielkości komórek przy użyciu okularu mikrometrycznego
Do wykonania pomiaru potrzebne są dwa mikrometry: okularowy i przedmiotowy. Na
mikrometrze przedmiotowym wyryta jest skala o długości 1 mm, podzielona na 100 równych
części, stąd odległość między kreskami podziałki jest równa 0,01 mm, tj. 10 µm.
Mikrometr okularowy zaopatrzony jest w skalę o długości 5 mm, której działki oddalone są
od siebie o 0,1 mm, tj. 100 µm. Przed przystąpieniem do pomiaru należy wyznaczyć wartość
mikrometryczną mikroskopu dla danego układu optycznego: okular, obiektyw. Po
umieszczeniu mikrometru okularowego w okularze, a mikrometru przedmiotowego na stoliku
i znalezieniu obrazu, ustawia się obie skale mikrometrów w taki sposób, aby ich punkty
zerowe pokryły się.

M
IKROBIOLOGIA ŻYWNOŚCI
Ć
wiczenie 7
WTŻ II rok
___________________________________________________________________________
http://www.ar.krakow.pl/tz/ktfimt/
7
Następnie oblicza się, ile kresek (działek) mikrometru okularowego przypada na określoną
liczbę kresek mikrometru przedmiotowego.
Wartość mikrometryczną oblicza się ze wzoru:
b
a
czna
mikrometry
wartosc
10
×
=
gdzie:
a – liczba odczytanych jednostek mikrometru przedmiotowego,
b – liczba jednostek mikrometru okularowego.
Po wyznaczeniu wartości mikrometrycznej mikrometr przedmiotowy zastępujemy
preparatem. Pomiar przeprowadzamy przy użyciu mikrometru okularowego, odczytując
liczbę kresek przypadających na mierzoną komórkę. Wartość rzeczywistą obliczamy mnożąc
odczytaną wielkość przez wyznaczoną wartość mikrometryczną.
•
pomiar wielkości komórek przy użyciu programu komputerowego
Wyszukiwarka
Podobne podstrony:
Lab 31.charakterystyka pompy, Ćwiczenie 31
Prezentacja z ćwiczeń 31.03.2009, Epidemiologia UMLUB
Cwiczenie 31, MIBM WIP PW, fizyka 2, laborki fiza(2), 31-Ruch elektronu w polu magnetycznym i elektr
ćwiczenie 31, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
45 Arkuszy ćwiczeniowych Matura angielski rozmowy sterowane, Arkusz ćwiczeniowy 31, Arkusz ćwiczenio
Ćwiczenie 31 - notatki, Elektronika
Z Ćwiczenia 31.05.2008, Zajęcia, II semestr 2008, Analiza matematyczna
31, Cwiczenie 31, Tomasz Dobrzycki
Sprawozdanie do ćwiczenia 31
ĆWICZENIE 31 RAV doc
ćwiczenie 31,1
Cwiczenie 31
ćwiczenie 31
Ćwiczenie 31(2) doc
Ćwiczenie 31 doc
Wyniki ćwiczenia 31
cwiczenie 31
Cwiczenie$,30,31
więcej podobnych podstron