Nazwisko, imię (DRUKOWANYMI LITERAMI)
.
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. ..
.
.
.
.
....
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. ..
.
.
.
.
....
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. ..
.
.
.
.
....
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
. .
.
.
http://sylwester_stepniak.users.sggw.pl
ALKACYMETRIA
e-mail: sylwester_stepniak@sggw.pl
Alkacymetria - jest to metoda ilościowej analizy stechiometrycznej (analizy objętościowej), w której wykorzystuje się
reakcje typu: kwas - zasada.
Substancja podstawowa - krystaliczny kwas szczawiowy (H
2
C
2
O
4
·2H
2
O), Masa molowa (M
1
) : M
1
= 126,06 g·mol
–1
.
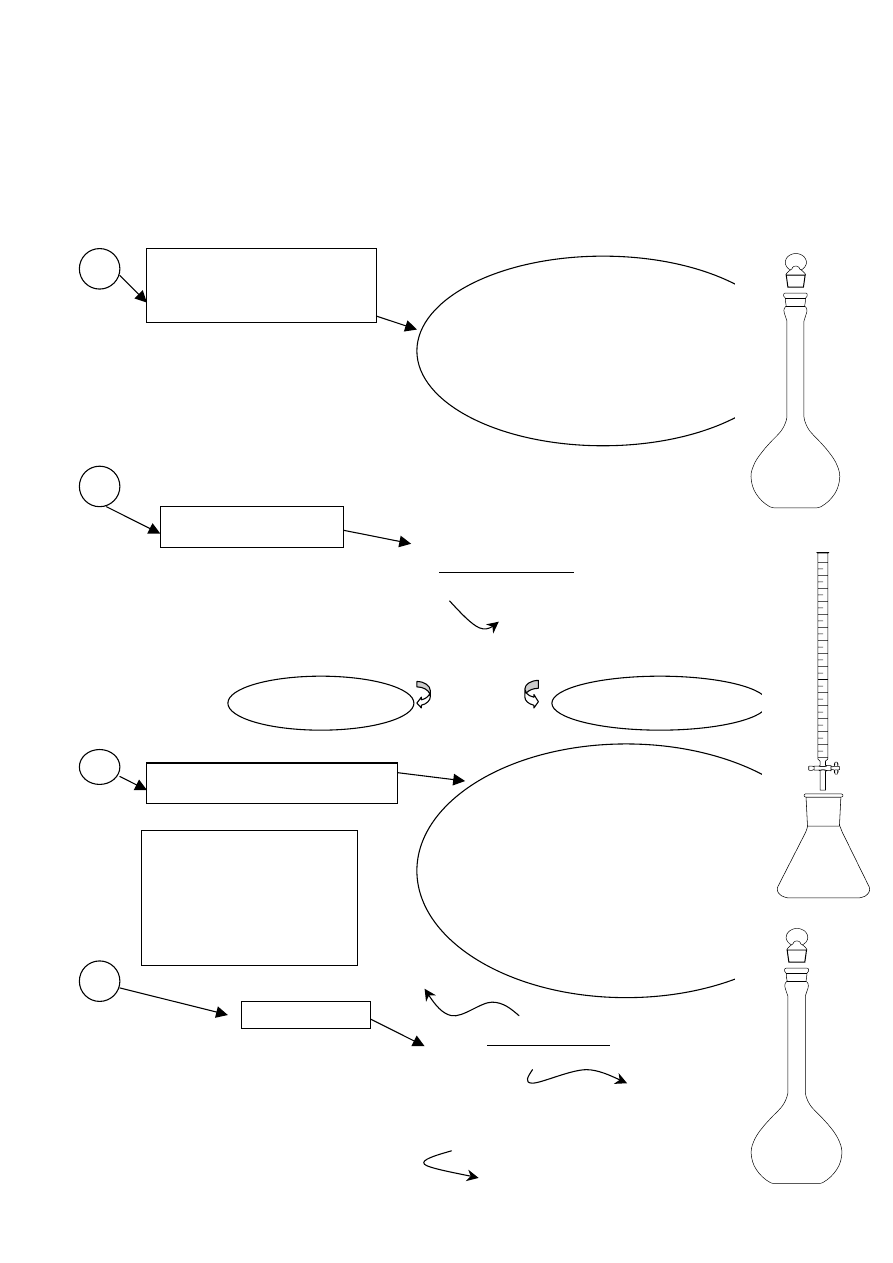
ALKACYMETRYCZNE OZNACZANIE NaOH - METODYKA POSTĘPOWANIA ANALITYCZNEGO
I.
Przygotowanie mianowanego roztworu H
2
C
2
O
4
o stężeniu około 0,05 mol·dm
–3
w kolbie miarowej (V
k
)
Objętość kolby miarowej w dm
3
II. Oznaczenie
stężenia NaOH
Równanie reakcji: H
2
C
2
O
4
+ 2 NaOH
→ Na
2
C
2
O
4
+ 2 H
2
O
Wskaźnik punktu
równoważności molowej:
fenoloftaleina
Miareczkowanie mianowanego roztworu
kwasu H
2
C
2
O
4
roztworem NaOH
Objętość pipety w cm
3
III. Obliczenie masy NaOH w badanym roztworze
Odczyt z biurety w cm
3
Masa NaOH w badanym roztworze: m
NaOH
= M
NaOH
·V
kolby
·c
NaOH
= ................................................
Objętość kolby w dm
3
Roztwór bezbarwny
(nadmiar H
2
C
2
O
4
)
Bladoróżowe zabarwienie
roztworu (nadmiar NaOH)
1
Ważenie na wadze analitycznej
substancji podstawowej
w naczyńku wagowym
(H
2
C
2
O
4
·2H
2
O)
H
2
C
2
O
4
2
1.
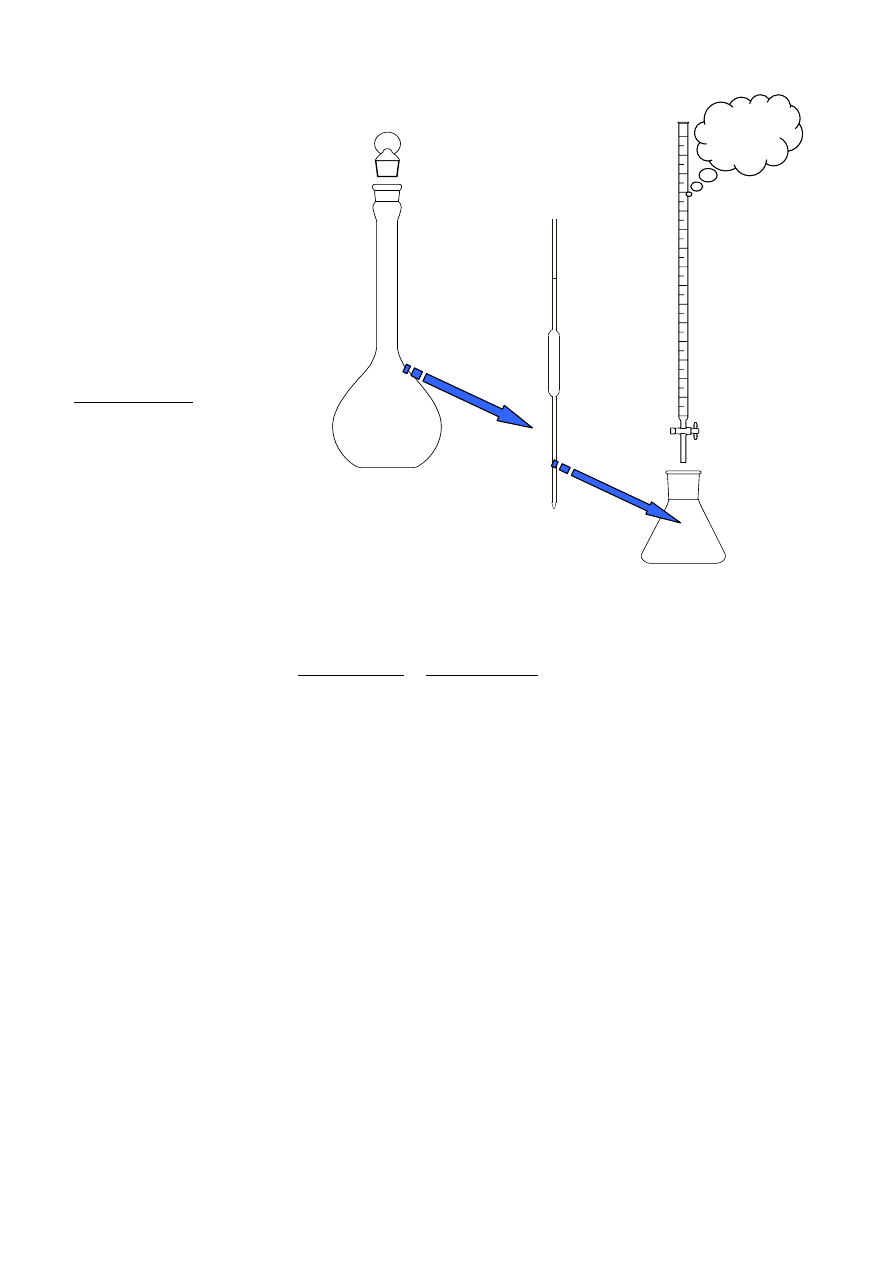
Pobrać pipetą (V
r
) z kolby miarowej roztwór H
2
C
2
O
4
i przenieść ilościowo do kolby stożkowej.
2. Dodać 2-3 krople fenoloftaleiny do roztworu
w kolbie stożkowej
3. Miareczkować roztworem NaOH do momentu, gdy
roztwór w kolbie stożkowej zabarwi się na kolor różowy,
nie znikający przez 30 sekund (po tym czasie roztwór
może się odbarwić, gdyż pochłania z powietrza CO
2
).
Uwaga: Po skończeniu miareczkowania biuretę należy
przepłukać wodą destylowaną.
Obliczenie stężenia H
2
C
2
O
4
(c
r
)
H C O
H C O
H O
k
H C O
H O
c
m
V M
2 2 4
2 2 4
2
2 2 4
2
2
2
=
⋅
=
⋅
⋅
....................................
1
Obliczenie stężenia
NaOH
H C O
H C O
NaOH r
c
c
V
=
⋅
=
⋅
2 2 4
2 2 4
2 V
ś
,
.........................................
H
2
C
2
O
4
Fenoloftaleina
NaOH
NaOH
m
H C O
H O
2 2 4
2
2
⋅
=............................
V
NaOH,1
= ........................................
V
NaOH,2
= ........................................
V
NaOH,śr
= ......................................
2
1.
Odważyć na wadze analitycznej około
1,3 g krystalicznego kwasu szczawiowego
z dokładnością do 0,0001g.
2.
Przenieść ilościowo odważony kwas, p
pując go przez suchy lejek do kolby miaro-
wej.
rzesy-
re-
3.
Spłukać dokładnie lejek i uzupełnić roztwór
w kolbie miarowej wodą destylowaną do k
ski.
Zadanie 1.
Ile gramów HCl znajduje się w kolbie miarowej o objętości 250 cm
3
, jeśli na zobojętnienie 25 cm
3
tego roztworu zużyto średnio 28,35 cm
3
roztworu NaOH o stężeniu 0,1778 mol·dm
-3
?
NaOH
HCl
Fenoloftaleina
HCl
Dane:
V
3
250cm
kolby
=
3
25cm
V
pipety
=
3
35
,
28
cm
V
NaOH
=
3
/
1778
,
0
dm
mol
c
NaOH
=
mol
g
M
HCl
/
5
,
36
=
Należy obliczyć:
m
HCl
= ?
Rozwiązanie:
HCl + NaOH = NaCl + H
2
O
3
/
2016
,
0
25
1778
,
0
35
,
28
dm
mol
V
c
V
c
pipety
NaOH
NaOH
HCl
=
⋅
=
⋅
=
g
c
V
M
m
HCl
kolby
HCl
HCl
8398
,
1
2016
,
0
25
,
0
5
,
36
=
⋅
⋅
=
⋅
⋅
=
Zadania do samodzielnego rozwiązania:
1.
Jakie jest stężenie molowe roztworu kwasu szczawiowego powstałego przez rozpuszczone odważki
krystalicznego związku o masie 1,3850 g w wodzie i dopełnieniu kolby miarowej do objętości
250 cm
3
? Odp.: 0,0439 mol/dm
3
2.
Jakie jest stężenie molowe zasady sodowej, jeśli 20 cm
3
roztworu tej zasady zobojętnia 15,8 cm
3
roz-
tworu kwasu szczawiowego o stężeniu 0,1125 mol·dm
-3
? Odp.: 0,1778 mol/dm
3
3.
Ile gramów dwuwodnego kwasu szczawiowego zużyto do przygotowania 200 cm
3
roztworu,
jeśli 18,0 cm
3
tego roztworu zobojętnia 25,0 cm
3
roztworu NaOH o stężeniu 0,1500 mol·dm
-3
?
Odp.: 2,6267 g
4.
Jakie jest stężenie molowe i miano kwasu siarkowego, jeśli 18,35 cm
3
tego kwasu zobojętnia 20cm
3
zasady sodowej o mianie 3,82·10
-3
g·cm
-3
? Odp.: 0,0520 mol/dm
3
; 5,10·10
–3
g/cm
3
Wyszukiwarka
Podobne podstrony:
alkacymetria zadania1
Alkacymetria zadania, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA CZŁOWIEKA, ROK I, SEM 1, ROZNE
Seminarium z alkacymetrii zadania dodatkowe
, chemia analityczna L, alkacymetria zadania
zadania - pH i alkacymetria, studia, chemia analityczna, alkacymetria
zadania - stężenia, studia, chemia analityczna, alkacymetria
zadania testowe z alkacymetrii, chemia analityczna
Zadania z treścia
Prezentacja 2 analiza akcji zadania dla studentow
Przedmiot i zadania dydaktyki 4
zadanie 1 v 002
Przedmiot dzialy i zada
więcej podobnych podstron