
Medycyna Wet. 2006, 62 (1)
20
Artyku³ przegl¹dowy
Review
Pryszczyca jest zakan¹, wysoce zaraliw¹ chorob¹
wirusow¹ zwierz¹t parzystokopytnych domowych
i dzikich, o du¿ej dynamice szerzenia siê. Aktualnie
pryszczyca wystêpuje na du¿ych obszarach naszego
globu (24), przyczyniaj¹c siê do znacznych strat fi-
nansowych krajów zapowietrzonych. O wielkoci tych
strat mog¹ wiadczyæ dane z epizootii pryszczycy
w Wielkiej Brytanii w 2001 r., podczas której straty
w sektorze pañstwowym przekroczy³y 3 mld funtów
brytyjskich, a w prywatnym 5 mld (9). W krajach UE
pryszczycê zwalcza siê metod¹ radykaln¹, która pole-
ga na wybijaniu wszystkich zwierz¹t chorych, zaka-
¿onych i podejrzanych o zaka¿enie, utylizacji ich zw³ok
przez spalenie lub zakopanie, a tak¿e likwidacji wszyst-
kich produktów pochodz¹cych od takich zwierz¹t. Po-
nadto obowi¹zuj¹ odpowiednie re¿imy administracyj-
ne i sanitarno-weterynaryjne, takie jak: kwarantanna,
szczegó³owa kontrola i ograniczenia ruchu zwierz¹t,
dok³adna dezynfekcja, a tak¿e serologiczne badania
przegl¹dowe zwierz¹t podatnych na zaka¿enie, u któ-
rych mog¹ wystêpowaæ swoiste przeciwcia³a. Dopusz-
cza siê równie¿ stosowanie szczepieñ interwencyjnych
piercieniowych i wyt³umiaj¹cych (suppresive) wo-
kó³ gospodarstw zagro¿onych, w celu zahamowania
szerzenia siê choroby poprzez utworzenie strefy bufo-
rowej ograniczaj¹cej dalsze rozprzestrzenianie siê wi-
rusa w populacji zwierz¹t podatnych na zaka¿enie (18).
Poniewa¿ zwierzêta szczepione, lecz nie zaka¿one, nie
stanowi¹ ryzyka szerzenia siê choroby, to nie musz¹
byæ eliminowane, jak to mia³o miejsce podczas zwal-
czania pryszczycy w Holandii w 2001 r. (16). Jednak-
¿e, przed wprowadzeniem takich szczepieñ do prak-
tyki nale¿y opracowaæ i zwalidowaæ laboratoryjne
metody diagnostyczne umo¿liwiaj¹ce odró¿nienie
zwierz¹t po przebytym zaka¿eniu i nosicieli od im-
munizowanych szczepionkami inaktywowanymi. Pod-
stawowe wytyczne w zakresie stosowania takich tes-
tów diagnostycznych do wykrywania przeciwcia³ dla
bia³ek niestrukturalnych (NSPs) wirusa pryszczycy,
których obecnoæ wiadczy o aktualnym lub przeby-
tym zaka¿eniu wirusem pryszczycy, s¹ zawarte w OIE
Terrestrial Animal Health Code (http://www.oie.int/)
oraz w Dyrektywie Rady (1). Zgodnie z wymieniony-
mi dokumentami, odzyskanie statusu kraju wolnego
od pryszczycy, w którym stosowano szczepienia, mo¿e
nast¹piæ co najmniej po 18 miesi¹cach od ich zastoso-
wania, gdy przeprowadzono serologiczne badania prze-
gl¹dowe na obecnoæ NSPs.
Serologiczne ró¿nicowanie zwierz¹t szczepionych
od zaka¿onych wirusem pryszczycy
WIES£AW NIEDBALSKI, ANDRZEJ KÊSY
Zak³ad Pryszczycy Pañstwowego Instytutu Weterynaryjnego, ul. Wodna 7, 98-220 Zduñska Wola
Niedbalski W., Kêsy A.
Serological differentiation of animals infected and vaccinated against foot-and-mouth disease virus
Summary
Foot-and-mouth disease (FMD) is a severe and highly infectious viral disease of cloven-hoofed animals.
Differentiating FMDV-infected animals from those that have merely been vaccinated is important for inter-
national and local trade of live animals, FMD control programs and in particular for eradication campaigns
where emergency vaccinations have been applied. Several diagnostic tests have been developed to distinguish
between these animals and are all based on detecting antibodies for non-structural proteins (NSPs) of FMDV.
These assays have been described using either panels of proteins or individual proteins 3D, 2C, 3AB1 or
3ABC. The response to 3ABC and its cleavage products (mainly 3AB, 3A and 3B) seem to be the most reliable
indices of infection. There are four commercially available tests for antibodies to FMDV NSPs: CHEKIT
FMD-3ABC (Bommeli AG, Switzerland), Ceditest FMDV-NS (Cedi-Dignostics, B.V. the Netherlands),
SVANOIR FMDV 3ABC-Ab ELISA (Svanova Biotech AB, Sweden) as well as UBI FMDV NSP ELISA (United
Biomedical, Inc., USA). These kits have been validated to some extent but need to be harmonized and stan-
dardized against a set of standards which should cover different epidemiological situations.
Keywords: foot-and-mouth disease
Medycyna Wet. 2006, 62 (1)
21
Organizacja i ekspresja
genomu wirusa pryszczycy
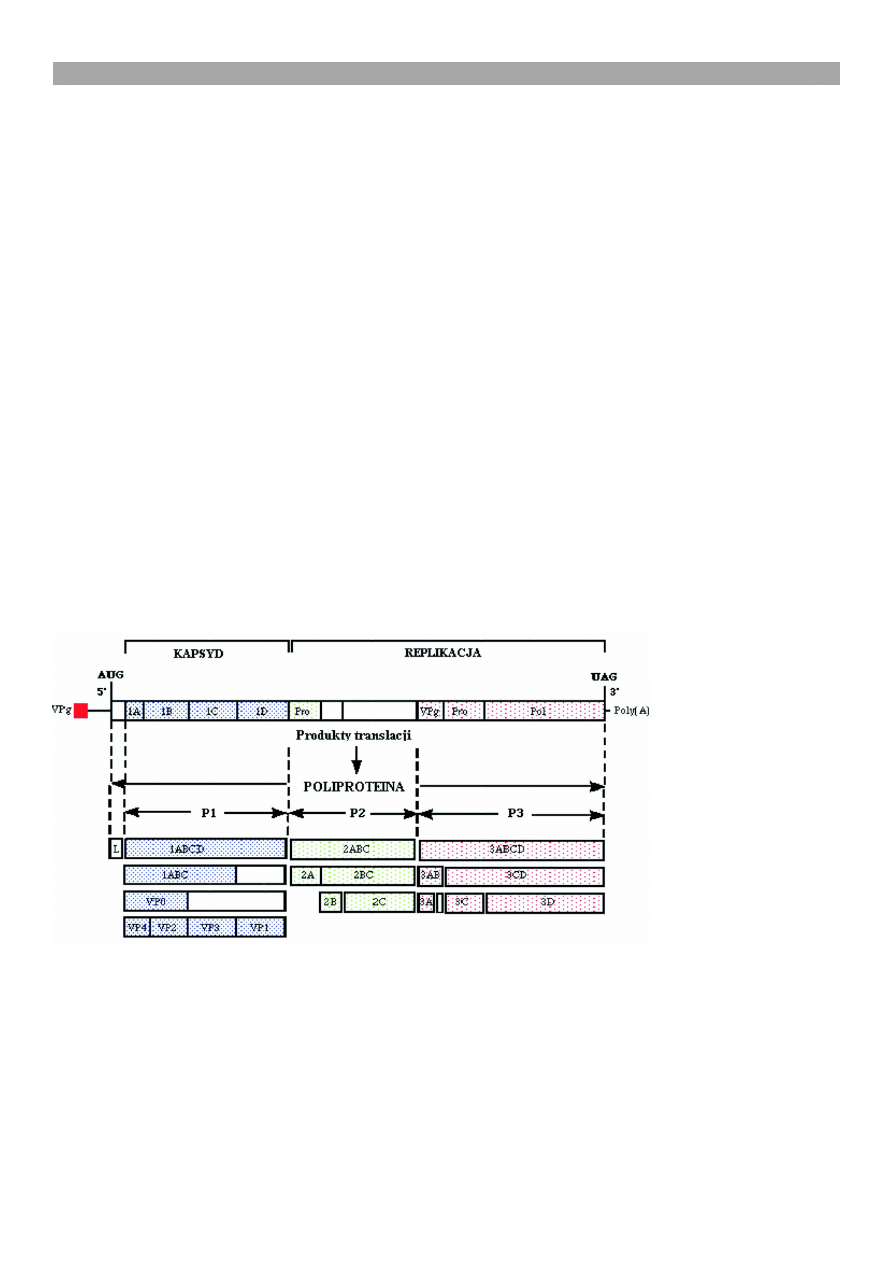
Genom wirusa pryszczycy stanowi pojedyncza, do-
datnio spolaryzowana niæ RNA o d³ugoci oko³o 8500
nukleotydów (ryc. 1). Na koñcu 5 genomu wystêpuje
ma³e bia³ko wirusowe VPg. Region niekoduj¹cy 5
NTR zawiera fragment poly(C) sk³adaj¹cy siê z oko³o
1200 zasad, natomiast odcinek niekoduj¹cy 3 NTR
obejmuje fragment poly(A) o d³ugoci 87 zasad wa¿-
ny w procesie replikacji wirusa. Otoczona regionami
niekoduj¹cymi, otwarta ramka odczytu (ORF) koduje
pierwotn¹ poliproteinê o d³ugoci 2332 aminokwasów,
która w wyniku procesów potranslacyjnych, na sku-
tek dzia³ania proteaz, ulega rozbiciu na 4 poliprote-
iny: L proteaza, P1 prekursor bia³ek strukturalnych
kapsydu wirusa (VP4-VP1) oraz P2 i P3 prekursory
bia³ek niestrukturalnych wirusa: 2A o aktywnoci
proteolitycznej, 2B uczestniczy w replikacji RNA,
2C bierze udzia³ w formowaniu pêcherzy i enkapsy-
dacji wirusa, 3A hamuje ekspresjê antygenu MHC
klasy I na powierzchni zaka¿onych komórek, a tak¿e
wydzielanie i wewn¹trzkomórkowy transport bia³ek,
bia³ko ³¹cznikowe 3B, proteaza 3C i polimeraza RNA
3D. Za wiêkszoæ procesów trawienia odpowiada pro-
teza 3C, a proteza 2A inicjuje uwalnianie bia³ek kap-
sydowych (2).
Bia³ka niestrukturalne wirusa pryszczycy
jako markery zaka¿enia
Aktywny wirus pryszczycy, w odró¿nieniu od zinak-
tywowanego antygenu tego wirusa wchodz¹cego
w sk³ad szczepionek przeciw pryszczycowych, posia-
da zdolnoæ replikacji w niektórych komórkach orga-
nizmu zwierzêcia i w konsekwencji powoduje produk-
cjê nie tylko strukturalnych bia³ek kapsydu wirusa
(VP1-VP4), ale równie¿ szeregu bia³ek niestruktural-
nych (2A-C i 3A-D), z których kilka wykazuje w³aci-
woci immunogenne (23). Inaktywowany antygen wi-
rusa pryszczycy, na którego bazie produkuje siê obec-
nie stosowane szczepionki przeciwpryszczycowe, sta-
nowi przede wszystkim strukturalne bia³ko kapsydu
wirusa oraz ladowe iloci NSPs, przede wszystkim
bia³ka 3D, czyli polimerazy RNA. Bia³ko to jest bar-
dzo silnie zwi¹zane z cz¹steczk¹ wiriona i nawet za-
stosowanie nowoczesnych technologii oczyszczania
antygenu podczas produkcji szczepionki nie gwaran-
tuje, ¿e bia³ko to zostanie ca³kowicie usuniête. Jest to
jedno z najbardziej immunogennych NSPs i wielokrot-
na immunizacja takimi szczepionkami przyczynia siê
do powstawania swoistych dla niego przeciwcia³, co
uniemo¿liwia jednoznaczne stwierdzenie, czy zwie-
rzê to by³o wy³¹cznie szczepione czy równie¿ zaka¿o-
ne wirusem pryszczycy (12, 14).
W ostatnim okresie, w wielu laboratoriach prysz-
czycowych podjêto badania nad opracowaniem me-
tod pozwalaj¹cych na identyfikacjê swoistych przeciw-
cia³ dla NSPs, które s¹ bardziej wiarygodnym wyznacz-
nikiem przebytego lub trwaj¹cego zaka¿enia. Berger
i wsp. (3) wykazali, ¿e zwierzêta po przebytym zaka-
¿eniu mog¹ byæ identyfikowane na podstawie obec-
noci przeciwcia³ dla NSPs 3AB oraz 3C i 2C. Inni
badacze stwierdzili, ¿e do odró¿nienia nosicieli od
zwierz¹t szczepionych przeciwko pryszczycy, mo¿na
zastosowaæ metody wykrywania swoistych przeciw-
cia³ dla bia³ka 2C i poli-
peptydu 3ABC, których
obecnoæ w surowicy
krwi zwierz¹t stwierdza
siê nawet po 365 dniach
od zaka¿enia (10). Rod-
riquez i wsp. (17) porów-
nuj¹c immunogennoæ
ró¿nych bia³ek wirusa
pryszczycy u wiñ udo-
wodnili, ¿e polipeptyd
3ABC, który mo¿na wy-
kryæ w surowicy ju¿ 14
dni po zaka¿eniu, jest
najbardziej immunogen-
nym antygenem wirusa
pryszczycy i mo¿e byæ
u¿yty do ró¿nicowania
zwierz¹t zaka¿onych od
szczepionych. Jeszcze
innym markerem pozwalaj¹cym oceniæ, czy zwierzê-
ta by³y zaka¿one, czy szczepione, jest bia³ko 3AB1,
dla którego swoiste przeciwcia³a wykrywa siê w suro-
wicach byd³a w okresie od 7 do 560 dni po zaka¿eniu
(20). Wyniki badañ wykonanych w innych laborato-
riach pryszczycowych wykaza³y, ¿e zwierzêta zaka-
¿one mo¿na ró¿nicowaæ od zaszczepionych na pod-
stawie obecnoci przeciwcia³ dla bia³ek 2C, 3A
i 3ABC, przy czym przeciwcia³a dla antygenu 3ABC
s¹ najbardziej wiarygodnym serologicznym wskani-
kiem zaka¿enia (8, 11).
Ryc. 1. Schemat organizacji i ekspresji genomu wirusa pryszczycy

Medycyna Wet. 2006, 62 (1)
22
Metody diagnostyczne wykrywania
przeciwcia³ dla NSPs
Wprowadzone na pocz¹tku lat 90. do diagnostyki
laboratoryjnej w kierunku przeciwcia³ dla NSPs me-
tody elektroimmunotransferu (EITB) (4) oraz radio-
immunoprecypitacji (RIA) (10), ze wzglêdu na skom-
plikowan¹ procedurê i d³ugi czas wykonania, okaza³y
siê nieprzydatne do rutynowej diagnostyki, a przede
wszystkim do badañ serologicznych przegl¹dowych na
du¿¹ skalê. W kolejnych latach opracowano szereg
metod immunoenzymatycznych (ELISA), które z po-
wodu prostoty i znacznie krótszego czasu wykonania,
a tak¿e niskiego kosztu i wy¿szej precyzji s¹ obecnie
powszechnie wykorzystywane do badañ monitoringo-
wych. Znanych jest kilkanacie wersji ELISA do ró¿-
nicowania zwierz¹t zaka¿onych od szczepionych, jed-
nak¿e testy do wykrywania przeciwcia³ dla polipepty-
du 3ABC s¹ najczêciej stosowane. W metodach tych
wykorzystuje siê antygeny rekombinowane uzyskane
w systemie ekspresyjnym bakteryjnym (8, 22) lub wi-
rusowym (21). Jednak¿e stwierdzono, ¿e wystêpowa-
nie przeciwcia³ dla antygenów wektorów ekspresyj-
nych mo¿e byæ powodem reakcji niespecyficznych
i utrudnia interpretacjê wyników. W celu redukcji od-
setka takich reakcji, zaleca siê dodatkowo wykonanie
testu potwierdzaj¹cego lub zwi¹zanie rekombinowa-
nego antygenu ze specyficznymi przeciwcia³ami mo-
noklonalnymi (Mabs). Jako test potwierdzaj¹cy mo¿e
byæ u¿yta metoda EITB, stosowana powszechnie
w ostatnim dziesiêcioleciu w Ameryce Po³udniowej
(5). Przyk³adem testu ELISA z u¿yciem rekombino-
wanego bia³ka 3ABC zwi¹zanego z Mabs jest test
3ABC-ELISA opracowany przez badaczy w³oskich
(8). Do identyfikacji przeciwcia³ dla FMDV NSPs
mog¹ równie¿ byæ zastosowane peptydy, np. 3B lub
3A, przy których pomocy mo¿liwe jest ró¿nicowanie
surowic pochodz¹cych od rekonwalescentów i zwie-
rz¹t szczepionych (19). Nale¿y zaznaczyæ, ¿e testy te
s¹ w zasadzie przeznaczone do wykrywania przeciw-
cia³ dla NSPs u byd³a i s¹ mniej u¿yteczne w przypad-
ku owiec i wiñ. W szczególnoci u owiec, ze wzglê-
du na czêsto wystêpuj¹c¹ subkliniczn¹ formê zaka¿e-
nia, ich przydatnoæ mo¿e byæ ograniczona. Ponadto,
wykorzystanie istniej¹cych metod diagnostycznych jest
w¹tpliwe, jeli mamy do czynienia ze zwierzêtami
szczepionymi przeciwko pryszczycy, które nastêpnie
mia³y kontakt z wirusem pryszczycy i zosta³y nosicie-
lami. Wykazano bowiem, ¿e przy zastosowaniu tych
metod niemo¿liwe jest wykrycie przeciwcia³ dla NSPs
L, 2C, 3A, 3D i 3ABC u wszystkich zwierz¹t nosicie-
li (11). Stwierdzono tak¿e, ¿e nie u wszystkich zwie-
rz¹t zaka¿onych nastêpuje serokonwersja dla NSPs
(12). Dlatego testy dla NSPs powinny byæ stosowane
do badania ca³ego stada zwierz¹t, przy zastosowaniu
okrelonego programu pobierania próbek krwi, a nie
tylko dla pojedynczych zwierz¹t podejrzanych o za-
ka¿enie. Takie badanie powinno pomóc w ocenie
wczeniejszej aktywnoci wirusa i okreleniu praw-
dopodobieñstwa wyst¹pienia nosicieli.
Obecnie dostêpne s¹ komercyjnie nastêpuj¹ce ze-
stawy do wykrywania przeciwcia³ dla NSPs wirusa
pryszczycy: CHEKIT FMD-3ABC (Bommeli AG,
Szwajcaria), Ceditest FMDV-NS (Cedi-Diagnostics,
B.V. Holandia), SVANOIR FMDV 3ABC-Ab ELISA
(Svanova Biotech AB, Szwecja) oraz UBI FMDV NSP
ELISA (United Biomedical, Inc., USA). Wszystkie
testy s¹ ³atwe i szybkie w wykonaniu, a ich czu³oæ
i specyficznoæ jest bliska 100% (6, 13).
Walidacja i standaryzacja metod wykrywania
przeciwcia³ dla NSPs
Metody wykrywania NSPs, szczególnie dla potrzeb
handlu miêdzynarodowego zwierzêtami i produktami
zwierzêcego pochodzenia, musz¹ byæ w pe³ni zwali-
dowane. Walidacja istniej¹cych metod NSPs jest jed-
nym z zadañ projektu badawczego Unii Europejskiej
FMD-ImproCon (SSPE-CT-2003-503603), realizo-
wanego w latach 2003-2005. Celem miêdzynarodo-
wych badañ laboratoryjnych jest porównanie czu³oci
i specyficznoci szeciu metod diagnostycznych. Za-
daniem ka¿dego z jedenastu uczestnicz¹cych w bada-
niach laboratoriów by³o zbadanie przy u¿yciu dostar-
czonych zestawów diagnostycznych oko³o 19 000 pró-
bek surowic pobranych od ró¿nych gatunków zwie-
rz¹t zdrowych oraz w ró¿nym okresie po szczepieniu
i/lub zaka¿eniu. Specyficznoæ oceniono na 95-100%
w zale¿noci od u¿ytej metody. Do chwili obecnej
wykonano czêciow¹ walidacjê metod, lecz koniecz-
ne s¹ dalsze badania z u¿yciem surowic od zwierz¹t,
u których objawy kliniczne s¹ s³abo wyra¿one lub
w ogóle nie wystêpuj¹, np. u owiec. Niezbêdne jest
tak¿e porównanie metod do wykrywania przeciwcia³
dla NSP u zwierz¹t innych gatunków podatnych na
zaka¿enie wirusem pryszczycy (7). Z powodu braku
walidacji, do chwili obecnej ¿adna z metod nie zosta-
³a jeszcze oficjalnie zatwierdzona. OIE Manual of
Diagnostic Tests and Vaccines for Terrestrial Animals,
2004 zaleca stosowanie po³udniowo-amerykañskiego
poredniego testu PANAFTOSA ELISA, w którym wy-
korzystuje siê rekombinowany antygen 3ABC, uzys-
kany metod¹ ekspresji w komórkach Escherichia coli.
Antygen ten oczyszczany jest metod¹ preparatywnej
elektroforezy i nak³adany bezporednio na p³ytkê ELI-
SA. Przeciwcia³a dla bia³ka 3ABC wykrywa siê w re-
akcji z odpowiednim koniugatem. Surowice dodatnie
lub w¹tpliwe w metodzie ELISA zaleca siê dodatko-
wo badaæ metod¹ EITB (5). Jednak¿e metody te nie
znalaz³y dotychczas zastosowania w laboratoriach eu-
ropejskich, g³ównie ze wzglêdu na problemy z inter-
pretacj¹ wyników uzyskanych metod¹ western blot.
Ponadto, wstêpne badania wykonane w kilku labora-
toriach nie potwierdzi³y wysokiej specyficznoci me-
tody oszacowanej wczeniej w Centre Panamericano
de Fiebre Aftosa w Brazylii (15) Dotychczas niedo-
stêpne s¹ równie¿ miêdzynarodowe standardy surowic

Medycyna Wet. 2006, 62 (1)
23
dla kalibracji metod NSPs. Zgodnie z zaleceniami OIE,
takie surowice referencyjne wymagane dla byd³a,
owiec i wiñ s¹ obecnie opracowywane.
Testy serologiczne do wykrywania przeciwcia³ dla
NSPs w po³¹czeniu z metodami do identyfikacji prze-
ciwcia³ dla bia³ek strukturalnych wirusa pryszczycy
mog¹ byæ u¿yteczne do oceny statusu immunologicz-
nego zwierz¹t, zw³aszcza w regionach dotkniêtych
pryszczyc¹, w których w zwalczaniu epizootii stoso-
wano szczepienia interwencyjne. Jednak¿e zanim zo-
stan¹ one u¿yte do zakrojonych na szerok¹ skalê ba-
dañ przegl¹dowych zwierz¹t lub zatwierdzone przez
wiatow¹ Organizacjê ds. Handlu jako dowód, ¿e kraj
jest wolny od pryszczycy, musz¹ byæ kontynuowane
dalsze badania nad ich doskonaleniem, a przede
wszystkim powinny byæ one ujednolicone w odniesie-
niu do zestawu standardów opracowanych dla ró¿nych
sytuacji epidemiologicznych.
Pimiennictwo
1.Anon.: Council directive on community measures for the control of FMD
repealing Directive 85/511/EEC and Decision 89/531/EEC and 91/665/EEC
and amending Directive 92/46/EEC.
2.Belsham G. J.: Distinctive features of foot-and-mouth disease wirus, a mem-
ber of the picornavirus family; aspects of virus protein synthesis, protein
processing and structure. Prog. Biophys. Molec. Biol. 1993, 60, 241-260.
3.Berger H. G., Straub O. C., Ahl R., Tesar M., Marquardt O.: Identification of
foot-and-mouth diasese virus replication in vaccinated cattle by antibodies
to non-structural proteins. Vaccine 1990, 8, 213-216.
4.Bergmann I. E., Aule de Mello P., Neitzert E., Beck E., Gomes I.: Diagnosis
of persistent aphtovirus infection and ist differentiation from vaccination
response in cattle by use of enzyme-linked immunotransfer blot analysis with
bioenergineered nonstructural viral antigens. Am. J. Vet. Res. 1993, 54, 825-
-831.
5.Bergman I. E., Malirat V., Neitzert E., Beck E., Panizzutti N., Sanchez C.,
Falczuk A.: Improvement of a serodiagnostic strategy for foot-and-mouth
disease virus surveillance in cattle under systematic vaccination: a combined
system of an indirect ELISA-3ABC with an enzyme-linked immunoelectro-
transfer blot assay. Arch. Virol. 2000, 145, 473-489.
6.Clavijo A., Wright P., Kitching P.: Development in diagnostic techniques for
differentiating infection from vaccination in foot-and-mouth disease. Vet. J.
2004, 167, 9-22.
7.Clercq K. De, Brocchi E., Grazioli S., Bergmann I., Paton D., Dekker A.,
Yadin H., Haas B., Sorensen K., Bulut N., Sammin D., Malirat V., Neitzert E.,
Parida S., Goris N., Tjornehoj K., Giovanni A., De Simone F.: Report of
workshop on validation of NSP-ELISAs: a comparison of 6 assays. Report of
the session of the research group of the standing technical committee of the
European Commission for the control of foot-and-mouth disease, Chania,
(Crete), Greece 12-15 October 2004, s. 56-65.
8.Diego M. De, Brocchi E., Mackay D., De Simone F.: The non-structural po-
lyprotein 3ABC of foot-and-mouth disease virus as a diagnostic antigen in
ELISA to differentiate infected from vaccinated cattle. Arch. Virol. 1997,
142, 2021-2033.
9.Donaldson A.: Informal review of world Foot-and-mouth disease situation.
Report of the sixty-sixth Session of the Executive Committee of the European
Commission for the Control of Foot-and-Mouth Disease, Heelsum, the
Netherlands, 15-16 November 2001, s. 24-27.
10.Lubroth J., Brown F.: Identification of native foot-and-mouth disease virus
non-structural protein 2C as a serological indicator to differentiate infected
from vaccinated livestock. Res. Vet. Sci. 1995, 59, 70-78.
11.Mackay D. K. J., Forsyth M. A., Davies P. R., Berlinzani A., Belsham G. J.,
Flint M., Ryan M. D.: Differentiating infection from vaccination in foot-and-
-mouth disease using a panel of recombinant, non-structural proteins in ELI-
SA. Vaccine 1998, 16, 446-459.
12.Mackay D. K. J.: Differentiating infection from vaccination in foot-and-
-mouth disease. Vet. Q. 1998, 20, 20-24.
13.Moonen P., van der Linde E., Chenard G., Dekker A.: Comparable sensitivi-
ty and specificity in three commercially available ELISAs to differentiate
between cattle infected with or vaccinated against foot-and-mouth disease
virus. Vet. Mirobiol. 2004, 99, 93-101.
14.ODonnell V. K., Smitsaart E. N., Cetra B., Duffy S., Finelli J., Boyle D.,
Draghi G., Fondevila N., Schudel A. A.: Detection of virus infection-asso-
ciated antigen and 3D antibodies in cattle vaccinated against foot-and-
-mouth disease. Rev. Sci. Tech. Off. Epiz. 1997, 16, 833-840.
15.Paton D. J., Parida S., Anderson J.: Detection of FMD infection in vaccina-
ted animals. Report of the session of the research group of the standing tech-
nical committee of the European Commission for the control of foot-and-
-mouth disease, Gerzensee, Berne, Switzerland 16-19 September 2002,
s. 44-51.
16.Pluimers F. H.: Eradication of foot-and-mouth in the Netherlands by emer-
gency vaccination and the trade implications. Rep. conf. Foot-and-mouth
disease. Control strategies, Lyon, France 2-5 June 2002, s. 63.
17.Rodriquez A., Dopazo J., Saiz J. C., Sobrino F.: Immunogenicity of non-
structural proteins of foot-and-mouth disease virus: differences between in-
fected and vaccinated swine. Arch. Virol. 1994, 136, 123-131.
18.Salt J.: Vaccination against FMD, [w:] Pastoret P. P., Blancou J., Vannier P.,
Verschueren C.: Veterinary Vaccinology. Elsevier, Amsterdam 1997, 641-
-649.
19.Schen F., Chen P. D., Walfield A. M., Ye J., House J., Brown F., Wang C. Y.:
Differentiation of convalescent animals from those vaccinated against foot-
-and-mouth disease by a peptide ELISA. Vaccine 1999, 17, 3039-3049.
20.Silberstein E., Kaplan G., Taboga O., Duffy S., Palma E.: Foot-and-mouth
disese virus-infected but not vaccinated cattle develop antibodies against
recombinant 3AB1 nonstructural protein. Arch. Virol. 1997, 142, 795-805.
21.Sorensen K. J., Madsen G. K., Madsen E. S., Salt J. S., Nqindi J., Mac-
kay D. K. J.: Differentiation of infection from vaccination in foot-and-
-mouth disease by the detection of antibodies to the non-structural proteins
3D, 3AB and 3ABC in ELISA using antigens expressed in baculovirus. Arch.
Virol. 1998, 143, 1461-1476.
22.Strebel K., Beck E., Strohmaier K., Schaller H.: Characterization of foot-
-and-mouth disease virus gene products with antisera against bacterially syn-
thesized fusion proteins. J. Virol. 1986, 57, 983-991.
23.Tesar M., Berger H. G., Marquardt O.: Serological probes for some foot-
-and-mouth disease nonstructural proteins. Virus Genes 1989, 3, 29-44.
24.Valarcher J.-F., Knowles N., Fernandez R., Davies P., Midgley R., Hutchings G.,
Newman B., Ferris N., Paton D.: Global FMD situation 2003-2004. Report
of the session of the research group of the standing technical committee of
the European Commission for the control of foot-and-mouth disease, Chania
(Crete), Greece 12-15 October 2004, s. 137-148.
Adres autora: doc. dr hab. Wies³aw Niedbalski, ul. Zielona 48/4, 98-220
Zduñska Wola; e-mail: wies³aw@piwzp.invar.net.pl
Wyszukiwarka
Podobne podstrony:
Zwierzęta cenniejsze od ludzi
Epizootiologia konie, Chów i Hodowla, Choroby zwierząt i szczepienia
Żywienie zakażonego wirusem HIV, Dietetyka
Epizootiologia owce i kozy, Chów i Hodowla, Choroby zwierząt i szczepienia
Epizootiologia Âwinie, Chów i Hodowla, Choroby zwierząt i szczepienia
Zwierzęta cenniejsze od ludzi
Opieka medyczna nad osobami zakażonymi wirusem HIV
charakterystyka szczepów candida izolowanych od zwierząt
ćw.4 - interna od dr Radwińskiej, weterynaria, Choroby wewnętrzne zwierząt gospodarskich
fizjo zwierząt krwionośny nerwowy pytania od marioli
Zwierzaki od A do Ż (F)
Egzamin z przedmiotu Choroby Zwierzat Gospodarskich, Studia, IV ROK, Bydło, Zakaźne, Egzamin z Zakaz
salceson czarny Szczepana, weterynaria, Higiena produktów pochodzenia zwierzęcego, Puszki różne, pus
Zwierzaki od A do Ż (B)
Egzamin końcowy-, GINEKOLOGIA pytania od profesora, Do badań serologicznych (grupa krwi próba zgodno
więcej podobnych podstron