1
BUDOWA I PROMIENIOWANIE
ATOMÓW
2
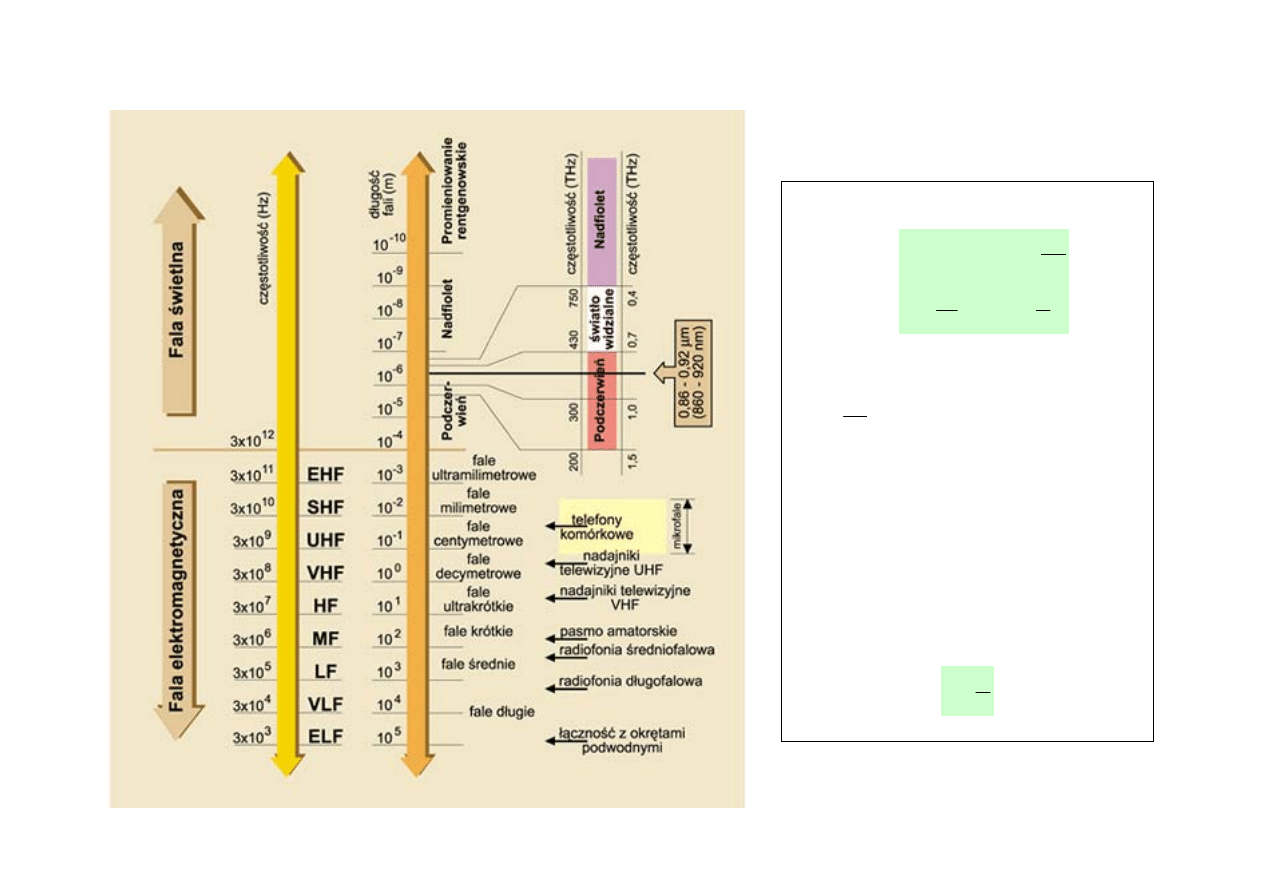
FALE ELEKTROMAGNEYCZNE – WIDMO FAL ELEKTROMAGNETYCZNYCH
Teoria korpuskularna
foton
λ
λ
ν
ν
1
~
,
,
E
hc
E
c
h
p
h
E
=
=
=
stała Plancka h = 6,6·10
-34
J·s
1J =
eV
19
10
6
,
1
1 ⋅
Prędkość fal świetlnych w próżni
c = 3·10
8
m/s.
Związek między częstotliwością
i długością fali elektromagnetycznej
λ
ν
c
=

3
Zakres długości fali
Nazwa
Energia
0,38 < λ < 0,77 µm (1 µm = 10
-6
m)
światło widzialne (fale świetlne)
3800 Å
< λ <
7700 Å
(1 Å = 10
-10
m)
od
fioletu
do
czerwieni
λ > (7700 Å) 770 nm
podczerwień
λ < 380 nm (1 nm = 10
-9
m)
nadfiolet (ultrafiolet)
λ < 380 nm
130 < λ < 380 nm
nadfiolet bliższy
~ eV
10 < λ <130 nm
nadfiolet dalszy
~ eV
0,01 < λ < 10 nm
fale rentgenowskie
~ 10
3
eV (keV)
10
-4
< λ < 0,01 nm
promienie γ
~ MeV
λ< 10
-4
nm
składowa γ promieniowania kosmicznego
> MeV
λ > 770 nm
770 < λ < 3000 nm
podczerwień bliższa
< eV
3 < λ < 100 µm
podczerwień dalsza
< eV
10
-3
< λ < 1 m
mikrofale(~cm), radarowe
λ > 10
-2
m
fale radiowe i telewizyjne
może być λ ~ 10
3
km (ν ~ 10
2
Hz)
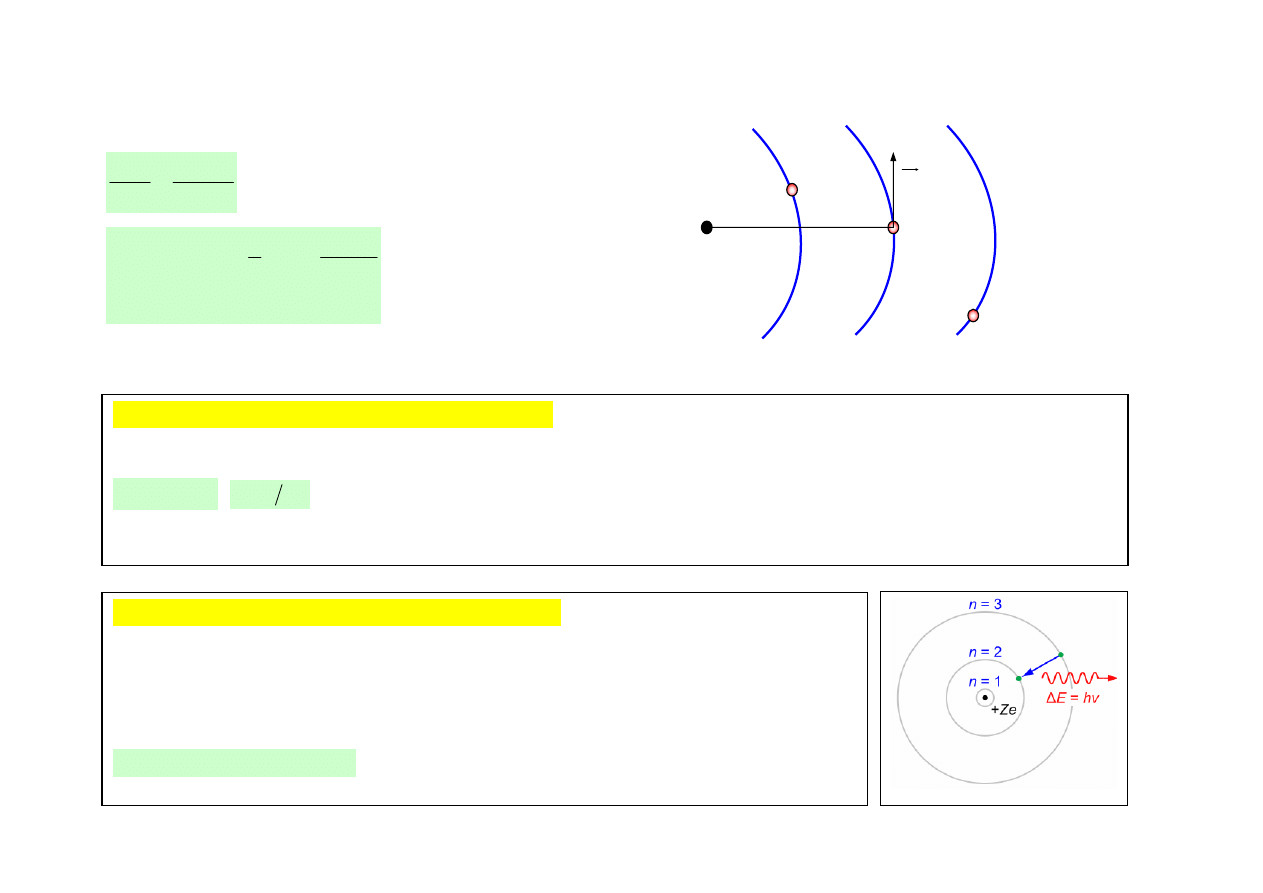
4
ŹRÓDŁO FAL ŚWIETLNYCH – WZBUDZONE ATOMY - ŹRÓDŁO PROMIENIOWANIA ŚWIETLNEGO
Promieniowanie atomów według modelu Bohra
2
0
2
2
2
4
n
n
n
r
Ze
r
m
πε
υ
=
k
c
k
pot
n
n
pot
k
n
E
E
E
E
r
Ze
m
E
E
E
−
=
−
=
−
=
+
=
,
2
4
2
1
0
2
2
πε
υ
n = 1, 2, 3, ... główna liczba kwantowa
+Ze
e
e
e
r
n
n
υ
I postulat kwantowy (stan stacjonarny atomu)
W atomie istnieją takie orbity, po których poruszające się elektrony nie promieniują energii.
h
n
r
m
n
n
=
υ
,
π
2
h
=
h
n = 1, 2, 3, ... główna liczba kwantowa
II postulat kwantowy (stan stacjonarny atomu)
Każda emisja lub też absorpcja energii promieniowania odpowiada przejściu elektronu
pomiędzy dwoma orbitami stacjonarnymi. Promieniowanie emitowane w czasie takiego
przejścia jest określone wzorem:
nm
nm
m
n
nm
h
E
E
E
ω
ν
h
=
=
−
=

5
Atomy wodoropodobne (1 elektron w atomie)
Rozmiar atomu wodoru w stanie podstawowym:
m
r
Z
n
r
r
n
10
1
1
10
53
,
0
,
−
⋅
=
=
Prędkość:
c
c
n
Z
c
n
Z
n
⋅
=
⋅
=
⋅
=
⋅
⋅
=
137
1
,
1
1
α
υ
υ
α
υ
, c – prędkość światła w próżni
Stała struktury subtelnej:
137
1
=
α
Skwantowane stany energii atomu:
(
)
2
1
2
2
2
0
2
2
1
1
2
1
n
E
Z
n
c
m
Z
E
n
=
−
=
α
Energia stanu podstawowego atomu wodoru:
(
)
eV
c
m
E
6
,
13
2
1
2
0
2
1
−
=
−
=
α
(
)
wodoru
atom
Z
n
1
,
1
=
=
Energia spoczynkowa elektronu swobodnego:
MeV
c
m
511
,
0
2
0
=
Widmo wodoru
−
=
=
2
2
1
2
1
1
1
m
n
hc
E
Z
hc
h
λ
λ
ν
takie „długości fal” promieniują atomy
Stała Rydberga:
1
1
807
,
109736
−
∞
=
=
cm
R
hc
E
M
stała Rydberga dla skończonej masy jądra:
1
580
,
109677
1
−
∞
=
+
=
cm
m
m
R
R
p
e
M
M
=
1836
1
p
e
m
m
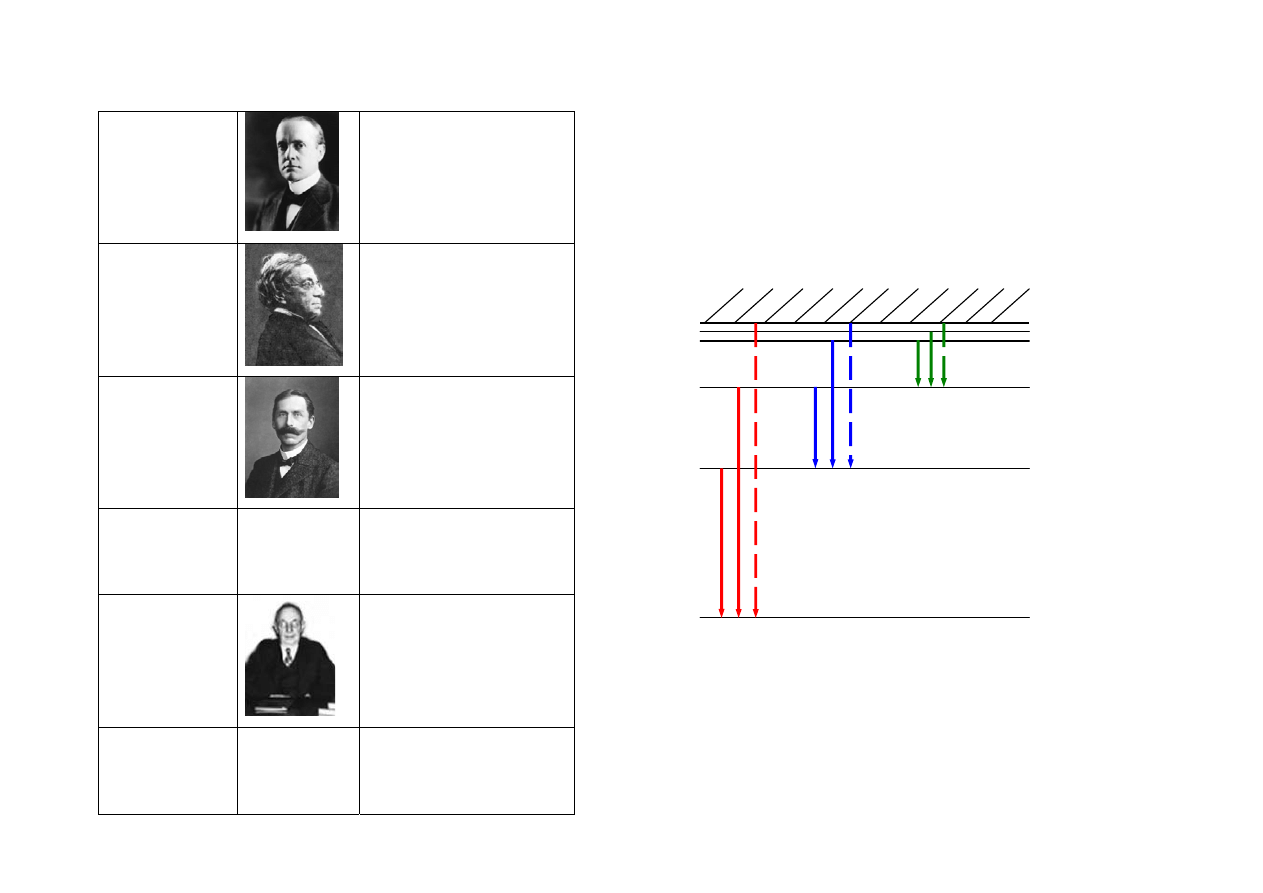
6
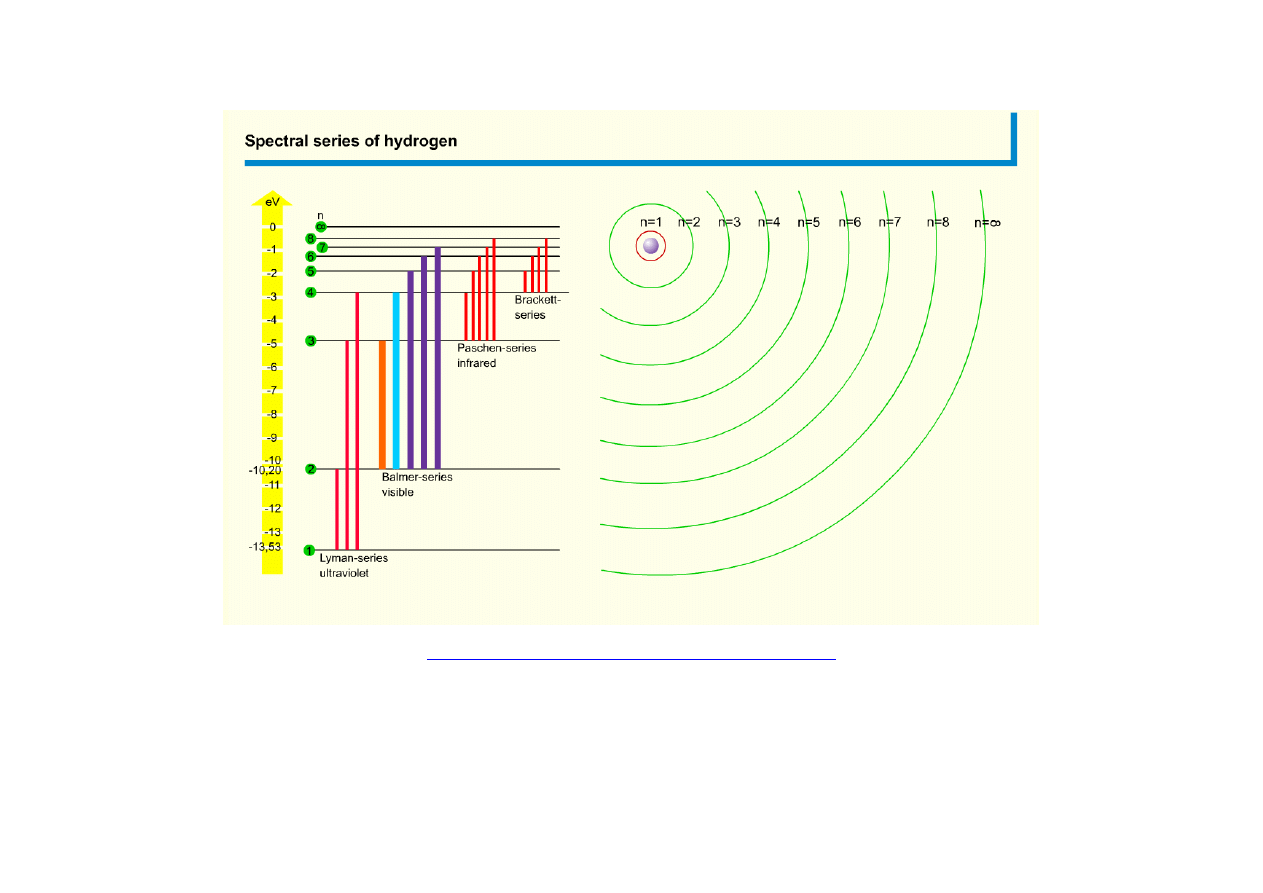
Serie widmowe
Lymanna
n=1
Theodore Lyman
(1874 - 1954)
Balmera
n=2
Johann J. Balmer
(1825 –1898)
Rok odkrycia: 1885
Paschena
n=3
Louis K.H.F. Paschen
(1865 -1947)
Rok odkrycia: 1908
Bracketta
n=4
Frederick S. Brackett
(1896 – 1988)
Rok odkrycia: 1922
Pfunda
n=5
August H. Pfund
(1879–1949)
Rok odkrycia: 1924
Humphreysa
n=6
Curtis J. Humphreys
(1898- 1986)
Rok odkrycia: 1953
Elektron swobodny
E > 0
n
∞
3
2
1
E
0
s. Paschena
s. Balmera
(widzialne linie serii)
s. Lymanna
-13,6 eV
Dozwolone przejścia elektronu
7
Animacja serii widmowych w atomie wodoru
http://www.bigs.de/en/shop/anim/termsch01.swf
8
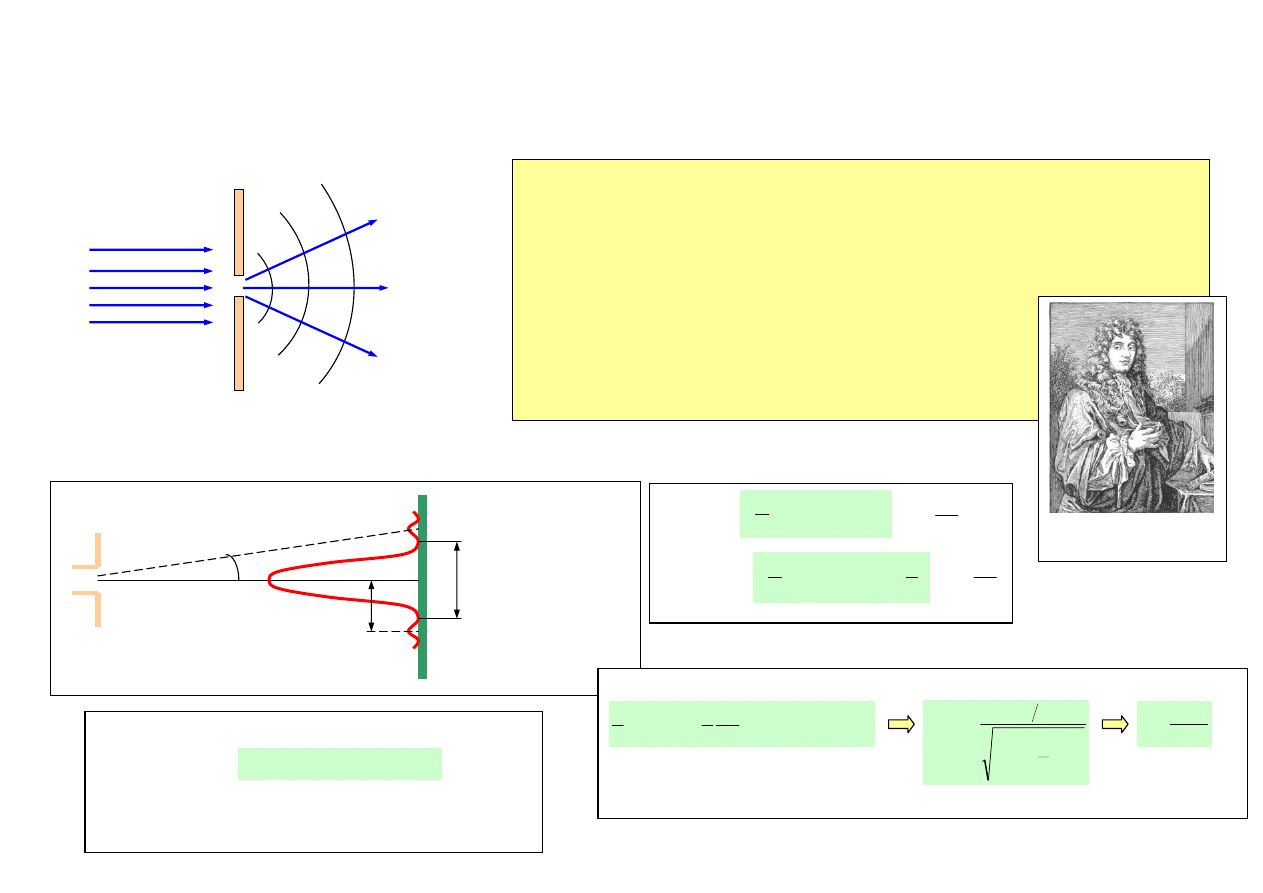
ISTOTA DYFRAKCJI (UGIĘCIA)
Dyfrakcja – zespół zjawisk, które występują, gdy fale rozchodzą się w obecności przeszkód.
Dyfrakcja na pojedynczej szczelinie
Obraz ugiętego światła = obraz po przejściu światła przez siatkę dyfrakcyjną
L
Zasada Huygensa
każdy punkt ośrodka, do którego dotarło czoło fali w chwili
wcześniejszej, jest źródłem wtórnej fali kulistej o tej samej częstości,
co fala(padająca) pierwotna.
λ – długość fali padającej, L – rozmiar otworu
Gdy λ ≈ L, na otworze występuje dyfrakcja.
Christiaan Huygens
(1629-1695)
minima
n
L
k
mw
⋅
±
=
π
α
sin
2
,
λ
π
2
≡
k
maksima
+
±
=
2
1
sin
2
n
L
k
n
π
α
,
λ
π
2
≡
k
L
x >> L
α
α
α
k=1
k=1
α
ekran
Prążek centralny
0
D
Wyznaczenie szerokości szczeliny z obserwacji obrazu ugiętego
1
,
sin
2
2
1
sin
2
1
=
=
=
n
L
kL
π
α
λ
π
α
2
2
2
1
2
sin
+
=
D
x
D
α
α
λ
sin
=
L
(np. L ~ mikronów można wyznaczyć)
- Dyfrakcja elektronów (fali de Broglie’a elektronów)
rozmiar atomu:
(
)
m
eV
E
e
10
3
10
10
~
−
≈
λ
obserwacja struktur krystalicznych
- Dyfrakcja promieni X (E~keV)
9
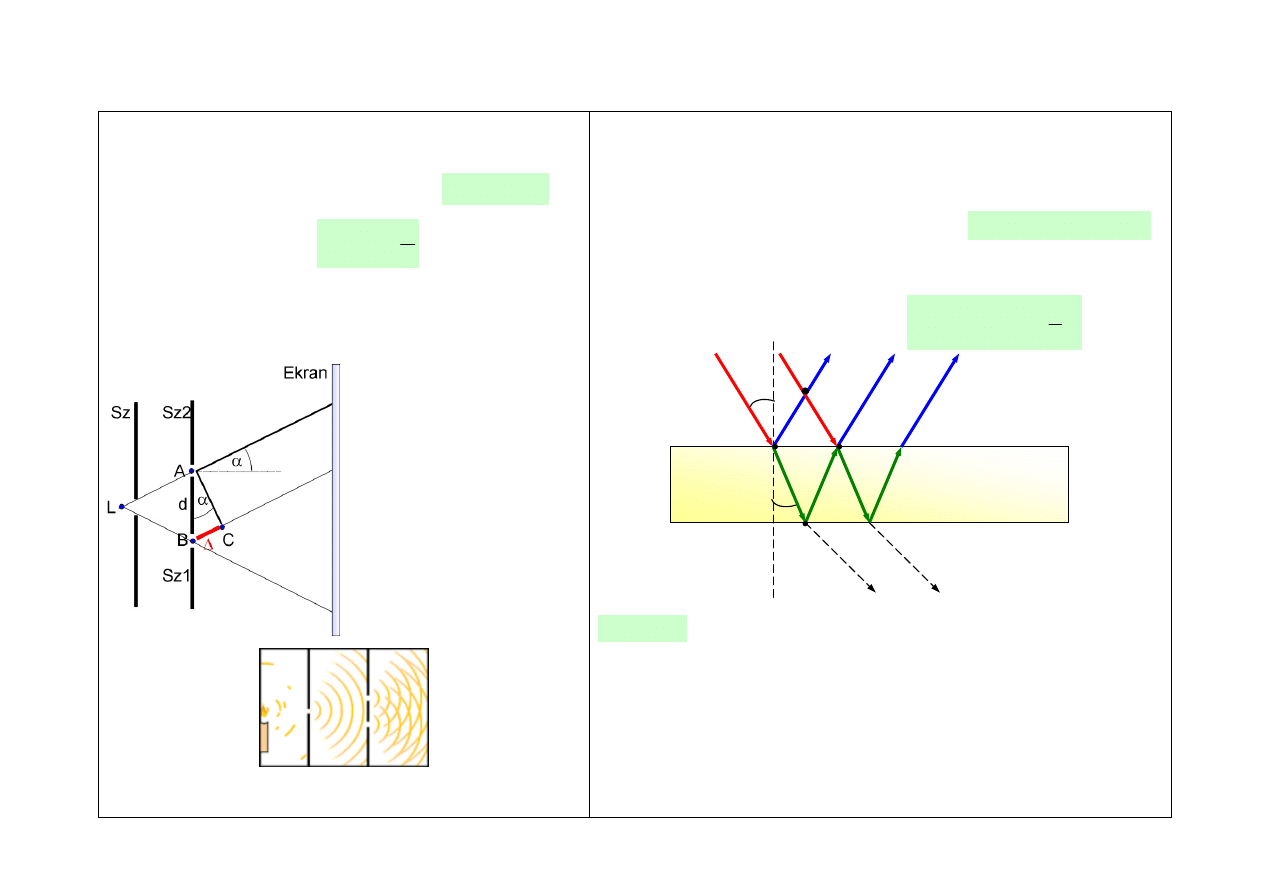
INTERFERENCJA FAL ŚWIETLNYCH
Doświadczenie Younga
różnica dróg optycznych promieni
k
d
α
sin
=
∆
położenie maksimów
d
k
k
λ
α
=
sin
d – odległość szczelin
k – rząd prążka interferencyjnego
Ilustracja doświadczenia Younga
Odbicie światła od cienkich płytek
(prążki jednakowej grubości)
różnica dróg interferujących promieni
(
)
LM
n
CD
LC
−
+
=
∆
n – współczynnik załamania
różnica dróg promieni odbitych
λ
β
2
1
cos
2
+
=
∆
hn
( )
λ
,
n
∆
=
∆
- obraz barwny, gdy mamy źródło światła
białego (kolorowe smugi na powierzchni, np. plama
oliwy)
może wystąpić interferencja promieni przechodzących
L – źródło światła
S
Z
– szczeliny
(siatka interferencyjna
– zasada działania)
h
α
β
C
L
D
M
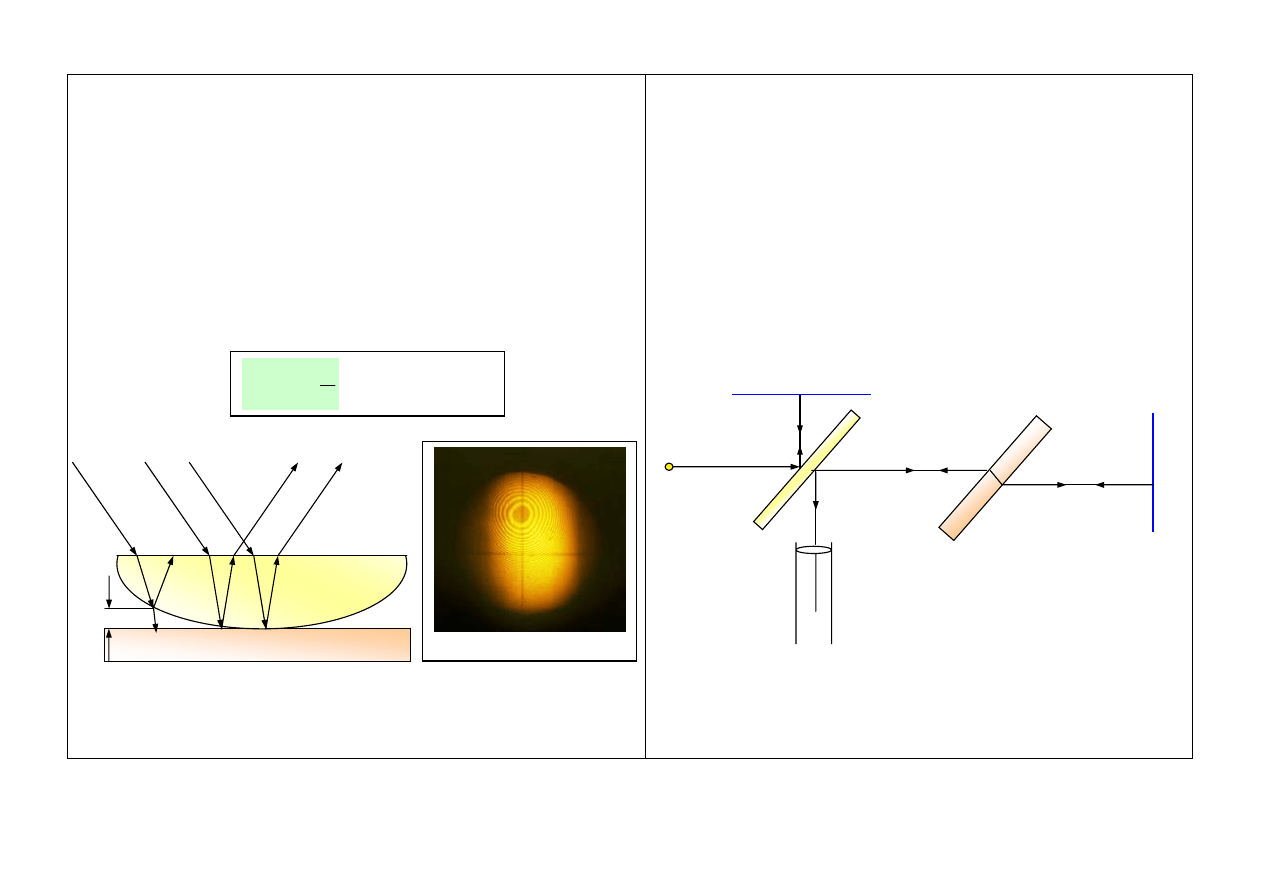
10
Pierścienie Newtona
Prążki są wynikiem interferencji promieni odbitych od
tylnej powierzchni soczewki z odbitych od przedniej
powierzchni płytki płasko – równoległej.
Dla światła
białego powstają wielobarwne prążki dla
monochromatycznego jasne i ciemne prążki.
Interferometr Michelsona
D
1
, D
2
– płytki płasko – równoległe
Z
1
, Z
2
– zwierciadła
L – źródło światła
Pierwszy bardzo dokładny
pomiar prędkości światła (c = const)
h
Układ do obserwacji
Z
1
D
D
L
Z
2
Luneta
Pierścienie Newtona
2
2
λ
+
=
∆
h
h – zmienne
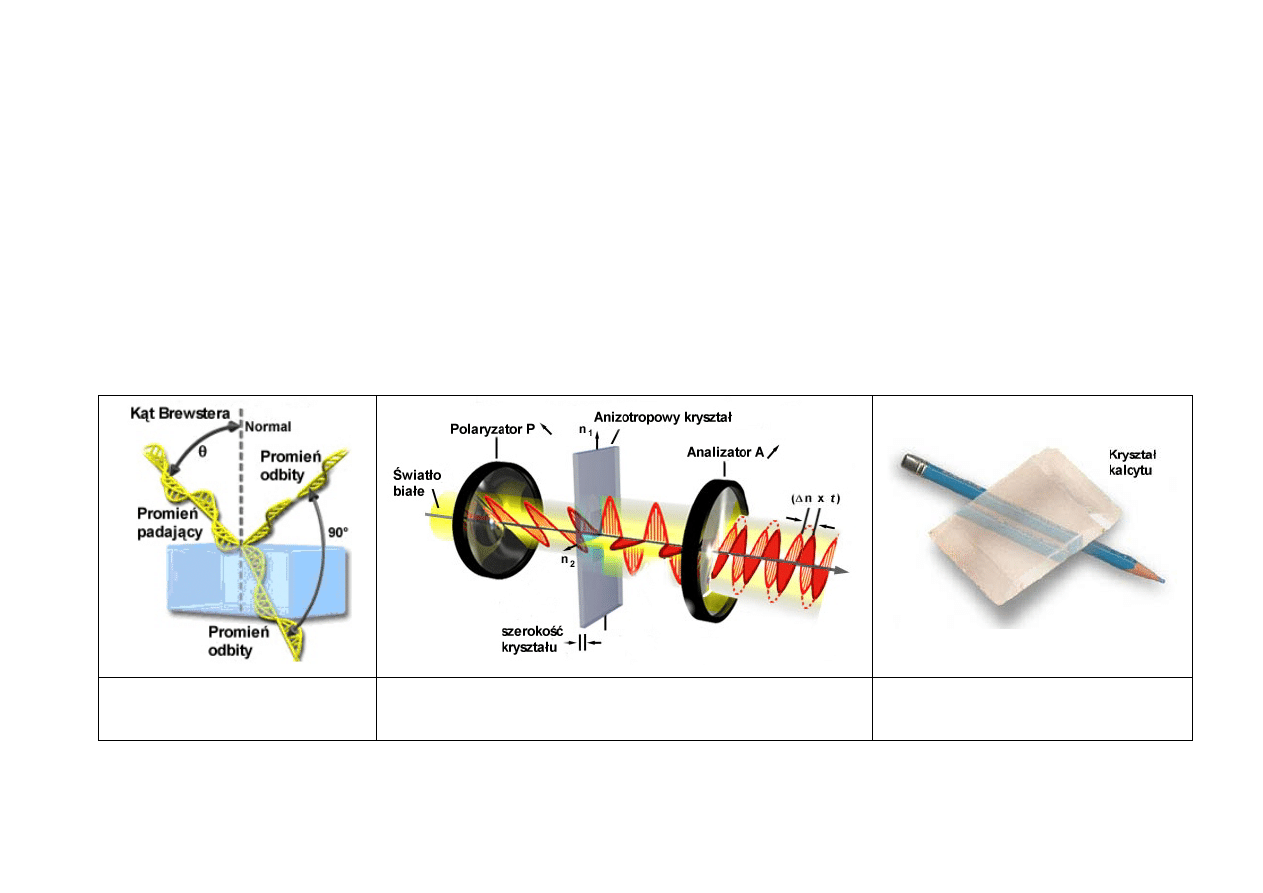
11
POLARYZACJA ŚWIATŁA
• podwójne załamanie światła w kryształach i polaryzacja światła przy podwójnym załamaniu
• zasada działania Nikola; polaryzatory i analizatory
• prawo Malusa
• polaryzacja przez odbicie, kąt Brewstera
• polaryzacja przez załamanie
Polaryzacja przez odbicie,
kąt Brewstera
Zasada działania Nikola;
polaryzatory i analizatory
Dwójłomność kryształów
Wyszukiwarka
Podobne podstrony:
BUDOWA JĄDRA ATOMOWEGO, PROMIENIOTWÓRCZOŚĆ xp
PROMIENIOWANIE ATOMÓW WZBUDZONYCH
Budowa jądra atomowego(1)
39 Budowa jądra atomowego Energia jądrowa Reakcje jądrowe Reaktory jądrowe 2
Budowa jadra atomowego, sily ja Nieznany (2)
39 Budowa jądra atomowego Energia jądrowa Reakcje jądrowe Reaktory jądrowe
SPRAWDZIAN BUDOWA JĄDRA ATOMOWEGO, Publikacje
BUDOWA JĄDRA ATOMOWEGO
Budowa jądra atomowego
promień atomowy
Budowa jadra atomowego, siły jadrowe, defekt masy
7 BUDOWA ATOMU I PROMIENIOTW ôRCZO Ü ć zadania maturalne
4 6 budowa atomu,promieniotwórczosc izotopy
chemia, BUDOWA ATOMÓW, WIĄZANIA
więcej podobnych podstron