
CHEMICZNE I ENZYMATYCZNE REAKCJE
LIPIDÓW – JAKO PRZYKŁAD
MOŻLIWOŚCI MODYFIKACJI ICH
WŁAŚCIWOŚCI
dr inż. Joanna Bryś
mgr inż. Magdalena Wirkowska
Katedra Chemii,
Wydział Nauk o Żywności
SGGW

PRZEMIANY TŁUSZCZÓW
POŻĄDANE:
modyfikacje tłuszczów np.:
- przeestryfikowanie
- uwodornienie
NIEPOŻĄDANE:
- autooksydacja
- hydroliza
- polimeryzacja
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
2
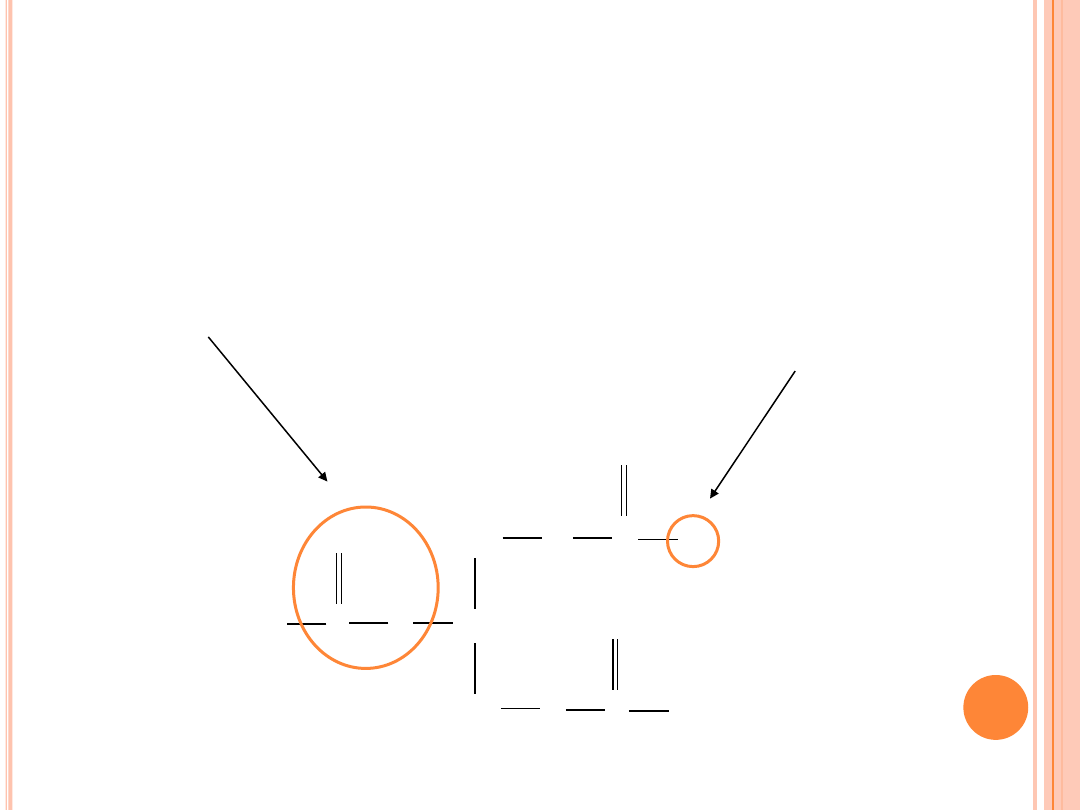
PRZEMIANY TŁUSZCZÓW
związane z grupą
karbonylową (estrową)
związane z łańcuchem
węglowodorowym kwasów
tłuszczowych
CH
2
O
C
O
R
1
R
2
R
3
O
O
O
O
CH
2
CH
C
C
sn -1
sn -2
sn -3
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
3
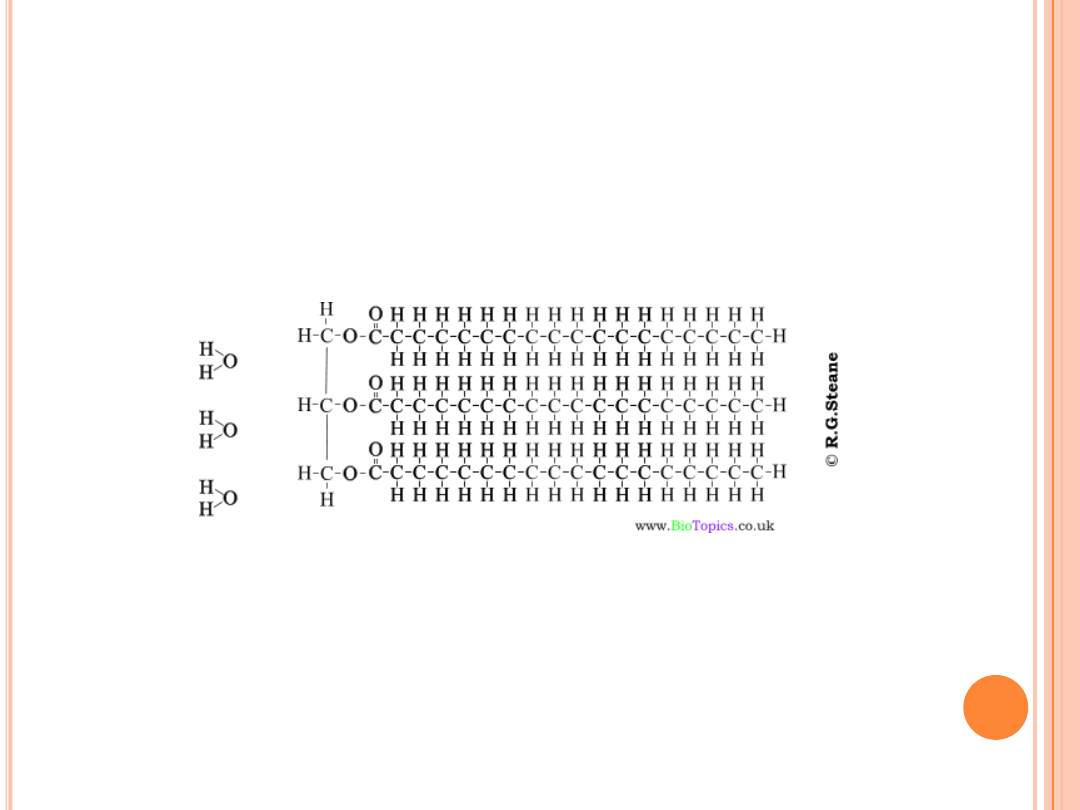
HYDROLIZA TŁUSZCZÓW
Hydroliza
tłuszczów związana jest z rozpadem wiązań estrowych
w cząsteczkach triacylogliceroli pod wpływem
wody
Wysoka temperatura i ciśnienie przyśpieszają hydrolizę. Reakcję
hydrolizy katalizują kationy wodorowe (kwasy).
Hydroliza znajduje zastosowanie w produkcji gliceryny oraz
kwasów tłuszczowych. Kwasy tłuszczowe wykorzystuje się do celów
technicznych oraz do produkcji środków myjących i piorących.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
4

HYDROLIZA ENZYMATYCZNA - LIPOLIZA
Hydrolizę enzymatyczną wykorzystuje się m.in. w badaniu struktury
triacylogliceroli.
W celu określenia struktury triacylogliceroli stosowane są najczęściej metody
wykorzystujące
regio- i sterospecyficzność
enzymów – lipaz do selektywnego
odszczepiania reszt acylowych z określonych pozycji triacylogliceroli.
Pierwsze z nich pozwalają na oznaczenie składu kwasów tłuszczowych w pozycji
sn
2 triacylogliceroli i sumy kwasów tłuszczowych
w pozycjach zewnętrznych: sn
1 i sn
3. W metodach tych wykorzystuje się
zdolność
lipazy trzustkowej
ssaków
do deacylacji triacylogliceroli w pozycjach
zewnętrznych (sn
1 i 3). Z tego względu, iż lipaza trzustkowa nie rozróżnia
pozycji zewnętrznych przyjmuje się, że są one równocenne.
W metodach wykorzystujących enzymy stereospecyficzne istnieje możliwość
oznaczenie składu kwasów tłuszczowych w każdej z trzech pozycji
triacylogliceroli oddzielnie.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
5

STRUKTURA TRIACYLOGLICEROLI
- ma znaczenie żywieniowe (lipaza trzustkowa odczepia kwasy
tłuszczowe tylko w pozycjach zewnętrznych cząsteczek
triacylogliceroli, natomiast sn
2 monoacyloglicerole wchłaniane
są do organizmu człowieka w stanie niezmienionym);
- wpływa na właściwości fizyczne tłuszczów między innymi na
temperaturę mięknięcia, zawartość fazy stałej, strukturę
krystaliczną oraz szybkość ich utlenienia i polimeryzacji;
- ważna jest przy programowaniu strukturyzowanych lipidów
o z góry założonych właściwościach fizycznych, reologicznych
czy żywieniowych
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
6

HYDROLIZA ALKALICZNA - ZMYDLANIE
CH
CH
2
CH
2
CHOH
CH
2
OH
CH
2
OH
+ 3 NaOH
3 CH
3
(CH
2
)
14
CO
2
Na
+
C(CH
2
)
14
CH
3
O
O
C(CH
2
)
14
CH
3
O
C(CH
2
)
14
CH
3
O
O
O
(lub 3 KOH)
Hydroliza alkaliczna prowadzi do powstania soli
odpowiedniego kwasu oraz alkoholu. Produktami
zmydlania tłuszczów są mydła i gliceryna.
Mydła to sole sodowe lub potasowe wyższych
kwasów tłuszczowych głównie kwasów
palmitynowego, stearynowego i oleinowego.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
7

HYDROLIZA TRIACYLOGLICEROLI –
PROCES NIEPOŻĄDANY
Podczas
składowania
surowców
tłuszczowych
oraz
wydobywania tłuszczów może zachodzić, zwłaszcza pod
wpływem enzymów, częściowa hydroliza triacylogliceroli z
uwolnieniem
kwasów
tłuszczowych
i
wytworzeniem
niepełnych acylogliceroli (
jełczenie hydrolityczne
).
Te
niepożądane przemiany, poza koniecznością stosowania
procesów rafinacyjnych, prowadzą do strat substancji
tłuszczowej. Jełczenie jest szczególnie uciążliwe sensorycznie
w artykułach i przetworach mlecznych. Krótkołańcuchowe
kwasy tłuszczowe (zwłaszcza masłowy) są przyczyną
powstawania nieprzyjemnego zapachu i smaku. Niekiedy
uwalnianie
tych
kwasów jest sensorycznie pożądane
(dojrzewanie serów). Długołańcuchowe kwasy tłuszczowe dają
z kolei posmak „mydlany”.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
8

JEŁCZENIE HYDROLITYCZNE
W technologii tłuszczów przewidziano specjalne etapy rafinacyjne
w celu usunięcia „wolnych” kwasów tłuszczowych. Najczęściej
stosuje się odkwaszanie alkaliczne.
Powstające mydła, w postaci tzw. soapstocków, oddziela się od
tłuszczu. Zawartość wolnych kwasów tłuszczowych w tłuszczach,
będąca często miarą ich świeżości i jakości, określa się za pomocą
liczby kwasowej metoda miareczkową
RCOOH + NaOH
RCOONa + H
2
O
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
9

UZYSKIWANIE NOWYCH ESTRÓW
Estry uzyskuje się w reakcjach:
- grupy karbonylowej albo pochodnej acylowej z alkoholem
(
estryfikacja
);
- estru z alkoholem (
alkoholiza
);
- estru z kwasem (
acydoliza
);
- estru z innym estrem (
interestryfikacja, przeestryfikowanie
właściwe
).
Każdy z tych procesów przebiega w obecności katalizatorów,
zazwyczaj kwasowych lub alkalicznych.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
10
ESTRYFIKACJA
Estryfikacja w technologii tłuszczów
jadalnych rzadko jest wykorzystywana.
Często
natomiast
jest
stosowana
w analizie lipidów w celu uzyskania
estrów metylowych kwasów tłuszczowych
(do celów chromatograficznych).
Otrzymuje się je z kwasów tłuszczowych
i metanolu zawierającego katalizator np.
H
2
SO
4
, HCl, BF
3
albo w reakcji
z diazometanem.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
11
Alkoholiza bardzo często jest stosowana do przekształcania
acylogliceroli w estry metylowe (
metanoliza
), bez konieczności
wstępnego izolowania wolnych kwasów oraz w technologii
uzyskiwania
niepełnych
acylogliceroli
(otrzymywanie
emulgatora) w reakcji triacylogliceroli z wolnym glicerolem
(
gliceroliza
).
ALKOHOLIZA
R
1
COOR
2
+ CH
3
OH
R
1
COOCH
3
+ R
2
OH
kat.
CHOCOR
2
CH
2
OCOR
3
CH
2
OCOR
1
CHOH
CH
2
OH
CH
2
OH
+
+
CHOH
CH
2
OCOR
3
CH
2
OH
CHOCOR
2
CH
2
OH
CH
2
OCOR
1
kat.
metanoliza
gliceroliza
katalizator: H
2
SO
4
, HCl, BF
3
lub NaOH, CH
3
ONa
katalizator: NaOH, CH
3
ONa
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
12

Acydoliza obejmuje wzajemne oddziaływanie estrów z kwasem
karboksylowym w obecności katalizatora (H
2
SO
4
, ZnO, CaO).
Reakcja acydolizy jest wykorzystywana do wymiany kwasów
tłuszczowych w cząsteczkach triacylogliceroli przy produkcji
lipidów strukturyzowanych. Może być wykorzystywana np. do
zastąpienia kwasów C 16:0 i C 18:0 kwasem C 12:0 .
ACYDOLIZA
R
1
COOR
2
+ R
3
COOH
R
1
COOH + R
3
COOR
2
kat.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
13

Interestryfikacja - reakcja wymiany acyli miedzy estrami,
głównie między triacyloglicerolami.
Reakcja ta ma największe znaczenie technologiczne. Za pomocą
tej reakcji można dokonać zmiany sposobu rozkładu kwasów
tłuszczowych w triacyloglicerolach jednego lub kilku
składników tłuszczowych, uzyskując
tłuszcze zmodyfikowane o
pożądanym zakresie temperatury topnienia i właściwościach
krystalizacyjnych, plastyczności i konsystencji
.
Proces ten zmienia strukturę i skład triacylogliceroli, natomiast
nie zmienia naturalnej budowy występujących w nich kwasów
tłuszczowych, co powoduje, że cenne biologicznie aktywne
kwasy tłuszczowe pozostają nienaruszone. W procesie tym nie
powstają nienasycone kwasy tłuszczowe o konfiguracji trans.
INTERESTRYFIKACJA
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
14
Ponieważ triacyloglicerole mają trzy grupy estrowe w cząsteczce,
istnieje wiele możliwości wymiany.
Wymiana grup acylowych pomiędzy estrami może zachodzić:
-wewnątrz cząsteczek acylogliceroli tzw.
przeestryfikowanie
intramolekularne, wewnątrzcząsteczkowe
INTERESTRYFIKACJA
P
S
O
S
O
P
- pomiędzy cząsteczkami acylogliceroli tzw.
przeestryfikowanie
intermolekularne, międzycząsteczkowe
P
P
P
O
O
P
O
O
O
P
P
O
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
15

W zależności od temperatury reakcji proces może zachodzić
jako niekierowany lub kierowany.
- Przeestryfikowanie
niekierowane
(jednofazowe, statystyczne)
wykonywane jest w temperaturze wyższej od temperatury
topnienia najwyżej topniejącego składnika w mieszaninie
triacylogliceroli;
- Przeestryfikowanie
kierowane
(wielofazowe, heterogeniczne)
prowadzone jest w temperaturze niższej od temperatury
topnienia najwyżej topliwego składnika.
INTERESTRYFIKACJA
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
16

Proces przeestryfikowania to reakcja katalityczna.
Jako katalizatory stosowane są m.in.:
katalizatory chemiczne
:
• metale alkaliczne (sód, potas, ciekły stop sodu i potasu);
• wodorotlenek sodu;
• alkoholany (CH
3
ONa, C
2
H
5
ONa i glicerynian sodu);
katalizatory biologiczne
Biokatalizatory reakcji enzymatycznego przeestryfikowania, zwane
lipazami
, zaliczane są według Międzynarodowej Unii Biochemicznej
do hydrolaz estrów glicerolowych.
Enzymy lipolityczne otrzymywane są z grzybów, bakterii oraz
tkanek zwierzęcych i roślinnych. Głównym źródłem pozyskiwania
lipaz są grzyby strzępkowe oraz drożdże.
INTERESTRYFIKACJA
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
17

W zależności od specyficzności lipaz rozróżnia się:
• lipazy
niespecyficzne (randomizujące)
, które katalizują rozpad
wiązań estrowych we wszystkich trzech pozycjach cząsteczek
triacylogliceroli;
• lipazy
regiospecyficzne
, zdolne są do rozróżniania w cząsteczkach
triacylogliceroli pozycji zewnętrznych od pozycji wewnętrznych;
• lipazy
stereospecyficzne
, rozróżniają wiązania estrowe w
pozycjach sn
1 i sn
3 cząsteczek triacylogliceroli;
• lipazy
substratowo specyficzne
, czyli lipazy specyficzne w
stosunku do długości łańcucha kwasowego lub stopnia jego
nienasycenia (lipazy specyficzne w stosunku do struktury kwasów
tłuszczowych).
INTERESTRYFIKACJA
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
18

Zastosowanie procesu przeestryfikowania:
• otrzymywanie margaryny bez izomerów
trans (tzw. „zero trans”);
INTERESTRYFIKACJA
• otrzymywanie tanich substytutów
tłuszczów cukierniczych, piekarniczych
i kuchennych
np.: produkcja ekwiwalentów masła
kakaowego;
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
19

Zastosowanie procesu przeestryfikowania c.d.:
• otrzymywanie produktów tłuszczowych o
lepszych właściwościach żywieniowych
i dietetycznych np.: odżywki dla niemowląt,
sportowców, preparaty dla osób mających
zaburzenia w wydzielaniu żółci i w pracy
trzustki
INTERESTRYFIKACJA
• otrzymywania koncentratów kwasów
tłuszczowych szeregu n-3
• otrzymywania emulgatorów
żywnościowych
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
20

Uwodornienie polega na wysycaniu wodorem podwójnych wiązań
występujących w cząsteczkach kwasów tłuszczowych surowca.
Uwodornienie jest reakcją katalityczną, którą można przyspieszać
przez niektóre heterogeniczne lub homogeniczne katalizatory,
zawierające takie metale, jak
Pt, Pd, Ni, Cu i Co
.
Z tych metali tylko
nikiel
ma znaczenie przemysłowe.
UWODORNIENIE
Uwodornienie w praktyce przebiega w układzie niejednorodnym,
składającym się z trzech faz:
stałej (katalizator), ciekłej (olej) i
gazowej (wodór).
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
21
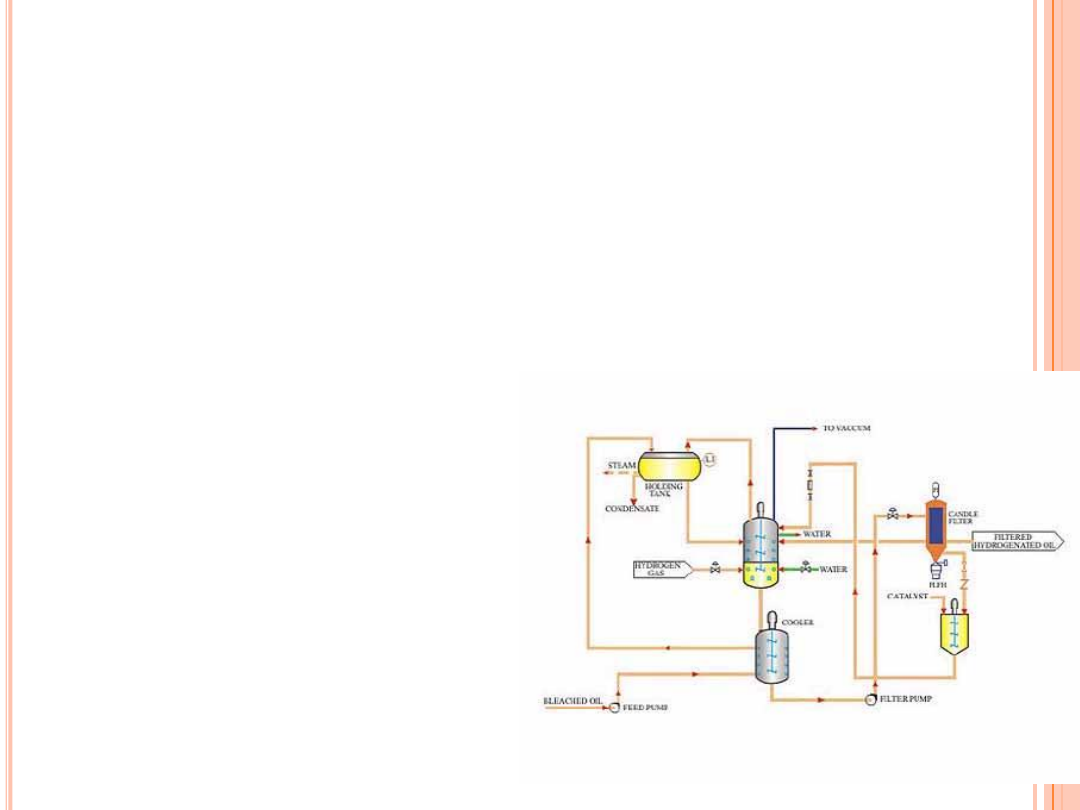
UWODORNIENIE
W praktyce przemysłowej proces uwodornienia prowadzi się
w autoklawie (10-20 t), wyposażonym w mieszadło oraz w system
grzejny i chłodzący. Stosuje się różne ciśnienia (10
5
– 6*10
5
N/m
2
)
oraz temperatury reakcji (120-220°C).
W przypadku katalizatora
niklowego stężenie metalu w oleju
(zawiesina) wynosi ok. 0,05%.
Ponieważ ten proces opiera się na
mechanizmie reakcji odwracalnej
(uwodornienie-odwodornienie),
czynnikiem determinującym jego
przebieg jest stężenie wodoru na
powierzchni katalizatora.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
22

UWODORNIENIE
W celach spożywczych prowadzi się tylko częściowe
uwodornienie olejów. Dlatego ważnymi cechami tak
prowadzonego procesu są
selektywność i izomeryzacja
.
Selektywność jest związana z różnymi szybkościami reakcji
uwodornienia nienasyconych kwasów tłuszczowych o różnym
stopniu nienasycenia (np. trienów, dienów, monoenów).
Izomeryzacja wynika z tego, że podwójne wiązania pozostawione
w częściowo uwodornionym tłuszczu mogą mieć zmienioną
pozycję
lub
konfigurację
(cis-trans).
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
23
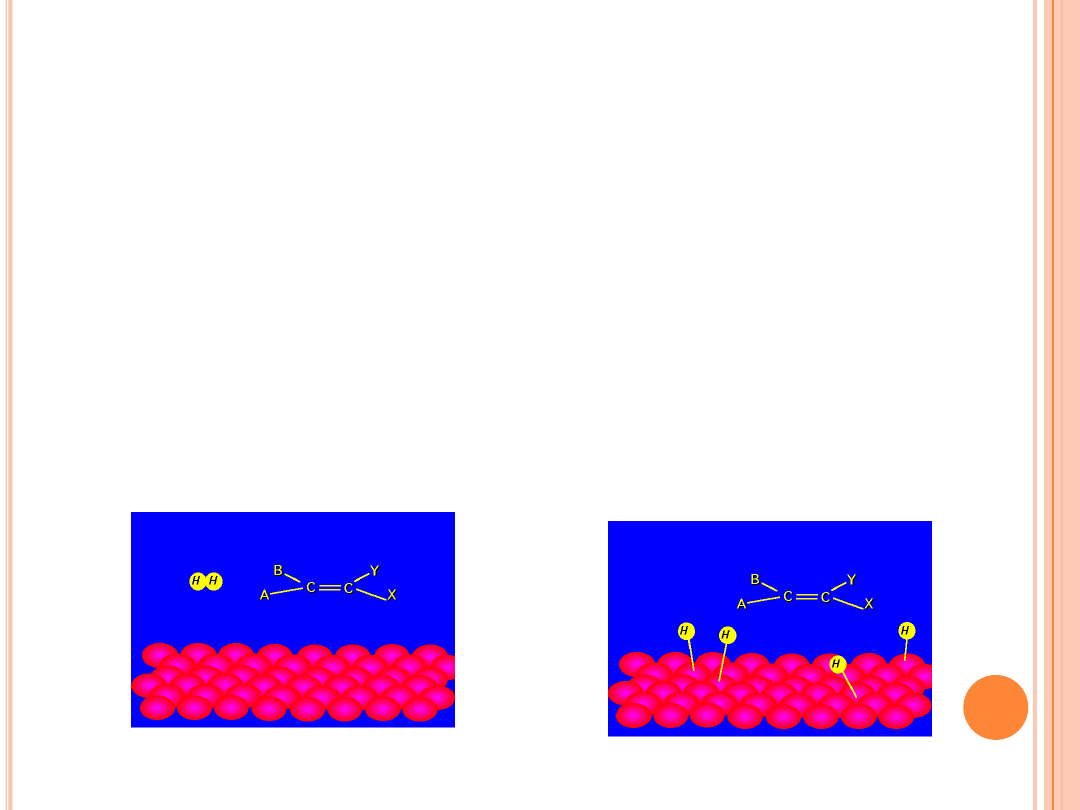
UWODORNIENIE
Na powierzchni katalizatora, na aktywnych centrach (
*
) zachodzi w
wyniku chemisorpcji aktywacja substratów reakcji:
nienasyconego
acylu i wodoru
.
W chemisorpcji alkenu biorą udział
p
elektrony podwójnego
wiązania. Adsorpcja wodoru na centrach aktywnych metalu jest
połączona z jego dysocjacją: H
2
+ 2
*
H–
*
+ H–
*
.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
24
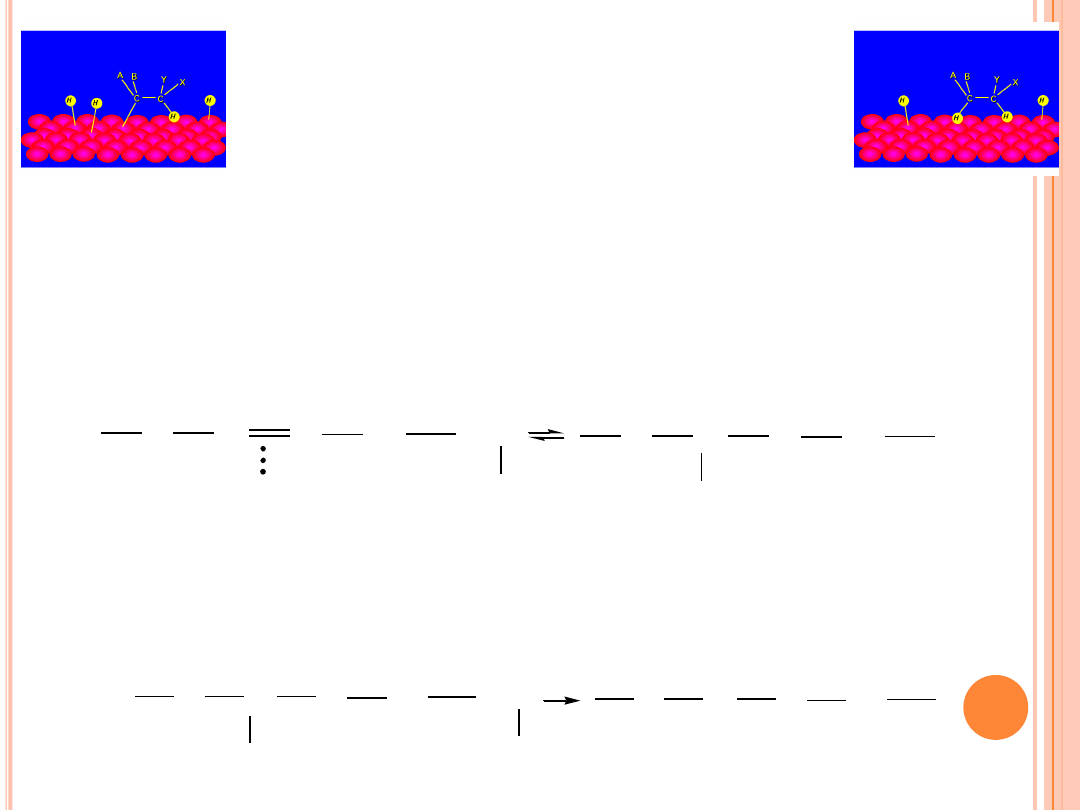
UWODORNIENIE
Reakcja uwodornienia, w której udział biorą kompleksy aktywne:
metal-alken i metal-wodór, przebiega prze tworzenie się związku
półuwodornionego
. Wodór z powierzchni metalu jest
przeniesiony z jednego z węgli podwójnego wiązania, natomiast
drugi węgiel wiąże się z powierzchnią metalu wiązaniem
s
.
*
CH
2
CH
CH
CH
2
+ H
*
CH
2
CH
CH
2
CH
2
s
*
p
W wyniku przyłączenia się drugiego atomu wodoru do związku
półuwodornionego powstaje związek całkowicie uwodorniony.
Reakcja ta jest praktycznie nieodwracalna.
CH
2
CH
CH
2
CH
2
+ H
*
CH
2
CH
2
CH
2
CH
2
*
s
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
25
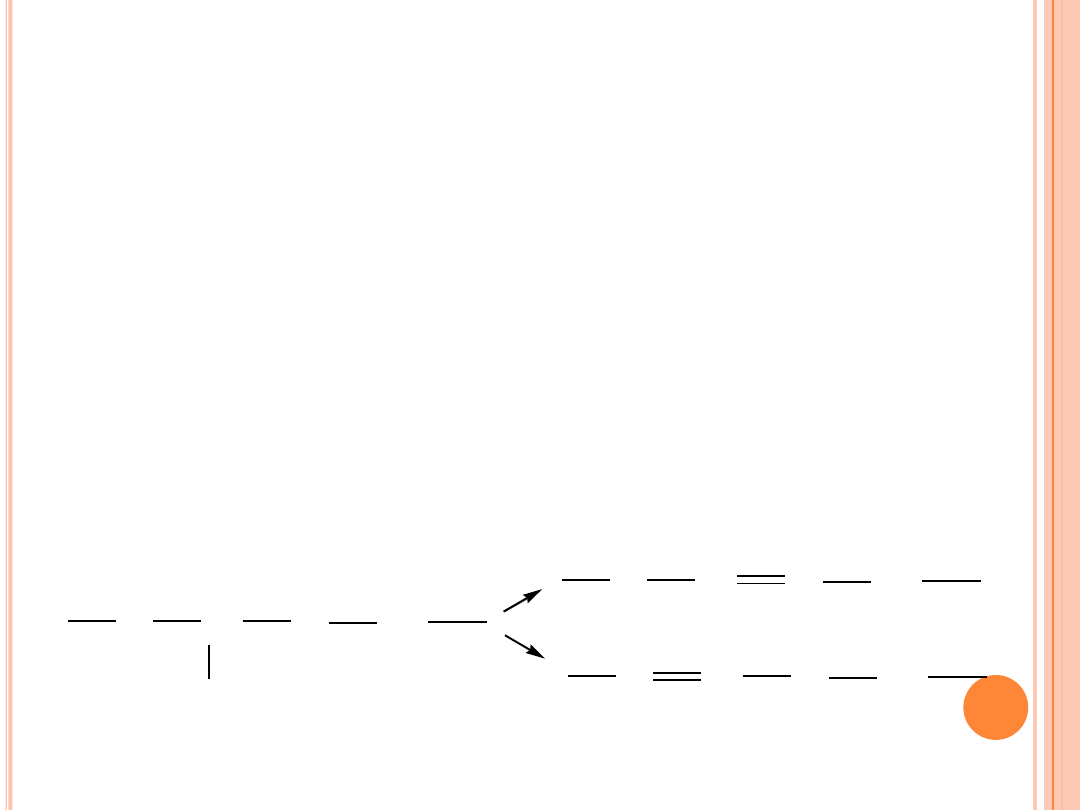
UWODORNIENIE
Ponieważ reakcja powstawania związku
półuwodornionego
jest
odwracalna, związek ten po oddaniu atomu wodoru do metalu może
powrócić do stanu alkenowego.
Oddanie wodoru może nastąpić od węgla z lewej strony lub prawej
strony, względem węgla związanego z powierzchnia metalu. W ten
sposób może być odtworzone wiązanie podwójne oryginalne (przed
adsorpcją) lub przesuniecie (
izomeryzacja pozycyjna
).
CH
2
CH
CH
2
CH
2
*
CH
2
CH
CH
CH
2
CH
CH
CH
2
CH
2
-H
-H
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
26

UWODORNIENIE
Wobec swobodnej rotacji wokół wiązań między węglami w
związku
półuwodornionym
,
powstające
na
skutek
odwodornienia wiązania podwójne mogą mieć konfiguracje
cis
lub
trans
.
Stosunek izomerów trans do cis wynosi w stanie równowagi,
co najmniej 2:1. Ponieważ izomery trans mają wyższe
temperatury topnienia niż cis, utwardzanie tłuszczów zależy
nie tylko od reakcji wysycania wiązań podwójnych (kwasy
nasycone), lecz również od
transizomeryzacji (izomeryzacja
konfiguracyjna)
.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
27
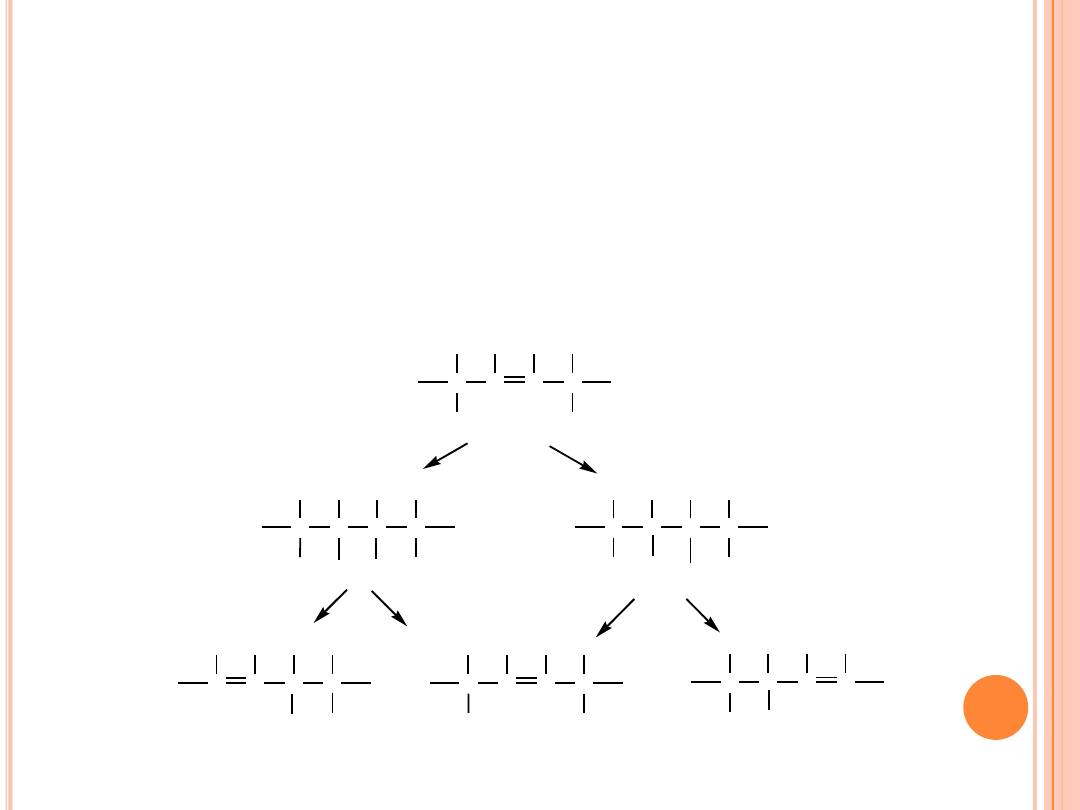
UWODORNIENIE
Mechanizm reakcji izomeryzacji pozycyjnej na przykładzie kwasu
oleinowego:
C
C
H
H
C
H
C
H
H
H
8
9
10
11
C
C
H
H
C
H
C
H
H
H
C
C
H
H
C
H
C
H
H
H
H
H
*
*
C
C
H
H
C
H
C
H
H
H
8
9
10
11
C
C
H
H
C
H
C
H
H
H
C
C
H
C
H
C
H
H
H
H
10
9
-H
-H
-H
-H
+H
+H
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
28
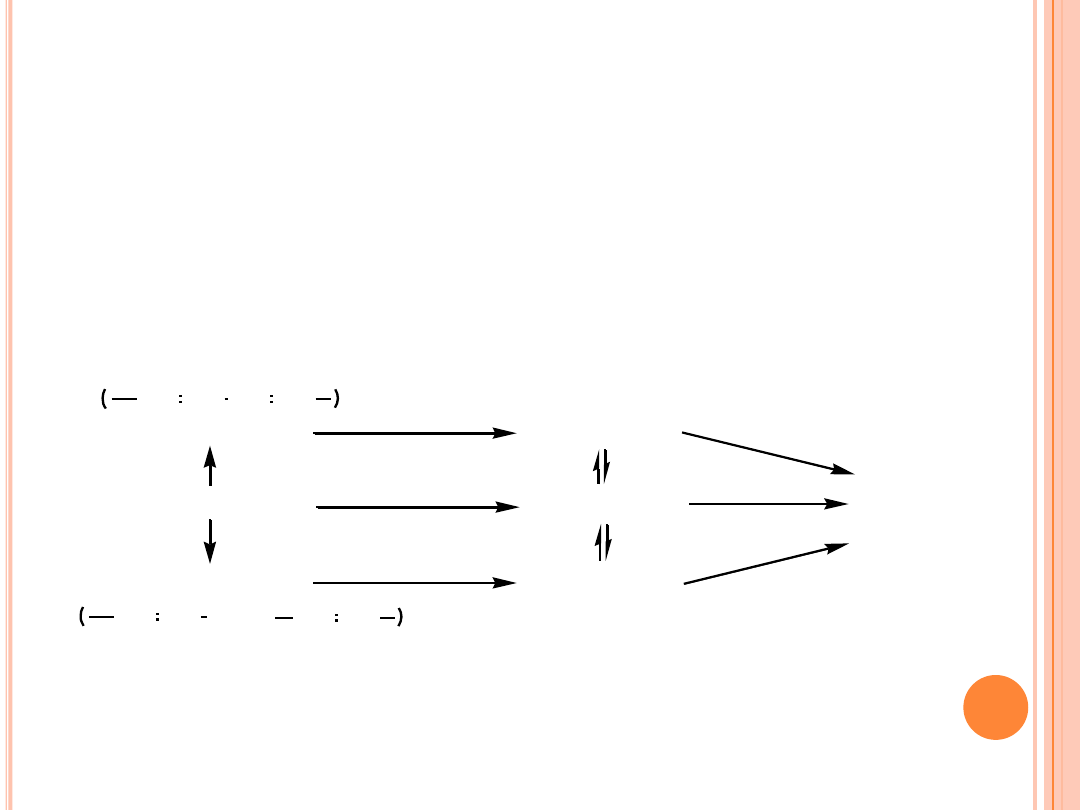
UWODORNIENIE
Mechanizm reakcji izomeryzacji pozycyjnej na przykładzie kwasu
linolowego:
18:2 izomery
18:2 (9c, 12c)
18:2 izomery
18:1 izomery
18:1 (9c, 12c)
18:2 izomery
18:0
CH CH CH CH
CH CH (CH
2
)
n
CH CH
n= lub >2
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
29

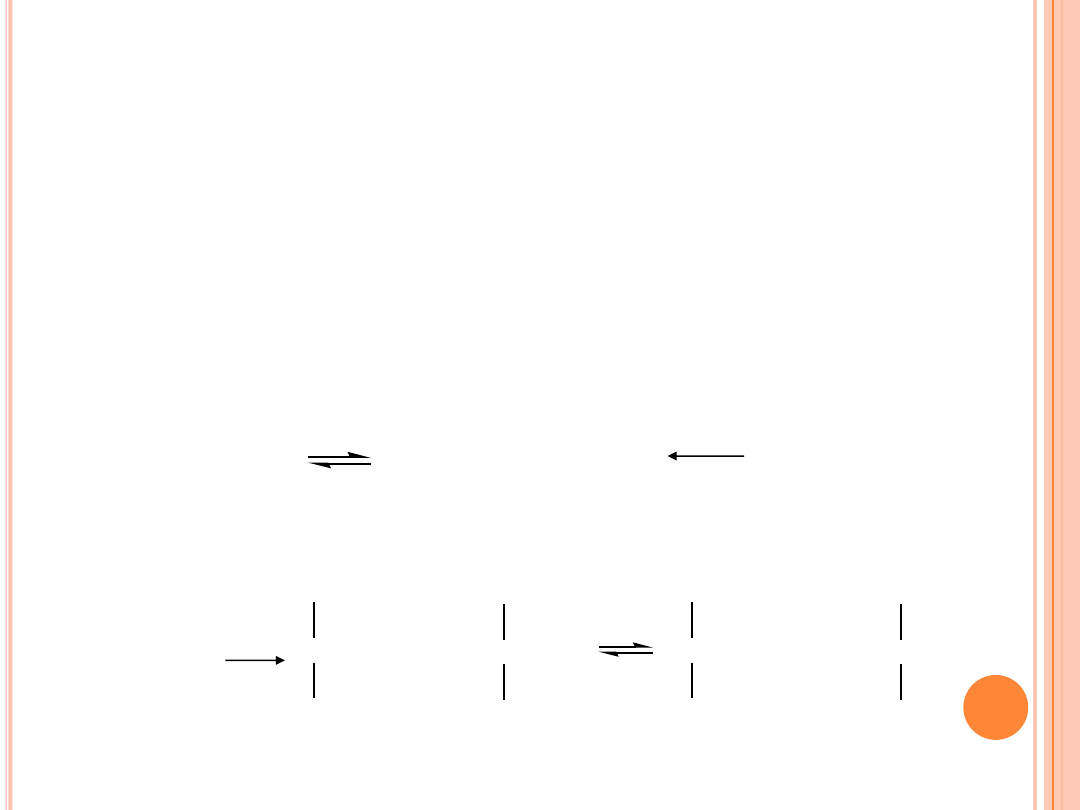
UWODORNIENIE
W procesie uwodornienia
kwasy polienowe
są bardziej
reaktywne niż
monoenowe
. Gdy w układzie reakcyjnym
występują jednocześnie kwasy tłuszczowe o różnym stopniu
nienasycenia, ważną rolę odgrywa selektywność procesu.
Selektywność można wyjaśnić na uproszczonym schemacie
reakcji uwodornienia jako reakcji następczych:
trieny
kwas linolenowy
dieny
kwas linolowy
monoeny
kwas oleinowy
nasycone
kwas stearynowy
k
3
k
2
k
1
Selektywność
definiuje się jako stosunek stałych szybkości
reakcji. Podczas nieselektywnego uwodornienia, selektywność
S
2/1
= k
2
/k
1
przyjmuje małą wartość (ok. 5), natomiast
selektywnego ok. 50 i więcej. Jeżeli S = 0, to wszystkie
cząsteczki ulegają przemianie bezpośrednio w kwas stearynowy.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
30

UWODORNIENIE
Przy uwodornieniu triacylogliceroli należy pamiętać o różnej
reaktywności kwasów tłuszczowych w zależności od
zajmowanych przez nie pozycji w cząsteczce. Stwierdzono, że
szybkość uwodornienia tych samych kwasów w pozycjach
zewnętrznych jest większa niż w pozycjach wewnętrznych
(
selektywność pozycyjna
).
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
31

UWODORNIENIE
Proces uwodornienia tłuszczów jest
często stosowany w przemyśle
tłuszczowym, do zmiany ich
charakteru fizycznego i chemicznego
oraz składu występujących w nich
kwasów tłuszczowych.
Uwodornienie tłuszczów
prowadzi się w dwóch ważnych
celach –
zwiększenie ich stabilności
oksydatywnej
oraz
przekształcenia
olejów w produkty plastyczne
, które
są bardziej przydatne do wyrobu
margaryn i innych tłuszczów
jadalnych.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
32

UWODORNIENIE
Powstające podczas uwodornienia
izomery geometryczne
oraz
izomery położenia
są niekorzystne z punktu widzenia
żywieniowego. Badania wykazują, że izomery trans podnoszą
poziom frakcji LDL cholesterolu we krwi, zaburzają funkcje
komórek limfatycznych, a także mają związek z chorobami
nowotworowymi.
Podczas procesu uwodornienia mogą również powstawać
sprzężone związki kwasów tłuszczowych jak również związki
cykliczne, które mogą mieć działanie rakotwórcze.
Do niekorzystnych zmian zachodzących podczas uwodornienia
należą również straty witamin i prowitamin.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
33

AUTOOKSYDACJA
Reakcja kwasu nienasyconego z tlenem wymaga aktywacji
alkenu lub tlenu, dlatego utlenianie lipidów rozważa się jako
dwa procesy przebiegające wg różnych mechanizmów i
prowadzące do nieco innych produktów. Są to
autooksydacja
(samoutlenianie) i
utlenianie fotosensybilizowane
(utlenianie
pod wpływem światła).
Autooksydacja
jest rodnikową reakcja łańcuchową, w której
można wyróżnić trzy podstawowe etapy.
Inicjacja
(zapoczątkowanie reakcji) – hemolityczne oderwanie
wodoru i utworzenie węglowego rodnika alkilowego w
obecności inicjatora
RH
R
+ H
inicjator
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
34

AUTOOKSYDACJA
Rodnik to cząsteczka posiadająca jeden lub więcej wolnych,
niesparowanych elektronów. Innymi słowy, jest to cząsteczka
(lub jon) o spinie elektronowym różnym od 0.
Większość elektronów w atomach i cząsteczkach występuje
parami (po dwa na każdym orbitalu). Gdy zdarzy się, że jakiś
elektron nie ma „pary”, jego orbital bardzo chętnie przyjmuje
„kolegę” ze swojego otoczenia - zwykle od jakiegoś innego
atomu lub cząsteczki.
Rodniki są obojętne elektrycznie i bardzo reaktywne. Prawie
każdy rodnik, niezależnie od swojej struktury, może łatwo
reagować z dowolnym innym rodnikiem, dlatego zazwyczaj
niemal zaraz po powstaniu reagują same z sobą na skutek czego
ich stężenie w środowisku reakcji chemicznej jest zazwyczaj
bardzo niskie.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
35

AUTOOKSYDACJA
Rodniki powstają na skutek homolitycznego rozpadu wiązań
chemicznych, tj. takiego w wyniku którego przy obu połowach
rozerwanej cząsteczki zostaje po jednym z elektronów, które
wcześniej tworzyły owo wiązanie. Może ono następować pod
wpływem
naświetlania gazów lub cieczy światłem
ultrafioletowym, promieniowaniem rentgenowskim lub przez
bombardowanie elektronami oraz w wyniku niektórych reakcji
redoks, a także w wyniku termicznego rozpadu takich związków
jak np: nadtlenki
.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
36
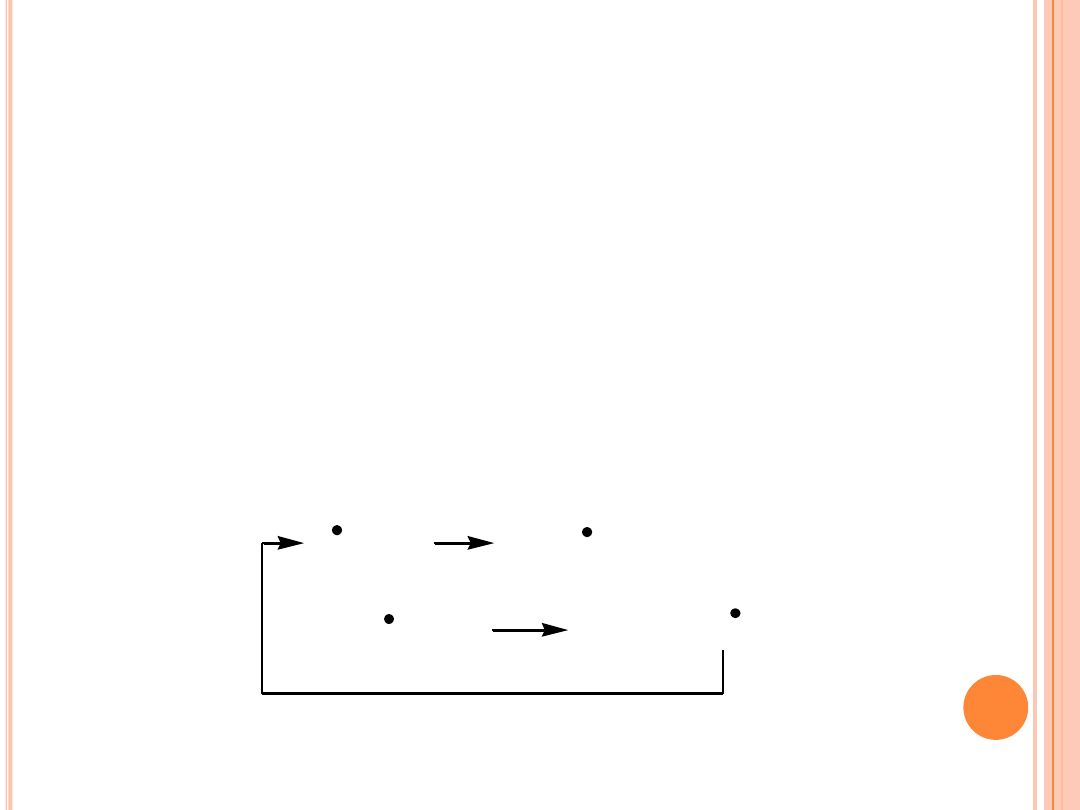
AUTOOKSYDACJA
Propagacja
(rozwijanie reakcji) – reakcja rodnika z O
2
i
utworzenie rodnika nadtlenowego, który następnie reaguje z
nienasyconym
lipidem
(alken-RH)
i
tworzy
się
wodoronadtlenek oraz nowy rodnik lipidowy. Nowo powstały
rodnik reaguje z O
2
tworząc rodnik nadtlenkowy itd. W ten
sposób autooksydacja staje się rodnikowym procesem
łańcuchowym.
R + O
2
ROO + RH
ROOH + R
ROO
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
37

AUTOOKSYDACJA
Terminacja
(zakończenie reakcji). Reakcja łańcuchowa może być
zakończona (co oznacza przerwanie łańcucha) na skutek
rekombinacji rodników i tworzenia się nierodnikowych
produktów, które nie są ani inicjatorami, ani propagatorami
reakcji
R + R
RR
ROO + R
ROOR
ROO + ROO
ROOR + O
2
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
38

AUTOOKSYDACJA
Powstałe podczas propagacji wodoronadtlenki są źródłem
dodatkowych rodników inicjujących
ROOH
RO + HO
RO + RH
R + ROH
HO + RH
R + H
2
O
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
39

AUTOOKSYDACJA
Mimo że wszystkie nienasycone lipidy ulegają utlenianiu, to z
praktycznego
punktu
widzenia
problem
autooksydacji
sprowadza się do nienasyconego łańcucha węglowodorowego
kwasów tłuszczowych, zwłaszcza kwasów polienowych.
Szybkość reakcji rośnie wraz ze stopniem nienasycenia
.
Kwas linolowy utlenia się 10-40-krotnie szybciej niż oleinowy,
natomiast linolenowy 2-4-krotnie szybciej niż linolowy.
Z podwyższeniem
temperatury
szybkość utlenienia wzrasta, a
okres indukcji ulega skróceniu.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
40

AUTOOKSYDACJA
Tlen rozpuszczony w tłuszczu przyłącza się do atomu węgla
w
pozycji
od podwójnego wiązania
kwasu tłuszczowego
tworząc wodoronadtlenek (hydronadtlenek). Im więcej
podwójnych wiązań w tłuszczu, tym więcej podatnych na
utlenianie miejsc (pozycji
) i tym szybszy jest proces
utleniania. Każde następne podwójne wiązanie w kwasie
tłuszczowym zwiększa podatność na utlenianie nawet 10 –
krotnie.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
41
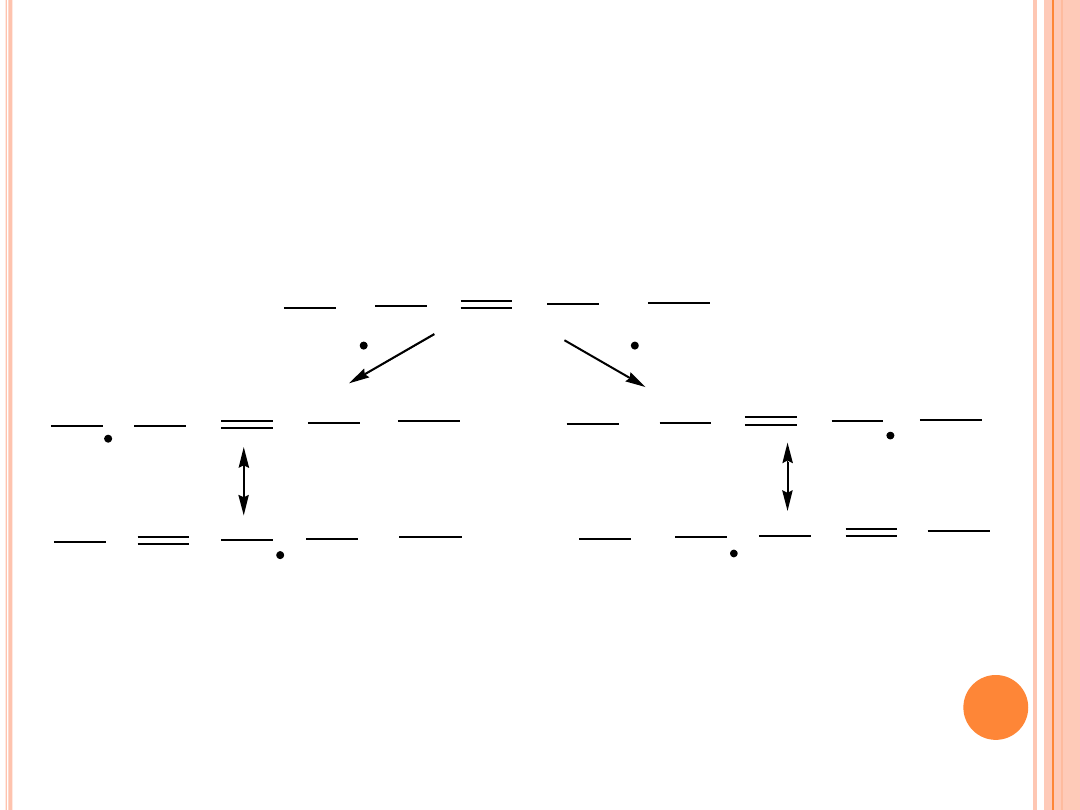
AUTOOKSYDACJA
Mechanizm autooksydacji kwasu monoenowego:
8
9
10
11
CH
2
CH
CH
CH
2
8
CH
CH
CH
CH
2
11
CH
2
CH
CH
CH
10
CH
CH
CH
CH
2
9
CH
2
CH
CH
CH
mezomeria
mezomeria
-H
-H
Przesunięcie podwójnego wiązania w następstwie mezomerii
prowadzi na ogół do zmian jego geometrii cis w trans.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
42
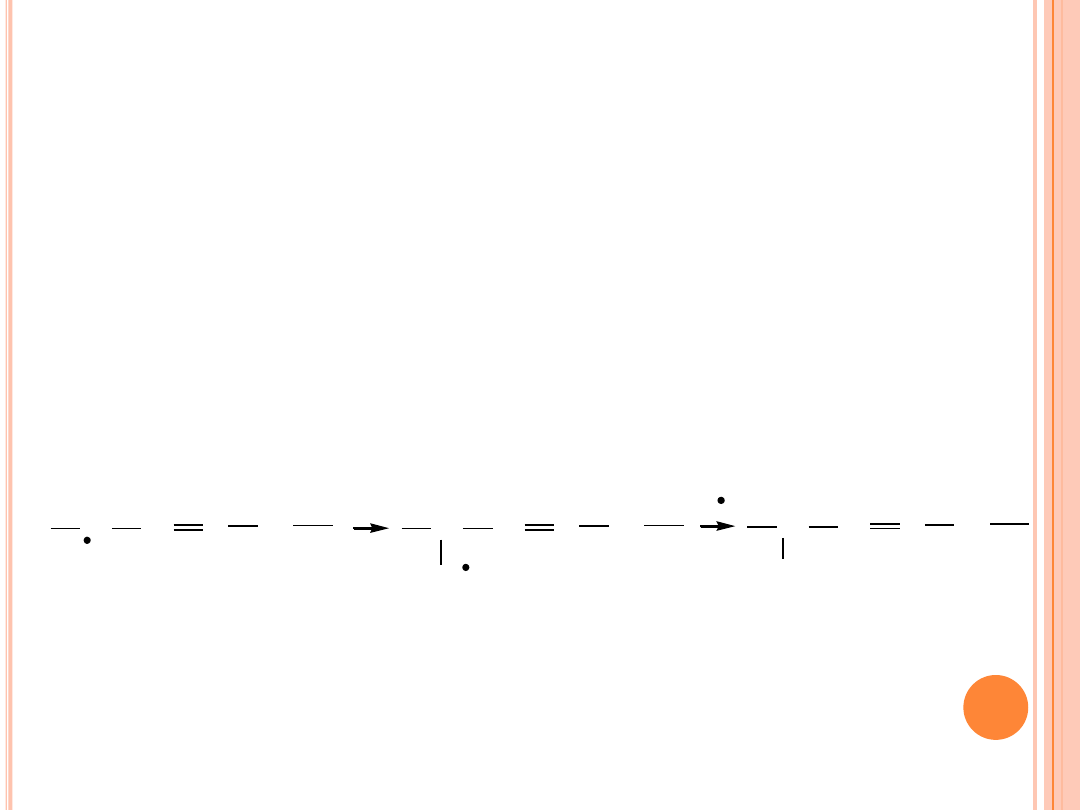
AUTOOKSYDACJA
Przyłączenie tlenu powoduje z kolei wytworzenie czterech
różnych rodników nadtlenowych, które później, po
przyłączeniu wodoru odszczepionego od nowych cząsteczek
kwasu, przechodzą w odpowiednie wodoronadtlenki
CH
CH
CH
CH
2
CH
CH
CH
CH
2
CH
CH
CH
CH
2
+O
2
+H
OO
OOH
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
43
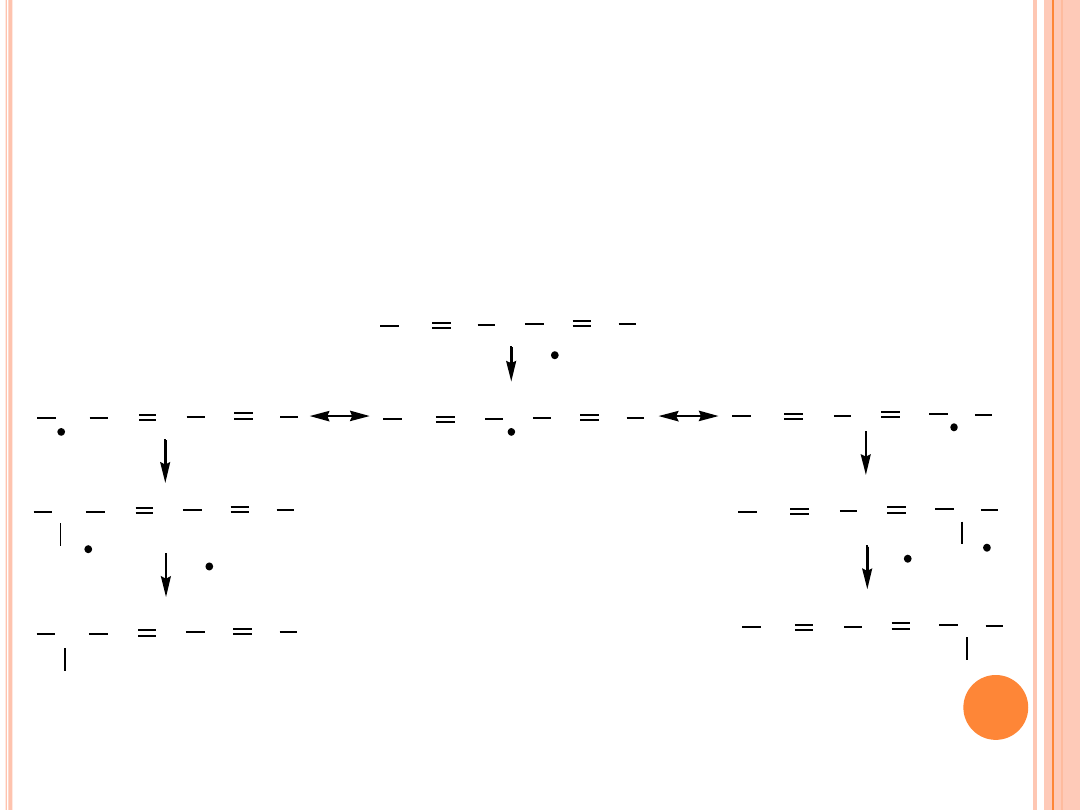
AUTOOKSYDACJA
Mechanizm autooksydacji kwasu polienowego (linolowego):
CH
CH CH
2
CH
CH
10
11
12
13
9
CH
CH
CH
CH
CH
9
trans
cis
CH
CH
CH
CH
CH
11
cis
cis
CH
CH
CH
CH
CH
13
trans
cis
CH
CH
CH
CH
CH
9
trans
cis
CH
CH
CH
CH
CH
9
trans
cis
CH
CH
CH
CH
CH
13
trans
cis
CH
CH
CH
CH
CH
13
trans
cis
OO
OO
OOH
OOH
+O
2
+O
2
+H
+H
-H
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
44

FOTOSENSYBILIZOWANE UTLENIANIE
Fotoutlenianie obejmuje reakcję alkenu z tlenem w obecności
światła
i odpowiedniego
sensybilizatora (uczulacza).
Takie
sensybilizatory,
jak
chlorofil
czy
erytrozyna
,
przekształcają tlen w jego bardziej reaktywny stan singletowy.
W tym stanie tlen reaguje z alkenem bez wytwarzania rodnika
(reakcja enowa), przyłączając się do jednego z węgli
podwójnego wiązania.
Ta reakcja jest połączona z migracją podwójnego wiązania i
zmianą jego konfiguracji z
cis w trans
.
Jest
inhibowana
przez „wygaszacze” tlenu singletowego, jak np.
b
-karoten czy tokoferole
.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
45
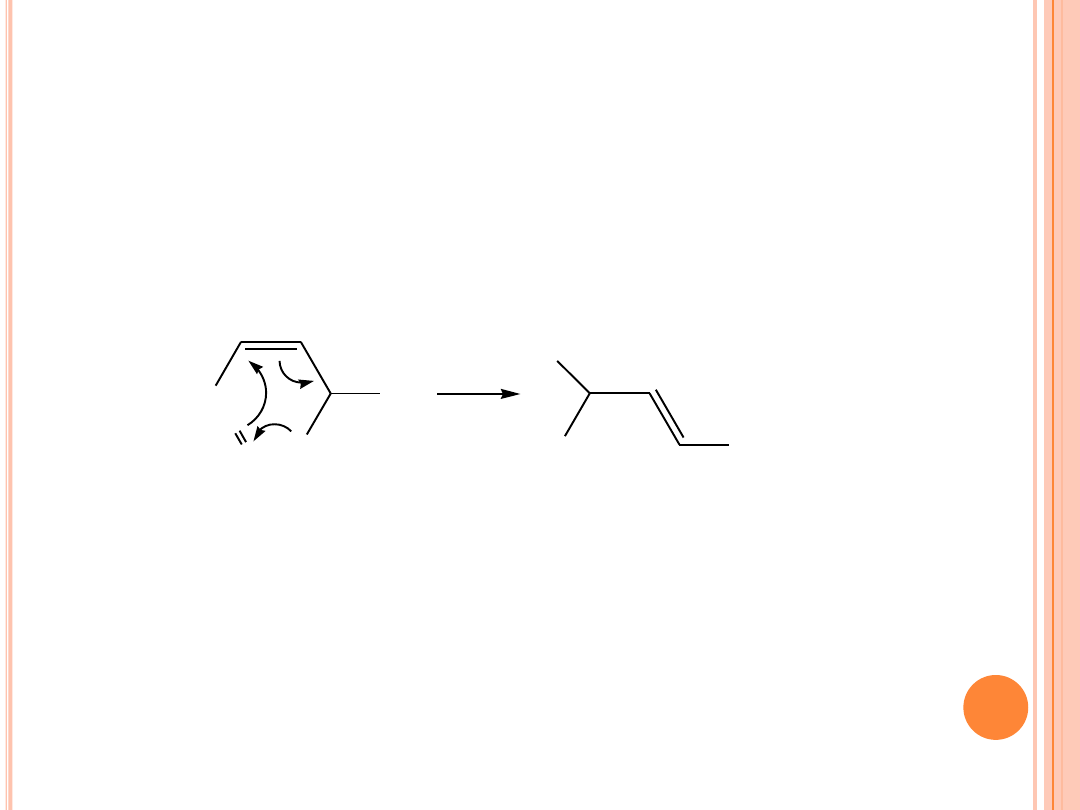
FOTOSENSYBILIZOWANE UTLENIANIE
W wyniku ataku tlenu singletowego na podwójne wiązanie tworzą
się wodoronadtlenki alkilowe w konfiguracji trans.
R
R'
H
HOO
R'
R
cis
trans
O
O
Ponieważ przyłączenie tlenu singletowego następuje do jednego z
dwóch węgli przy podwójnym wiązaniu, w przypadku kwasu
oleinowego tworzą się wodoronadtlenki: 9-OOH i = przy 10 C
oraz 10-OOH i = przy 8 C.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
46
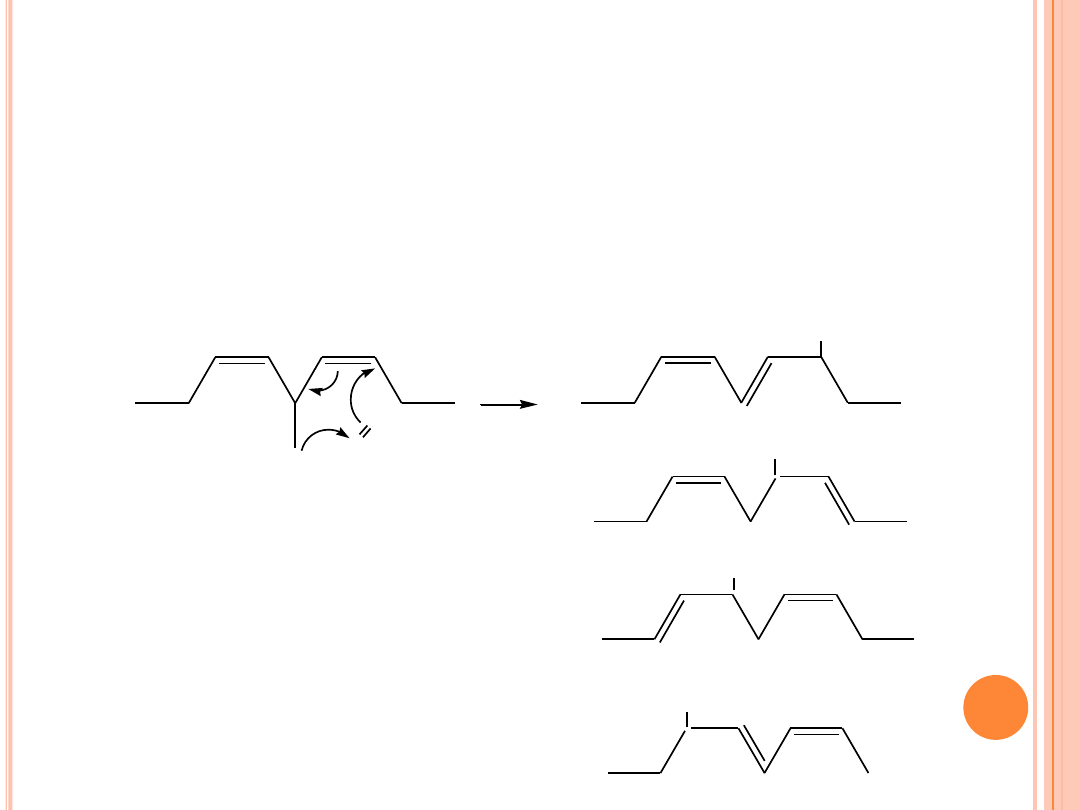
FOTOSENSYBILIZOWANE UTLENIANIE
Mechanizm reakcji fotosensybilizowanego utleniania kwasu
linolowego :
H
OOH
O
O
13
10
12
9
9
13
10
12
10
OOH
OOH
OOH
13
12
9
13
12
13
10
9
10
9
12
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
47

FOTOSENSYBILIZOWANE UTLENIANIE
A AUTOOKSYDACJA
Fotosensybilizowane
utlenianie
jest
dużo szybsze niż
autooksydacja, a różnice w reaktywności pomiędzy kwasami
oleinowym, linolowym, linolenowym są w przybliżeniu
proporcjonalne do liczby występujących w nich wiązań
podwójnych.
Istnieją przypuszczenia, że autooksydacja naturalnych tłuszczów
może by zainicjowana przez fotoutlenianie, wskutek obecności
w nich określonych barwników. Powstałe w wyniku
fotosensybilizowanego utleniania wodoronadtlenki rozpadając
się tworzą rodniki, które mogą zapoczątkować reakcję
łańcuchową autooksydacji.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
48

WTÓRNE PRODUKTY UTLENIANIA LIPIDÓW
Powstające w procesie utleniania lipidów wodoronadtlenki są
bardzo
nietrwałe i mogą ulegać różnokierunkowym
przemianom, stając się źródłem wielu produktów wtórnych.
Wskutek rozerwania łańcucha węglowego powstają produkty
krótkołańcuchowe, takie jak
węglowodory, aldehydy, ketony,
estry, laktony, alkohole i etery
. Wszystkie mogą występować
jako
związki
nasycone
lub
nienasycone.
Aldehydy
krótkołańcuchowe oraz powstające z nich wskutek utleniania
kwasy w dużym stopniu wpływają na charakterystyczny zapach
zjełczałego tłuszczu lub produktu żywnościowego zawierającego
lipidy.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
49

WTÓRNE PRODUKTY UTLENIANIA LIPIDÓW
Rozkład wodoronadtlenków może być przyspieszany przez
wiele czynników, m.in. przez
promieniowanie o dużej energii,
energię cieplną, katalityczne działanie metali ciężkich i
aktywność enzymatyczną
. Duże znaczenie mają jony niektórych
metali (
Cu, Fe, Co, Mn, Cr
). Nawet w ilościach śladowych (0,1
– 1 5 mg/g) bardzo silnie przyspieszają reakcje rozpadu
wodoronadtlenków. Jony metali katalizują wszystkie reakcje
zachodzące podczas utleniania lipidów, a więc również
powstawania wodoronadtlenków i ich dalsze przemiany. Stąd
tak ważną sprawa jest
dezaktywacja jonów
metali, np. za
pomocą
czynników chelatujących (kwasu cytrynowego, kwasu
fosforowego, lecytyny i innych).
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
50

WTÓRNE PRODUKTY UTLENIANIA LIPIDÓW
Oksydatywne jełczenie tłuszczów pogarsza nie tylko ich cechy
sensoryczne, lecz także wartość żywieniową, która staje się tym
mniejsza, im głębsze nastąpiły zmiany. Przy dalej posuniętym
procesie utleniania tłuszczów mogą powstawać różne
substancje toksyczne. Do nich należą również rodniki. Uważa
się, że wiele wtórnych produktów utleniania lipidów
negatywnie oddziałuje na ustrój, m.in.
niszcząc aktywne
biologicznie białka
oraz
działając mutagennie na kwasy
nukleinowe
. Istnieją także dowody wskazujące na
działanie
rakotwórcze tłuszczów utlenionych
. Ponadto
zmniejsza się w
tłuszczach zawartość NNKT
.
Silnej destrukcji
ulegają również
karoteny i witamina A
. W miarę utleniania tokoferoli maleje
także aktywność biologiczna witaminy E.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
51

PRZECIWUTLENIACZE
Szybkość utleniania tłuszczów jest uwarunkowana wieloma
czynnikami, w tym obecnością w nich niektórych substancji.
Substancje przyspieszające proces utleniania zwane są
prooksydantami
, natomiast hamujące –
antyoksydantami lub
przeciwutleniaczami
.
Przeciwutleniacze
należy
rozpatrywać
jako
naturalne
występujące w tłuszczach lub jako substancje umyślnie
dodawane celem zwiększenia ich stabilności oksydatywnej.
Naturalne tłuszcze mają w swym składzie charakterystyczne
antyoksydanty, z tym, że oleje maja ich na ogół więcej niż
tłuszcze zwierzęce. Dlatego te pierwsze wykazują większa
odporność na utlenianie przy porównywalnym stopniu
nienasycenia.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
52

PRZECIWUTLENIACZE
Współcześnie termin
przeciwutleniacze żywności
dotyczy na
ogół tych związków, które przerywają rodnikową reakcje
łańcuchową. Ich cechą charakterystyczna jest to, że są one
efektowne już przy bardzo małych stężeniach, np. 0,001-0,1%.
Niektóre z nich mają określone optymalne stężenia (np.
tokoferole
ok.
0,05%),
których przekroczenie może
spowodować zmniejszenie ich aktywności, a nawet przy dużych
stężeniach mogą działać prooksydatywnie.
Ze względu na pochodzenie przeciwutleniacze można podzielić
na
naturalne
lub
syntetyczne
.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
53

PRZECIWUTLENIACZE
Do ważniejszych
przeciwutleniaczy naturalnych
należą m.in.
tokoferole, kwas nordihydrogwajaretowy (NDGA)
. Szczególnie
ważna
rolę
odgrywają
tokoferole
.
Są
one
bardzo
rozpowszechnione w świecie roślinnym. Zwierzęta nie mają
zdolności syntezowania tych związków, lecz mogą je
magazynować w wątrobie. Ponieważ tokoferole odznaczają się
nie tylko właściwościami przeciwutleniającymi, lecz również
biologicznymi, są więc objęte ogólną nazwą witamina E.
Z
syntetycznych antyoksydantów
na uwagę zasługują:
di-tert-
butylohydroksytoluen (BHT), mono-tert-butylohydroksyanizol
(BHA) oraz estry kwasu galusowego (np. galusan propylu i
oktylu)
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
54
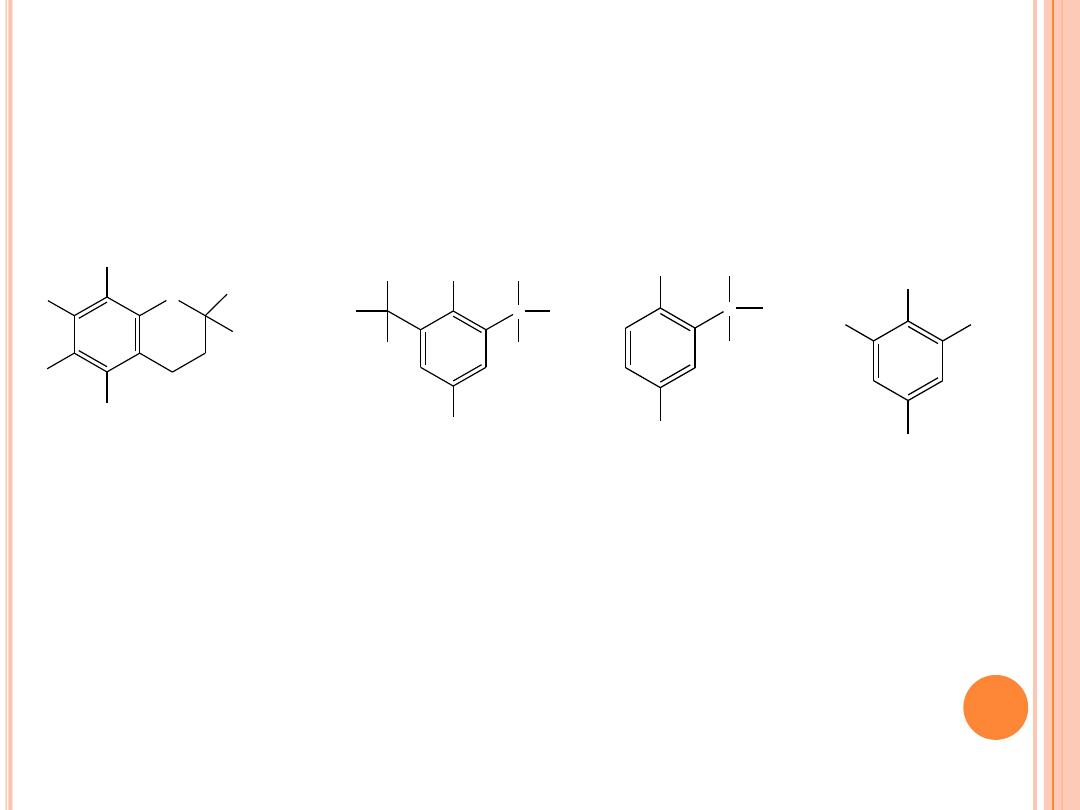
PRZECIWUTLENIACZE
Struktury ważniejszych przeciwutleniaczy:
O
CH
3
C
16
H
33
CH
3
HO
H
3
C
CH
3
C
OH
CH
3
CH
3
CH
3
CH
3
CH
3
H
3
C
CH
3
-tokoferol
BHT
C
OH
OCH
3
CH
3
CH
3
CH
3
OH
OH
COOCH
2
CH
2
CH
3
HO
BHA
galusan propylu
Użycie mieszaniny dwóch lub więcej przeciwutleniaczy jest
czasami skuteczniejsze niż użycie tej samej ilości jednego z nich.
Efekt ten jest znany pod nazwą
synergizmu
, np. między BHA i
BHT. Istnieją także synergenty, które same nie przejawiają
aktywności przeciwutleniającej, jednak wielokrotnie zwiększają
lub przedłużają działanie właściwych antyoksydantów.
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
55
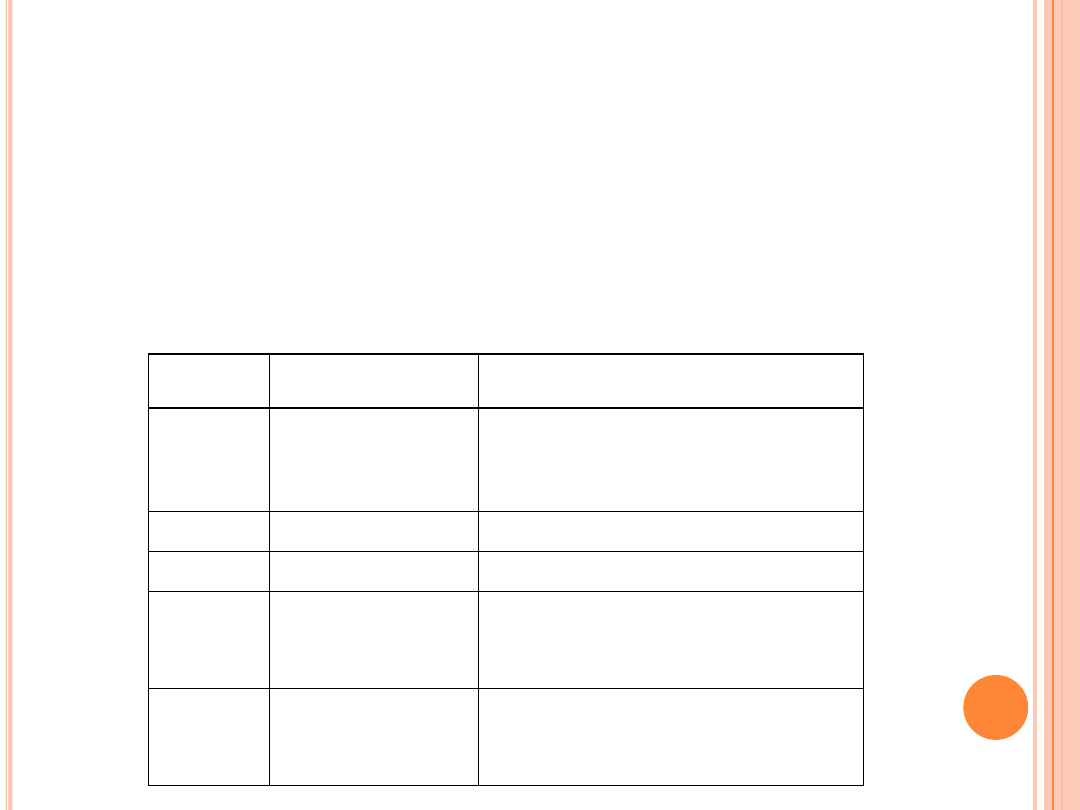
PRZECIWUTLENIACZE
W Polsce do ochrony różnych tłuszczów i produktów tłuszczowych
jest dozwolone dodawanie tokoferoli naturalnych i syntetycznych.
Ograniczone zastosowanie mają BHA i galusany
E-Numer
Substancja
Produkty żywnościowe, w których dany
antyoksydant został użyty
E 300
E 301
E 302
Kwas askorbinowy
Askorbinian sodu
Askorbinian wapnia
Napoje bezalkoholowe, dżemy, mleko
kondensowane, kiełbasa
E 304
Palmitynian askorbylu
Kiełbasa, buliony
E 306-309
Tokoferole
Oleje
E 310
E 311
Galusan propylu
Galusan oktylu
Tłuszcze i oleje wykorzystywane w
profesjonalnej produkcji, tłuszcze i oleje do
smażenia, przyprawy, zupy w proszku, gumy do
żucia
E 320
E 321
Butylohydroksyanizol
(BHA)
Butylohydroksytoluen
(BHT)
Słodycze, rodzynki, serki topione, masło
orzechowe, zupy typu instant
TŁU
S
ZCZE 2 C
HEMI
A
ŻYW
NO
Ś
C
I W
NoŻ
dr
inż
. J
oa
nna
B
ry
ś
56
Wyszukiwarka
Podobne podstrony:
alergeny chemia ywno Ťci
chemia, ywno ci pytania na egzamin www.przeklej.pl, Chemia Żywności – pytania na egzamin
chemia ywno ci pytania na egzamin www.przeklej.pl, Chemia żywności
aa chemia ywno ci www.przeklej.pl, Technologia zywnosci, semestr III, chemia zywnosci
Zagadnienia treningowe na egzamin z Chemii ywno Ťci
Opakowania +-ywno+Ťci, Opakowania do żywności
02 Psychospo eczne determinanty wyboru ywno ci Mariusz Jaworski, Anna Fabisiak
higiena ywno ci w 1 21 02 2011
higiena ywno ci w 4 14 03 2011
higiena ywno ci w 2 i 3 28 02 2011 i 7 03 2011
higiena ywno ci w 5 i 6 21 03 2011 i 28 03 2011r
Chemia1, wrzucaj co ci zawadza na kompie
Žci▒ga kolos chemia 3 25 11 2006 trzeci
9 chemiaogolna wyklad 271009, Motto wieczoru: ,,Chemia to nie lada gratka powie Ci to sąsiad i sąsia
9 chemiaogolna wyklad 271009, Motto wieczoru: ,,Chemia to nie lada gratka powie Ci to sąsiad i sąsia
�CI�GA - CHEMIA WYJ�CI�WKA cz.4 (3) , MANGANOMETRIA-KMnO4-
więcej podobnych podstron