KONKURS CHEMICZNY
DLA UCZNIÓW GIMNAZJUM
ROK SZKOLNY 2010/2011
ETAP WOJEWÓDZKI
Informacje:
1. Sprawdź, czy otrzymałeś/aś łącznie 9 stron. Ewentualny brak zgłoś
przewodniczącemu komisji.
2. Na stronie pierwszej tekstu wpisz w wyznaczone miejsce swój kod.
Nie wpisuj swojego imienia i nazwiska!
3. Części I składa się z 11 zadań otwartych. Przy każdym zadaniu
podana jest liczba punktów możliwych do uzyskania.
4. Części II składa się z 6 zadań testowych. Prawidłową odpowiedź
zaznacz znakiem X. W razie pomyłki błędną odpowiedź otocz
kółkiem, a prawidłową zaznacz X. W każdym zadaniu tylko
jedna odpowiedź jest prawidłowa. Za każdą prawidłową
odpowiedź otrzymujesz 1 punkt.
5. W rozwiązaniach zadań rachunkowych pamiętaj o jednostkach
i pisaniu odpowiedzi.
6. Wyniki zadań rachunkowych podaj z dokładnością do dwóch
miejsc po przecinku.
7. Za rozwiązanie wszystkich zadań możesz uzyskać łącznie
53 punkty.
8. Pisz czytelnie. Używaj długopisu lub pióra. Nie używaj ołówka.
9. Nie używaj korektora. Gdy popełnisz błąd w zadaniach
otwartych, przekreśl odpowiedź i obok napisz poprawną.
10. W trakcie konkursu możesz korzystać wyłącznie z tablic
dołączonych do zestawu zadań i prostego kalkulatora.
11. Brudnopis nie podlega ocenie.
Uzyskane punkty
Nr zad.
Pkt.
1
2
3
4
5
6
7
8
9
10
11
12
–
17
Suma
pkt
Kod ucznia
Wpisuje uczeń po otrzymaniu zadań
Wpisać po rozkodowaniu pracy
Imię
Czas pracy:
120 minut
Nazwisko

2
Zadanie 1. (0 – 3 pkt)
W naczyniu znajduje się 60 mg izotopu radonu. Okres połowicznego rozpadu tego pierwiastka wynosi 4 dni.
Sporządź wykres przedstawiający zależnoś masy pierwiastka promieniotwórczego od czasu. Z narysowanego
wykresu odczytaj, ile miligramów radonu pozostanie w naczyniu po 18 dniach.
Odpowiedź: .............................…………………………………………………………….………………………
Zadanie 2. (0 – 4 pkt)
Stężonym H
2
SO
4
podziałano na chlorek sodu, otrzymując gaz o charakterystycznym zapachu, który po
wprowadzeniu do roztworu azotanu(V) srebra(I) spowodował wytrącenie się białego, serowatego osadu. Napisz
równania reakcji w formie cząsteczkowej i jonowej pełnej.
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................

3
Zdanie 3. (0 – 5 pkt)
Zmieszano 50 cm
3
roztworu CaBr
2
o stężeniu 1-molowym, 20 g 10 % roztworu NaBr oraz 10 cm
3
roztworu
FeBr
3
zawierającego 0,02 mola substancji. Roztwór uzupełniono wodą do objętości 200 cm
3
. Oblicz stężenie
molowe jonów bromkowych w otrzymanym roztworze.
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
Zadanie 4. (0 – 5 pkt)
W odpowiednich warunkach siarkowodór reaguje z kwasem azotowym(V). Produktami tego procesu są trzy
dwuskładnikowe związki chemiczne, a atomy siarki i atomy azotu przechodzą na IV stopień utlenienia. Zapisz
równanie tej reakcji, współczynniki stechiometryczne dobierz metodą bilansu elektronowego. Wskaż reakcje
utleniania i redukcji. Podaj wzory substancji pełniących rolę utleniacza i reduktora.
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................

4
Zadanie 5. (0 – 5 pkt)
Mieszaninę czystych chemicznie soli KCl i KNO
3
o masie 0,500 g rozpuszczono w wodzie. Z roztworu
wytrącono jony chlorkowe Cl
–
w postaci AgCl, którego masa po przemyciu i wysuszeniu wynosiła 0,577 g.
Obliczyć procentową zawartość azotu w analizowanej mieszaninie soli w stanie stałym.
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
..................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
..................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
Zadanie 6. (0 – 3 pkt)
Uzupełnij tabelę:
Wzór grupowy
(półstrukturalny) związku
chemicznego
Nazwa związku
Nazwa szeregu
homologicznego,
do którego należy
dany związek
Wzór strukturalny
grupy funkcyjnej
Nazwa grupy
funkcyjnej
CH
3
CH
2
COOCH
3
pent-2-en
CH
3
CH
2
CH
CH
3
OH
kwas
2-aminopropanowy
CH
3
( CH
2
)
14
COOH
5
Zadanie 7. (0 – 4 pkt)
Karbid techniczny zawiera 10 % zanieczyszczeń. Reakcja karbidu z wodą przebiega według równania:
CaC
2
+2 H
2
O → Ca(OH)
2
+ C
2
H
2
W wyniku powyższej reakcji otrzymano w warunkach normalnych 50 dm
3
acetylenu z wydajnością 68%.
Oblicz, ile gramów technicznego karbidu wzięto do reakcji.
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
..................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
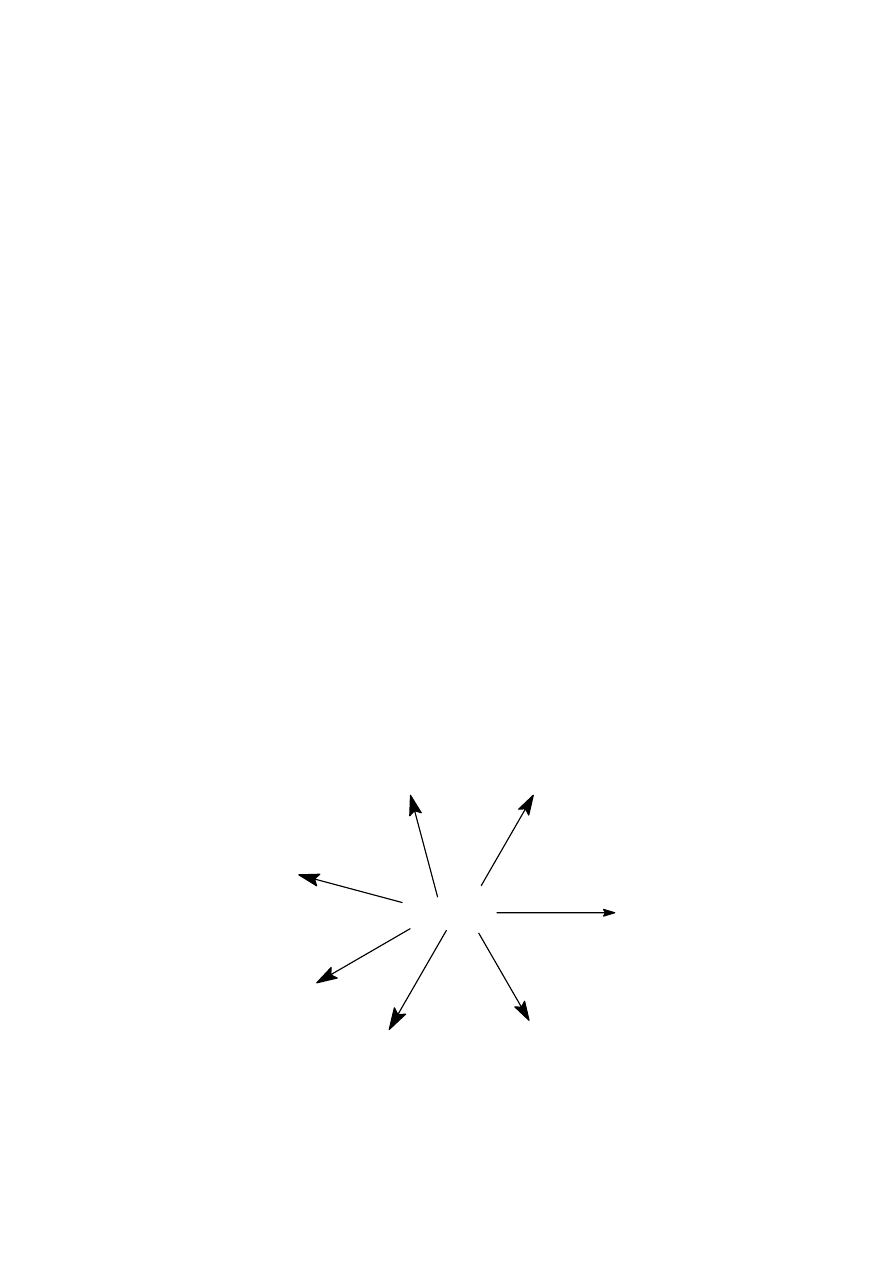
Zadanie 8. (0 – 5 pkt)
Na schemacie przedstawiono szereg doświadczeń przeprowadzonych z użyciem kwasu octowego. Napisz
równania reakcji przedstawione na schemacie lub zaznacz, że reakcje nie zachodzą.
CH
3
COOH
1
2
3
4
5
6
7
CuO
NH
3
H
2
O
Ag
CH
3
CH
2
OH
O
2
Na
2
CO
3
.
C
15
H
31
COOH
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................

6
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
Zadanie 9. (0 – 8 pkt)
W trzech nieoznakowanych probówkach znajdują się roztwory glukozy, sacharozy i skrobi. Zaprojektuj
doświadczenie pozwalające zidentyfikować te roztwory jeżeli masz do dyspozycji: jodynę i wodę utlenioną
oraz roztwory: azotanu(V) srebra(I), wodorotlenku sodu, wodorotlenku wapnia, amoniaku, kwasu
azotowego(V).
Odczynniki chemiczne: ............................................................................................................................................
..................................................................................................................................................................................
Opis słowny: .............................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
Przewidywane obserwacje: .....................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
Wnioski: ...................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................

7
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
Informacja do zadań 10 i 11
W wyniku reakcji 2,22 g kwasu nasyconego jednokarboksylowego z magnezem, otrzymano
21
10
03
,
9
cząsteczek wodoru.
Zadanie 10. (0 – 3 pkt)
Za pomocą obliczeń wyznacz masę molową kwasu jednokarboksylowego.
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
Zadanie 11. (0 – 2 pkt)
Za pomocą obliczeń wyznacz wzór sumaryczny kwasu jednokarboksylowego, narysuj wzór grupowy
(półstrukturalny) tego kwasu i podaj nazwę.
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
..................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
8
Zadanie 12. (0 – 1 pkt)
Do 100 cm
3
0,1- molowego roztworu kwasu chlorowodorowego (solnego) dodano 900 cm
3
wody. Stężenie
molowe roztworu:
A. zmalało 10 razy
B. zmalało 2 razy
C. wzrosło 10 razy
D. nie uległo zmianie
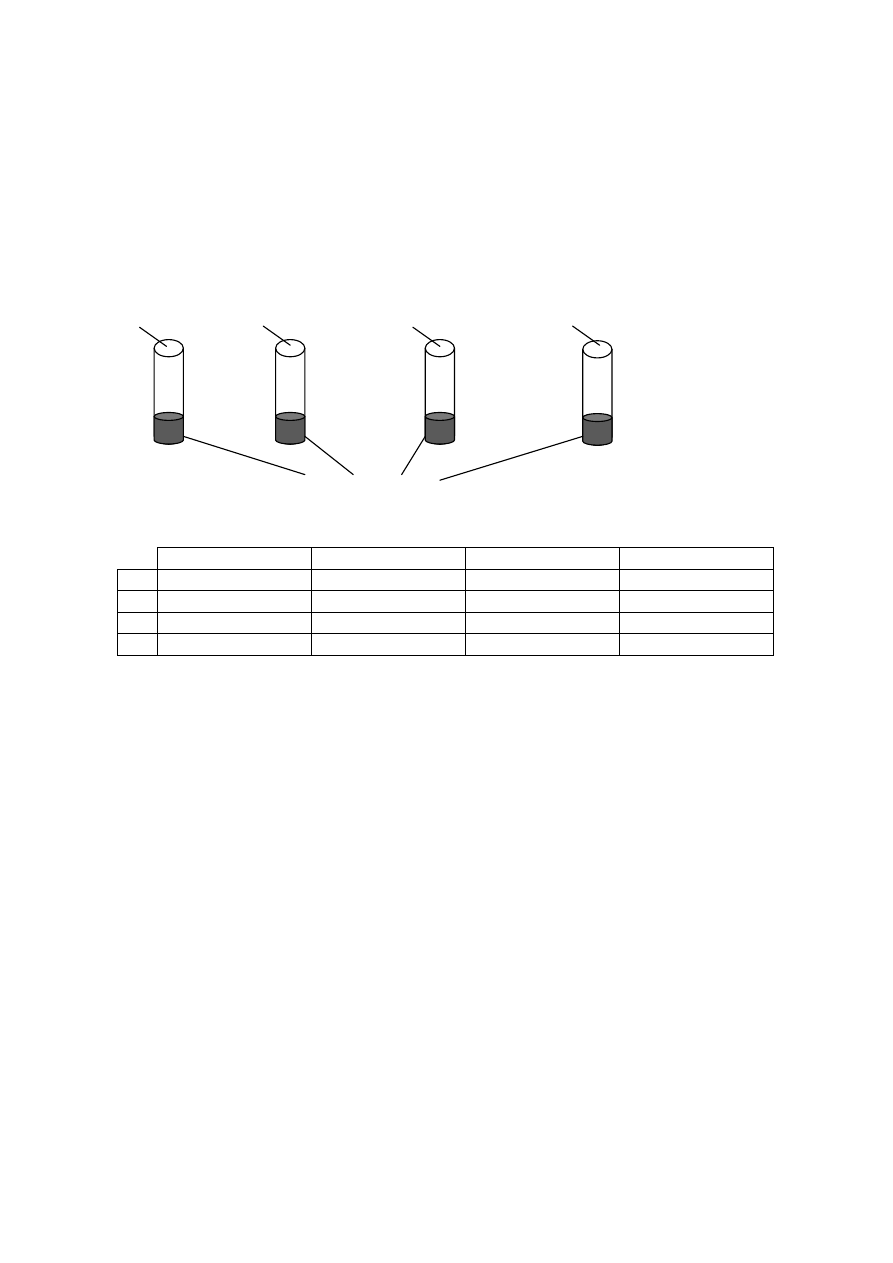
Zadanie 13. (0 – 1 pkt)
Rysunek przedstawia schematy doświadczeń:
NaCl C
2
H
5
OH Pb(NO
3
)
2
HNO
3
białko jaja kurzego
Zaznacz prawidłową odpowiedź wskazującą procesy zachodzące w poszczególnych probówkach.
NaCl
C
2
H
5
OH
Pb(NO
3
)
2
HNO
3
A.
koagulacja
denaturacja
peptyzacja
peptyzacja
B.
koagulacja
denaturacja
denaturacja
denaturacja
C.
denaturacja
peptyzacja
peptyzacja
koagulacja
B.
peptyzacja
koagulacja
koagulacja
denaturacja
Zadanie 14. (0 – 1 pkt)
Ścieki miejskie poddane fermentacji dostarczają biogazu o składzie CH
4
, CO
2
, N
2
, H
2
. Gaz ten bywa stosowany
do otrzymywania energii cieplnej. Składniki biogazu dostarczające ciepła podczas spalania to:
A. CH
4
, N
2
B. CH
4
, CO
2
C. CH
4
, H
2
D. N
2
, H
2
Zadanie 15. (0 – 1 pkt)
Procesu eutrofizacji zbiorników wodnych nie powodują:
A. detergenty i nawozy sztuczne
B. katastrofy tankowców i pierwiastki promieniotwórcze
C. środki piorące i mydła
D. ścieki komunalne i metale ciężkie
Zadanie 16. (0 – 1 pkt)
Stężony kwas siarkowy(VI) można przewozić w cysternach wykonanych z metali:
A. żelaza
B. cynku
C. srebra
D. miedzi
Zadanie 17. (0 – 1 pkt)
W wyniku całkowitego uwodornienia trioleinianu glicerolu otrzymano:
A. mydło
B. kwas oleinowy i glicerol
C. tripalmitynian glicerolu
D. tristearynian glicerolu

9
BRUDNOPIS
Wyszukiwarka
Podobne podstrony:
mzm zad roz woj 2006
mzm zad kryt woj pod 2006
mzm zad roz woj 2006
chem fiz 14 11 zad id 111352 Nieznany
chem fiz L chem fiz zad
Chem zad 1 (1), szkoła etc, studia
chem fiz 14 11 zad id 111352 Nieznany
chem fiz 14 11 zad
wm 2011 zad 2
Instrukcja do zad proj 13 Uklad sterowania schodow ruchom
CAD CAM KWPPWPS Zad graf PDF
2009 klucz zad 01 092 u
ALGEBRA zad 2 id 57346 Nieznany (2)
K2 2009 10 zad 2 id 229691
więcej podobnych podstron