
Władysław Walkowiak - Chemia Ogólna WPC 1002w
.
Rozdz. II. Roztwory i stężenia
1 / 15
II. ROZTWORY i STĘśENIA
1.
Roztwór a mieszanina.
Rozpuszczalnik, substancja rozpuszczona,
masa i gęstość roztworu.
Zmieszanie
dwóch
lub
więcej
składników
daje
mieszaninę. Wyróżniamy mieszaniny homo- i heterogeniczne.
Przykłady mieszanin heterogenicznych – skały, mleko.
Tutaj składniki można zidentyfikować gołym okiem lub za
pomocą mikroskopu.
Przykłady
mieszanin
homogenicznych
–
syrop
(mieszanina cukru i wody), sól kamienna rozpuszczona
w wodzie. Tutaj w żaden sposób nie można odróżnić składników
mieszaniny.
Mieszaniny
homogeniczne
noszą
nazwę
roztworów.
Składnik
roztworu
występujący
w
większej
ilości
(b. często woda) to rozpuszczalnik. Pozostałe składniki
roztworu to substancje rozpuszczone. Najczęściej mamy do
czynienia z roztworami wodnymi.

Władysław Walkowiak - Chemia Ogólna WPC 1002w
.
Rozdz. II. Roztwory i stężenia
2 / 15
2. Masa i objętość i gęstość roztworu
m – masa roztworu w kg (g, Mg)
V – objętość roztworu w dm
3
(cm
3
, m
3
)
d – gęstość roztworu w g/cm
3
(kg/dm
3
, Mg/m
3
)
Do obliczeń i przeliczeń stężeń potrzebne są
następujące definicje:
a) gęstość roztworu:
Jednostki: 1g/cm
3
≡≡≡≡
1mg/dm
3
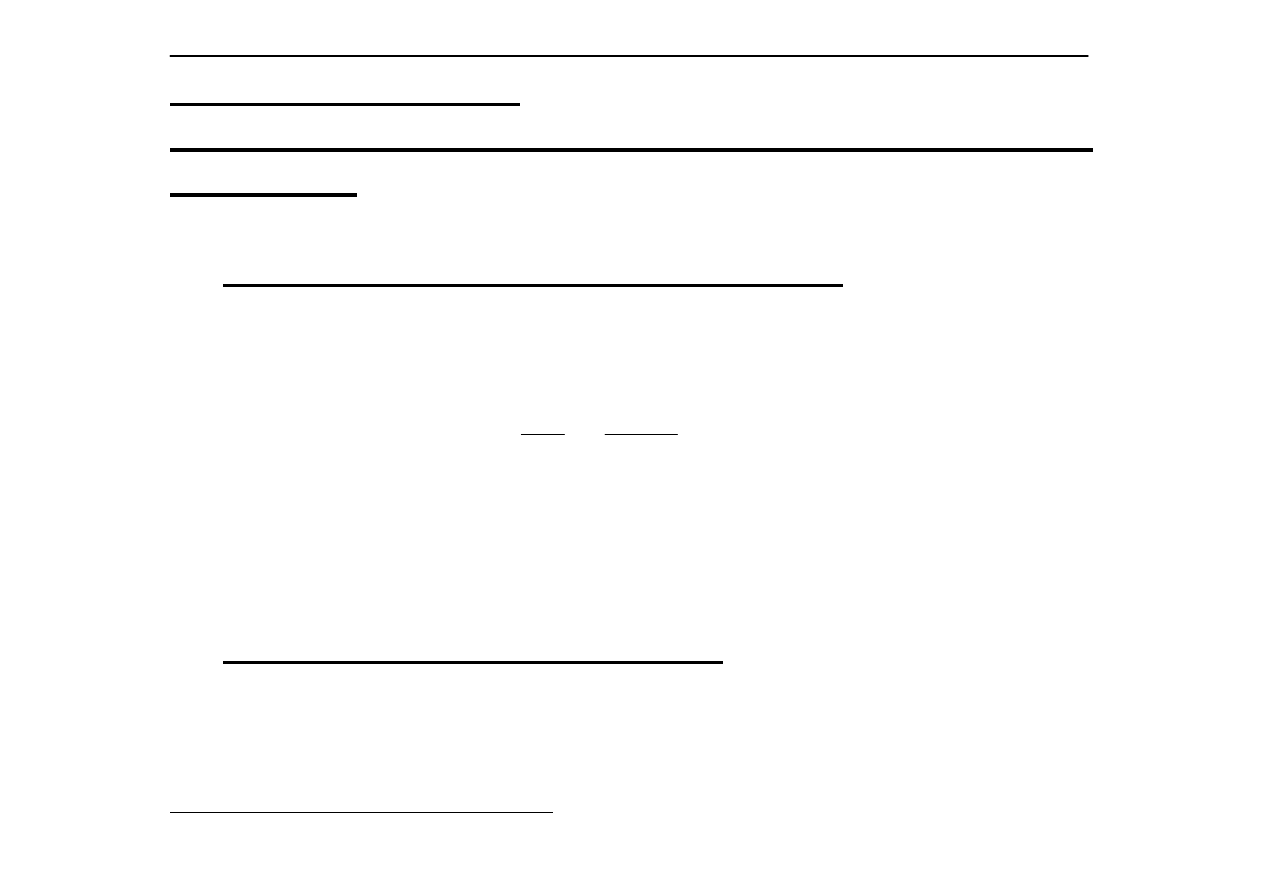
b) liczność i-tego składnika roztworu w molach:
m
i
= masa i-tego
składnika (g)
M
i
= masa molowa i-tego składnika (g/mol)
Uwaga
Indeks i oznacza i-ty składnik roztworu
Wielkość bez indeksu odnosi się do całego roztworu
i
i
i
M
m
n
====
V
m
d
====
Władysław Walkowiak - Chemia Ogólna WPC 1002w
.
Rozdz. II. Roztwory i stężenia
3 / 15
3. Jednostki stężeń
3.1. Ułamek wagowy (masowy). Procent wagowy
(wagowy)
Ułamkiem
wagowym
(masowym)
(w
i
)
i-tego
składnika
nazywamy
stosunek
masy
(m
i
)
tego
składnika do masy całego roztworu (m) :
p
i
(wag) = w
i
⋅⋅⋅⋅
100%
Procent wagowy (masowy) jest równy liczbie
gramów danego składnika w 100g roztworu
UWAGA : wagowy = masowy
1
=
w
m
m
=
m
m
=
w
i
i
i
i
i
ΣΣΣΣ
ΣΣΣΣ

Władysław Walkowiak - Chemia Ogólna WPC 1002w
.
Rozdz. II. Roztwory i stężenia
4 / 15
3.2. Stężenie molowe
Stężenie molowe (c
i
) i-tego składnika w danym
roztworze jest to stosunek liczności (n
i
) tego składnika
do objętości (V) całego roztworu:
1M ≡ 1kmol/m
3
≡ 1mol/dm
3
≡ 1 mmol/cm
3
≡ roztwór
1-molowy ≡ roztwór w którym stężenie danej
substancji wynosi 1 mol/dm
3
dm
mol
V
n
=
c
3
i
i

Władysław Walkowiak - Chemia Ogólna WPC 1002w
.
Rozdz. II. Roztwory i stężenia
5 / 15
3.3. Ułamek molowy. Procent molowy
Ułamek molowy (x
i
) jest to stosunek liczności (n
i
)
danego składnika do sumy liczności wszystkich
składników roztworu:
procent molowy : p
i
(mol) = x
i
⋅⋅⋅⋅
100%
1
i
x
i
n
i
n
i
x
====
ΣΣΣΣ
ΣΣΣΣ
====

Władysław Walkowiak - Chemia Ogólna WPC 1002w
.
Rozdz. II. Roztwory i stężenia
6 / 15
3.4. Procent objętościowy (dla gazów)
dla gazów idealnych: V =
ΣΣΣΣ
V
i
p
i
(obj) = p
i
(mol)
%
100
V
V
)
obj
(
p
i
i
i
⋅⋅⋅⋅
ΣΣΣΣ
====

Władysław Walkowiak - Chemia Ogólna WPC 1002w
.
Rozdz. II. Roztwory i stężenia
7 / 15
3.5. pJ (pH)
c
J
→
→
→
→
stężenie molowe jonu J
c
o
→
→
→
→
stężenie standardowe = 1 mol/dm
3
Dla jonów H
+
i OH
-
:
o
OH
o
H
c
c
log
pOH
c
c
log
pH
−−−−
++++
−−−−
====
−−−−
====
c
o
c
log
-
=
pJ
J

Władysław Walkowiak - Chemia Ogólna WPC 1002w
.
Rozdz. II. Roztwory i stężenia
8 / 15
3.6. ppm
*
i ppb
**
ppm i ppb odnoszą się tak do masy jak i objętości.
W przypadku masy:
a)
1 ppm = 1 część na milion czyli 1 mg substancji
w 1 kg roztworu (mieszaniny)
b)
1 ppb = 1 część na miliard czyli 1
µµµµ
g substancji
w 1 kg roztworu (mieszaniny)
1 ppm = 1000 ppb
*
ppm
≡≡≡≡
parts per million
**
ppb
≡≡≡≡
parts per billion
billion w j. ang. oznacza w j. pol. miliard

Władysław Walkowiak - Chemia Ogólna WPC 1002w
.
Rozdz. II. Roztwory i stężenia
9 / 15
4. Zadania ze stężeń
Zadanie 1 - Stężenie molowe
1,50 g
stopu
zawierającego
60,0
%
aluminium
roztworzono
w
nadmiarze
wodorotlenku
sodu
otrzymując 250 cm
3
roztworu. Oblicz stężenie molowe
glinianu sodu w tym roztworze.
Rozwiązanie:
Aluminium jako metal amfoteryczny roztwarza się
w roztworach wodnych mocnych wodorotlenków:
Al + OH
-
+ 3H
2
O = Al(OH)
4
-
+
3
/
2
H
2
Z tej reakcji wynika, że:
1 Al → 1 Al (OH)
4
-
1 mol Al → 1 mol glinianu
n
Al
= n
Al(OH)4

Władysław Walkowiak - Chemia Ogólna WPC 1002w
.
Rozdz. II. Roztwory i stężenia
10 / 15
Masa aluminium w stopie:
m
Al
= 1,50 g 60,0 g / 100 % = 0,9000 g
Liczność aluminium:
n
Al
= 0,9000 g / 26,98 g/mol = 0,03336 mola
Jest to także liczność glinianu!
Stężenie molowe glinianu:
c = 0,03336 mol / 0,250 dm
3
= 0,1334 mol/dm
3
= 0,133 M

Władysław Walkowiak - Chemia Ogólna WPC 1002w
.
Rozdz. II. Roztwory i stężenia
11 / 15
Zadanie 2 – rozcieńczanie roztworu stężonego
Do 200 cm
3
22,4% -go roztworu HNO
3
o gęstości
1,135 g/cm
3
dodano 1,00 dm
3
wody, otrzymując
roztwór o gęstości 1,025 g/cm
3
. Jakie jest pH?
Rozwiązanie
1)
Obliczamy liczność początkową HNO
3
:
2) Obliczamy objętość końcową roztworu :
mola
0,8068
=
63,02
100
22,4
1,135
200
=
n
⋅⋅⋅⋅
⋅⋅⋅⋅
⋅⋅⋅⋅
cm
1197
=
1,025
1000
+
1,135
200
=
d
m
=
V
3
⋅⋅⋅⋅

Władysław Walkowiak - Chemia Ogólna WPC 1002w
.
Rozdz. II. Roztwory i stężenia
12 / 15
3) Obliczamy stężenie końcowe HNO
3
:
4) Obliczamy pH :
pH = -log[H
+
] = -log 0,6740
⋅⋅⋅⋅
0,1713 = 0,171
dm
mol
0,6740
=
dm
1,197
mola
0,8068
=
c
3
3

Władysław Walkowiak - Chemia Ogólna WPC 1002w
.
Rozdz. II. Roztwory i stężenia
13 / 15
Zadanie 3 – mieszanie roztworów
Zmieszano 100 cm
3
2,00M roztworu H
2
SO
4
o gęstości
1,18
g/cm
3
z
200
cm
3
kwasu
siarkowego
o x
H2SO4
= 0,025 i gęstości 1,12 g/cm
3
.
Oblicz
stężenie
molowe
jonów
wodorowych
w roztworze po zmieszaniu (d = 1,15 g/cm
3
).
Rozwiązanie
1) Obliczamy liczność H
2
SO
4
w pierwszym roztworze :
n = c
⋅⋅⋅⋅
V = 0,100
⋅⋅⋅⋅
2,00 = 0,200 mola
2) Obliczamy masę drugiego roztworu :
m = 200
⋅⋅⋅⋅
1,129 = 225,8 g

Władysław Walkowiak - Chemia Ogólna WPC 1002w
.
Rozdz. II. Roztwory i stężenia
14 / 15
3)
Obliczamy masę H
2
SO
4
w drugim roztworze:
0,01020x = 2,549
⋅⋅⋅⋅
10
-4
x + 0,3133 - 1,387
⋅⋅⋅⋅
10
-3
x
0,01133x = 0,3133
x = 27,65 g
4)
Obliczamy liczność H
2
SO
4
w drugim roztworze:
5) Liczność sumaryczna H
2
SO
4
:
n = 0,2000 + 0,2819 = 0,4819mola
18,02
x
-
225,8
+
98,08
x
98,08
x
=
0,025
mola
0,2819
=
98,08
27,65
=
M
m
=
n

Władysław Walkowiak - Chemia Ogólna WPC 1002w
.
Rozdz. II. Roztwory i stężenia
15 / 15
6)
Obliczamy objętość roztworu końcowego:
7)
Stężenie końcowe H
2
SO
4
:
8) Stężenie końcowe H
+
:
Zakładamy, że kwas siarkowy ulega całkowitej
dysocjacji dwustopniowej:
c = 2 × 1,620
⋅⋅⋅⋅
3,240 = 3,24 mol/dm
3
Koniec rozdz. II-go
cm
297,4
=
1,15
1,12
200
+
1,18
100
=
V
3
⋅⋅⋅⋅
⋅⋅⋅⋅
dm
mol
1,62
=
1,620
=
0,2974
0,4819
=
c
3
Wyszukiwarka
Podobne podstrony:
Wykład 2. Roztwory i stężenia, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wyklad 2. Roztwory i stezenia, Inżynieria środowiska, inż, Semestr I, Chemia ogólna
Wyklad 2. SKP PCHN Roztwory i stężenia studport
2010 Wyklad 2 SKP PCHN Roztwory i stezenia
4 Roztwory i stężenia
9 roztwory-stężenie molowe
Wykład 4 roztwory(1)
Chemia mieszaniny, roztwory, stężenia
Wyklad 9, ROZTWORY
Roztwory i stężenia
4 Roztwory i stężenia klucz
10.roztwory-stężenie procentowe
02 Roztwory i stężenia
więcej podobnych podstron