
CHLOR I JEGO
ZWIĄZKI
Anna Pernal
kl. 1f
Katarzyna
Machowska

Grupa: 17
DANE CHLORU

Chlor jest pierwiastkiem 17 grupy nazywaną grupą
fluorowców. Są to pierwiastki, które na ostatniej powłoce
elektronowej mają po 7 elektronów. Przykładem jest
atom chloru o konfiguracji elektronowej
17
Cl - (2, 8, 7)
Wobec takiej konfiguracji elektronowej, wszystkie mają
tendencję do tworzenia jonów ujemnych a z niektórymi
pierwiastkami jednego wiązania kowalencyjnego.
WYSTĘPOWANI
E
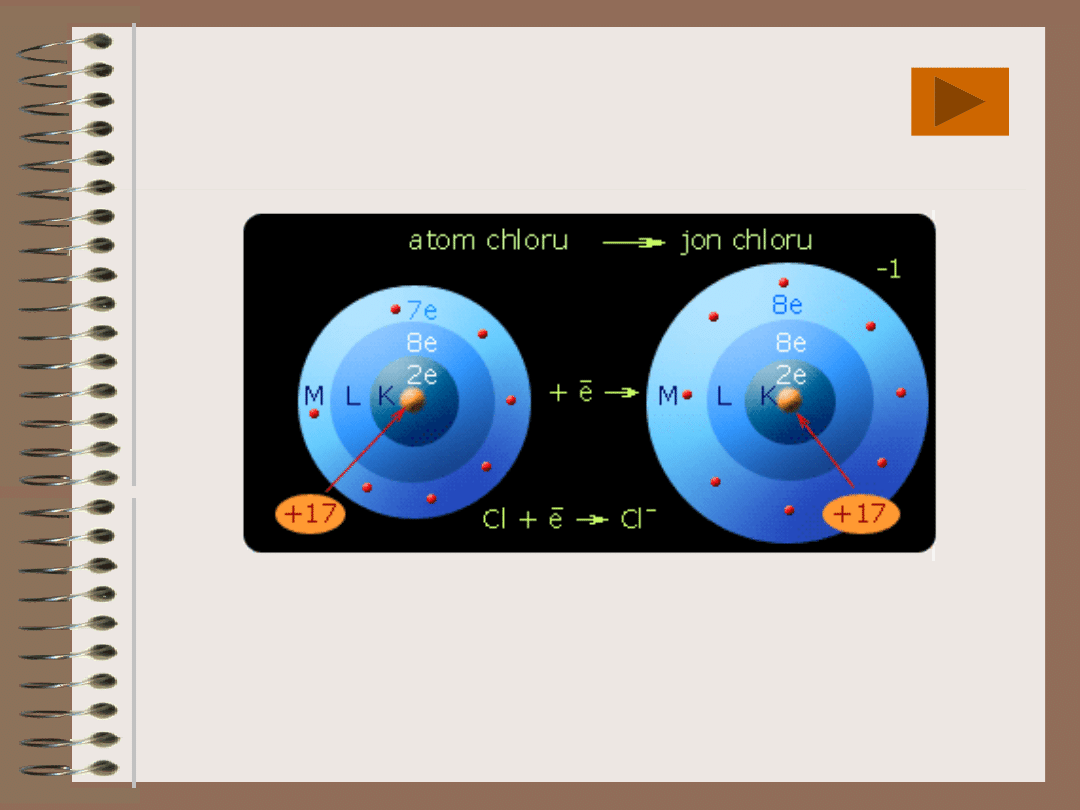
TWORZENIE
JONU
Cl (2, 8, 7) + e ---> Cl
--
(2, 8, 8)
Po przyjęciu elektronu atom chloru uzyskuje
strukturę helowca Ar (2, 8, 8)

TWORZENIE WIĄZANIA
KOWALENCYJNEGO
Chlor, podobnie jak i inne fluorowce należą do
najbardziej reaktywnych pierwiastków.
Chlor reaguje z wodą z utworzeniem chlorowodoru i
kwasu chlorowego(I) (podchlorowy).
Cl
2
+ H
2
O --> HCl + HClO

Chlor w stanie wolnym nie występuje, ale duże ilości
chloru spotykamy w wodzie morskiej, jak również w
złożach soli, które są pozostałością po odparowaniu
starodawnych mórz. W obu przypadkach podstawową
postacią jest chlorek sodowy NaCl. Jest to tzw. sól
kuchenna.
Często złożom soli kamiennej towarzyszą złoża chlorku
potasowego KCl (sylwin) oraz KCl * MgCl
2
* 6H
2
O
(karnalit).
Związki chloru mają duże znaczenie biologiczne. I tak
kwas solny jest składnikiem soku żołądkowego, chlorek
sodu występuje w płynach pozakomórkowych, a chlorek
potasu wewnątrz komórek.
Model chlorku sodu
Chlorek sodu (sól
kuchenna)

W soku żołądkowym znajduje się 0,6 % kwasu solnego,
99 % wody, resztę stanowią białka; pH kwasu
żołądkowego wynosi od 0,9 do 1,5. W żołądku przy
aktywnym udziale kwasu solnego zostaje
zapoczątkowane trawienie białka a ponadto kwaśne
środowisko niszczy bakterie, które dostają się z
pokarmem do żołądka. Jest to obrona organizmu przed
zakażeniem przewodu pokarmowego.
SOK ŻOŁĄDKOWY

CHLOREK SODOWY
W PŁYNIE
POZAKOMÓRKOWY
M
Chlorek sodowy znajdujący sie w płynie
pozakomórkowym organizmów jest zdysocjowany
zgodnie z równaniem chemicznym
NaCl <=> Na
+
+ Cl
-
Kation sodowy Na
+
, który tutaj powstaje jest
odpowiedzialny za prawidłową gospodarkę wodną,
równowagę kwasowo-zasadową i pobudliwość nerwowo-
mieśniową. I właśnie to zapotrzebowanie organizmu na
sód uzupełniamy poprzez spożywanie chlorku sodowego
jako przyprawy.

OTRZYMYWANI
E
Chlor na skalę przemysłową otrzymuje się
przez elektrolizę stopionych chlorków albo wodnych
roztworów chlorków (NaCl).
2NaCl + 2H
2
O --> 2NaOH + Cl
2
+ H
2
2NaCl --> 2Na + Cl
2
W laboratorium chlor można otrzymać w reakcji.
MnO
2
+ 4HCl ---> MnCl
2
+ 2H
2
O + Cl
2

WŁAŚCIWOŚCI
Właściwości fizyczne chloru:
- gaz
- zielonawożółty
- umiarkowanie rozpuszczalny w wodzie
- roztwór wodny, zwany wodą chlorową, jest bezbarwny
Właściwości chemiczne chloru:
- silna trucizna (był użyty jako gaz bojowy)
- ma charakterystyczny, ostry, nieprzyjemny zapach (m.in.
można poczuć go na basenach)
- bardzo reaktywny
- z większością metali tworzy chlorki
- z wodorem tworzy kwasowy wodorek – chlorowodór HCl

Gazowy chlor jest substancją o silnych właściwościach
trujących. Był używany podczas I wojny światowej jako
gaz bojowy.
Chlor reaguje z metalami, a także i z wieloma
niemetalami. W czasie reakcji powstają odpowiednie
chlorki. W mieszaninie z wodorem wystawiony na
działanie promieniowania ultrafioletowego, wybucha.
H
2
+ Cl
2
---> 2HCl
2Na + Cl
2
---> 2NaCl
Chlor w połączeniu z tlenem tworzy szereg kwasów
tlenowych.
Związki chloru z tlenem:
(
HClO, Cl
2
O), HClO
2
, ClO
2
, HClO
3
, (HClO
4
, Cl
2
O
7
)

ZASTOSOWANI
E
chlor w stanie wolnym (Cl

CHLORAN POTASU vs. MISIEK

SPALANIE MIEDZI W GAZOWYM
CHLORZE

REAKCJA SODU Z CHLOREM

DZIĘKUJEMY
ZA UWAGĘ
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
Wegiel i jego zwiazki z wodorem, odpowiedzi IIIg
MATERIAŁ NA CHEMIĘ 'Węgiel i jego związki z wodorem' pojęcia
Odpowiedzi do sprawdzianu Węgiel i jego związki z wodorem C D, Chemia nowej ery 3 ( 2011 - 2012 ) -
Chrom i jego zwiazki
Odpowiedzi do sprawdzianu Węgiel i jego związki z wodorem A B, Chemia nowej ery 3 ( 2011 - 2012 ) -
Węgiel i jego związki z wodorem
Chrom i jego związki
Węgiel i jego związki z wodorem
Mangan i jego związki
Mangan i jego zwiazki
Chrom i jego zwiazki
Krzem i jego związki
06 4 Mangan i jego związki zadania do lekcji nr 2
07 4 Chrom i jego związki zadania do lekcji nr 2
M Smoliński BISKUP KAMIEŃSKI HERMAN VON GLEICHEN I JEGO ZWIĄZKI Z ZAKONAMI KRZYŻOWYMI
Śliwiński Kasztelan krakowski Spycimir z Tarnowa i jego związki genealogiczne z moznowładztwem mało
Schematy najważniejszych reakcji chemicznych, którym ulegają miedź i jego związki chemiczne
Kadm i jego związki w środowisku pracy
więcej podobnych podstron