
Immobilizacja białek na powierzchni cząstek magnetycznych
Przedmowa
Zestaw umożliwia przeprowadzenie reakcji kowalencyjnego wiązania białka na powierzchni magnetycznych cząstek. Pozwala na:
- izolację unikalnych komórek lub białek z roztworu,
- zwiększenie efektywności izolacji w stosunku do tradycyjnie stosowanych metod.
Porównanie metody kowalencyjnego wiązania białek i pasywnej metody adsorpcyjnej:
• Kowalencyjne
wiązanie białka pozwala na związanie powierzchniowo od 20-40% więcej białka niż w przypadku standardowych procedur izolacji.
• Kowalencyjne
wiązanie pozwala na normalizację i ujednolicenie otrzymanych cząstek, z określonym poziomem pokrycia magnetycznych cząstek.
• Kowalencyjne
wiązanie białka podnosi jego stabilność. Po 1 min inkubacji w temp. 56°C ilość IgG kowalencyjnie związana z nośnikiem pozostaje praktycznie niezmienna – około 100%, natomiast w metodzie adsorpcyjnej zostaje związane tylko 50-70%.
• W przypadku immobilizacji małych białek tylko metoda kowalencyjnego wiązania umożliwia immobilizacje ich na powierzchni.
• Białka kowalencyjnie związane na powierzchni magnetycznych cząstek są bardziej odporne na warunki reakcji, zmniejsza się również ilość niespecyficznych reakcji z innymi białkami.
Odczynniki wchodzące w skład zestawu, pozwalają na przeprowadzenie 5 reakcji immobilizacji po 400-600 μg białka, wg poniższej procedury.
Skład zestawu:
Magnetyczne cząstki, 50 mg/mL
1 mL
Bufor fosforanowy, 0.1 M, pH 7.4
10 mL
Aldehyd glutarowy, 50%
5 mL
Azydek
sodu,
1%
200
μl
Bufor terminujący
5 mL
Bufor
dla
immobilizacji
5
mL
Woda
destylowana
10
mL
Przechowywanie: +4 °C
NOVAZYM POLSKA ul. Żywokostowa 23, 61-680 Poznań tel. +48 61 825 95 99 fax +48 61
825 95 98 Informacje i zamówienia: info@novazym.com Zapraszamy na nasze forum dyskusyjne:
www.novazym.ehost.pl

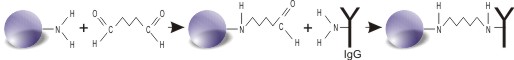
Protokół immobilizacji:
(Opisana procedura w protokole reakcji obliczona jest przede wszystkim dla immobilizacji immunoglobulin IgG. Wykorzystanie protokołu w celu immobilizacji innych białek niż immunoglobuliny może wymagać optymalizacji metody pod względem ilości użytego białka.) Magnetyczne
Aldehyd
Magnetyczne cząstki
Ligand
Magnetyczne cząstki
cząstki
glutarowy
z aktywnym
z dostępną
z ligandem, unieruchomionym
aldehydem
grupą aminową
przez wiązanie aminowe
glutarowym
na powierzchni
(np.IgG)
1.
Do 2 mL probówki dodać następujące składniki reakcji (magnetyczne cząstki przed użyciem dokładnie zwiesić w roztworze):
- woda destylowana
50 μl
- 0.1 M bufor fosforanowy, pH 7,4
250 μl
- aldehyd glutarowy, 50%
500 μl
- magnetyczne cząstki, 50 mg/mL
200 μl
Dokładnie wymieszać zawartość probówki przez pipetowanie.
2. Inkubować probówkę w czasie 3 godz., w temperaturze pokojowej i przy stałym mieszaniu. *
3. Przygotować 3 mL 0,025 M buforu fosforanowego do przemywania magnetycznych cząstek (2250 μl wody destylowanej + 750 μl 0,1 M buforu fosforanowego).
4. Ulokować probówkę z magnetycznymi cząstkami w statywie, aby pozwolić na ich sedymentację pod wpływem działania magnezu; następnie zlać supernatant.
5. Wykorzystując magnetyczny statyw przemyć cząstki 3-krotnie stosując po 1 mL 0,025M
buforu fosforanowego.
6.
W nowej 2 mL probówce przygotować roztwór białka przez rozpuszczenie 500 μg białka w 500 μl buforu do immobilizacji. Pobrać 10 μl przygotowanego roztworu do oddzielnej probówki dla pomiaru efektywności procesu immobilizacji.
7.
Do probówki z magnetycznymi cząstkami dodać 250 μl wody destylowanej i 250 μl 0,1 M
buforu fosforanowego. Dokładnie wymieszać zawartość probówki przez pipetowanie.
8. Przenieść zawiesinę poddanych działaniu aldehydu glutarowego magnetycznych cząstek do probówki z unieruchomionym białkiem. Dokładnie wymieszać zawartość probówki poprzez pipetowanie.
9. Inkubować probówkę w czasie 2 godzin, w temperaturze pokojowej i przy stałym mieszaniu.*
Po zakończeniu inkubacji ulokować probówkę w magnetycznym statywie, a następnie po sedymentacji cząstek pobrać 20 μl supernatantu w celu dalszego pomiaru efektywności immobilizacji.
10.
Do probówki dodać 500 μl buforu terminującego w celu zablokowania nieużywanych, ale ciągle aktywnych grup na powierzchni magnetycznych cząstek.
11. Inkubować probówkę następne 2 godziny w temperaturze pokojowej i przy stałym mieszaniu.* Po inkubacji ulokować probówkę z magnetycznymi cząstkami w statywie, możliwie najdokładniej zlać supernatant. Dodać 1 mL buforu PBS i dokładnie zmieszać zawartość probówki przez pipetowanie.
12. Ponownie
ulokować probówkę z magnetycznymi cząstkami w statywie, możliwie najdokładniej zlać supernatant. Powtórzyć 5-krotnie przemywanie cząstek przy pomocy PBS.
Po zakończeniu płukania zawiesić cząstki w 1 mL buforu PBS. Dodać 20 μl 1% azydku sodu w celu eliminacji ryzyka przypadkowego zakażenia.
NOVAZYM POLSKA ul. Żywokostowa 23, 61-680 Poznań tel. +48 61 825 95 99 fax +48 61
825 95 98 Informacje i zamówienia: info@novazym.com Zapraszamy na nasze forum dyskusyjne:
www.novazym.ehost.pl

Dodatkowa informacja
Mieszanie cząstek
* Mieszanie nie powinno być zbyt intensywne. Nie zaleca się wykorzystania worteksu lub ultradźwięków do mieszania cząstek magnetycznych. W przypadku braku mieszadła można regularnie (w przybliżeniu, co ok. 5-10 min.) odwracać probówkę.
Ilość aldehydu glutarowego
Etap z aldehydem glutarowym jest kluczowy dla procesu immobilizacji białka i warunkuje optymalną wydajność reakcji immobilizacji białka na powierzchni cząstek magnetycznych.
Zbyt mała ilość aldehydu prowadzi do powstania krzyżowych reakcji pomiędzy grupami aktywowanymi i tymi, które nie zostały aktywowane. Ilość dodanego aldehydu glutarowego powinna wystarczyć do pełnego nasycenia powierzchni cząstek magnetycznych. Bardzo ważny jest również sposób, w jaki podaje się ligand. Jeżeli nie jest to przeprowadzone optymalnie, efektywność immobilizacji raptownie obniża się.
NOVAZYM POLSKA ul. Żywokostowa 23, 61-680 Poznań tel. +48 61 825 95 99 fax +48 61
825 95 98 Informacje i zamówienia: info@novazym.com Zapraszamy na nasze forum dyskusyjne:
www.novazym.ehost.pl
Wyszukiwarka
Podobne podstrony:
Immobilizacja białek na powierzchni cząstek magnetycznych
45Załamania światła na powierzchni sferycznej
4 Co to są linie poślizgu widoczne na powierzchni próbki ze stali GX120Mn13
20 Wykonywanie powłok antykorozyjnych na powierzchniach metalu
Biofilm, tworzenie płytki bakteryjnej na powierzchni zębów
prezentacyja, thl teren, A1 Pomiar drzew na powierzchni:
Fundamenty - cz.1, Płyty fundamentowe na powierzchni gruntu, Płyty fundamentowe na powierzchni grunt
Niesamowite odkrycie! Czym jest tajemnicza baza na powierzchni Marsa, W ஜ DZIEJE ZIEMI I ŚWIATA, ●tx
Chemia labolatorium, Korozja, Korozja - szkodliwe działanie chemiczne lub elektrochemiczne na powier
Badanie wpływu właściwości materiałów magnetycznych na reluktancję obwodu magnetycznego
Na powierzchni Marsa jest między innymi woda. Curiosity rozwiał wszelkie wątpliwości, PAMIĘTNIK
Redukcja na powierzchnię odniesienia
Na powierzchni skrzyni widać otworki po kornikach, meble
4 5 Redukcja pomiarów na powierzchnię odwzorowawczą
Elektroforeza białek na żelu poliakrylamidowym w układzie Laemmli’ego oraz blotting białek na membra
PYTANIA, Technik górnictwa podziemnego, wpływ robót górniczych na powierzchnie
astro, Nawigacja - 5-12 - Współrzędne geograficzne rzutu cn na powierzchnię kuli ziemskiej; AKP, alp
Ściąga 1 z Wykładów z Gleboznawstwa, Gleboznawstwo- dziedzina nauk przyrodniczych zajmująca się gene
więcej podobnych podstron


