WYZNACZANIE CZĄSTKOWYCH OBJĘTOŚCI MOLOWYCH W UKŁADACH ETANOL - WODA I KCl - WODA
Jeżeli Z oznacza dowolną wielkość ekstensywną, której charakterystyczną własnością jest to, że przy stałej temperaturze, ciśnieniu i składzie jest ona proporcjonalna do masy roztworu
[Z = U (energia wewnętrzna), H (entalpia), F (energia swobodna), G (entalpia swobodna), S (entropia), V (objętość), Cp (pojemność cieplna przy stałym ciśnieniu), Cv (pojemność cieplna przy stałej objętości)], to będzie ona zależeć od takich parametrów zewnętrznych jak ciśnienie (p) i temperatura (T), oraz od liczby moli składników układu (ni):
Z = Z (T, p, n1, n2, .....) (1)
Dla układu dwuskładnikowego, różniczka zupełna tej funkcji ma postać:
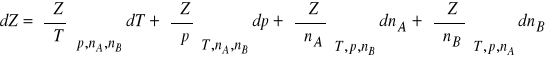
(2)
W stałej temperaturze i pod stałym ciśnieniem równanie (2) przechodzi w wyrażenie
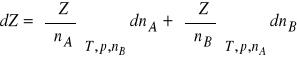
(3)
Zgodnie z teorematem Eulera o funkcjach homogenicznych, dla funkcji n-tego stopnia mamy
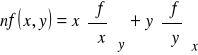
(4)
dlatego też, równanie (3) można zapisać w formie
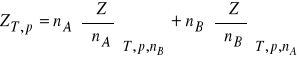
(5)
Wyrażenie 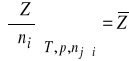
, będące pochodną ekstensywnej wielkości względem liczby moli składnika i, przy ustalonych warunkach zewnętrznych oraz liczbach moli pozostałych składników, nazywa się cząstkową wielkością molową i-tego składnika układu. Równanie (5) można więc zapisać w postaci
![]()
(6)
Jedną ze zmiennych wielkości ekstensywnych opisujących stan układu jest objętość (V). Zgodnie z wcześniejszymi rozwiązaniami, sumaryczna objętość układu dwuskładnikowego, złożonego z rozpuszczalnika (A) i substancji rozpuszczonej (B), w stałej temperaturze (T) i pod stałym ciśnieniem (p), jest sumą iloczynów liczby moli i cząstkowych objętości molowych obu składników
![]()
(7)
gdzie:
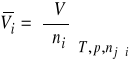
(8)
Cząstkowa objętość molowa czystej substancji jest równa jej objętości molowej: ![]()
.
Cząstkowe objętości molowe mogą przyjmować wartości ujemne. Na przykład graniczna cząstkowa objętość molowa MgSO4 w wodzie (w granicznym zerowym stężeniu) wynosi
-1,4 cm3 . mol-1 co oznacza, że dodatek 1 mola MgSO4 do dużej ilości wody spowoduje zmniejszenie jej objętości o 1,4 cm3. Zmniejszenie objętości jest wynikiem wiązania wody przez jony soli (hydratacja) co powoduje nieznaczne ściśnięcie jej stuktury.
Ponieważ nie można bezpośrednio mierzyć cząstkowych objętości molowych składników roztworu, do ich wyznaczania stosuje się metody oparte na pomiarze całkowitej objętości roztworu (bezpośredni pomiar objętości, albo pomiar gęstości roztworu). Poniżej opisane zostaną dwie metody wyznaczania objętości molowych: metoda pozornej objętości i metoda graficzna.
Metoda pozornej objętości
Jeżeli przez ![]()
oznaczymy objętość 1 mola czystego rozpuszczalnika, to aby otrzymać poprawną wartość całkowitej objętości roztworu V w miejsce całkowitej objętości molowej substancji rozpuszczonej (![]()
w równaniu (7)) musimy wstawić tzw. objętość pozorną ![]()
![]()
(9)
stąd
![]()
(10)
Różniczkując równanie (9) względem liczby moli substancji rozpuszczonej (![]()
) otrzymujemy równanie na cząstkową objętość molową substancji rozpuszczonej
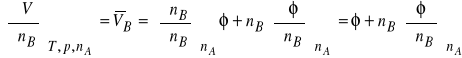
(11)
Cząstkową objętość molową rozpuszczalnika (![]()
) można obliczyć z równania (7)
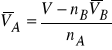
(12)
Wartość pochodnej 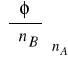
wyznaczamy metodą graficzną, korzystając z doświadczalnie wyznaczonej zależności ![]()
w funkcji ![]()
.
Posługując się stężeniami molalnymi m roztworów (stężenie molalne - liczba moli danej substancji zawarta w 1000 g rozpuszczalnika), można przyjąć, że liczba moli substancji rozpuszczonej ![]()
, natomiast liczba moli wody wynosi
![]()
zatem całkowita objętość roztworu wynosi
![]()
(13)
Analogicznie do powyższego równania możemy zapisać równanie (9) w postaci
![]()
(14)
gdzie ![]()
(![]()
- masa cząsteczkowa wody, ![]()
- gęstość wody w danej temperaturze).
Pozorną objętość ![]()
substancji rozpuszczonej określa równanie:
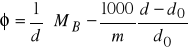
(15)
gdzie: d - gęstość roztworu,
![]()
- masa cząsteczkowa substancji rozpuszczonej,
wynikające z podstawienia do równania (10) następujących zależności: ![]()
, ![]()
, ![]()
, ![]()
i wykonania niewielkich przekształceń.
Różniczkując równanie (14) względem liczby moli ![]()
substancji rozpuszczonej w roztworze otrzymujemy równanie na cząstkową objętość molową ![]()
tej substancji w roztworze o stężeniu molalnym m
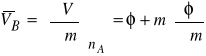
(16)
Podstawiając do równania (12) równanie (16) i uwzględniając, że ![]()
a liczba moli wody wynosi ![]()
otrzymamy równanie na cząstkową objętość molową wody
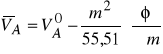
(17)
Ponieważ dla roztworów elektrolitów istnieje liniowa zależność ![]()
od ![]()
, można korzystając z zależności
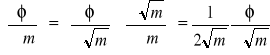
(18)
przekształcić równania (16) i (17) do postaci
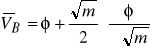
(19)
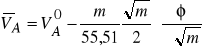
(20)
według których z danych doświadczalnych można wyznaczyć cząstkowe objętości molowe substancji rozpuszczonej i rozpuszczalnika (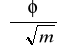
jest współczynnikiem kierunkowym prostej ![]()
).
Metoda graficzna
Metoda ta jest szczególnie przydatna dla układów dwóch cieczy mieszających się w całym zakresie stężeń. Wyznaczając dla takiego układu krzywą zależności objętości molowej V (![]()
, gdzie Vr jest całkowitą objętością roztworu) od ułamka molowego ![]()
(rys. 1.), można w dowolnym punkcie krzywej narysować styczną, co pozwoli obliczyć cząstkowe objętości molowe składników roztworu.
Równanie stycznej w punkcie a ma postać:
![]()
(21)
Z równania (21) wynika, że dla ![]()
, punkt przecięcia stycznej z osią rzędnych wyznacza cząstkową objętość molową składnika A 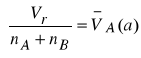
w mieszaninie o ułamku molowym ![]()
, natomiast dla ![]()
, przecięcie stycznej z osią rzędnych wyznacza objętość molową składnika B 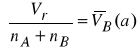
.
Zagadnienia do opracowania
1. Cząstkowe wielkości molowe.
2. Metody wyznaczania cząstkowej objętości molowej.
3. Metody pomiaru gęstości cieczy.
Literatura
1. Atkins P. W., Podstawy chemii fizycznej, WN PWN, Warszawa 1999, str. 161-163
2. Atkins P. W., Chemia fizyczna, Wn PWN, Warszawa 2001, str. 154-159.
2. Chemia fizyczna. Praca zbiorowa, PWN, Warszawa 1980, str. 563-567.
3. Sobczyk L., Kisza A., Gatner K., Koll A., Eksperymentalna chemia fizyczna, PWN, Warszawa 1982, str. 236-244.
Aparatura
Gęstościomierz (densitometr) lub piknometr i waga analityczna, szkło laboratoryjne.
Odczynniki
1,5 m KCl, alkohol etylowy absolutny.
Wykonanie ćwiczenia
1. Przygotować dwie serie roztworów mieszając podane w tabelkach objętości 1,5 m KCl z wodą i alkoholu etylowego absolutnego z wodą.
2. Po dokładnym zmieszaniu roztworów i ustabilizowaniu temperatury, zmierzyć ich gęstości.
3. Wyniki pomiarów zebrać w tabeli 1 i 2.
Tabela 1
lp |
[cm3] |
[cm3] |
dr [g/cm3] |
ma [g] |
mw [g] |
[cm3] |
na
|
nw |
xa = na/(na+nw) |
|
|
|
1 |
0 |
H2O |
|
|
|
|
|
|
|
|
|
|
2 |
3 |
9,5 |
|
|
|
|
|
|
|
|
|
|
3 |
5,5 |
7 |
|
|
|
|
|
|
|
|
|
|
4 |
7 |
5,5 |
|
|
|
|
|
|
|
|
|
|
5 |
8,5 |
4 |
|
|
|
|
|
|
|
|
|
|
6 |
9,5 |
3 |
|
|
|
|
|
|
|
|
|
|
7 |
10,5 |
2 |
|
|
|
|
|
|
|
|
|
|
8 |
11 |
1,5 |
|
|
|
|
|
|
|
|
|
|
9 |
11,5 |
1 |
|
|
|
|
|
|
|
|
|
|
10 |
12 |
0,5 |
|
|
|
|
|
|
|
|
|
|
11 |
alk |
0 |
|
|
|
|
|
|
|
|
|
|
Tabela 2
lp |
V1,5 m KCl [cm3] |
Vw [cm3] |
m [mol/kg] |
|
c [mol/dm3] |
dr [g/cm3] |
|
|
|
1 |
0 |
H2O |
|
|
|
|
|
|
|
2 |
0,75 |
24,25 |
|
|
|
|
|
|
|
3 |
2,5 |
22,5 |
|
|
|
|
|
|
|
4 |
5 |
20 |
|
|
|
|
|
|
|
5 |
10 |
15 |
|
|
|
|
|
|
|
6 |
15 |
10 |
|
|
|
|
|
|
|
7 |
KCl |
0 |
|
|
|
|
|
|
|
Opracowanie wyników
1. Obliczyć wartości ![]()
(tabela 1) (![]()
i ![]()
jest liczbą moli alkoholu i wody w
mieszaninie) wiedząc, że ![]()
.
2. Obliczyć ułamki molowe alkoholu etylowego (![]()
) w każdej mieszaninie.
3. Narysować wykres zależności V w funkcji ułamka molowego alkoholu etylowego.
4. Kreśląc styczne do krzywej w punktach pomiarowych, wyznaczyć cząstkowe objętości molowe alkoholu etylowego i wody.
Uwaga:
Cząstkowe objętości molowe można również wyznaczyć na podstawie wykresu zależności objętości właściwej ![]()
od ułamka wagowego etanolu ![]()
. Styczna do wykresu w punkcie odpowiadającym interesującemu nas ułamkowi wagowemu odcina na osiach rzędnych wartości odpowiadające cząstkowym objętościom właściwym wody i etanolu. Aby uzyskać cząstkowe ojętości molowe należy te wielkości pomnożyć przez odpowiednie masy cząsteczkowe.
5. Cząstkowe objętości molowe możemy obliczyć matematycznie stosując następującą procedurę:
a) opisać zależność ![]()
równaniem 2-giego stopnia: ![]()
(skorzystać np. z programu Microsoft Excel)
b) obliczyć wartość pochodnej 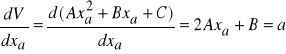
dla różnych wartości ułamka molowego alkoholu. Obliczone wartości a są równe tangensowi nachylenia prostej ![]()
, stycznej do krzywej ![]()
w punkcie ![]()
c) znając wartość Z w punkcie ![]()
oraz współczynnik kierunkowy prostej a obliczyć wolny wyraz b z równania stycznej: ![]()
d) znając wartości a i b mamy równanie stycznej przy określonej wartości ułamka molowego alkoholu ![]()
, skąd popodstawieniu ![]()
obliczamy cząstkową objętość molową wody, natomiast podstawiając ![]()
znajdujemy cząstkową objętość molową alkoholu.
6. Obliczyć pozorne objętości molowe (![]()
) dla roztworów KCl (równanie (15)).
7. Narysować wykres funkcji ![]()
(linia prosta) i wyznaczyć współczynnik kierunkowy prostej 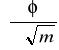
.
8. Z równań (19) i (20), obliczyć cząstkowe objętości molowe wody i KCl. Dla wody
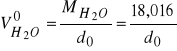
.
9. Wykreślić zależność cząstkowej objętości molowej KCl (![]()
) w zależności od ![]()
. W celu przeliczenia stężeń molarnych na stężenia molowe stosujemy wzór:
![]()
Ekstrapolując prostą do zerowej wartości ![]()
otrzymujemy cząstkową objętość molową elektrolitu w rozcieńczeniu nieskończenie wielkim.
Dyskusja wyników
1. Podać podstawowe różnice pomiędzy metodą graficzną wyznaczania cząstkowych objętości molowych a metodą pozornej objętości.
2. Porównać wyznaczone różnymi metodami wartości cząstkowych objętości molowych alkoholu etylowego i wody i ocenić dokładność tych metod.
3. Zinterpretować sens parametrów prostej ![]()
(nachylenie prostej i wolny wyraz), uzyskanej dla układu woda-KCl.
Uzupełnienie
METODA POZORNEJ OBJĘTOŚCI
Metoda pozornej objetości jest wykorzystywana między innymi do wyznaczenia molowych objętości cząstkowych elektrolitów.
Oznaczmy jaki ![]()
objętość molową czystego rozpuszczalnika A. W celu wyrażenia objętości roztworu posłużymy się równaniem
V = nA ![]()
+ nB φ (1)
w którym φ oznacza pozorną objętość molową substancji rozpuszczonej B.
Objętość molową roztworu, V, obliczymy dzieląc objętość roztworu, Vr ,przez sumę liczby moli składników:
Dane doświadczalne:
d0 - gęstość rozpuszczalnika [g/cm3] (w ćwiczeniu - woda)
d - gęstość roztworu [g/cm3] (w ćwiczeniu - KCl)
VA, VB - objętości składników A i B użyte do sporządzenia roztworów
Wzory do obliczeń:
![]()
Molarność roztworu m
![]()
Ustalamy liczbę moli rozpuszczalnika ![]()
oraz liczbę moli substancji rozpuszczonej nB = m
Obliczamy objętość roztworu jako
1. Obliczanie objętości pozornej na podstawie pomiarów gęstości.
Na podstawie równania (1)
V = nA ![]()
+ nB φ
wyliczamy objętość pozorną:
![]()
(2)
Podstawiamy za nB wartość m i otrzymujemy
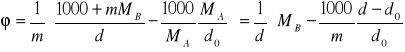
(3)
Równanie (3) umożliwia wyznaczenie pozornej objętości molowej elektrolitu w roztworach o różnych molarnościach na podstawie pomiarów gęstości roztworów i czystego rozpuszczalnika.
2. Obliczenie cząstkowej objętości molowej ![]()
.
Zgodnie z definicją molowej wielkości cząstkowej
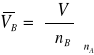
Aby uzyskać ![]()
, różniczkujemy równanie (1)
V = nA ![]()
+ nB φ,
względem liczby moli substancji rozpuszczonej B.
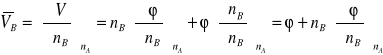
Dla nB = m otrzymujemy
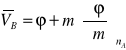
(4)
3. Obliczanie cząstkowej objętości molowej ![]()
Korzystamy ze wzoru
V = nA ![]()
+ nB ![]()
, (5)
zgodnie z którym
![]()
(6)
Podstawiając do tego wzoru
nA = m ,
V = nA ![]()
+ m φ,
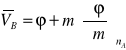
otrzymujemy
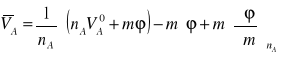
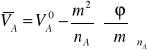
(7)
Dla wody jako rozpuszczalnika
![]()
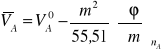
(8)
4. Wyznaczenie zależności objętości pozornej od stężenia.
Zarówno pozorne jak i cząstkowe objętości molowe elektrolitów są proporcjonalne do pierwiastka kwadratowego ze stężenia:
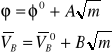
(9)
gdzie: ![]()
- pozorna objętość molowa w rozcieńczeniu nieskończenie wielkim,
![]()
- cząstkowa objętość molowa w rozcieńczeniu nieskończenie wielkim.
![]()
Stałe A i B zależą od temperatury, wartościowości jonów, przenikalności dielektrycznej i współczynnika ściśliwości roztworu.
Równania (9) można uzasadnić korzystając z granicznego prawa Debye'a Huckela.
Cząstkowa objętość molowa rozpuszczalnika w roztworze, ![]()
, jest różna od cząstkowej objętości molowej rozpuszczalnika w czystym rozpuszczalniku, ![]()
, która odpowiada objętości jednego mola wody w czystej wodzie.
Posługując się zależnościami
V = nA ![]()
+ nB ![]()
oraz V = nA ![]()
+ nB φ,
należy pamiętać, że ![]()
ponieważ ![]()
![]()
.
Jednakże w granicy
![]()
. (10)
Ze względu na liniową zależność φ od ![]()
dla elektrolitów, w dalszych obliczeniach pochodną 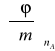
wyraża się jako
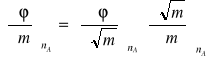
Ponieważ
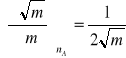
ostatecznie otrzymujemy
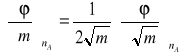
(11)
Molowe objętości cząstkowe można będzie więc obliczyć na podstawie równań:
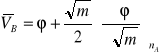
(12)
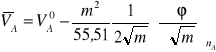
(13)
Wartość pochodnej 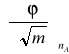
wyznaczymy z wykresu liniowej zależności φ od ![]()
.
Cząstkowe objętości molowe soli są funkcjami stężenia roztworów (![]()
). Można je ekstrapolować do nieskończonego rozcieńczenia, kiedy nie obserwuje się oddziaływań miedzy jonami, otrzymując wartości cząstkowych objętości molowych elektrolitów w rozcieńczeniu nieskończenie wielkim.
Wartości ![]()
są związane z właściwościami solwatowanych jonów i ich wpływem na strukturę wody. ![]()
dla wybranych elektrolitów w roztworach wodnych w temp. 25oC zestawiono poniżej.
Elektrolit ![]()
[cm3] Elektrolit ![]()
[cm3]
NaCl 16,6 KF 6,6
NaBr 23,5 KCl 26,8
NaJ 35,1 KBr 33,5
KF 6,6 KJ 45,3
Na2SO4 11,5 AgNO3 28,0
Analiza wartości cząstkowych objętości molowych wody, ![]()
, pozwala z kolei na ocenę wpływu jonów na strukturę wody. Można wyróżnić elektrolity rozluźniające lub „ściskające” strukturę lub nie wywierające na nią zasadniczego wpływu.
METODA GRAFICZNA
Metoda graficzna jest wykorzystywana do wyznaczenia molowych objętości cząstkowych składników mieszanin ciekłych w całym zakresie stężeń, wyrażonych w ułamkach molowych.
Rozważmy dwuskładnikowy roztwór złożony z substancji A i B, które wykazują pełną mieszalność.
Przykładem takiego układu jest mieszanina wody i alkoholu etylowego.
W celu wyrażenia objętości roztworu, Vr, posłużymy się równaniem
Vr = nA ![]()
+ nB ![]()
(1)
Objętość molową roztworu, V, obliczymy dzieląc objętość roztworu, Vr ,przez sumę liczby moli składników:
![]()
(2)
Dane doświadczalne:
dA , dB - gęstości czystych cieczy A i B [g/cm3]
dr - gęstość roztworu [g/cm3]
VA, VB - objętości składników A i B użyte do sporządzenia roztworów
Wzory do obliczeń:
Obliczanie molowych objętości cząstkowych na podstawie pomiarów gęstości.
Załóżmy, ze zależność objętości molowej roztworu, V, od ułamka molowego, xB, można opisać funkcją
![]()
(3)
czyli
![]()
(4)
Dla danego xB możemy wykreślić styczną do tej krzywej, opisaną równaniem
![]()
(5)
Współczynnik kierunkowy stycznej (wartość a) obliczamy różniczkując objętość względem xA.
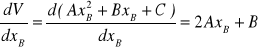
Mamy zatem
![]()
(6)
Dla wybranego ![]()
istnieje jeden punkt, dla którego V = Z
![]()
Z ostatniego równania obliczamy b (wyraz wolny w równaniu stycznej):
![]()
(7)
Dla ![]()
mamy też zależność
![]()
(8)
Znajomość parametrów A, B, C pozwala na obliczenie parametrów stycznej.
Równanie stycznej ![]()
odpowiada zależności
![]()
(9)
Stąd
![]()
(10)
![]()
(11)
![]()
(12)
Podsumowanie.
Obliczanie cząstkowych objętości molowych przebiega w następujących etapach:
1. dopasowanie zależności objętości molowej roztworu od ułamka molowego alkoholu (na przykład wielomian drugiego stopnia, ![]()
),
2. wyliczenie parametrów stycznej, ![]()
, do wykresu V=V(x2) dla określonych ułamków molowych etanolu,
![]()
oraz ![]()
3. obliczenie ![]()
oraz ![]()
na podstawie równań
![]()
![]()
Przykład
Dla układu woda-alkohol etylowy otrzymano dopasowanie
y=3.54x2 + 35.68x + 18.014
czyli
![]()
1. ![]()
= 0.402
a = 38.526
b = 17.44
![]()
= 17.44
![]()
= 55.966
2. ![]()
= 1 (czysty etanol)
a = 42.76
b = 14.47
![]()
= 14.47
![]()
= 57.23
3. ![]()
= 0 (czysta woda)
a = 35.68
b = 18.01
![]()
= 18.01
![]()
= 53.69
Komentarz
Należy przeanalizować problem zależności objętości molowych składników od stężenia.
14
![]()
[cm3/mol]
xB
0
0,5
1,0
![]()
![]()
![]()
Rys. 1. Metoda graficznego wyznaczania cząstkowych objętości molowych
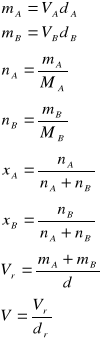
![]()
![]()
![]()
![]()
![]()
Wyszukiwarka
Podobne podstrony:
WYZNACZANIE CZĄSTKOWYCH OBJĘTOŚCI MOLOWYCH W UKŁADACH ETANOL-WODA I KCL-WODA, NAUKA, WIEDZA
nemś, Termodynamika L, Wyznaczenie objętości właściwej roztworu i cząstkowych objętości właściwych s
,wentylacja i pożary, Wyznaczanie strumieni objętości powietrza potrzebnych do przewietrzenia
SPRAWOZDANIE Metalografia ilościowa – wyznaczanie udziałów objętościowych?z stopu za pomocą metody w
rosiek, wentylacja i pożary L, Wyznaczanie strumienia objętości i strumienia masy powietrza w wyrobi
5 cząstkowe objętości molowe
cząstkowe objętości, chemia fizyczna, Nowy folder, zalaczniki
5 cząstkowe objętości molowe
Cw 3Wyznaczanie objetosci czastkowych molowych
wyznaczanie cz▒stkowych objŕtoÂci molowych
Wyznaczanie współczynnika rozszerzalności liniowej i objętościowej, Fizyka
Wyznaczanie niezbędnego strumienia objętości powietrza do pr
07 Metody wyznaczania objetosci mas ziemi
Srumień objetości powietrza wyznaczenie wspolczynnika coriolosa, mechanika plynów
ćw # Wyznaczanie nadmiaru molowej objętości mieszania dla układu dwuskładnikowego
(Srumien objetosci powietrza wyznaczenie wspolczynnika coriolosa)
Wyznaczanie objętości nadmiarowych, Studia, Politechnika
Wyznaczanie współczynnika rozszerzalności liniowej i objętościowej ciał stałych, Fizyka
więcej podobnych podstron