Nr grupy: 32 Zespół 2 |
ĆWICZENIE NR 4 |
Data: 03-11-1998 |
Agnieszka Bobak Andrzej Kozioł Arkadiusz Krochmal |
Wyznaczanie powierzchni właściwej adsorbenta metodą BET |
Ocena: |
WSTĘP TEORETYCZNY
Adsorpcja - to zagęszczanie się substancji zwanej adsorbatem na powierzchni innej substancji zwanej adsorbentem stanowiącej odrębną fazę.
Najczęściej występuje adsorpcja gazów, par, substancji rozpuszczonej na powierzchni ciała stałego. Może być procesem odwracalnym (desorpcja), co ma zastosowanie do oczyszczania lub rozdzielania mieszanin gazów lub cieczy.
Wśród adsorpcji wyróżniamy:
adsorpcję chemiczną - chemisorpcja - polegająca na tworzeniu się wiązań chemicznych między adsorbatem a adsorbentem,
adsorpcję fizyczną - polegającą na oddziaływaniach międzycząsteczkowych, tzw. sił van der Waalsa, między substancją zaabsorbowaną a absorbentem.
Zdolność adsorpcyjna ciał stałych zależy od ich natury oraz od stopnia rozwinięcia powierzchni, tj. od ilości, rozmiarów i kształtów porów występujących w jednostce masy ciała.
Gazy i pary są na ogół tym chciwiej adsorbowane przez jeden i ten sam adsorbent im niższa temperatura adsorbenta w równowadze z adsorbowanym gazem, wyższe ciśnienie cząstkowe adsorbatu, wyższy ciężar cząsteczkowy adsorbatu oraz wyższa temperatura krytyczna adsorbatu, tzn. im łatwiej ulega on skropleniu.
Badanie procesu adsorpcji polega najczęściej na wyznaczeniu zależności między ilością gazu zaadsorbowanego przez daną masę adsorbentu a ciśnieniem gazu. Pomiary takie dokonuje się zwykle w stałej temperaturze a wyniki przedstawia się graficznie w postaci tzw. izotermy adsorpcji.
PRZEBIEG ĆWICZENIA
Wyznaczamy ciśnienie równowagowe par eteru dietylowego nad adsorbentem, którym jest węgiel aktywny. Ilość wprowadzonego adsorbatu określa się przy pomocy mikrobiuretki dozującej. Wyznaczamy izotermę adsorpcji dla tego układu.
Najpierw węgla aktywnego oznaczonego symbolem Ag2n poddajemy desorpcji pod próżnią. Po pojemnik z węglem aktywnym studzimy. Następnie podłączamy dozownik z 5 cm3 eteru dietylowego. W procesie adsorpcji dokonujemy odczytu w zależności od ilości zaadsorbowanego gazu.
Temperatura otoczenia 200C, aktualne ciśnienie atmosferyczne 740 mmHg.
Wyniki przedstawiamy w tabeli
Lp |
vi [cm3]
|
pi [mmHg] |
pi0 [mmHg] |
Δpi |
viads |
p0-pi |
viads∗ (p0-pi) |
pi/[viads(p0-pi)] |
1 |
0,2 |
2 |
34 |
32 |
0,014 |
407,56 |
5,70 |
5,96 |
2 |
0,4 |
2 |
34 |
32 |
0,028 |
407,56 |
11,41 |
2,97 |
3 |
0,75 |
2 |
34 |
32 |
0,054 |
407,56 |
22,0 |
1,54 |
4 |
1,1 |
2 |
34 |
32 |
0,079 |
407,56 |
32,19 |
1,05 |
5 |
1,3 |
3 |
47 |
44 |
0,129 |
394,56 |
45,09 |
1,04 |
6 |
1,5 |
5 |
70 |
65 |
0,220 |
371,56 |
8,74 |
8,0 |
7 |
1,7 |
8 |
100 |
92 |
0,354 |
341,56 |
120,79 |
0,827 |
8 |
1,9 |
14 |
164,7 |
150,7 |
0,648 |
276,86 |
179,4 |
0,918 |
9 |
2,2 |
24 |
262 |
315 |
1,56 |
179,56 |
280,1 |
0,935 |
10 |
2,4 |
32 |
347 |
344 |
1,86 |
94,56 |
178,7 |
1,94 |
11 |
2,6 |
41 |
244,7 |
383,7 |
2,25 |
16,86 |
37,93 |
11,19 |
OBLICZENIA
Sporządzamy wykres zależności pi = f(vi), a następnie przesuwamy prostoliniowy fragment wykresu do początku układu współrzędnych i z niego odczytujemy wartości pi0 dla danego vi.
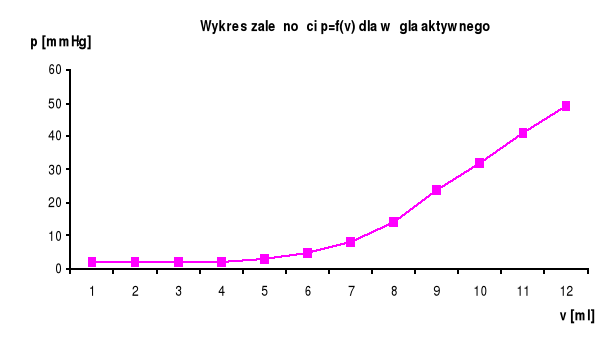
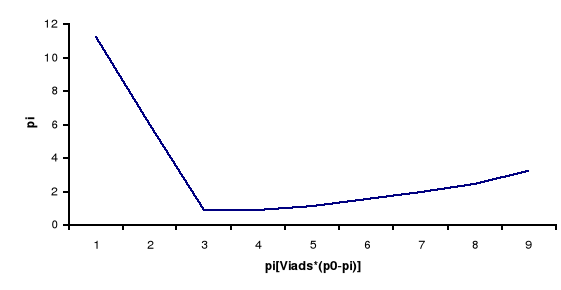
Z danych zawartych w kolumnach 3 i 9 sporządzamy wykres zależności pi/[viads∗(pi0-pi)]=f(pi), a następnie obliczamy z niego tgα.
Zgodnie z równaniem izotermy BET mamy:
tgα = (c - 1)/(c∗vm∗p0)
tgα = 5,524∗10-3
b = 1/(vm∗c)
vm < 2 ⇒ 1/vm = 5,524∗10-3∗441,56 = 2,31 ⇒ vm = 0,432
Gęstość eteru dietylowego w 200C wynosi: ρ = 0,736 g/cm3
Masa molowa eteru M(C2H5)2O = 74 g/mol
Z tego obliczamy:
m = 0,317 g
n = 4,29∗10-3 mola
Powierzchnia zajmowana przez adsorbent wynosi:
S = 6,023∗1023∗4,29∗10-3∗52,3 [A0]2
S = 1,35∗1023 [A0]2
Obliczamy powierzchnię czynną właściwą:
Sr = S/ madsorbentu
S = 1,35∗1023/6 = 2.25∗1022 [A0]2/g
WNIOSKI
Otrzymany przez nas wynik pomiary powierzchni węgla aktywnago jest zgodny z wynikami uzyskiwanymi prze inne grypy, jak również zgodny z danymi zawartymi w literaturze (700 -1100 m2/g). Należy tu jeszcze wspomnieć, że dotychczas to ćwiczenie było wykonywane na innej cieczy lotnej - n-pentanie - jako adsorbacie. Jednaj jak już wspomnieliśmy nie ma t zbyt wielkiego wpływu na wynik pomiaru.
LITERATURA
H. Jankowska, A. Świątkowski, J.Choma: Węgiel aktywny
J. Ościk: Adsorpcja
Wyszukiwarka
Podobne podstrony:
lab fiz sem 5, lab 4s, nr grupy : 32
lab fiz sem 5, lab 4w, nr grupy : 32
lab fiz sem 5, lab 4b, Nr ćwiczenia : 4
lab fiz sem 5, spr, Marta Sołtys
lab fiz sem 5, lab 4c, Zesp˙˙ 5
Lab PŁ, nr 6 immobilizowane biokatalizatory
Wyznaczanie prędkości dźwięku w powietrzu metodą przesunięcia fazowego, LAB 104O, Nr ćw.
Lab PŁ, nr 2 Skrinning drobnoustrojów
TB (Lab), Sprawozdanie nr 1
MB (Lab) Instrukcja nr 06
Wyznaczanie modułu Younga metodą ugięcia, LAB 108, Nr ćw.
Lab PŁ, nr 3 biodegradacja bialek
MB (Lab), Instrukcja nr 06
Lab PŁ, nr 5 biodegradacja oleju napędowego, 1
Badanie rezonansu mechanicznego, LAB 120B, Nr ćw.
MB (Lab) Instrukcja nr 07
Lab PŁ, nr 1 materiały celulozowe
więcej podobnych podstron