CHEMIA BIONIEORGANICZNA
1 . Przykłady procesów biologicznych, które wymagają jonów metali:
oddychanie
część procesów azotu (nitrogenaza)
FOTOSYNTEZAA
PRZEWODZENIE NERWÓW
SKURCZ MIĘŚNIA
OCHRONA PRZED CZYNNIKAMI TOKSYCZNYMI I MUTAGENNYMI
Z zewnątrz celowo wprowadzane są do organizmów kompleksy metali jako:
leki - np. przeciwnowotworowe, przeciwreumatyczne, radiofarmaceutyki
próby diagnostyczne - np. środki kontrastowe dla NMR, próbniki konformacji DNA i białek
jony metali istotne jako elementy układów biologicznych
pierwiastki odgrywające podstawową rolę dla organizmu:
H, Mg, Na, K, Ca, V, Cr, Mo, Mn, Fe, Co, Ni, Cu, Zu, O, p, Si, S, Cl, Br, J, Se, As, Sr
Stężenie kationów w płynach ustrojowych
Osocze płyn śródmiąższowy płyn komórkowy
Na 142 145 10
K 4,3 4,4 156
Ca 2,5 2,4 1,7
Mg 1,1 1,1 13
Transport przez błony
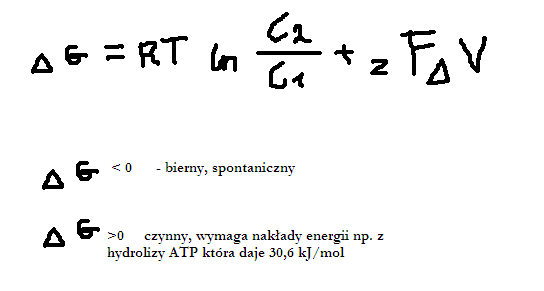
Formy występowania w plazmie krwi
Na - sód w białku 1 % - niejonowy
Na CO3 ; NaHCO3 - 0,5 % elektrostatycznie związany
Wolny sód - aktywny Na +
Ca 2+
W formie niejonowej
albuminy, globuliny, CaHCO3+
W formie jonowej
Ca2+ elektrostatycznie związany i Ca 2+ wolny
Elektroda jonoselektywna - mierzy potencjał; mierzy aktywność. Różna aktywność od stężenia
Rezultaty pomiaru Na+ i K+ różnymi metodami w plazmie
Jon stężenie (fotometria) aktywność
Na+ 140 104 (bezpośredni odczyt) 135 - po rozcieńczeniu 200x
K+ 4 3 3,9
Biomimetyki - odtwarzają proces który zachodzi w organizmach żywych
konstruowanie modeli aktywnych metaloprotein i błon biologicznych
zalety badań biomimetycznych: stosunkowo prosta kontrola procesów poprzez wprowadzaie systematycznych jednostkowych zmian strukturalnych w ukłądzie modelowym np.:
zmiana polarności centrum wiążącego
celowe wprowadzanie zawad sterycznych w wybranych regionach układu modelowego
zmiany układu donorowego
zmiany rozpuszczalnika
Niedogodność:
brak oddziaływań białko - kompleks
biomimetyki aparatu fotosyntetycznego
AMINOKWASY
pojęcie zwitterjonu H3N+CH(R)COO-
grupa aminowa i kwasowa
taki zakres pH gdzie jest zwitterjon- jon obojnaczy
różnice formy aminokwasów w zależności od pH
grupy aminowe i COOH mogą tworzyć wiązanie pepetydowe
125 i 114 stopni - kąty wiązania peptydowego 2 formy tego wiązania
delokalizacja wolnej pary elektronowej na azocie
z tym wiązaniem jony metali tworzą kompleksy - można badać je spektrofotometrycznie
Struktura I- rzędowa białka
kolejność aminokwasów w białku
Struktura II - rzędowa
jakie są oddziaływania np. wiązanie wodorowe wewnątrzcząsteczkowe i międzycząsteczkowe
też w kwasach nukleinowych
Struktura III- rzędowa
struktura przestrzenna
oddziaływania pi-elektronowe między grupami aromatycznymi
IV- rzędowa
duze zegmenty łączą się w jedną całość
ENZYMY
białka uczestniczące w procesach biokatalitycznych
proces szybciej zachodzi
grupa prostetyczna - koenzym - związany jest na stałe z enzymem (w tym jony metali) niebiałkowa; odpowiada za konkretną reakcję apoenzym+ koenzym= holoenzym
jony metali aktywują koenzym
enzymy wiażące tlen redukcja tlenu np. hemoglobina
Kompleksy ważne decydują w jakiej formie jest transportowane, przechowywane żelazo; Fe wytrąca się w pH ok. 4
jeśli wytrącanie następuje nie jest tak w organizmie bo powstają kompleksy...
Puryny i pirymidyny budują DNA i RNA oraz ATP - kwas adenozynotrójfosforanowey
kwas deoksyrybonukleinowy - polimer dwuniciowy
rola wiązań wodorowych destabilizacja lub stabilizacja DNA
kompleks cynku - sczepia białka helisy ` palce cynkowe'
próbniki - kompleksy jonów metali; można wmieszać je w nici DNA i obserwować je
BŁONA KOMÓRKOWA
Funkcje błon;
bariera utrzymująca objętość i skłąd komórki
matryca dla receptorów (białek) przekazujących bodźce i substancje do komórki
miejsce przebiegu procesów przemiany energii
fotosynteza
fosforylacja oksydacyjna
W2 ENZYMY
stężenie O2 w roztworze nie przekraca 10^-3 mola/dm3 musi być enzym odpowiedzialny za transport tlenu w organizmach żywych enzym wiąże tlen
Enzymy redoks
nośniki tlenu; hemoglobina (1-centrum) i hemocjanina (2 centra)
deoksyhemerytryna i oksyhemerytryna
Biologiczne centrum Fe
centrum aktywne hemoglobiny hem
4 atomy azotu
podjednostki składjaące się na molekułę hemoglobiny
grupy karboksylowe ulegają zamianie
CO2 + H2O > H+ + HCO3-
efekt Bohra; wiązanie tlenu zwiększa wydalanie CO2
kooperatywny mechanizm wiązania tlenu
związanie tlenu powoduje opadnięcie Fe na powierzchnie porfiryny
Układy miedziowe
niebieskie białka miedziowe - barwa niebieska ; miedź, azot, siarka, przeniesienie elektronów powoduje zabarwienei; tetraedr
typ II - niezabarwiony bo nie ma struktury tetraedrycznej; dysmutaza zawiera Zn - nie bierze udziału w procesie redoks
typ III - pary jonów Cu (II) sprzężone oddziałują ze sobą antyferromagnetycznie
typ IV - zawiera kilka typów centrów np. neuroplazmatyczne
HEMOCJANINA
desoxy Cu+1 donory - azoty z histydyny; 350 pm( mała odległość) wiązanie tlenu zmiana barwy; tlen łączy się pomiędzy miedzi
Problemy w ustaleniu struktury:
1 - odległość centrów Cu (II)
2 - odległość centrów Cu (I)
3 - liczba i rodzaj ligandów formie utlenionej
4 - liczba i rodzaj ligandów w formie zredukowanej
5 - brak sygnału widma EPR dla centrów Cu (II) - diamagnetyczne własności utlenionej formy białka
6 - jak związany tlen w cząsteczce
EXTAF - pokazuje donorowe atomy w stosunku do jonu metali; rentgenowska
Widma Romera - dowiodły istnienia nadtlenku - pasmo drgania rozciąganego O-O
WIDMO UV Vis- 2 pasma, które odpowiadają ...
w różnych układach różne struktury
badania spektroskopowe
Biologiczna redukcja tlenu do wody przy użyciu LAKAZY :
1:1 1:2 w takim stosunku reaguje O2 nośnik tlenu
ukłądy biomimetyczne w temp. 90 stopni apoenzym powoduje zachamowanie nieporządanych reakcji chemicznych
redukcja biologiczna- wodór jest związany w NADH i oddaje wodór i elektrony poprzez cytochromy elektrony redukują tlen
LAKAZA - białko miedziowe, niebieska, tetraedryczne centrum; 4 -elektronowy reduktor tlenu produktem jest O2; by zredukować O2 musi występować w formie zredukowanej; substrat redukuje laktazę (cząsteczkę hydrohinonu) laktaza utlenia hydrohinon do hinonu i ulega redukcji i sama redukuje tlen
2Cu2+ + hydrohinon 2 Cu + + hinon 2 H+
2 Cu 2+ + ½ O2 + 2 H+ 2Cu2+ + H2O
lakaza stosunkowo trwała; do utleniania różnych substancji przemysł drzewny, wybielanie papieru, tani enzym
tworzą go grzyby i drzewo lakowe
4 atomy miedzy w otoczce apoenzymu
grupy COOH, NH2 przez to przyłączanie do podłoża
typ I białka miedziowego Cu 2 histydyny i siarka przyjmowanie elektronów od substratu; jeśli tego nie ma laktoza nie działa
elektron przekazany do centrum (2 miedzy są blisko siebie i są sprzężone antyferromagnetycznie) związanie i redukcja O2
trzecia miedź - klaster miedziowy
3 typy centrów ( I, II, III)
laktozy mają różne potencjały formalne
by zastosować lakazę ten potencjał musi być najwyższy takie atomy Cu otoczone hydrofobowym otoczeniem Ala, Ser, His izoluje centrum miedziowe i hydrohinon może dotrzeć do centrum i oddziaływać tunelowanie elektronowe na centrum Cutunelowanie zależne od odległości im większa tym gorzej
Typ I - miedź na II stopniu utl. Max absorbcji przy 610 nm
Typ II - miedź na II stopniu utl.sygnał EPR zbliżony do niskocząsteczkowego kompleksu
Typ II - 2 miedzi sprzężone
Lakaza niebieska
Lakaza żółta dodatkowe ligandy
Lakaza biała Zn zamiast Cu w jednym miejscu
Oczyszczanie wysokoaktywnych preparatów lakazowych:
chromatografia jonowymienna
adsorpcyjna
oddziaływania hydrofobowe
powinowactwa
Właściwości oczyszczonych lakaz:
masa cząsteczkowa
zawartość skłądnika węglowodanowego
stałe kinetyczne
potencjał redoks - jak aktywna lakoza
liczba atomów Cu w centrum aktywnycm optima działania lakaz
większość pracuje w pH 3,5 - 5
niektóre pH >7
Funkcje lakazy:
uczestniczy w biosyntezie ligniny u roślin wyższych
detoksyfikuje środowisko naturalne (fenole, hinony, utleniane to co ma pierścień hinonowy)
udział w procesie mikrobiologicznej depolimeryzacji ligniny
Zastosowania:
delignifikacja w produkcji papieru i pulpy drzewnej
sensory enzymatyczne w analizie leków (morfina a kodeina)
klarowanie wina
usuwanie zanieczyszczeń środowiska; trichlorofenole, alkeny, odpady przemysłowe, degradacja herbicydów, odbarwianie
Układ bioelektroniczny - biomateriał unieruchamia się na podłoży przewodzącym (np. elektrodzie) osadza się lakazę i pełni ona funkcję czujnika na substancję np. O2 monitorowanie stężenia substancji ; lakaza zachowuje własności
Korzyści z tych układów
wysoka specyficzność oddziaływań enzym-substrat i duża liczba obrotów w biokatalizie może być wbudowana w układach biosensorowych
uaktywnienie enzymów na powierzchni przewodzącej biotransformacja
fotoczułe enzymy i proteiny zaadsorbowane na elektrodzie aktywacja światłem; optoelektronika
Problemy kontaktu materiału
trzeba znać strukturę biokatalizatora i położenie redoks
odległość elektrody od centrum aktywnego często zbyt duża
enzym powinien być w pobliżu elektrody
unieruchomienie enzymu bepośredni kontakt enzymu z elektrodą niekorzystny
Związanie enzymów z podłożem:
bezpośredni kontakt elektryczny
Met - przeniesienie elektronów dzięki synetycznym i biologicznym nośnikom (mediatory)
Adsorpcja enzymu na powierzchni elektrody
Złącza (mostki) molekularne - zapewniają przeniesienie elektronu na większe odległości
Tworzenie mono- multiwarstw związków organicznych i biomateriału
Polimery przewodzące do unieruchomienia enzymu by nie stracił aktywności
Unieruchomienie enzymu w membranie
Łączenie enzymu z elektrodą poprzez nanocząstki i nanorurki
BIOOGNIWO
nowe źródło energii
na 1 elektrodzie enzym (oksydaza glukozowa) utlenia glukozy do glukuronianu H2O2 utleniany do tlenu (drugi substrat) ANODA - utlenianie
na KATODZIE - proces z udziałęm lakazy i mediatora
utlenianie cukru
elektrody w jednym roztworze
kataliza enzymatyczna na elektrodzie
elektroda trudno redukuje lakazę potrzebny mediator do przekazywania elektronów do środka białka
O2 + 4H+ + 4 e 2H2O
Mała energia z tych procesów stosuje się do zasilania czujników
SWCNT - nanorurki; rurka z przekaźnikiem; na końcu ziązane centrum aktywne enzymu
konstrukcje na anodach bardziej zaawansowane
czynniki wiążące - polianilina; polimery łączenie by enzym nie zdenaturował się
można umieścić warstwę (membranę) i tam mediator i enzym proces utleniania substratu
najefektywniejszy system wiązania warstwa jest polimerem. Do niego kompleks osmu transportuje elektrony
ciekłokrystaliczne matryce biokompatybilna
przezroczysta - badanie spektroskopowo
enzym jako czujnik do mierzenia poziomu O2
można wiązać bezpośrednio białko z elektrodą problem- lakaza jest dużą cząsteczką i można przyłączyć bardzo mało cząsteczek warstwa mało aktywna bo mało katalizatora
mikroskopia skaningowa i elektronowa moc bioogniwa
5 TRANSPORT JONÓW METALI W ORGANIZMACH ŻYWYCH
zakres użytecznysą toksyczne jony np. Cd muszą być usuwane- stężenie krytyczne (bez wpłwu) ale wyższe niż to jest toksyczne
Mechanizmy regulujące:
1 - transport jonow do komórek
2 - przechowywanie jonów
3 - wydalanie jonów
Fe (3-4 g) :
70% hemoglobina, mioglobina
0,7 % enzymy wewnątrzkomórkowe
29,3% postać magazynowana
- pH fizjologiczne w pH 4 wytrąca się wodorotlenek żelaza i białka nie dopuszczja...
żelazo magazynowane w formie białek - transferyna lub ferrytrynaFe wprowadzone a w środku micele ortofosforanu
transferyna - Fe łączone w ukłądzie oktaedrycznym
bariera to błona kom. Fe wiązane z białkiem i w nim przedostaje się do komórki i uwypukla się część błony i odrywa w formie liposomu (modelowane) układać warstwę; usuwanie żelaza - potrzebna energia
wchłonięcie liposomu i uwolnienie białka i oczekuje na następną cząsteczkę ligandu (hydrofobowe biało przenosi i ... w postaci liposomu)
kompleksy działające jako przechowalnie metali (tworzone układy podobne ferytrynie) ochrona środowiskamagazynowanie żelaza w nośnikach związek do wody i wiąże on Fe
Fe 2+ wnika do apoproteiny reakzja Fe2+ Fe3+ się wytrąca i może tam trwać; reduktory (związki tiolowe) przeprowadzją Fe 3+ w Fe2+
Transport Fe
syderofory - układy wiążące jony metali (Fe, Pn) przekazywanie radioaktywnych metali
1 - pochodne kwasów hydroksyamowych
2 - pochodne katecholi
jon chromianowy łączy się z DNA (zmiany nowotworowe)związanie cykliczne i liniowe
transportujemy w Formie Fe(III) - redukują do Fe(II) i uwalniane
Fe tworzy labilne kompleksy labilność uniemożliwia badanie kompleksów i zastępuje się Fe Chromem (inertnym)
Mg, Zn - labilne ; trudne do badania
Magazynowanie i transport Cu
cytoplazma - składnik miedziowy we krwi; synteza w wątrobie; redukcja tlenu
albumina - przenośnik miedzi we krwi żylnej, białko ma 600 reszt aminokwasowych opary rtęci lek odtruwający
choroba Willsona nadmiar miedzi w organizmie !!!
Wydalanie jonów metali:
nadmiar; odpowiedzialne są Metaloteniny małe peptydy i 6-7 atomów na cząsteczkę wiąże Zn(II), Cd(II), Cu(I)
naturalne środki odtruwające; hydrofobowe
transport jonów przez błonę kom.
Funkcje błon:
bariera utrzymująca objętość i skład komórki
matryca dla receptorów (białek) przekazujących bodźce i substancje do komórki
miejsce przebiegu procesów fotosyntezy
- każdy lipid ma część polarną (cukier-głowa-hydrofilowa- wiąz. Pojedyncze) i niepolarną (łańcuch kwasu- hudrofobowa- wiązei podwójne)
sfingomielina;
cholesterol
Oddziaływania między skłądnikami warstwy:
wiązania wodorowe
oddziaływania hydrofobowe - siły Van der Waalsa
oddziaływnia elektrostatyczne
stworzenie agregatów w obrębie warstwy
Białka błon:
peryferyjne (cytochrom c)
integralne (osydaza cytochromowa)
jonofor - cząsteczka przenosząca jon przez błonę; układ o dużej labilności; proces przypomina katalizę; nośnik zwiększa liczbę obrotów jak w katalizatorze
białka kanałowe przechodzą przez całą szerokość dwuwarstwy np. Gramicydyna
oddziaływania między składnikami membrany
- kompleksy 1: 1 - domeny błonowe
równowagi pomiędzy składnikami dwuwarstw a jonami obecnymi w roztworach wodnych
kanały jonowe - nośniki
układ fosfatydylocholina - walinomycyna
transport sodu i potasu
ATP-aza sodowo-potasowa
Na - na zewnątrz - K- do środka pompy protonowe działają stale
____________________________________________________________
Transport przez błonę komórkową
dwuwarstwa lipidowa różne układy białek; białka peryferyczne; integralnie związane z błoną
białka membranowe hydrofobowe ogony
fosfatydylocholina (lecytyna)
jonofory- układy transportujące substancje przez błony
nośnik kompleksuje jon i uwalnia po drugiejs tronie katalizuje się to
warstwa ma własności ciekłego kryształu
lipidy wewnątrz może się przemieszczać; swoboda jak w cieczy
są też domeny błonowe- podobne substancje w błonie zbliżają się do siebie - ubichinol. Likofenol. Fosfatydylocholiny
kanały jonowe
nośniki: walinomycyna reorientacja wewnątz błony
Gramicydyna A - dimer kanał
Układ fosfatydylocholina- walinomycyna (wiąże potas , sód i lit)
Walinomycyna - antybiotyk- przenosi potas
Pompa sodowo-potasowa
energia przechodzi z przemiany ATP w ADP
wiązanie 3 jonów Na
ATPADP fosforylacja ATP-azyenergia zmiana orientacji białka w błonie; jony Na uwolnione na zewnątrz; K wprowadzane do środka; uwolnienie fosforany (2 jony K)
Nadciśnienie pompa sodowo-potasowa nie daje rady
Wypompowywanie i przepompowywanie protonów
Rola związków wanadu jako blokerów miejsc wiążących ATP (amawadine)
Rola wapnia
pompa wapniowa
retikulum endoplazmatyczne
sygnał nerwowy pobudza błonę RE
uwolnienie Ca 2+ z błony i przyłączenie do miejsc aktywnych włókien mięśniowych wiązanie z białkiem troponiną
blokada ATP-azy magnezowej- pompującej Ca2+ do retikulum, energia z hydrolizy ATP
wapń można zastąpić lantanem, który świeci i można zbadać drogę wapnia
reakcja na bodziec nerwowy- wydzielanie neurotransmitera - acetylocholina
impuls nerwowy przez szczelinę synaptyczną uwalnia się acetylocholina (w formie liposomu)
acetylocholina wchłania się w błonę kom. i wpływa do kanałów po drugiej stronie kanału są białka receptorowe zawsze receptor zamkniety ale jest zmiana konformacji i się otwiera
jeśli bodziec zanika to acetylocholina dysocjowana na octan przez esterazę symetryczna reakcja na dwóch miejscach aktywnych
Reakcja na bodziec elektryczny
komórka w stanie spoczynku ma -90mV
powstaje potencjał czynnościowy w komórce wpływają jony i zmienia się potencjał depolaryzacja do -20mV
po zaniku bodźca repolaryzacja (EKG)
Symport 2 związki transportowane w jednym kierunku
Uniport - 1 składnik jest transportowany w 1-nym kierunku
Antyport- 2 różne związki transportowane są w 2 strony
Badanie transportu - mierzenie prądów pikoamperami do komórki przytyka się szklaną pipetą z pompką i wciąg się mała część błonu kom. mikroelektrodę do środka a drugą do pipety i mierzy się przepływajacy prąd jak częstry transport i jak zmienia się transport po lekach
Formowanie układów lipolowych do badań modelowych
Liposom- błona kom. - z roztworem uzyskiwany przez ultradźwięki sztuczna dwuwarstwa glukoza i lipid. Filtrujemy i mierzymy
Czarne błony lipidowe (BCM)- naczynie z przegrodą w której jest dziurka- tam ustawiają się lipidy i tworzy się dwuwarstwa w stronę wody; gęsty układ cząsteczek wygląda jak czarna błona
pojedyncze warstwy tworzą micele
Metoda Langmuira
pozwala badać pojedyncze warstwy lipidowe woda z solą na powierzchnie lipid rospuszczony w chloroformie różne połączenia cząsteczek na powierzchni wody; można wymuszać położenie cząsteczek przez bariery
rejestracja zmian ciśnienia powierzchniowego izoterma - 2 wymiary warstwa pojedyncza
z izotermy wyznaczamy - wartość współczynnika ściśliwości warstwy (Kg) oraz powierzchnię zajmowaną przez pojedynczą cząsteczkę
BADANIE
przekłądanie monowarstwy z granicy faz woda-powietrze na substrat hydrofilowy
przekładanie monowarstwy na substrat hydrofobowy
przytknięcie się do pierwszej warstwy
Skaningowa tunelowa mikroskopia (STM)
mikroskop ten ma rozdzielczość cząsteczkową
przykłąda się stały prąd między ostrze przesuwamy to topografia pwierzchni w rozdzielczości cząsteczkowej
złota elektroda
pokryta monowarstwą lipidu lub warstwą mieszaną (lipid- gramicydyna)
upakowanie heksagonalne lipidów
można policzyć odległość , wymiary
histogram rozkłąd najbardziej prawdopodobnych wymiarów
gramicydyna- antybakteryjny polipeptyd w medycynie przy zaburzeniach transplantacji
Transport ładunku przez błony - aparat fotosyntetyczny
H2O + CO2 < CH2O + O2
112 x 10 ^11 ton CO2 organicznego rocznie asymilowanego w procesie fotosyntezy
fosforylacja; H2O utlenia się do O2; przemiana ATP w ADP zużywana w cyklu Calvina
NADP przechodzi w NADPH
PSI i PS II
kompleksy pochłaniające światło ; wzbudzenie kompleksu pod wpływem światła
rozdzielenie ładunku w centrum reakcji i sensybilizator oddaje elektrony na przenośnik
porfiryna - częsty sensybilizator; ulega wzbudzeniu pod wpływem światła
kompleks rutenowy
jest donor elektronów w centrum utleniającym
micelarne rozdzielenei łądunku w środku hydrofobowo; napromieniowanie sensybilizatora, który jest w środku miceli, po adsorpcji...
dwuwarstwy lipidowe
fullereny pobierają elektrony; ukłądy zbudowane z węgla; mogą redukować się z wymianą do 6-ciu elektronów
metalokataliza
Wyszukiwarka
Podobne podstrony:
Chemia Bionie wyk1
Chemia Bionie wyk1 [tryb zgodności]
CHEMIA BIONIEORGANICZNA wyklady
Chemia Bionie wyk1
chemia powt
Wykład Chemia kwantowa 11
wyklad z czwartku chemia fizycz dnia19 marca
chemia(1) 3
Chemia węglowodory
Chemia organiczna czesc I poprawiona
ERGONOMIA chemia
chemia organiczna wykład 6
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
więcej podobnych podstron