Dysocjacja pod wpływem rozp. Polarnego (H2O) proces rozp. Cząsteczek zw. Chem na jony. Tylko zw. W których wiąz. Jonowe lub silnie spolaryz. Odwracalna. Dysocj.-całkowita lub częściowa. L=n/n0 (cząstki zdysocjowane / wszystkie) wzrost stopnia dysocjacji: temperatura, stężenie, wpływ innych elektrolitów
Stała dysocjacji- określa moc dysocjowanych elektrolitów, zależy od temperatury, stosunek iloczynu stężeń jonów powstałych w wyniku d. elektr. Do stęż. cząst. niezdysocjowanych w danej temp. K = [A+][B-]/[AB]. Elektrolity to subst. które rozpuszczając się w wodzie/rozpuszcz. ulegają rozpadowi na jonu dod. I ujemne. W zależności od stopn. dys - słabe i mocne.
Stopień dysocjacji stosunek liczy moli cząst. danego związku chem. które uległy rozpadowi na jony do łącznej liczy cząst. tego związku znajdującego się w roztworze, w którym zaszła dysocjacja.
rozpuszczanie HCl w wodzie HCl+H2OH3O++Cl-
Bronsted -kw ind. chem. może odszczepić proton, zasada przyłącza proton.Dwa układy sprzęż. ze sobą kw i zas., pary zw. różniące się protonem
Svante Arrhenius związki co w roztworach wodnych ulegaja rozpadowi na jony,wyróżnił kationy i aniony (tabelka) każdy kwas dysocjuje w roztw. wodnym, wydzielając kationy wodorowe. Każda zasada wyd. aniony wodorotlenowe
HnR nH+ + R -N Me(OH)n Me+N+nOH-
MenRm nMe+m+mR-N Kw(T)=[H+] [OH-]
Iloczyn jonowy wody Stały w przybliżeniu, opisuje równowagę dyn. Prawa działania mas. Obecność kwasów i zasad zmniejsza stopień Dys. H2O i zwieksza stężenie jonu (wzór: iloczyn stężenia jonów hydroniowych i jonów hydroksylowych powstałych w wyniku autodysocjacji) Kx[H2O]=[H+]x[OH-]=10-14 (proces niszczenia zabytków)
pH ujemny logarytm dziesiętny ze stęż. kationów wodorowych ph=-log[H+] kw-pH<7 zasada-pH>7 pH=14- jednomolowy NaOH, pH=0-jednomol kwas solny. Wskaźniki kwasowości: czerwień metylowa, oranż metylowy, fenoloftaleina. Hydroliza podwójna wymiana między wodą i rozp. w niej subst. Powstają nowe związki chemiczne. AB+H2OAH+BOH (a,b -coś co ulega hydrolizie) Hydrolizie ulegają sole, aby dana sól uleg. hydr. jakaś część jej jonów musi pochodzić od słab. elektrolit. (odczyny) CCl-nie zachodzi(4chlorometan) CHCOONH4CH3COO-+NH4+ CHCOONH4+H2OCH3COO+NH4(obojętny) CH3COOH(hydroliza nie zachodzi)
Podciąganie kapilarne zdolność do kapil. przemieszczania się cieczy, w mat. Porowatych. Drobne pory -wyżej. 1.Pory>1mm ciecz się przelewa, brak podc. kapilarnego. 2. 0,5<por<1mm-podciaganie k. 3. por<0,5mm-ruch cząstecz. kondensacja pary wodnej. Rurki: Mirowskiego i Karnstena. W konserwacji źle bo obiekt ma kontakt z wodą gruntową i dobrze bo można wprowadzać impregnat. Reakcje w chemii nieorganicznej syntezy -łączenie H2O+CO2 H2CO3, analizy -rozkładu CaCO3CaO+CO2, wymiany pojedynczej (pierwiastek i zw. chemiczny, tworzą się inne związki) H2SO4+Zn ZnSO4+H2 podwójna (między dwoma lub więcej zw chemicznymi) HCl+NaOH NaCl+H2O Utleniania i redukcji: oddawanie i przyjmowanie elektronów O2+CCO2 -utlenianie: C-4eC4+, redukcja: O2+4e2O-2 dawca elektronów-reduktor a biorca-utleniacz
Wiązania chemiczne -zalezy od budowy atomu, struktury elektronowej i wielkość. ładunku. 1.atomowe: między jonami tego samego pierwiastka w warunkach normalnych np. O2 -forma czastecz. robi się przez uwspólnianie elektronów 2.jonowe(1916 Kossel) w zw heteropolarnych elektrostatycz. przyciąg przeciwnie nał. jonów w war. normalnych mają krystaliczne sieci z atomów naprzemiennych Fluor-najaktywniejszy 3. metaliczne -w metalach i stopach, łączą się ze struk. metal. przyciąg. między zrębami atom. i gazem elektron. zręby-dodatnie. uwspólnianie Elek. walencyjnych do chmury.
Metale-zręby i chmura, w kwasach ulegają roztwarzaniu, np. Cu+H2SO4CuSO4+SO2+H2O, złoto tylko w wodzie królewskiej (kw. solny i azotowy 3:1) budowa krystaliczna, uporzadkowana,geometryczna, właść: ciągliwe, kowalne, gładkie, błyszczą, dobre przew. cieplne i elektr., raczej alkaliczne podlegają utlenianiu i redukcji. są w szeregu napięciowym metali. przed wodorem -aktywne.
Zwilżalność-zależy od oddziaływań cieczy i na granicy ciecz-materiał. zjawisko zwilż. kiedy adhezji są większe lub równe jak kohezji (adh-siła z jaką kropla zaczepia się o podłoże, kohez-spójność wewnętrzna kropli) kąt styku < 90stop. -ciecz zwilża a jeśli większy to nie zwilża.
Oddziaływania międzycząsteczkowe 1.dipol-dipol między cząst. np. wody, czyli czegoś co mam momenty dipolowe, tam gdzie związek ma punkt bardziej dodatni i ujemny, słabsze niż 2. jon-jon -między różnie naładowanymi cząsteczkami, siła:1/r2 (r-odległość między cząstkami) 3. wodorowe kiedy atom wodoru z cząstkowym ładunkiem dodatnim jest współdziel. przez inne cząsteczki z ład. ujemnym (np. w celulozie) 4. van der waalsa 5. siły dyspersyjne (chwilowe odpychanie bądź przyciąganie) fdys+fp+fh=100% (fp-dipol-dip., fh-wodorowe)
iloczyn rozpuszczalności-do ilościowego przewidywania wpływu składu roztw. na rozpuszcz. iloczyn ze stęż. molowych, tworząc. się w hydrolizie. zależy od temp., rodzaju substancji, dla trudno rozpuszcz-określony. (trójkąt rozp.) po to żeby wiedzieć czy będzie osad. Os.-wtedy kiedy il. ze stęż. będzie większy niż Ir.podobne rozp. się w podobnym. Bierze się tu pod uwagę liczbę i rodzaj wiązań chem. : 1.dipol dipol, 2.wodorowe, 3.wanderwalsa. Proces rozp.wielkocząstecz. zaczyna się od pęcznienia. 1 etap-niszczenie oddziaływ. między cząstecz. 2etap otaczanie cząsteczek rozp. przez cząst. rozpuszczalnika. Rozp. przebiega na granicy faz. na rozp wpływa: rozdrobnienie, temp.
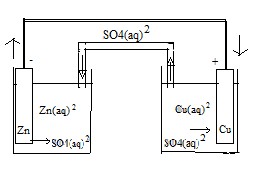
ogniwo galwaniczne -elektrody płyną od anody do katody, Zalezy od zd. roztwórczej metal. jon z roztw. może zbliżyc się do płyt. i przechwycic el. swobodny, po usunięciu kilku el.płytka robi się dodatnia. klucz elektrolit. i przewód elektr. wypełniony KCl(chlorek potasu) klucz elektrolit. utrudnia dotarcie jonu Cu2+ do cynku metal. bo bezp. wymiana jonów popsułaby. Zapobiega też dyfuzji jonów SO bo wyrównałoby ładunki w roztworach. Zn+2HClZnCl2+H2 Cu+HClnie zachodzi, miedź za wodorem
w szeregu napięciowym
Gęstość materiałów porowatych- pozorna i właściwa d=n/v właściwa-masa próbki bez porów (np. zmielona) pozorna-masa próbki z porami.
Wapno-1.hydratyzowane-suchogasz. skład: Ca(OH)2 -ok70% i CaO, SiO2, CaCO3. Zalać wodą 1:1, w szczelnie zamknietym na 2 tyg. 2.dołowane-czystsze,lepsze,gaszone z więcej wody. dół w ziemi,nadmiar wody do gruntu,konsyst. śmietany, zanieczyszczenia do ziemi. 3.dyspergowane-obecnie. wapno+H2O do dyspermatu(wirówka)
Skały Wapienne-osadowe zbudowane z węglanu wapnia w post. kalcytu (CaCO3) powstaje z luźnego osadu wapiennego. Ulega wietrzeniu chemicznemu. Ze skał wapiennychspoiwo wapienne. wapienie:porowate i nieporowate(można polerować imitacja marmuru) zabielenia-miejsca gdzie zaczyna się korozja kremowy-pińczowski-28%porowatości biały-karsy-40%porowatości,drobne pory, dębnik-wapień ciemny.
Cienkie warstwy-karbonatyzacja Ca(OH)2+CO2CaCo3+H2O
Skały osadowe-sedymentacyjne, przez czynniki zew.(woda,lodowiec,wiatr) piaski, piaskowce, zlepieńce, tufy wulkaniczne. Pochodzenia chemicznego-w wyniku rozpuszczenia skał starczych i ponownego wytrącenia się osadu:wapienie, kwarcyt,gips, anhydryt, sól. Organogeniczne-ze szczątków roślin i zwierząt: torf, węgiel brunatny, ropa naftowa, kreda.
skały magmowe-1wylewne 2żyłowe 3głębinowe. Struktura krystaliczna, wolnokrzepnąceduże kryształy, pow.5mm, szybkokrzepnącemikrokryształy poniżej 1mm. Kwaśne -pow66% krzemionki. Obojętne -53-66% Zasadowe-45-53% Skrajnie zasadowe poniżej 45%
Właściwości piaskowca Gotlandzkiego 17wiek w PL, prawdopod. jako balast statków ze Szwecji, szaro-zielony, spoiwo krzemionkowo-ilasto-węglanowe, b.nieodporny chemicznie. -portale, gzymsy, sterczyny, złota brama Gdańsk, portal w oliwie, wieżyczki przy ratuszu Toruń, portale-pod gwiazdą, kuranty. 60-70MPa wytrzymałość. mechanicznej. Ze wzgl. na kolor-polichromowany.
Spoiwo wapienne- otrzymywane z wglanu wapnia (kamienia wapiennego, marmurowego) właść przed związ: dobra plastyczność, db urabialność z kruszywem, duży skurcz w trakcie wiąz,(dlatego trzeba zacierać) Po związaniu: bdb właść. kapilarne, niska wytrz. mechaniczna, niska odp na działanie wody(dwutlenku wgla, i kw. czynników korozyjnych z wody) duża nasiąkliwość. Przymieszki hydrauliczne: puzzolany, ziemia santoryjska, tras reński, metakaolinit. Muszą zawierać aktywną krzemionkę zdolną do reakcji z Ca(CH)2 Glinokrzemiany aktywow. przez ogrzew. kaolinitu do 800stopni metakaolinit. Wytrzymałość z 1MPa wzrost 13x kosztem nasiąkliwości i kapilarności.
wiązanie: Ca(OH)2+2H2O Ca(OH)2x2H2O i równolegle karbonatyzacja Ca(OH)2+CO2CaCO3+H2O
Zaprawy - wł. zaczynu: dobra plastyczność, urabialność z kruszywem, duży skurcz w trakcie wiązania. Właściwości zapraw: stos. Spoiwa do kruszywa - 1:3/1:4, b. dobre właśc.. kapilarne, niska wytrzymałość mech. Charakt. się stosunkowo małą odpornością na działanie H2O, CO2 i kwaśnych czynników korozyjnych. Wszystkie zaprawy charakt. się małym kapilarnym wznoszeniem wody. Wł. zapraw bez dodatków: jeśli materiał ma duży skurcz trzeba dobrać odpowiednie tworzywa np. gips, wpływa na wytrzymałość. Więcej kruszywa = zmalenie skurczu. Proces wiązania i twardnienia wapna zachodzi w wyniku następujących procesów: przez krystalizację zaprawy tracącej wodę, przez karbonatyzacje: Ca(OH)2 + nH2O + CO2 = CaCO3 + (n+1)H2O, przez tworzenie się krzemianów wapnia. Odpowiednie proporcje między wysychaniem a karbonizacją są ważne przy wykonywaniu powłok malarskich farbami wapiennymi. Jeżeli proces schnięcia farby następuje zbyt szybko, to proces twardnienia nie zajdzie (tzw. spalenie farby) i farba będzie ścierać się ze ściany. Jeżeli proces schnięcia będzie przebiegał zbyt wolno proces twardnienia obejmie zbyt dużą część wapna, powstała powłoka straci biały kolor, będzie szklista, nałożone następne warstwy będą odpadały.
domieszki hydrauliczne - subst. o różnej bud. chem, nat i szt, ale o wł. podobnych do wosku pszczelego. Estry wyższych kwasów tł. monokarboksylowych (do 80 atomów C) oraz wyższych alkoholi monowodorotlenowych. . W woskach nat. ponadto występują domieszki węglowodorów parafinowych, wolne alkohole, i kwasy tłuszczowe. Również temperatury topnienia wosków są wyższe niż tł -w granicach 50-90 C. Powoli rozpuszczają się w rozpuszczalnikach organicznych. Ulegają trudniej hydrolizie niż glicerydy, przez co są od nich bardziej trwałe. Ciała stałe - w grubszych warstwach nieprzezroczyste, ogrzewane topią się tworząc ciecz o niskiej lepkości. Plastyczne przy zgniataniu, wł. hydrofob. Nie rozpuszczają się w wodzie. W. pszczeli, carnauba, kopalny - w. ziemny, po oczyszczeniu - cerezyna. Woski mikrokrystaliczne: Cosmolloid (dość twardy), montanowy, cerezyna. W. polioksyetylenowe (białe rozp. w wodzie), polietylenowe (w wyniku degradacji polietylenem).
Gips Modelarski -biały, drobnomielony, najlepszy, nadaje się do obróbki mechanicznej, zawiera głównie L półhydrat, podlega reakcji hydratacji
Wiązanie gipsu jastrychowego: CaSO4+2H2OCaSO4x0,5H2Ox1,5H2O uwodnienie- gips modelarski, alabastrowy, budowlany CaSO4x0,5H2Ox1,5H2OCaSO4x2H2O
Cement Portlandzki (1824)-skład- klinkier z gipsem do 5%
alit -50%-65% 3CaOxSiO2 belit20% 2CaOxSiO2
brownmilleryt 10% -4CaOxAl2O3xFe2O3
cellit-10% (+inne związki glinu,wapnia,magnezu)
Klinkier-wydobyte glinokrzemiany (wapień lub margiel) wypalane w 1200stopniach, przekształca się w klinkier-> związki glinokrzemianów w postaci tlenkowej: allit, bellit, cellit, brownmilleryt. Klinkier się mieli, dodaje gipsu 1-2% bo regulator czasu wiąz. Najwięcej jest alitu. K.: szary, biały.
Puzzolany-cer. mat. bud. służący do domieszek hydr. (wypełniacz) Pył lub drobny popiół, kiedyś poch. wulk. głównie z czystej krzemionki o b. drobnych zaokrąglonych ziarnach. umie wiązać pod wodą. dodatek do betonów od 40% popiołów cement puzzolanowy
Wiązanie cementu, najpierw uwadnia się
cellit, 3CaOxAl2O3+12H2O3CaOxAl2O3x12H2O belit 2CaOxSiO2+2H2O2CaOxSiO2x2H2O
allit, tzw hydroliza 3CaOxSiO2+3H2O2CaOxSiO+Ca(OH)2
Nasiąkliwość-zdolność do wchłaniania H2O, maksymalne nasycenie.
1. masowa(masa nasiąknięcia wody do próbki bez) 2. objętościowa(masa ![]()
![]()
nasiąkniętej do objętości próbki) [wszedzie x100%]
Hybrydyzacja -przeksz. funkcji orbitalnych czyli skrzyżowanie 2 lub więcej orbitali, one maj ą inny kształt i energię. operacja matematyczna, nie właściwe zjawisko fizyczne. hybrydyzacja węgla zależy od wiązań w związ. Tylko wiązania pojedyncze-hybr. sp3, jedno wiąz podwójne -sp2, potrójne-sp węgiel-umie bud. łańcuchy, ukł. się w tetraedr
Aminokwasy organiczne, pochodne wglwodorów, 2 grupy funkcyjne: aminowa(zasadow.) i karboksyl.(kwas.) prez co sa jonem obojnaczym. mogą być alifatyczne lub cykliczne, kwaśne, zasadowe lub obojętne (zalezy od długości łańcucha pochodzącego od kw. karboksyl.) Tworzą peptydy i białka.
z kwasami i zas. tworzą sole. Subs. krystaliczne, wys. temp. topnienia. d. rozp
w wodzie i alk., nie rozp się w niepolarnych(np.benzen)
Reakcja aminokwasu z kwasem solnym
![]()
Reakcja estryfikacji - kw. karbosk. + alkohol ( w obecności H+ jako katalizatora)
![]()
R1-COOR2
Estry to pochodne kwasów karboksylowych o wzorze RCOOH, w którym atom wodoru grupy karboksylowej został zastąpiony grupą alkilową lub arylową R2.
ESTRY:
-np. tłuszcze, ( np. kwas masłowy, nie rozpuszczalny w wodzie)
-uczestniczą w skomplikowanych procesach biochemicznych.
![]()
-nadają charakt. zapachy kwiatom i owocom.
- trudno rozpuszczalne w wodzie
- gęstość mniejsza od gęstości wody
- charakterystyczny przyjemne zapachy
HYDROLIZA ESTRÓW → w środowisku kwaśnym jest odwracalna, w zasadowym (powstawanie soli kwasu karboksylowego i alkoholu) jest nieodwracalna. Tworzy się mydlo, reakcja zmydlania
![]()
Otrzymywanie żelaza: Fe2O3 + 3C = 2Fe + 3CO, Fe2O3 + 3CO = 2Fe + 3CO2, CO2+C=2CO Stopy: Stal (<2% wag. C), żeliwo (>2%wag. C) surówka (0,05 - 0,65%C). Obecność C - decyduje o stopniu odporności na korozję.
KOROZJA METALI: chem. - Fe - 2e = Fe2+, 2H + 2e = 2H, 2H+0,5O2 = H2O, Fe+H2O + 0,5 O2= Fe(OH)2 żelazo z wodą w obecności tlenu reaguje - I faza k. Im więcej C tym stop bardziej podatny na korozje. Warstwy ochronne - metaliczne i niemetaliczne: subst. org. - lakiery i farby. Wady - porowatość i różna rozszerzalność termiczna.
![]()
![]()
Otrzymywanie METANU: CH3COONa + NaOH → CH4↑ + Na2CO3 (octan sodu)
Spalanie metanu CH4 + 2O2 CO2 + 2H2O
Spalanie 2,2 Dimetylopropanu
![]()
![]()
![]()
![]()
Spalanie 1,2 Dimetylocykloheksanu
Reakcja utleniania alko II rzęd. - C3H7OH
![]()
Porowatość - stosunek łącznej objętości porów do objętości materiału, wyrażany w %. Można ją określic np. przez pomiar nasiąkliwości materiału. Występowanie porów pogarsza wytrzymałość mechaniczną i elektryczną materiałów, polepsza zaś własności izolacyjne. Są to np. materiały sypkie, takie jak być piasek czy różnego rodzaju mieszanki piaskowo-żwirowe, skały osadowe - wapień, czy też materiały budulcowecegła. Ze względu na wielkość porów powietrznych - drobnoporowate (pory o wymiarach setnej i tysięcznej części milimetra) i wielkoporowate (pory wielkości od dziesiątej części milimetra do 1-2 mm).
Grupa karboksylowa R-COOH - ma właśc. do dysocjacji, jedna z podstawowych grup funkcyjnych charakterystyczna dla kwasów karboksylowych, należy do złożonych grup funk. bo składa się z grupy karbonylowej połączonej z grupą hydroksylową. Charakter → kwasowy, a kwas. zależy od reszty węglowodorowej. Podobnie jak w kwasach nieorganicznych reaguje z metalami, tlenkami, wodorotlenkami metali, tworząc SOLE. Poza bardzo słabymi kwasami tłuszczowymi ulega dysocjacji elektrolitycznej w roztworze wody.
Celuloza: nierozgałęziony biopolimer, polisacharyd, o cząst. złożonych z jednostek glukozy połączonych wiązaniami β-1,4-glikozydowymi. Nierozp. w wodzie, ale dobrze absorbuje. Najw. c. zawieraja włókna bawełny, drewno, ulega estryfikacji kwasem: (C6H7O2-(OH)3)n + 3nHNO3 Ⴎ (C6H7O2 -(ONO2)3)n + 3n H2O - azotan celulozy w wyniku całk. e. wszystkich grup OH w cząst.
Podział ciekłych tłuszczów / mydła, właściwości i budowa. Tłuszcze- nasycone i nien. Stałe, półstałe i ciecze, o parzystej liczbie at.C, mieszaniny glicerydów, o ich właśc. decydują reszty kw. tłuszcz. Nie można ich oczyścić poprzez destylację, rozp. w eterze, disiarczku C, chlorowcopod., benzenie, węglow. arom. Rozpuszczalnikach niepolarnych. Nie w wodzie i innych alkoholach. hydroliza: RCOOR + H2O [H+] RCOOH [kwas] + ROH - gliceryna, jest alkoh. R. zmydlania: RCOOR+KOH RCOOK [mydło] + ROH [gliceryna]. Proces nieodwracalny.
Liczby charakt. dla tł: Służą do badania rodzaju tłuszczu: - LICZBA JODOWA [LJ] -określa ilość wiązań =. LICZBA ZMYDLANIA [LZ] -do badania jego jakości. Jeśli jest mała to rodniki są duże, reakcja z KOH. LICZBA KWASOWA [LK], określa ilość wolnych kwasów tłuszczowych, ilość mp KOH potrzebną do zobojętnienia kwasów tłuszczowych zawartych w 1 g badanego tłuszczu. Miara zawartości wolnych kwasów tł, czyli określa stopień hydrolizy tłuszczu. Im większa tym więcej wolnych rodników kw. tł. - tł. jest mniej świeży. Lk podwyższa się w wyniku starzenia. Tł. tworzą długie łańcuchy → kwasy tłuszczowe, wyst. w tkankach zwierzęcych, nasionach roślin, smalec, masło, łój, oleje. W TŁUSZCZACH NIE WYSTEPUJĄ WIĄZANIA POTRÓJNE.!!! Z H20 mogą tworzyć emulsją lub dyspersję, ulegają utlenianiu i polimeryzacji. Ogólny wzór:
![]()
T. schnące: Lj 154 - 176: lniany, konopny i tungowy - są to twarde, suche powłoki o wys. stopniu wsiąkania, odporne na rozp. org. usuwa się je poprzez zmydlanie.
T. półschnące Lj. 127-144: makowy, orzechowy i słonecznikowy. Powłoki łatwe do usunięcia, pęcznieją, mniej odporne na rozp. org.
T. nieschnące: Lj<90: rzepakowy i o. z oliwek.
NASYCONE: Kwasy mające reszty kw. nasyconych są CIAŁAMI STAŁYMI. (wiązania pojedyncze zazwyczaj). Palmitynowy - C16H32O2 /C15H31COOH stearynowy -C18H36O2 / C17H35COOH Mirystynowy - C14H28O2 arachinowy - C20H40O2/ C19H39COOH
NIENAS. kwasy które mają reszty kwasów nienasyconych są CIECZAMI (1 lub więcej wiązań podwójnych). Oleinowy - C18H34O2 : CH3(CH2)7CH = CH3(CH2)7COOH linolowy - C18H32O2: : CH3(CH2)4CH = CH - CH2 - CH - CH= CH(CH2)7COOH linolenowy - C18H30O2 : CH3(CH2)4CH = CH - CH2 - CH = CH- CH2 - CH= CH(CH2)7COOH aleostearynowy - C18H30O2 :CH3(CH2)3 - CH = CH - CH = CH- CH = CH - CH(CH2)7COOH
Taka struktura kwasów odpowiada za szybkość polimeryzacji. W środowisku kwasowym hydrolizie odwracalnej w zasadowym ulegają zmydleniu:
![]()
Tłuszcze ulegają hydrolizie pod wpływem wody lub roztworów zasad. Zasadowa hydroliza tł. zwana jest reakcją zmydlania. jej produktami są → gliceryna i sole kwasów tł. → mydło! Sykatywy - rozkładają ukł. wodorotl. Reakcja mydeł alkaicznych tlenków metali glicerydami - powst. mydło. Sykat. jest MYDŁEM nierozp. w wodzie, dobre wł. hydrofobowe. SOLE SODOWE, AMONOWE LUB POTASOWE WYŻSZYCH KWASÓW TŁUSZCZOWYCH (GŁ. KWAS STEARYNOWY, PALMITYNOWY) TO MYDŁA. Powstają w reakcji ZMYDLANIA.
Mydła: (RCOO)4 Me: nierozp. w wodzie, stałe, półstałe i ciekłe(potasowe), ze względu na odczyn wodnych roztworów: alkaliczne i obojętne. Rozp. w rozp. org - bezynie lakowej, mają niską temp. topnienia. Ich proces produkcji polega na długotrwałym gotowaniu tłuszczów ze stęż. roztworem zasady NaOH, zas. Mg lub Li, na skutek czego dochodzi do zerwania wiązań estrowych oraz powstania gliceryny i mydła właściwego. Współcześnie coraz częściej produkuje się też mydła poprzez bezpośrednią reakcję zasad z kwasami tłuszczowymi otrzymanymi z rafinacji ropy naftowej.
Utlenianie alkoholi / chlorki Poprzez utlenienie alkoholu I-rzęd. (za pom. Utleniacza) powstają aldehydy: R - CH2OH + [O] ----> R - CHO + H2O Poprzez utlenianie alkoholu II rzęd. powstają ketony:
R - CH - R' + [O] -----> R - C - R' + H2O
![]()
Ketony to aktywne rozpuszczalniki, np. do impregnacji drewna. ALDEHYDY - zw. zbud. z gr. aldehydowej połączonej z gr. Alkilową/arylową. → Wyjatek stanowi metanal, połączony z dwoma atomami wodoru. REAKCJE CHARAKTERYSTYCZNE: utleniania do kwasów karboksylowych: reakcja redukcji do alkoholi I rzędowych.
![]()
R. utlenienia wodolnego alko IIrz. - propanol:
Szkło, budowa i korozja / budowa szkła wodnego - Szkło - mat. Izotropowy, duża odporność chem.(ale nie na kw. fluorowodorowy). Składniki - piasek kwarcowy+dodatki Na2CO3, CaCO3+ topniki: B2O3, PbO + pigmenty. Wypalane w piecu 1200-1300C.
W wyniku reakcji krzemionki Na2SiO3 z wodorotlenkami metali alkalicznych, takich jak sód i potas, powstają tzw. szkła wodne, będące mieszaniną oligomerów krzemianowych o różnej strukturze. Ze względu na dobrą rozp. w wodzie szkła w. nazywa się „rozpuszczalnymi krzemianami”/krzemianami. Najczęściej stosowane i najbardziej rozpowszechnione są szkła wodne sodowe. Mogą być wytwarzane z dwóch podst. składników: krzemionki i tlenku metalu alkalicznego- SiO2 do Na2O. Najłatwiejszy sposób na otrzymanie szkła wodnego - to prażenie piasku z sodą, a następnie rozpuszczenie powstałego szkła w wodzie. Im bardziej stężone szkło wodne, tym ma wyższą lepkość. Sodowe szkło wodne jest używane do produkcji betonów o szczególnych właściwościach - kwasoodpornych oraz odpornych na oddziaływanie wysokich temperatur; do produkcji żaroodpornych farb i materiałów ogniotrwałych, żelu krzemionkowego, krzemianu ołowiu. W budownictwie używane do ochrony fundamentów od wód gruntowych. Jest popularnym naturalnym, nietoksycznym klejem. stosuje się go w charakterze spoiwa do materiałów ceramicznych. Odczyn zasadowy szkła w. - w reakcji hydrolizy wydziela się jon OH- , reakcja: Na4SiO3 + H2O -> H4SiO4 + 4Na + 4 OH szkło wodne jest z słabych kw. krzemowych i mocnej zas.
WOSK KOPALNY - wosk ziemny - OZOKERYT, ( po oczyszczeniu cerezyna), jest to mieszanina stałych węglowodorów nasyconych. Właściwości fizyczne: brawa od żółtej do czerwonobrązowej, temp. Topnienia 50 - 100`C, nie rozpuszczalny w wodzie, a rozp. W rozpuszczalnikach węglowodorowych, odporny na czynniki zewnętrzne, liczba kwasowości i zmydlania =0, budowa drobnokrystaliczna
Woski - pochodzenia zwierzęcego( pszczeli), pochodzenia roślinnego( carnauba), pochodzenia mikrokrystalicznego( cosmolloid do ochrony metali 80, cerezyna) woski mineralne( kopalny, parafina) woski syntetyczne( makroparafina, polioksyetylenowe, polietylenowe)
![]()
![]()
Wosk pszczeli - temp. Top. 63 - 70`C, liczba kwasowa 17,36 , l.zmd. - 90-150. Najważniejszym składnikiem jest eter kwasu palmitynowego i alkoholu nirycylowego.
benzyna lakowa benzyna ciężka (zawierająca węglowodory o liczbie atomów węgla od 10 do 15-16), którą odrzuca się w procesie otrzymywania benzyny paliwowej ze względu na zbyt wysoką temperaturę wrzenia. jest stosowana jako rozcieńczalnik do lakierów (także farb i innych wyrobów ftalowych i olejnych, bitumicznych oraz pokostów); zmywanie powierzchni przed malowaniem, usuwanie plam
Chlorowanie toluenu Zmiana benzenu w toluen
Wyszukiwarka
Podobne podstrony:
sciagaCHEMIA2, Chemia, sciaga chemia
sciaga chemia, chemia, chemia
ściąga chemia wykład, Studia, Sem 1,2 +nowe, ALL, szkoła, Chemia
SCIAGA CHEMIA made in Arek, ŚCIĄGI
ściąga chemia
rozkladana sciaga chemia woda zarobowa
ściąga chemia 2
pat sciąga chemia zerówka, NAUKA, chemia, lab
ściaga+chemia, Budownictwo PK, Chemia Budowlana
nakolosa SCIAGA CHEMIA
Sciaga chemia
sciaga chemias
ŚCIĄGA?ŁOŚĆ chemia organiczna
Chemia pomoce naukowe, Chemia zadania sciaga, Chemia zadania
ŚCIĄGA - CHEMIA - KOMPLEKSOMETRIA+Twardość wody, KOMPLEKSOMETRIA
Chemia pomoce naukowe, Chemia zadania sciaga, Chemia zadania
ŚCIĄGA - CHEMIA - KOMPLEKSOMETRIA+Twardość wody, KOMPLEKSOMETRIA
ściąga chemia analityczna
chemia organiczna ściąga, Chemia organiczna
więcej podobnych podstron