Centrum aktywne enzymu; prawdziwe są:
1. Jest to złożony układ grup funkcyjnych, leżących w różnych pozycjach sekwencji aminokwasów
2. W tworzeniu kompleksu E-S biorą udział głównie wiązania kowalencyjne.
3. Jest szczeliną dostępną dla cząsteczek wody. NIE
4. Reszty aminokwasów pełnią tylko wolę grup kontaktowych.
5. Rozpoznanie substratu przez enzym nie jest genetycznie zdeterminowane strukturą I-rzędową.
A. tylko 1 B. tylko 3 C. tylko 2 D. 2,3 i 4 E. wszystkie
2. Które z poniższych enzymów są białkami złożonymi:
1. Dysmutaza ponadtlenkowa -metaloproteina
2. Pepsyna
3. Katalaza - ma grupę prostetyczną (hemina)
4. Peroksydaza G-SH - ma grupę prostetyczną
5. Chymotrypsyna
A. 1,2 i 3 B. 1, 3 i 5 C. 2,3 i 4 D. 1,3 i 4 E. 3,4 i 5
3. Cynkoenzymy to:
1. Dysmutaza ponadtlenkowa(T), karboksypeptydaza(T),pepsyna(N)
2. Anhydroza węglanowa(T), katalaza, peroksydaza glutationowa
3. Dehydrogenaza alkoholowa(T), anhydroza węglanowa(T), dysmutaza ponadtlenkowa(T)
4. Peroksydaza glutationowa, kinaza, dysmutaza ponadtlenkowa(T)
5. Karboksypeptydaza(T), kinaza, anhydroza węglanowa(T)
A. 1 i 3 B. tylko 3 C. tylko 5 D. tylko 2 E. 1,2 i 3
? 4. Vmax: (zdania poprawne to)
1. Ujawnia liczbę cząstek substratu przekształconych w produkt reakcji na jednostkę czasu w
warunkach pełnego wysycenia enzymu substratem
2. Określa powinowactwa enzymu do substratu
3. V ≠ Vmax przy dużych stężeniach substratu, kiedy [S]>Km
4. V= Vmax przy małych stężeniach substratu, kiedy [S]<Km
5. Dla Vmax+ Km równanie ma kształt paraboli, ponieważ (Vmax-Vo)(Km+ [S])
A. tylko 1 B. 1 i 5 C. tylko 2 D.1,2 i 3 E. wszystkie prawdziwe
5. Poniższy wykres dotyczy:
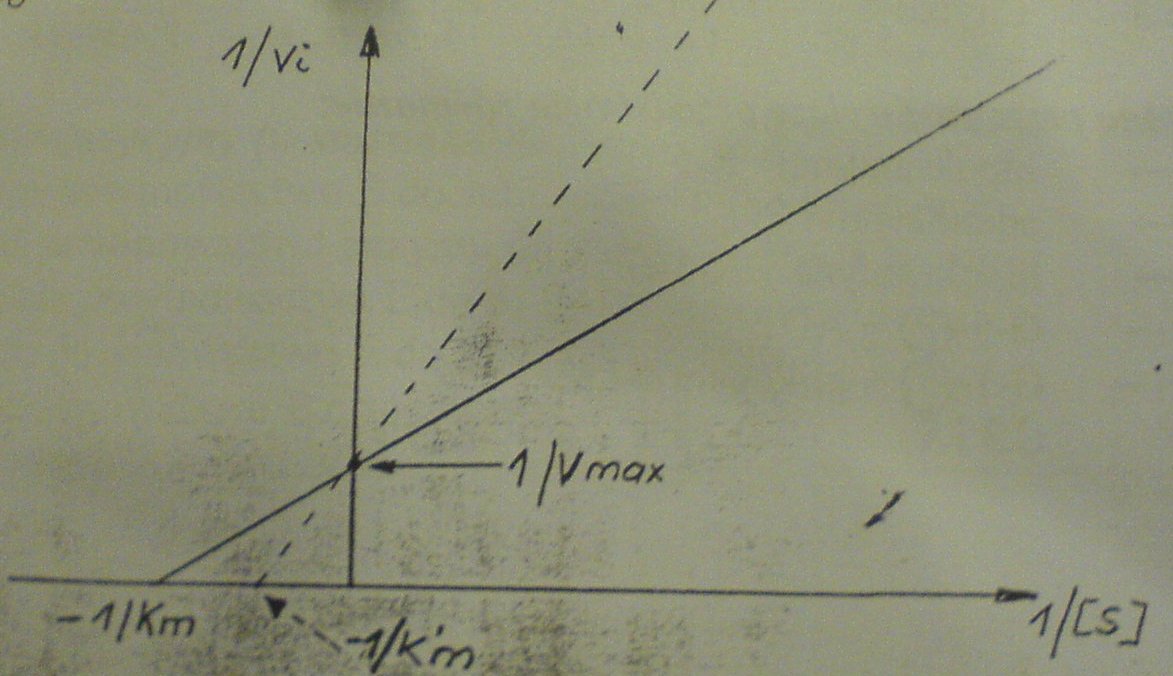
1. Inhibicji niekompetencyjnej, której nie można odwrócić przez zwiększenie stężenia
substratu
2. Inhibicji kompetencyjnej, dla której charakterystyczne są powstające kompleksy EnzIS
3. Kinetyki inhibitora, który współzawodniczy z substratem o te same miejsca wiązania na
powierzchni enzymu
4. Inhibicji reduktazy dihydrofolianowej przez metotreksat ?
A. 1 i 4 B. 2,3 i 4 C. 1i 3 D. 3 i 4 E. 2 i 3
6. W teście optycznym Warburga w czasie przejścia NAD+ w NADH+ H+
1. Azot pierścienia adeninowego zyskuje ładunek
2. Zachowania zostaje aromatyczna struktura pierścienia Wit. B3
3. W pierścieniu pirymidynowym powstają dwa wiązania nienasycone
4. Mierzymy przyrost ekstynkcji przy 340 nm
5. Mierzymy spadek ekstynkcji przy 340 nm
A. 1,2 i 3 B. 3i 4 C. 2,3 i 4 D.2,3 i 5 E.1,3,4 i 5
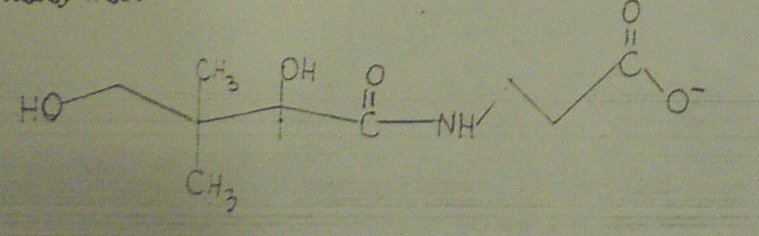
7. Poniższy wzór:
1. To kwas pantoinowy, składnik CoA i ACP
2. To kwas pantotenowy zawierający cz. Kwasu pantoinowego
3. To kwas pantotenowy zawierający merkaptoeranolaminę
4. To kwas pantotenowy, którego aktywną formą jest wyłącznie CoA.
5. Obecność wiązania peptydowego w tym związku można wykryć reakcją Piotrowskiego
A. tylko 1 B. tylko 2 C.2 i 3 D. 1 i 4 E. 2 i 5
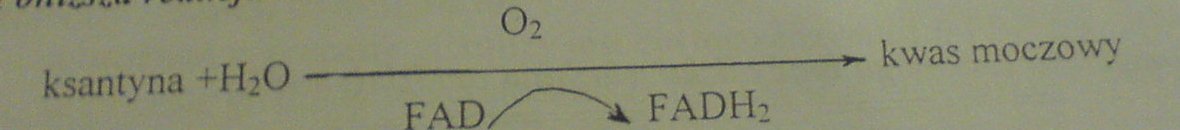
8. Odnośnie Wit. B6 wybierz zdanie(a) prawdziwe:
1. Pirydoksal, pirydoksyamina, pirydoksyna to równocenne pod względem aktywności
biologicznej formy witaminy B6
2. Flara bakteryjna przewodu pokarmowego nie syntetyzuje pirydoksyny, jedynym jej
źródłem jest więc pokarm
3. PLP jest koenzymem m.in. karboksylaz, aminotransferaz, dekarboksylaz oraz dehydrogenaz
4. Fosforan pirydoksalu jest grupą prostetyczną ponieważ trwale łączy się z e- NH2 w białku
enzymatycznym
5. PLP nie może być grupą prostetyczną ponieważ trwale łączy się z azotem grupy aminowej
w rodniku Lys
A. tylko 2 B. tylko3 C. tylko 4 D. 1 i 4 E. 1, 3 i 5
9. Reakcję katalizowaną przez fosforylazę przedstawia równanie:
1. Inozyna + Pi hipoksantyna + R-5-P
2. AMP+ H2O adenozyna+ Pi
3. Inozyna+ Pi hipoksantyna+ R-1-P
4. Glukoza+ ATP G-6-P + ADP
5. Glikogen(n) + Pi G-1-P + glikogen(n-1)
A. 1 i 5 B. 2 i 4 C.3 i 5 D. 1 i 3 E. tylko 5
10. Zaszereguj enzymy do odpowiednich grup:
1. Dekarboksylazy -liazy
2.karboskylazy -ligazy
3. Mutazy -izomerazy
4. Dehydratazy - liazy
5. Epimerazy - izomeraza
6. Syntetaza aminoacylo- tRNA - ligazy
7. Aldoza treoninowa - liazy
Izomerazy Liazy Ligazy
A. 1,2 i 6 3 i 7 4 i 5
B. 3 i 5 1,4 i 7 2 i 6
C. 5 i 7 1,3 i 4 2 i 6
D. 1 i 6 2,3 i 5 4 i 7
E. 2, 6 i 7 1, 4 i 5 3
11. Poniższa reakcja katalizowana jest przez:
A. oksygenazę ksantynową należącą do oksydoreduktaz
B. transferazę ksantynową należącą do transferaz
C. oksydazę ksantynową należącą do oksydoreduktaz
D. oksygenazę kwasu moczowego należącą do oksydoreduktaz
E. hydroksylazę ksantynową należącą do oksydoreduktaz
12. Do metod oznaczania aktywności enzymatycznej zaliczamy:
1. Pomiar narastania produktów czasie
2. Test optyczny Warburga dla enzymów z klas transferaz
3. Pomiar zużycia enzymu w czasie
4. Pomiar ubytku substratu w czasie
5. Metodę manometryczną Warburga z ilości O2 zużytego podczas reakcji enzymu
z substratem
A. 1 i 2 B. 2,4 i 5 C. 1,3 i 4 D. 1,4 i 5 E. 1,2,3,4 i 5
13. Model sekwencyjny oddziaływań allosterycznych Koshlanda zakłada, że:
1. Każda podjednostka może występować tylko w dwóch formach konformacyjnych R i T
2. Związanie liganda z 1 podjednostką zmienia jej konformację pozostając bez wpływu na
konformację sąsiednich jednostek
3. Zmiana konformacji wprowadzona wiązaniem liganda do jednej podjednostki powoduje
zmniejszenie lub zwiększenie powinowactwa wiązania innych podjednostek w tej
samej cząsteczce
A. 1 i 2 B. tylko 3 C. tylko 2 D. 1 i 3 E. 1,2 i 3
14. Inhibitor kompetencyjny ( w stosunku do Vmax i Km)
1. Zmniejsza powinowactwo E do substratu, Vmax bez zmian (Vmax rośnie nie maleje!)
2. Zwiększa powinowactwo enzymu do substratu, Vmax rośnie
3. Nie zmienia powinowactwa E do S, Vmax maleje
4. Zmniejsza powinowactwo E do S, Vmax maleje
5. Obniża powinowactwo E do S, obniża Vmax.
A. tylko 1 B. tylko 2 C. tylko 3 D. tylko 5 E. wszystkie odp. są złe
15. Jony Mg 2+ są niezbędne w działalności kinaz, ponieważ:
1. Z centrum kinetycznym tworzą połączenie E-Me-S
2. Są niezbędne do kończenia reakcji przez ATCazy
3. Ułatwiają oddysocjowanie reszt fosforanowych z adenozynotrifosforanem tworząc z nim
wiązania koordynacyjne
4. Pełnią funkcję aktywatorów allosterycznych dla heksokinaz i glukokinaz
5. Tworzą z ATP wiązania wodorowe lub jonowe dla ułatwienia odszczepienia jonów
nieorganicznych przy powstawaniu energii w trakcie hydrolizy
A. tylko 1 B. tylko 3 C. 3 i 4 D. 1 i 5 E. tylko 5
16. Do białek enzymatycznych prostych zaliczamy:
1. Pepsyna(T ), trypsyna(T)
2. Katalaza(T), chymotrypsyna(T)
3. Rybonukleaza(T), anhydraza węglowa(N)
4. Chymotrypsyna,(T) peroksydaza glutaminowa(N)
5. Peroksydaza glutationowa(N), oksydaza cytochromowa(N)
A. tylko 1 B. tylko 2 C. tylko 1 i 2 D. tylko 3 E. 4 i 5
17. W utworzeniu kompleksu E-S mogą brać udział wiązania(oddziaływanie):
1. Wodorowe
2. Siły Van der Vaalsa
3. Elektrostatyczne
4. Atomowe
5. Hydrofobowe
A. tylko 1 B. tylko 3 C. 1,2 i 3 D. 1,2,3 i 5 E. wszystkie
18. Prawdziwe zdania to:
1. Holoenzym to połączenie apoenzymu z koenzymem
2. Grupę prostetyczną można oddzielić od apoenzymu przez dializę
3. Układ żelazoporfiryny katalazy lub peroksydazy jest przykładem grupy prostetycznej…
4. …
5. …
A. tylko 1 B. tylko 3 i 4 C. tylko 3 i 5 D. wszystkie są prawdziwe E. wszystkie są błędne
19. Koenzymami I klasy enzymów są m.in.:
1. Pochodne ryboflawiny(FAD i FMN T), Sam(N), ubichinon(T)
2. Pochodne kwasu nikotynowego, G-SH(N), amid kwasu ditiooktanowego
3. NADP+(T), PAPS, FAD(T),FMN(T)
4. Pochodne pirydoksalu, biotyna, kwas askorbinowy
5. Pochodne kwasu pantotenowego, NAD+, mononukleotyd flawinowy, FMNH2 ?
A. 2 i 3 B. tylko 2 C. tylko 5 D. 2 i 5 E. 1 i 4
20. Z przemian cukrowców, prawdziwe zdania to:
1. Glukozo-6-fosfataza to transferaza mięśniowa, pozwalająca na uzyskanie dodatkowej
energii w fosforylacji substratowej
2. Karboksylaza pirogronianowa jest enzymem mitochondrialnym(?), należy do ligaz
3. Przejście szczawiooctanu z mitochondrium do cytozolu przebiega dzięki dehydrogenazie
jabłczanowej
4. Reakcję przemiany pirogronianiu do fosfoneolopirogronianiu katalizuje karboksylaza
fosfoenolopirogronianowa (N-kinaza pirogronianowa)
5. Fosfofruktokinaza 2, katalizuje przemianę 2,6 FBO, który to hamuje glukogenezę i aktywuje
glikolizę
A. 1,4 i 5 B. 1,2 i 3 C. 2,3 i 5 D. tylko 4 E. tylko 5
21. W glikogenezie biorą udział:
1. Fosfataza glikogenowa
2. Transferaza (glikogenowa)
3. Fosforylaza glikogenu
4. α-1,6-glukozydaza
5. α-1,4-glukozydaza
6. Fosfotransferaza glikogenowa
A.1,2 i 4 B. 2,3 i 4 C. 1,3 i 4 D. 2,4 i 6 E. 3 i 4
22. Etapy glikolizy katalizowane przez enzymy z klasy transferaz to:
1. Fosforylacja glukozy (T- przez heksokinazę)
2. Fosforylacja F-6-P (T- przez fosfofruktokinazę)
3. Przemiana 1,3-difosfoglicerynianu do 3-fosfoglicerynianu (T- Kinaza fosfoglicerynianowa)
4. Przemiana 3-fosfoglicerynianu do 2-fosfoglicerynianu (T- Mutaza fosfoglicerynianoiwa)
A. 1,2 i 3 B. 1,2 i 4 C. 2 i 4 D. 2 i 3 E. wszystkie
23. Aldolazy- zdania prawdziwe:
1. Substratem w procesie glikolizy jest dla tego enzymu 1,6-FBP dając GAP i DHAP
2. W procesie glikolizy substratem może być F-1-P, wówczas powstaje aldehyd
glicerynowy i fosfodihydroksyaceton
3. W procesie glukoneogenezy substratem dla enzymu staje się powstały w glikolizie aldehyd
glicerynowy i DHAP
4. W procesie glukoneogenezy substratem dla enzymu staje się GAP i DHAP
5. Gdy substratem jest Thr to powstaje aldehyd glicerynowy + Gly
6. Gdy substratem jest Thr to powstaje aldehyd octowy + amino octan
A. 1 i 2 B. 2,3 i 5 C. 4 i 6 D. 1,2 i 6 E. 1,3 i 6
24. W skład kompleksu dehydrogenazy pirogronianowej(multienzym) wchodzą:
1. Kinaza pirogronianowa
2. Dehydrogenaza pirogronianowa
3. Acetylotransferaza dihydroliponianowa
4. Transferaza sukcynylo-CoA
5. Dehydrogenaza dihydroliponianowa
A. 1,2 i 4 B. 2,3 i 4 C. 3 i 5 D. 2,3 i 5 E. 1 i 2
25. Zaznacz enzymy związanie z wykorzystaniem ciał ketonowych jako materiału energetycznego
1. 3-ketotiolaza
2. Transferaza bursztynylo- CoA
3. Liaza HMG- CoA
4. Syntetaza acetoacetylo-CoA
5. Syntetaza acylo-CoA
A. 1 i 5 B. 2 i 4 C. 1,3 i 4 D. 1,2 i 4 E. 2,3 i 4
26. Enzymy dostarczające energii do elongacji kwasów tłuszczowych, to:
1. Liaza izocytrynianowa ATP-zależna
2. Dehydrogenaza G-6-P
3. Dehydrogenaza jabłczanowa
4. Cytozolowa dehydrogenaza izocytrynianu
5. Enzym jabłczanowy
6. Dehydrogenaza 6-P-glukonianowa
A. 1,2 i 3 B. 4 i 5 C. 2,4,5 i 6 D. 2,3,4 i 6 E. wszystkie
27. Z biosyntezy cholesterolu- prawdziwe są:
1. Fosforylacja reduktazy HMG-CoA zmniejsza aktywność tego enzymu
2. Szybkość translacji reduktazy HMG-CoA jest hamowana przez sterolowe pochodne
cholesterolu ?
3. Element regulatorowy wrażliwy na sterol (SRE) konroluje transkrypcję mRNA
reduktazy HMG-CoA
4. Rozpad reduktazy HMG-CoA zachodzi wyłącznie pod wpływem niesterolowych
metabolitów pochodzących z mewalonianu
A. 1,2 i 3 B. 1 i 3 C. 2 i 4 D. 2,3 i 4 E. wszystkie
28. W jednym cyklu β-oksydacji kwasów tłuszczowych:
1. W reakcji katalizowanej przez dehydrogenazę L-(+)-3-hydroksyacylo-CoA powstaje
cząsteczka FADH2, która jest źródłem 2 ATP w łańcuchu oddechowym (N)
2. Dehydrogenaza acylo-CoA to flawoproteina katalizująca powstawanie ∆2-trans-enoilo-CoA
3. Zużywa się jedna cząsteczka NADH+H+ i jedna FADH2
4. Hydrataza ∆2-trans-enoilo-CoAkatalizuje powstawanie 2,3-nienasyconego acylo-CoA
5. Bierze udział enzym reduktaza 3-ketoacylo-CoA, katalizujący powstawanie
3-hydroksyacylo-CoA
A. 1,2 i 4 B. tylko 1 C. tylko 2 D. 2,3 i 4 E. 2,4 i 5
29. Reduktaza NADH-Q zawiera centra typu:
1. 2 Fe-2S
2. 4 Fe-4S
3. 4 Fe- 2S (N)
Właściwe to A. tylko 1 B. 1 i 2 C. tylko 3 D. 2 i 3 E. wszystkie
30.
31. W biosyntezie hemu uczestniczą enzymy:
1. Synteza δ-aminolewulinowa
2. Deaminaza porfobilinogenowa
3. Syntaza uroporfirynogenowa III
4. Kosyntaza uroporfirynogenowa III
5. Cytozolowa dekarboksylaza
6. Cytozolowa ferrochelataza
A.1,3 i 4 B. 2,3,5 i 6 C. 1,2,3,4 i 5 D. 1,3,4 i 5 E. wszystkie
32. Przykładem enzymów które mają postać zymogenów są:
1. Pepsyna, amylaza
2. Pepsyna, trypsyna
3. Chymotrypsyna, lipaza
4. Chymotrypsyna
A. 1 i 2 B. 2 i 3 C. 3 i 4 D. 2 i 4 E. tylko 2
Wyszukiwarka
Podobne podstrony:
Enzymy egzamin 1 termin 14
enzymy
pros 4 Enzymy 1
Egzamin zaoczne
Pytania egzaminacyjneIM
inhibicja enzymy wykresy
ENZYMY prezentacja biochemia
Enzymy
enzymy prezentacja
ANALIZA WYNIKÓW EGZAMINU GIMNAZJALNEGO DLA UCZNIÓW KLAS III
zadania egzaminacyjne
Egzamin 2008 2009
kol enzymy
Egzamin poprawkowy I 2009 2010
więcej podobnych podstron