15. Zjawiska korpuskularno-falowe
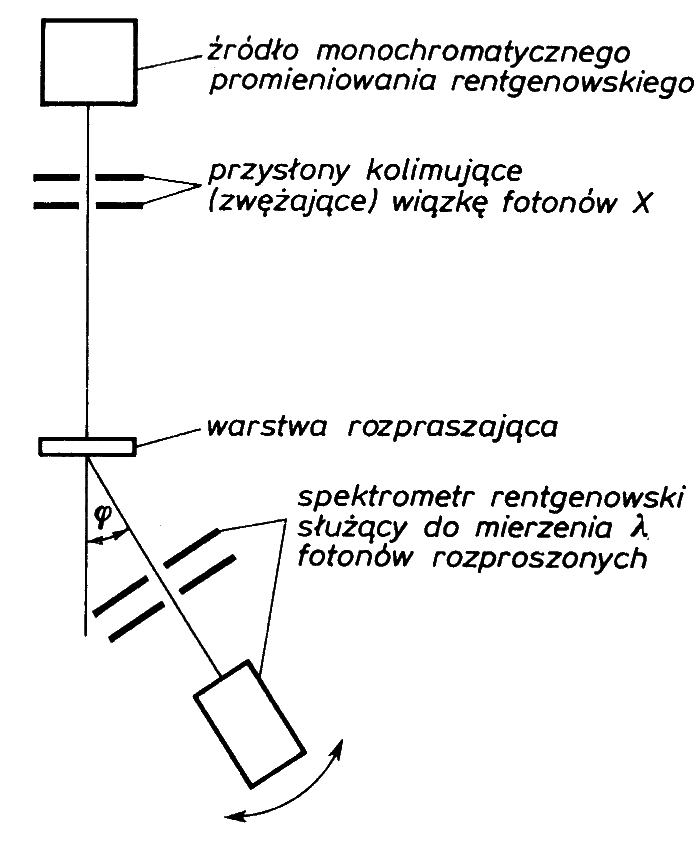
15.3. Zjawisko Comptona
Jest to drugi efekt wskazujący na korpuskularna naturę światła. Compton (1923) zaobserwował rozproszone promienie X o zmienionej długości fali. Klasyczna teoria fal elektromagnetycznych zjawisko rozproszenia tłumaczyła jako pobudzenie do drgań elektronów ośrodka rozpraszającego, które staja się wtórnym źródłem fal - ale bez zmiany długości !
Według teorii kwantowej zjawisko polega na zderzeniu padającego fotonu z elektronem swobodnym. Podczas zderzenia foton oddaje elektronowi jedynie część energii.
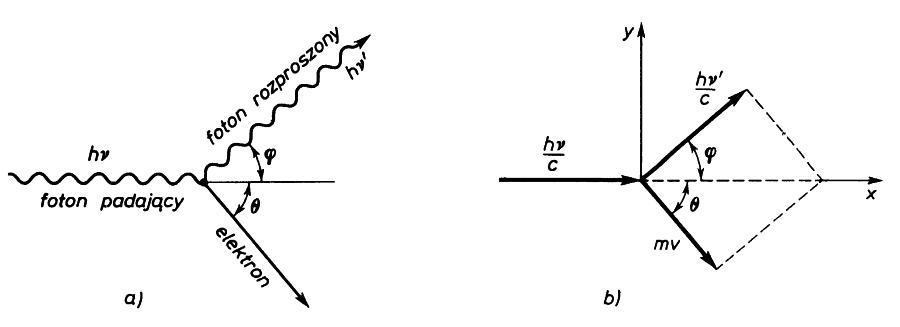
Zasada zachowania energii: Zasada zachowania pędu:
Zasada zachowania energii: Zasada zachowania pędu dla osi OX:
Zasada zachowania pędu dla osi OY:
Po wyeliminowaniu z równań v oraz ϕ otrzymujemy:
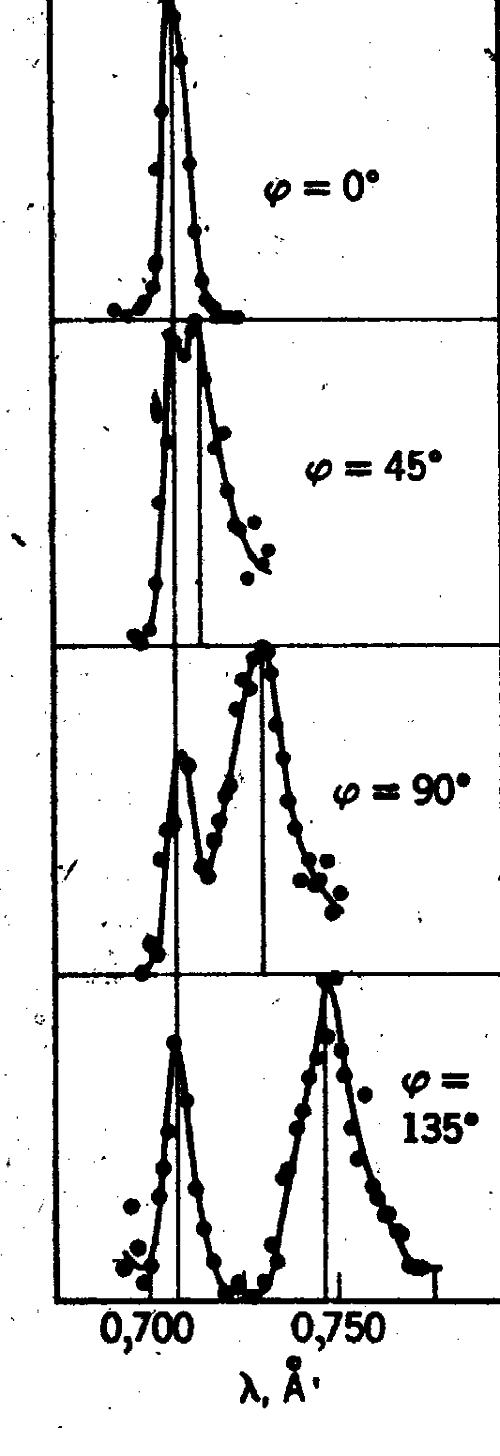
W zjawisku Cmptona zmiana długości fali nie zależy od energii fotonu padającego, a zależy jedynie od kata jego rozproszenia.
Dla ϕ = 00 Δλ = 0; dla ϕ = 1800 Δλ = 2 Λ (rozproszenie wsteczne), a dla ၪ = 900 ၄ၬ = Λ
Oba opisy światła: falowy i korpuskularny są poprawne: w pewnych przypadkach promieniowanie elektromagnetyczne zachowuje się jak fala o określonej długości i częstotliwości, a w innych jak zbiór fotonów o określonym pędzie i zerowej masie spoczynkowej. Przejście od obrazu falowego do korpuskularnego opisują wzory:
Dokładniej omówiony ten problem będzie w rozdz.16.
15.4. Model atomu Bohra
Postulaty Bohra:
I. Atom wodoru może znajdować się jedynie w ściśle określonych stanach stacjonarnych, w których nie promieniuje energii.
II. Elektron atomu w stanie stacjonarnym porusza się tylko po takich orbitach kołowych, dla których moment pędu jest skwantowany, tzn. spełnia zależność:
gdzie n = 1, 2, ..
III. Warunkiem wypromieniowania energii jest przejście atomu ze stanu o energii wyższej Ek do stanu o energii niższej Ej : hν = Ek - Ej
Skoro elektron porusza się po orbicie kołowej pod wpływem siły kulombowskiej będącej siłą dośrodkową, to z tego warunku można obliczyć prędkość elektronu. A zatem pęd p elektronu i jego moment pędu L można zapisać:
Uwzględniając warunek kwantyzacji momentu pędu otrzymujemy wyrażenia na promień orbity i energię kinetyczną elektronu.
A zatem promień orbity rośnie jak n2, a energia całkowita rośnie (do zera) jak 1/n2. Jonizacji atomu odpowiada n = ∝. Wówczas całkowita energia atomu E = 0, a r = ∝.
Energia atomu w stanie podstawowym n = 1 : E1 = -13,6 eV
Na podstawie powyższych wzorów otrzymujemy wzór na częstość linii widmowych atomu wodoru:
gdzie R jest stałą Rydberga.
Przejścia elektronu miedzy kwantowanymi poziomami energetycznymi można przedstawić w postaci tzw. serii widmowych.
Linie serii zagęszczają się w kierunku fal krótkich, a każdą serię ogranicza linia odpowiadająca najmniejszej długości fali danej serii.
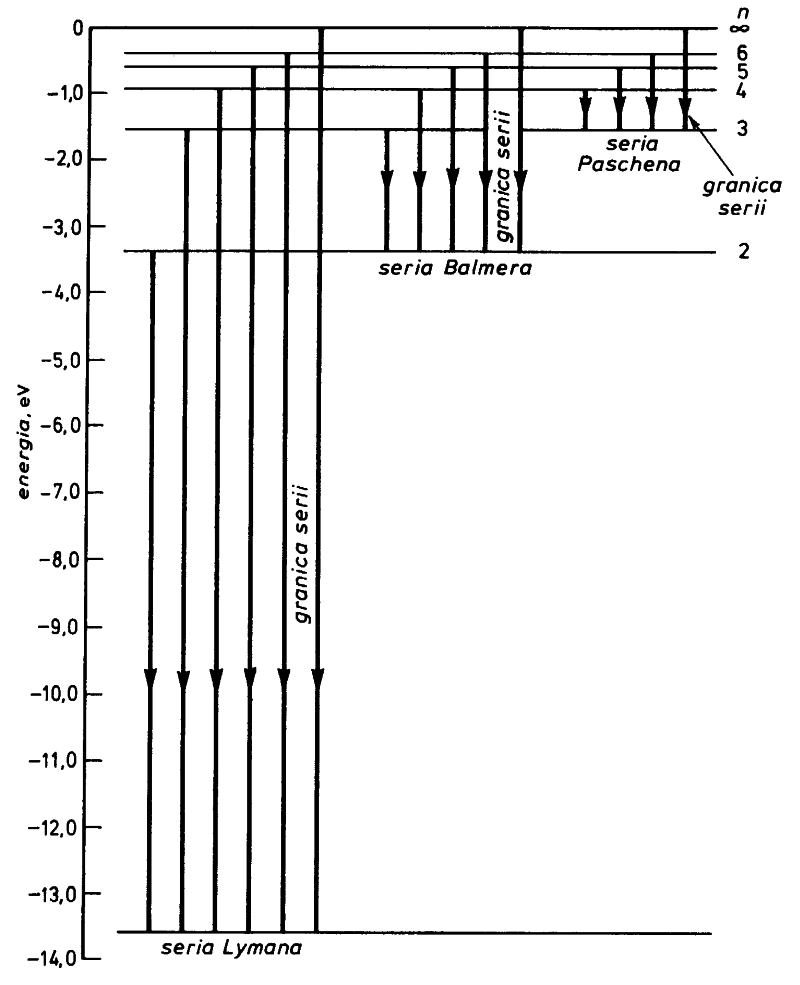
Przykład:
Obliczyć długość fali emitowanej przy przejściu elektronu z orbity 3 na pierwszą.
Wyszukiwarka
Podobne podstrony:
Korp fal 1 2
KORP TRANS GRUPY TEORII KTN i BIZ 2010
Fizyka 25a, Labolatoria fizyka-sprawozdania, !!!LABORKI - sprawozdania, 25 - Interferencja fal akust
34Prędkość fal akustycznych gazach
Sprawno cw6 anteny, pwr-eit, Anteny i propagacja fal radiowych
wyznaczanie dlugosci fal za pomoca siatki dyfrakcyjnej, studia, fizyka
FIZ OP~6, Zjawisko nak˙adania si˙ 2 lub wi˙cej fal nazywamy zjawiskiem interferencji
Wyznaczanie długości fal podstawowych barw w widmie, POLITECHNIKA CZ˙STOCHOWSKA
fal szeregowy
Elektrotermia - sciaga, Widmo fal elektromagnetycznych wykorzystywanych w elektrotermii
Wyznaczanie długości fal świetlnych przepuszczanych przez (2), Pracownia Zak˙adu Fizyki Technicznej
!!! KOMPENDIUM WIEDZY !!, 29, 25.21 Polaryzacja fal i prawo Mallusa.
sciaga z fizyki, 10-20, Interferencja fal-zjawisko nakładania się dwóch lub więcej fal spójnych,czyl
sciaga z fizyki, 10-20, Interferencja fal-zjawisko nakładania się dwóch lub więcej fal spójnych,czyl
teoria fal
Bank korp id 79862 Nieznany (2)
więcej podobnych podstron