1. Wymień sposoby uzyskania wzrostu temperatury w tkankach głębokich grzanie endogenne
Techniki grzania głębokiego zawierają formy energii, takie jak energia elektromagnetyczna /diatermia/ i energia akustyczna /ultradźwięki/, które mogą być transmitowane do tkanek głębiej położonych i poprzez konwersję powodują wytwarzanie ciepła.
2. Wymień sposoby uzyskania wzrostu temperatury w tkankach powierzchniowych grzanie egzogenne
Aplikacje powierzchowne dotyczą tych technik, które w maksymalnie bezpiecznej dawce klinicznej powodują wzrost temperatury tkanek powierzchownych do poziomu o znaczeniu terapeutycznym. Stosując grzanie powierzchowne temperatura skóry podnosi się o 10°C, tkanki na głębokości ok. 1cm o 3°C, tkanki na głębokości 2 cm o 1.3°C. ciepło powierzchowne może być suche lub wilgotne, w zależności od źródła ciepła.
Ciepło suche: słońce, promieniowanie podczerwone, poduszki elektryczne, ciepłe okłady, suche powietrze, fluidoterapia, peloidoterapia.
Ciepło mokre: woda, inne płyny, wilgotne powietrze, wilgotne okłady, sauna.
3. Opisz fizjologiczne reakcje na wzrost temperatury w tkankach
Pod wpływem wzrostu temperatury w tkance powstaje seria fizjologicznych zmian /schemat/. Reakcje na grzanie terapeutyczne obejmują:
zwiększenie przepływu krwi w wyniku rozszerzenia naczyń przy towarzyszącym zwiększeniu ciśnienia w kapilarach;
zwiększenie przepuszczalności błony komórkowej;
zwiększenie tempa przemian metabolicznych;
zmiana szybkości przewodzenia nerwów czuciowych;
zwiększenie elastyczności tkanki kolagenowej w ścięgnach, torebce stawowej, mięśniach.
W wyniku powyższych efektów ciepło przyspiesza regenerację, zmniejsza obrzęk, powoduje relaksację mięśni i zmniejszenie bólu. Najważniejsze czynniki decydujące o ilości oraz intensywności biologicznych reakcji na ciepło obejmują:
terapeutyczny próg temperatury: 41.5-45°C;
czas utrzymania terapeutycznego progu temperatury od 3 do 30 minut;
im szybszy wzrost temperatury tym lepszy skutek;
właściwe grzanie w celowanej tkance.
Czynnikiem determinującym uzyskanie reakcji fizjologicznych na ciepło jest tempo przepływu krwi. Poniższe zestawienie przedstawia szybkość przepływu krwi w mięśniach uda w zależności od uzyskanej temperatury:
Średnia temperatura w mięśniu |
Szybkość przepływu krwi |
36°C |
2.7ml/min/100g |
37°C |
2.7ml/min/100g |
38°C |
2.7ml/min/100g |
39°C |
2.7ml/min/100g |
40°C |
2.7ml/min/100g |
41°C |
2.7ml/min/100g |
42°C |
10ml/min/100g |
43°C |
20ml/min/100g |
44°C |
30ml/min/100g |
45°C |
40ml/min/100g |
Reakcje systemowe:
Sercowo-naczyniowe (generalnie rozszerzenie naczyń skórnych, spadek obwodowego ciśnienia w wyniku rozszerzenia naczyń, co czasowo może spowodować zmniejszenie ciśnienia, zwiększenie ilości skurczów serca, co powoduje zwiększenie ilości przepływu krwi)
Wydzielanie potu (ochładza ciało, w stopach i dłoniach - reakcja na emocje, pot zawiera sole mineralne)
Oddechowe (wydychane powietrze uwalnia ciało ludzkie od pewnej ilości ciepła)
Wydzielnicze (nieznaczne ilości ciepła w moczu)
Zdolność do oddawania ciepła zależy od: ilości ciepła, przewodzenia termicznego, różnicy temperatur, czasu trwania aplikacji.
4. Podaj wskazania i przeciwwskazania do stosowania ciepła
WSKAZANIA
Zmniejszenie bólu i sztywności, zmniejszenie napięcia mięśni, zwiększenie zakresu ruchu, usprawnienie gojenia tkanek poprzez zwiększenie krążenia krwi.
Kiedy stosować aplikację ciepła powierzchownego?
Przed czynnymi ćwiczeniami, ze względu na działanie przeciwbólowe
Przed ćwiczeniami zwiększającymi bierny zakres ruchu (streching) ze względu na zwiększenie relaksacji i rozciągliwości tkanek miękkich
Przed stymulacją prądem elektrycznym ze względu na zmniejszenie oporności skóry
Przed trakcją, ze względu na relaksacje i zmniejszenie napięcia mięśni
Przed masażem, ze względu na zwiększenie krążenia krwi i relaksacje tkanek
W przypadku wystąpienia napięcia mięśni
Przed ultradźwiękami, ze względu na relaksację i lokalne ogrzanie tkanek powierzchownych
Przed mobilizacją stawów, ze względu relaksację i usprawnienie rozciągliwości tkanek powierzchownych
PRZECIWWSKAZANIA
aplikacja w obszarze z zaburzeniami czucia,
aplikacja w rejonie z zaburzeniami krążenia,
ogólne infekcje,
aplikacja w obszarze ostrej infekcji,
zakrzepowe zapalenie żył,
aplikacja na obszarem z nowotworem,
reumatoidalne zapalenie stawów w stanie ostrym,
świeża opuchlizna,
aplikacja na obszarze, gdzie występuje krwawienie lub jego zagrożenie,
aplikacja na obszarze, gdzie zastosowano maści rozgrzewające
u pacjentów, z którymi brak komunikacji.
5. Właściwości fizyczne i działanie biologiczne pola elektromagnetycznego wielkiej częstotliwości
Z punktu widzenia fizyki pole elektromagnetyczne określamy jako działanie siły na pewną odległość bez bezpośredniego kontaktu ze źródłem siły. Pojęcie pola związane jest zawsze z obszarem w obrębie którego siła związana z tym polem oddziaływuje.
Pole elektryczne - siła elektryczna
Pole magnetyczne - siła magnetyczna
Im bliżej źródła energii tym większa jest siła działająca w polu. Pole elektryczne i magnetyczne są współzależne, wzrost siły jednego pola powoduje wzrost drugiego i odwrotnie. Związek ten silniejszy wraz ze zwiększeniem częstotliwości. Pole elektryczne wytwarza pole magnetyczne i odwrotnie, dlatego też uogólniając mówimy o polu elektromagnetycznym.
Pole elektromagnetyczne = siła na dystans
↓
pole elektryczne i magnetyczne
↓
pole elektryczne jest 10 milionów silniejsze niż pole magnetyczne
↓
pole magnetyczne nie jest ważne dla efektów terapeutycznych, pełni funkcje tworzenia pola elektrycznego
Energia pola elektromagnetycznego działa na cząsteczki i jony tkankowe, nie powoduje depolaryzacji tkanek pobudliwych, jest czynnikiem odpowiadającym za wzrost temperatury w tkankach.
Terapia falami krótkimi - leczenie pacjenta za pośrednictwem pola elektromagnetycznego o częstotliwości 27.12 MHz.
Częstotliwości stosowane w fizykoterapii
Częstotliwość |
Nazwa klasyczna |
Nazwa nowoczesna |
27.12 MHz |
Terapia falą 11 metrową, terapia krótkofalowa |
Terapia 27. 12 MHz, terapia krótkofalowa |
433.92 MHz |
Terapia falą 69 cm, terapia falą decymetrową |
434 MHz |
2450 MHz |
Terapia falą 12 cm, terapia mikrofalowa |
2450 MHz |
W/w częstotliwości dają podobne efekty, posiadają podobne wskazania i przeciwwskazania. Występujące różnice dotyczą głębokości penetracji w tkance ogrzewanej oraz różną dystrybucją energii w organizmie.
Źródło |
Typ: |
Elektryczne |
Magnetyczne |
|
Zasada: |
Końcówki kabli przewodzących |
Kabel przewodzący |
|
Forma: |
Metalowa płytka |
Zwój |
|
Nazwa: |
Elektroda |
Magnetoda |
|
Skutek działania: |
Wytwarzanie ładunków elektrycznych |
Strumień ładunków elektrycznych |
Pole |
Elektromagnetyczne |
Pole elektryczne wytwarza pole magnetyczne |
Pole magnetyczne wytwarza pole elektryczne |
Wzajemne oddziaływanie biofizyczne
Energia elektromagnetyczna pola penetrującego tkanki jest zamieniona w ciepło. Ciepło jest wytwarzane w tkankach poprzez:
Ruch jonów,
Rotacje dipolową,
Ruch elektronów.
Ciepło to energia. Ilość ciepła zależy od przypadkowych ruchów atomów, jonów i molekuł. Kiedy tkanki składające się z dużej ilości jonów znajdą się w pole elektrycznym o częstotliwości 27 MHz , ich ruch jest przyspieszany w różnych kierunkach. W wyniku zwiększenia się ruchu jonów zderzają się one z molekułami, przez co zwiększa się ich ruch oraz ilość wewnętrznej energii kinetycznej i powstaje ciepło w tkance. Wiele tkanek, jak mięśnie i krew są głównie złożone z wody. Molekuły wody są elektrycznie neutralne, ale posiadają polaryzację, jeden koniec molekuły jest naładowany dodatnio, a drugi ujemnie (dipol). W polu elektrycznym o wysokiej częstotliwości następuje rotacja dipoli wody. Dzięki zwiększonej ruchomości powstaje ciepło. Pod wpływem pola elektrycznej wielkiej częstotliwości w atomach i molekułach nie posiadających ładunku elektrycznego może nastąpić przesunięcie powłoki elektronowej w stosunku do jądra atomu lub przesunięcie powłoki elektronowej cząsteczki symetrycznym rozkładzie ładunków w stosunku źródła symetrii ładunków dodatnich. Ruch jonów jest najbardziej skutecznym mechanizmem powodującym przemianę na ciepło wpływu prądu wielkiej częstotliwości. Ciepło, czyli wzrost prędkości ruchu cząsteczek, może prowadzić do:
mierzalnego wzrostu temperatury w tkankach
występowania reakcji na poziomie komórkowym ( wzrost temperatury nie jest mierzalny).
UWAGA!!! Tylko wzrost temperatury w skórze jest odczuwalny przez człowieka. Wzrost temperatury zależy od:
dawki
przewodnictwa tkanek
P = 0.5 σ E2 (W/cm3)
P - wartość rozproszonej energii
σ - przewodnictwo elektryczne tkanek (powstawanie ciepła bazuje na procesach elektrycznych)
E - amplituda siły pola elektrycznego
Miejsce rozpraszania energii zależy od częstotliwości i metody aplikacji.
Przewodnictwo tkanki mięśniowej i tłuszczowej przy różnych częstotliwościach
Częstotliwość MHz |
Przewodnictwo Tkanka mięśniowa |
Przewodnictwo tkanka tłuszczowa |
7 |
0.6 |
0.04 |
100 |
0.9 |
0.08 |
433 |
1.4 |
0.12 |
915 |
1.6 |
0.15 |
2450 |
2.2 |
0.21 |
Przewodnictwo tkanek wzrasta wraz z częstotliwością. Przewodnictwo tkanki mięśniowej jest ok. 10 razy wyższe niż tkanki tłuszczowej. Energia rozproszona jest wyrażana w W/kg w celu standaryzacji stosując specyficzną gęstość masy p. Daje to nam tzw. specyficzny współczynnik absorpcji (SAR), ciepło wytwarzane w czasie sekundy na jednostkę objętości.
SAR = 0.5 σ E2 /p (W/kg)
Dla mięśni p= 1070 kg/ cm3, dla tkanki tłuszczowej p = 940 kg/ cm3
Wartość współczynnika absorpcji decyduje o głębokości penetracji, która jest definiowana jako głębokość, na której siła pola działającego na tkanki zmniejsza się o 37%.
Długość fali a głębokość penetracji
Częstotliwość MHz |
Długość fali (m) |
Głębokość penetracji (m) |
|||
|
Mięśnie |
Tłuszcz |
Powietrze |
Mięśnie |
Tłuszcz |
27 |
0.68 |
2.41 |
11.11 |
0.14 |
1.59 |
100 |
0.27 |
1.06 |
3.0 |
0.067 |
0.60 |
433 |
0.088 |
0.29 |
0.69 |
0.036 |
0.26 |
915 |
0.045 |
0.14 |
0.33 |
0.030 |
0.18 |
2450 |
0.018 |
0.052 |
0.12 |
0.017 |
0.097 |
Z dotychczasowych rozważań wynika iż na tkanki działa głównie pole elektryczne. Może ono powstawać przy użyciu metod:
kondensatorowej;
Rodzaje aplikacji:
Poprzeczna: pole prostopadłe do warstw tkanek, słabo penetruje, skóra i podskórna tkanka tłuszczowa stanowią pewien rodzaj ekranu (bariery) z naładowanych cząstek w przestrzeni granicznej tych warstw; ciepło powstaje tylko w powierzchownych warstwach ciała. Przy 27 MHz SAR w podskórnej tkance tłuszczowej jest 10 razy większy niż w leżącej pod nią warstwie mięśni.
Podłużna: pole elektryczne jest równoległe do tkanek, penetracja jest lepsza, gdyż efekt ochronny jest mniejszy. Przy 27 MHz SAR w tkance mięśniowej jest 20 do 30 razy większy niż w tkance tłuszczowej.
2. Indukcyjnej: pole magnetyczne wytworzone przez magnetodę (circuploda) powoduje powstawanie w tkankach pole elektrycznego.
WNIOSKI
Metoda kondensatorowa → ułożenie poprzeczne
Powierzchowne ciepło ( IR, okłady lignoparafinowe)
Skóra ok. 10x mocniej przegrzana niż mięśnie.
Metoda kondensatorowa → ułożenie podłużne (Rysunek)
Większa penetracja
Po przejściu skóra / podskórna tkanka tłuszczowa 20-30 x więcej ciepła w mięśniach niż w skórze.
Metoda indukcyjna
Pole elektryczne zamknięte w zwoju jest stosunkowo silne
Pole elektryczne w osi zwoju jest minimalne
Pole elektryczne jest równoległe do tkanek.
Metody wytwarzania:
Emisja ciągła; pole elektromagnetyczne działa w sposób ciągły, wywołuje głównie efekt termiczny, zmniejszenie natężenia pola powoduje obniżenie głębokości penetracji i brak efektów w tkankach głębiej położonych;
Emisja impulsowa; energia emitowana jest w postaci impulsów, których czas trwania i częstotliwość może być dobierana w szerokim zakresie w zależności od aparatury.
WNIOSKI
Siła pola elektrycznego jest największa w tkankach dobrze przewodzących,
Pole efektywne jest okrągłego kształtu, wywołuje powstawanie w tkankach tzw. prądów „Eddy'go” (wirowe)
Oś magnetody musi być ułożona obok chorej powierzchni.
6.Przeciwskazania do stosowania diatermii krótkofalowej
PRZECIWWSKAZANIA
UWAGA!! Zaabsorbowane pole elektromagnetyczne nie może wywoływać bólu ani silnych wrażeń cieplnych.
Nie należy stosować ciepła, jeżeli występują u pacjenta problemy krążeniowe lub możemy pogorszyć stan zapalny.
Metalowe implanty, rozrusznik serca (dystans 4.5 m), zaburzenia krążenia (zakrzepica, krwawienie zagrażające), tkanki ischemiczne, choroba Burgera, Raynaud'a, choroby serca, ciąża (okolica brzucha, krzyże, lędźwie), miesiączka, gruźlica, zaburzenia czucia, neuropatie, gorączka, infekcje, po leczeniu promieniami Rentgena (po 6 miesiącach).
Nie stosować na takie tkanki jak: oczy, jądra, wilgotne rany, tkanki w wysokim tempie mitozy (guzy, organy krwiotwórcze (powyżej 18 roku życia).
7.Wymień rodzaje aplikacji impulsowym prądem elektromagnetycznym wielkiej częstotliwości . Opisz jeden z nich (indukcyjna, kondensatorowa)
Długość fali a głębokość penetracji
Częstotliwość MHz |
Długość fali (m) |
Głębokość penetracji (m) |
|||
|
Mięśnie |
Tłuszcz |
Powietrze |
Mięśnie |
Tłuszcz |
27 |
0.68 |
2.41 |
11.11 |
0.14 |
1.59 |
100 |
0.27 |
1.06 |
3.0 |
0.067 |
0.60 |
433 |
0.088 |
0.29 |
0.69 |
0.036 |
0.26 |
915 |
0.045 |
0.14 |
0.33 |
0.030 |
0.18 |
2450 |
0.018 |
0.052 |
0.12 |
0.017 |
0.097 |
Z dotychczasowych rozważań wynika iż na tkanki działa głównie pole elektryczne. Może ono powstawać przy użyciu metod:
kondensatorowej;
Rodzaje aplikacji:
Poprzeczna: pole prostopadłe do warstw tkanek, słabo penetruje, skóra i podskórna tkanka tłuszczowa stanowią pewien rodzaj ekranu (bariery) z naładowanych cząstek w przestrzeni granicznej tych warstw; ciepło powstaje tylko w powierzchownych warstwach ciała. Przy 27 MHz SAR w podskórnej tkance tłuszczowej jest 10 razy większy niż w leżącej pod nią warstwie mięśni.
Podłużna: pole elektryczne jest równoległe do tkanek, penetracja jest lepsza, gdyż efekt ochronny jest mniejszy. Przy 27 MHz SAR w tkance mięśniowej jest 20 do 30 razy większy niż w tkance tłuszczowej.
2. Indukcyjnej: pole magnetyczne wytworzone przez magnetodę (circuploda) powoduje powstawanie w tkankach pole elektrycznego.
WNIOSKI
Metoda kondensatorowa → ułożenie poprzeczne
Powierzchowne ciepło ( IR, okłady lignoparafinowe)
Skóra ok. 10x mocniej przegrzana niż mięśnie.
Metoda kondensatorowa → ułożenie podłużne (Rysunek)
Większa penetracja
Po przejściu skóra / podskórna tkanka tłuszczowa 20-30 x więcej ciepła w mięśniach niż w skórze.
Metoda indukcyjna
Pole elektryczne zamknięte w zwoju jest stosunkowo silne
Pole elektryczne w osi zwoju jest minimalne
Pole elektryczne jest równoległe do tkanek.
Metody wytwarzania:
Emisja ciągła; pole elektromagnetyczne działa w sposób ciągły, wywołuje głównie efekt termiczny, zmniejszenie natężenia pola powoduje obniżenie głębokości penetracji i brak efektów w tkankach głębiej położonych;
Emisja impulsowa; energia emitowana jest w postaci impulsów, których czas trwania i częstotliwość może być dobierana w szerokim zakresie w zależności od aparatury.
WNIOSKI
Siła pola elektrycznego jest największa w tkankach dobrze przewodzących,
Pole efektywne jest okrągłego kształtu, wywołuje powstawanie w tkankach tzw. prądów „Eddy'go” (wirowe)
Oś magnetody musi być ułożona obok chorej powierzchni.
EFEKTY APLIKACJI CZĘSTOTLIWOŚCIĄ 27 MHz
Efekty biologiczne, nietermiczne są efekty terapeutyczne występujące jako wynik wpływu na lokalne procesy metaboliczne bez udziału CUN czy podwzgórza.
Podwyższenie poziomu Ca
Normalizacja Ph
Zmiany w błonie komórkowej i potencjale błonowym, powodujące zwiększenie wrażliwości na bodziec
Obniżenie poziomu glikogenu
Wzrost liczby leukocytów i limfocytów.
Efekty termiczne. Wzrost temperatury krwi, stymulacja termoreceptorów w skórze powoduje pobudzenie układu nerwowego.
1 i 2 bazuje na powstawaniu ciepła, w 1 nieodczuwalne, w 2 odczuwalne
8.Przeciwwskazania do stosowania impulsowego pola elektromagnetycznego wielkiej częstotliwości
UWAGA!! Zaabsorbowane pole elektromagnetyczne nie może wywoływać bólu ani silnych wrażeń cieplnych.
Nie należy stosować ciepła, jeżeli występują u pacjenta problemy krążeniowe lub możemy pogorszyć stan zapalny.
Metalowe implanty, rozrusznik serca (dystans 4.5 m), zaburzenia krążenia (zakrzepica, krwawienie zagrażające), tkanki ischemiczne, choroba Burgera, Raynaud'a, choroby serca, ciąża (okolica brzucha, krzyże, lędźwie), miesiączka, gruźlica, zaburzenia czucia, neuropatie, gorączka, infekcje, po leczeniu promieniami Rentgena (po 6 miesiącach).
Nie stosować na takie tkanki jak: oczy, jądra, wilgotne rany, tkanki w wysokim tempie mitozy (guzy, organy krwiotwórcze (powyżej 18 roku życia).
9.Biologiczne działanie ultradźwięków na organizmy żywe.
Działanie biologiczne - jest wypadkową działania cieplnego, mechanicznego i fizykochemicznego UD.
działanie miejscowe i ogólne, które jest następstwem mechanizmów nerwowo humoralnych
usprawnienie krążenia krwi
zwiększenie rozciągliwości włókien kolagenowych
przyspieszenie gojenia się ran
działanie p.bólowe
przyspieszenie regeneracji tkanek w stanie zapalnym
stan ostry (24-36 h po urazie) - przyśpieszenie zapalnej fazy naprawy
faza granulacji (3 dni - 3 tyg.) - usprawnianie syntezy kolagenu
faza odbudowy (3 tyg. - 3 mc.) - zwiększenie elastyczności kolagenu bez zmniejszenia wytrzymałości
Działanie nietermiczne:
głównie efekty mechaniczne (mikromasaż tkanek)
zwiększenie przepuszczalności błon komórkowych, podtrzymując proces dyfuzji, dzięki działaniu strumienia akustycznego.
okresowe zmiany w ciśnieniu, stosowanie dużych mocy może powodować kawitację (jamy powstające wskutek rozrywania cząsteczek, pod wpływem podciśnienia powstającego w fazie rozrzedzenia, które wypełniają się parami cieczy - mogą zagrażać rozerwaniem tkanki.)
10.Opisz efekty termiczne i nietermiczne działania ultradźwięków
Termiczne
Nietermiczne
Energia mechaniczna zamieniona w energię cieplną może spowodować lokalne podwyższenie temperatury. Działanie cieplne - zależy od:
właściwości tkanek (gęstości, wsp. absorbcji, poj. cieplnej)
krążenia krwi
kąta padania
częstotliwości
dawki (intensywności)
czasu działania
Przy dawkach niższych 0,3 W/cm2 UD nie mają działania cieplnego. Największe działanie cieplne występuje na granicy dwóch ośrodków. Ciepło powstaje głównie w tkankach o wysokim współczynniku absorpcji (kość, chrząstka, okostna, ścięgno, więzadło).
Gdy chcemy uzyskać efekt termiczny stosujemy:
głowica 4 cm2
wysoka dawka, czas działania minimum 5 min.
Działanie mechaniczne
mikromasaż w wyniku różnicy ciśnień
Działanie fizykochemiczne
przyśpieszenie rozpadu białek (utlenianie i redukcja)
wzrost szybkości dyfuzji
rozpad wody (zmiany pH - wzrost)
Działanie biologiczne - jest wypadkową działania cieplnego, mechanicznego i fizykochemicznego UD.
działanie miejscowe i ogólne, które jest następstwem mechanizmów nerwowo humoralnych
usprawnienie krążenia krwi
zwiększenie rozciągliwości włókien kolagenowych
przyspieszenie gojenia się ran
działanie p.bólowe
przyspieszenie regeneracji tkanek w stanie zapalnym
stan ostry (24-36 h po urazie) - przyśpieszenie zapalnej fazy naprawy
faza granulacji (3 dni - 3 tyg.) - usprawnianie syntezy kolagenu
faza odbudowy (3 tyg. - 3 mc.) - zwiększenie elastyczności kolagenu bez zmniejszenia wytrzymałości
Działanie nietermiczne:
głównie efekty mechaniczne (mikromasaż tkanek)
zwiększenie przepuszczalności błon komórkowych, podtrzymując proces dyfuzji, dzięki działaniu strumienia akustycznego.
okresowe zmiany w ciśnieniu, stosowanie dużych mocy może powodować kawitację (jamy powstające wskutek rozrywania cząsteczek, pod wpływem podciśnienia powstającego w fazie rozrzedzenia, które wypełniają się parami cieczy - mogą zagrażać rozerwaniem tkanki.)
Efekt termiczny pożądany?
Duża głowica, półstacjonarnie
Impuls ciągły, pacjent odczuwa ból
Krótkie wrażenie bólu? → czasowo wprowadzić współczynnik wypełnienia od 1:2 do 1:4 (25%), jeżeli odczucie bólu zniknie po ok.30 sek. Znów wracamy do impulsu ciągłego.
W przypadku zwiększenia bólu (ból okostnowy) → zmniejszyć intensywność.
Niewskazane jest zbyt szybkie ślizganie głowicy po skórze, gdyż tempo ruchu musi być wystarczająco wolne, aby tkanki zdążyły się zdeformować i wystarczająco szybkie, aby zapobiec powstawaniu „gorących punktów”.
Efekt nietermiczny pożądany?
Współczynnik wypełnienia 1:4
Czas leczenia: leczona pow=ERA minimum 5 minut, leczona powierzchnia > ERA, każda pow= ERA minimum 5 minut.
11.Metody aplikacji ultradźwięków
Bezpośrednia (konieczne zastosowanie środka sprzęgającego, cienka warstwa np. żelu). Powierzchnia leczona ≤ ERA → połstacjonarnie, powierzchnia leczona > ERA → dynamicznie. Max. Powierzchnia leczona = 3 x ERA.
Pośrednia: w środowisku wodnym (małe nieregularne powierzchnie, woda odgazowana, odległość głowicy ok. 10 cm lub 2 cm, wolny ruch głowicy, zwiększenie dawki). Metoda niewygodna, czasochłonna, terapeuta narażony na działanie UD. Kapturki wypełnione płynem (woda, olej, gliceryna), zastosowanie do leczenia kolana, łopatki, krętarza).
Przed przystąpieniem do terapii należy:
przeprowadzić wywiad z pacjentem
zlokalizować tkankę objętą chorobą, określić jej naturę, głębokość, tkanki otaczające,
przy ustalaniu dawki należy wziąć pod uwagę fazę naprawy tkanek
wybrać metodę aplikacji
prawidłowa pozycja wyjściowa, bez bólu, relaksacja, tkanki leczone maksymalnie zbliżone do powierzchni skóry
wyjaśnić pacjentowi sposób leczenia i odczucia (zawsze bezbolesne),
dawka: częstotliwość 1 lub 3 MHz, pow, głowicy 1 lub 4 lub 10 cm2, ciągła lub impulsowa forma terapii, moc (Watt), czas zabiegu.
włączyć urządzenie, sprawdzić parametry dobrane do terapii, odtłuścić skórę, środek sprzęgający na głowicę, wykonywać ruchy ciągłe w formie nachodzących na siebie okręgów lub podłużne, nie wolno odrywać głowicy od skóry, w razie bólu lub parzenia należy terapię zatrzymać i zmienić parametry.
Po terapii oczyścić skórę pacjenta i głowicę, ocenić efekty, ustalić termin nastepnej wizyty.
12.W jaki sposób dobieramy dawkę UD
dawka: częstotliwość 1 lub 3 MHz, pow, głowicy 1 lub 4 lub 10 cm2, ciągła lub impulsowa forma terapii, moc (Watt), czas zabiegu.
Powierzchnie znajdujące się blisko wyrośli kostnych należy leczyć małą dawką. W stanach ostrych należy stosować dawkę 0,1-0,5 W/cm2, w stanach podostrych 0,5-1,0 W/cm2, w stanach chronicznych 1,0-2,0 W/cm2 (USA), do 3 W/cm2 w Europie. Jeżeli pacjent toleruje można zwiększyć dawkę w przypadku stosowania UD w formie impulsowej, a także w wodzie. Ilość zabiegów 12-15, 2 tygodnie przerwy i kontynuacja w razie konieczności. W przypadku braku efektów leczniczych należy zmienić terapię i modyfikować ją w zależności od objawów. Jeżeli po 24-48 godzin po zabiegu następuje zwiększenie dolegliwości, należy przerwać terapię. Maksymalny obszar leczenia obejmuje powierzchnię o wielkości równej 3X powierzchnia głowicy leczniczej.
Intensywność; W/ cm2 , max 3 W/ cm2
Max ERA = 5 cm2 x 3 W/ cm2 = 15 W
Min ERA = 0.5 cm2 x 3 W/ cm2 = 1.5 W
ERA 1 cm2 (1:2), 1 W/cm2 → moc efektywna = 1 x 0.5 x 1= 0.5 W
13.NEGATYWNE EFEKTY DZIAŁANIA UD
uszkodzenie tkanki poprzez zbyt wysoką dawkę, zmniejszenie poziomu cukru we krwi, wywołanie uczucia zmęczenia, nerwowość i nadmierna wrażliwość, zmienny apetyt, skłonność do przeziębień
14. Wymień sposoby obniżania temperatury w tkankach
Zabiegi miejscowe
Okłady schładzane (żel, substancje hydrofilne) lub chemiczne (wytwarzanie zimna na drodze reakcji chemicznych). Czas zabiegu 10-15 minut. W celu zabezpieczenia skóry należy stosować suchy ręcznik lub mokry w celu zwiększenia przewodnictwa.
Schłodzone ręczniki. Czas zabiegu 10-15 minut. Należy je ciągle zmieniać, aby utrzymać obniżenie temperatury w tkankach.
Zimna woda z dodatkiem pokruszonego lodu. Schładzanie przez zanurzenie dystalnych części ciała. W przypadku bólu i obrzęku na 10 minut, przy spastyczności na tak długo, jak to jest możliwe.
Okłady z pokruszonego lodu (w plastikowym woreczku). Czas 5-15-20-40 minut.
Spray (chlorek etylu). Schładzanie punktów spustowych, obecnie rzadziej stosowane. Odległość ok. 30 cm, pod kątem 30°, około 6 sekund. Dłuższy czas może spowodować odmrożenie.
Szybkie chłodzenie (icing). Uderzanie kostką lodu (3-5 razy) w celu pobudzenia skurczu mięśni (uszkodzenia CUN, nerwów obwodowych), który utrzymuje się do 40 minut.
Masaż kostką lodu (okrężne ruchy wokół leczonego obszaru, zmniejszające się do środka). Czas 3-10 minut, lub dłużej w zależności od wielkości powierzchni.
Miejscowe zabiegi przy użyciu zimnego powietrza, dwutlenku węgla lub ciekłego azotu. Czas zabiegu od 40 sekund do kilku minut w zależności od wielkości schładzanej powierzchni. Jednorazowo u pacjenta można schładzać do 5 do 7 miejsc, a zabiegi powinny być wykonywane co najmniej 2 razy dziennie (4 h odstęp). Zawsze po zabiegu powinny być wykonywane ćwiczenia ruchowe.
Zabiegi ogólne
Komora kriogeniczna. W przedsionku temperatura -60°C, w komorze właściwej od
-110 do - 160 °C. Czas zabiegu do 3 minut. Pacjenci wchodzą do kriokomory w strojach kąpielowych, chroniąc jedynie stopy, podudzia, głowę, usta i nos. Po zabiegu pacjenci muszą koniecznie udać się na kinezyterapię. W czasie zabiegu nie zmienia się temperatura wnętrza ciała.
Lokalne i systemowe reakcje termiczne zależą od informacji z termoreceptorów.
16.Opisz fizjologiczne reakcje w tkankach na działanie skrajnie niskich temperatór
Hormonalna: wzrost stężenia ACTH, kortyzonu, A i NA oraz testosteronu u mężczyzn
Krążeniowa: skurcz naczyń krwionośnych, a następnie ich rozkurcz i silne przekrwienie (bez większego wpływu na RR i HR).
Nerwowo-mięśniowa: spadek napięcia mięśniowego, zwolnienie przewodnictwa nerwowego, wpływ na płytkę motoryczną i motoneurony.
Odpornościowa: wzrost odporności humoralnej i komórkowej.
Przeciwbólowa: połączenie działania endorfiny jako czynnika uśmierzającego ból oraz euforyzującego oraz mechanizmu bramki kontrolnej selekcjonującego bodźce dochodzące do CUN.
Reakcje bezpośrednie
ZIMNO
↓ temperatury tkanek
↑ lepkości krwi skurcz naczyń ↓ metabolizmu
↓ przepływu krwi ↓ produktów metabolicznych ↓ leukocytozy
↓ fagocytozy
↓ krwawienia ↓ usuwania produktów przemiany materii opóźnienie zdrowienia
Inne reakcje na zimno:
Wtórna reakcja naczyniowa powstaje w celu zapobiegania uszkodzenia tkanek. Po 15-30 minutach w zależności od statusu naczyniowego powierzchni schładzanej występuje zwiększenie przepływu krwi (fale Lewisa, okresowe zwężanie i rozszerzanie naczyń krwionośnych).
Reakcje systemowe mają na celu utrzymanie stałej temperatury wnętrza ciała. Opierają się na informacjach z receptorów powierzchownych w skórze i termoreceptorów zlokalizowanych centralnie oraz temperaturze krwi w układzie krążenia. Reakcje rozpoczynają się, gdy informacja o spadku temp. krwi dotrze do podwzgórza. Zależą od stopnia spadku od set-point.
W celu zachowania temp. wnętrza następuje skurcz skórnych naczyń krwionośnych (przeciwprądowa wymiana ciepła). Zwiększenie temp. wnętrza ciała uzyskuje się poprzez:
Termogenezę (produkcja ciepła wewnętrznego kontrolowana przez układ sympatyczny, wzrost tempa metabolizmu komórek).
Nieświadome napięcie mięśni.
Dreszcze
Fizjologiczne efekty w czasie działania zimna można pogrupować w następujące kategorie:
zmniejszenie temperatury,
zmniejszenie metabolizmu,
skutki zapalenia (zmniejszenie lub zwiększenie),
skutki krążenia ( zmniejszenie lub zwiększenie),
zmniejszenie bólu,
zmniejszenie napięcia mięśniowego,
zwiększenie sztywności tkanek.
W celu osiągnięcia maksymalnych korzyści z jakiejkolwiek terapii, należy zrozumieć specyficzne potrzeby pacjenta i fizjologiczne reakcje na różne sposoby terapii. Wiele
z fizjologicznych reakcji na zimno jest korzystne dla pacjenta, inne szkodliwe w czasie różnych faz urazu sportowego. Zmniejszenie metabolizmu jest w większości korzystne
w leczeniu urazów w stanie ostrym, gdyż ogranicza rozwój kolejnego niedotlenienia tkanek. Stosowanie ciepła jest zwykle preferowane w stanach podostrych, aby zmniejszyć bolesność
w połączeniu z rozciąganiem przykurczonej tkanki łącznej. W rehabilitacji aplikacja zimna jest stosowana w połączeniu z ćwiczeniami czynnymi. W chwili obecnej nie dowodów, aby zimno było przeciwwskazaniem do stosowania w stanach przewlekłych.
Skutki działania różnych temperatur na tkanki
Temperatura w tkance |
Reakcja |
23.0 °C |
Znaczne zmniejszenie aktywności nerwów obwodowych |
20.0 - 0°C |
Zakres krytyczny |
10.0°C |
Zaczerwienienie i obrzęk w czasie 1 h |
9.0°C |
Ustanie przewodzenia w nerwach |
5.0°C |
Porażenie nerwów obwodowych |
-1.9°C |
Znaczny ból i obrzęk w czasie 4-7 minut |
-2.2°C |
Zamrożenie skóry |
17. Wskazania do leczenia zimnem i skrajnie niskimi temperaturami kriostymulacja
Świeże oparzenia skóry, RZS, ZZSK, łuszczycowe zapalenie stawów, dyskopatia, niedowłady spastyczne, stany pourazowe, zmiany zwyrodnieniowe, zmiany wynikające z przeciążenia narządu ruchu, przewlekłe zespoły bólowe, odnowa biologiczna.
18. Przeciwwskazania do leczenia zimnem i skrajnie niskimi temperaturami kriostymulacja
Klaustrofobia (kriokomora), nadwrażliwość na zimno, choroby nowotworowe, wyniszczenie organizmu, niewydolność układu krążenia i oddechowego, zmiany zakrzepowe, zatorowe i zapalne w układzie naczyniowym, zapalenie małych naczyń w mieszanych krioglobulinemiach, otwarte rany i owrzodzenia.
Szczególną ostrożność należy zachować w następujących chorobach: dusznica bolesna, zaburzenia rytmu serca, wady zastawek serca, zespół Reynouda.
19.Biologiczne działanie pola elektromagnetycznego niskiej częstotliwości na organizmy żywe
Mechanizm działania pola magnetycznego na organizm
Zmieniające się w czasie pole magnetyczne indukuje w strukturach elektrolitowych organizmu zmienne napięcie zależne od powierzchni, siły i szybkości zmian pola. Zmienne napięcie z kolei wzbudza w elektrolicie pole elektryczne, którego siła przyspiesza ruch jonów, przy czym pojawia się prąd katoforetyczny (ruch dodatnio naładowanych cząsteczek ku katodzie). Wraz ze wzrostem szybkości wzrasta wewnętrzne tarcie cząsteczek elektrolitu przeciwdziałające tej sile i wyrównujące wpływ pola.
Wpływ sił Lorentza. W organizmie poddanym działaniu pola magnetycznego jony poruszają się prostopadle do linii sił pola. Zachodzie wtedy odchylanie się w przeciwnym kierunku kationów i anionów. Jony te gromadzą się na barierach np. błonach komórkowych. Rozdział ładunków powoduje spadek potencjału i zmianę przepuszczalności błon komórkowych i transport czynny.
W wyniku powyższych zmian następuje:
Wzrost energii drgań błon i/lub wymuszenie zwiększenia dyfuzji przez błony,
Wpływ na elektroosmotyczne procesy fizjologiczne,
Wpływ na procesy neuronalne przez sumowanie się potencjałów miniaturowych.
3. Wpływ na szybkość reakcji enzymatycznych poprzez oddziaływanie na paramagnetyki (hematyna, hemoglobina, mioglobina, cytochromy (katalizator oddychania tkankowego), enzymy.
Paramagnetyki: posiadają własne pole magnetyczne po namagnesowaniu, o kierunku zgodnym z polem zewnętrznym, wciągane przez to pole, ustawiają się równolegle do linii sił pola. Pobierają energię z pola zewnętrznego np. powietrze, wiele gazów, większość metali. Paramagnetyki rozpuszczone we krwi: tlen cząsteczkowy, metaloproteiny, wolne rodniki (produkty pośrednie w reakcjach enzymatycznych wrażliwe na obecność pola magnetycznego, mogą ustawić się w nim w linii → efekt magnetomechaniczny.
Diamagnetyki: własne pole po namagnesowaniu ma kierunek przeciwny do pola zewnętrznego, osłabia jego działanie, wypychanie przez pole, prostopadle do linii sił pola. Należą do nich np. wodór, woda, wodne roztwory elektrolitów, szkło, złoto, bizmut, żywica.
Ferromagnetyki: posiadają dużą zdolność do namagnesowania np. żelazo, nikiel, kobalt. Posiadają własne pole wielokrotnie większe od pola zewnętrznego, zgodne z jego kierunkiem.
4. Wpływ na systemy piezoelektryczne.
5. Zmiana fizykochemicznych właściwości wody.
6. Indukowanie w strukturach elektrolitowych organizmu zmiennego napięcia.
Efekt magnetoelektryczny → wytwarzanie mikronapięć i prądów w tkankach znajdujących się w polu magnetycznym.
7. Narzucanie przez pole elektromagnetyczne swego rytmu komórkom wykazującym automatyzm (serce, komórki układu nerwowego).
Oddziaływanie biologiczne elf - mf
↑ wychwyt tlenu przez hemoglobine i cytochromy
Nasilenie procesów regeneracji tkanek miękkich
Przyspieszenie procesów tworzenia zrostu kostnego
Działanie angiogenetyczne
Działanie przeciwzapalne i przeciwobrzękowe
Działanie analgetyczne
Inne: zmiana wnikania ca ++ do komórek, ↑ absorpcji białek, ↑ ogólnego transportu przez błony, ↑ dna, wpływ na k+, na+, atp- azę.
Nie wywołuje efektu termicznego
ELF-MF powoduje ruch jonów w komórkach, przez to hiperpolaryzacja błony komórkowej, wzmożenie przemiany materii i zwiększone wykorzystanie tlenu przez komórkę
20. Wymień przeciwwskazania do aplikacji polem magnetycznym niskiej częstotliwości
Cukrzyca młodocianych, ciąża, ciężkie choroby serca i krążenia, chorzy z rozrusznikiem serca, ostre choroby infekcyjne, nadczynność tarczycy, gruźlica, zagrożenie krwawieniem z przewodu pokarmowego.
Ostrożnie należy postępować w ciężkich chorobach naczyń krwionośnych (zarostowe zapalenie tętnic kończyn dolnych, angiopatia cukrzycowa, ciężka angina pectoris).
Impulsowe pole elektromagnetyczne niskiej częstotliwości jest cennym elementem kompleksowego leczenia wielu jednostek chorobowych
21.Cele elektrostymulacji mięśni prawidłowo unerwionych .Wymień i scharakteryzuj stosowane prady
Elektryczna stymulacja normalnie unerwionych mięśni może mieć podobny skutki na mięśnie, inne tkanki i układy jako równoważnik aktywnych ćwiczeń, w momencie, gdy są one ograniczone. Zwykle stosuje się prądy falujące, o krótkim czasie impulsu z częstotliwością około 50-100Hz, np. prądy typu faradycznego. Długość fali, tempo wzrostu i spadku amplitudy, przerwy między falami mogą być różnorodne. Stymulacja elektryczna ze stałą częstotliwością może wyzwolić coraz mocniejsze skurcze mięśni tylko przez pobudzenie większej ilości jednostek motorycznych z użyciem większego natężenia prądu. Ma różne terapeutyczne zastosowanie, które można pogrupować następująco:
Wzmacnianie siły mięśniowej.
Pobudzanie kontroli mięśniowej:
inicjowanie i pobudzanie skurczu mięśni zahamowanego przez ból lub zabieg chirurgiczny,
inicjowanie prawidłowych skurczy (płaskostopie),
inicjowanie nowych skurczy (po transplantacji nerwu),
w czasie zdrowienia uszkodzeń nerwów obwodowych,
w sytuacji, gdzie jest konieczne przedstawienie pacjentowi, że skurcze mięśni mogą być normalne (histerical paralysis).
Utrzymywanie lub zwiększanie zakresu ruchu w stawach:
stymulacja przykurczonych tkanek miękkich i blizn,
utrata możliwości ruchu w wyniku spastyczności lub w innych stanach neurologicznych,
stymulacja mięśni w skoliozach.
Działanie na metabolizm mięśni i przepływ krwi ( pompa mięśniowa).
Zmiany w strukturze- eutroficzna elektroterapia (dobór częstotliwości stymulacji zależy od częstotliwości potencjałów czynnościowych jednostek motorycznych, co jest badane przez EMG).
Stymulacja unieruchomionych mięśni.
Stymulacja dla kontroli spastyczności.
22. Wymień rodzaje TENS i parametry
Tradycyjny, wysokiej częstotliwości, definiowany jako ciągły nieprzerwany łańcuch generowanych z wysoką częstotliwością pulsów o krótkim czasie trwania i niskiej amplitudzie. Bardzo dobre rezultaty uzyskuje się przy f=60-100Hz i czasie impulsu 50-100 mikrosekund. Amplituda jest bardziej subiektywnym parametrem i powinna być tak dostosowana, aby pacjent odczuwał komfortowe wrażenie mrowienia, bez skurczu mięśni. Czas leczenia około 30 minut, cykl może być powtarzany. Niektórzy badacze twierdzą, że leczenie może trwać bez ryzyka do kilku godzin. Za pomocą tego rodzaju TENS-u stymulujemy grube i średnio-grube włókna nerwowe, co zamyka „bramkę” dla transmisji bólu przez cienkie włókna nerwowe.
Tens niskiej częstotliwości, stymulacja jak akupunktura, charakteryzuje się niskim zakresem częstotliwości, mniej niż 10Hz, optymalnie 2-4Hz z długim czasem pulsu 200 mikrosekund. Amplituda\natężenie najwyższe tolerowane przez pacjenta, powodujące widoczne skurcze mięśni. Ten typ stymulacji może działać na sekrecje endorfin, co tłumaczy dłuższy czas zmniejszenia odczuć bólowych u pacjentów.
Tens burst, bardzo podobny do wcześniejszego sposobu aplikacji. Dwa wybuchy impulsów na sekundę mają podobny skutek kliniczny jak dwa impulsy na sekundę. Szerokość serii impulsów w każdym wybuchu jest szersza niż szerokość pojedynczego impulsu, dlatego też natężenia konieczne do uzyskania widocznych skurczów jest mniejsze w Tensie typu burst niż w Tensie niskiej częstotliwości. Jest również lepiej tolerowany przez pacjentów. Efekty lecznicze utrzymują się około 4h w związku z wydzielaniem endorfin.
Brief intense Tens, podobny w charakterze do Tensu tradycyjnego, wysoka częstotliwość (100Hz), dłuższy czas impulsu (200mikrosekund), natężenie najwyższe tolerowane przez pacjenta, powoduje skurcze tężcowe oraz znieczulenia po około 15 minutach.
Tens modulowany, charakteryzuje się tym, że jeden z parametrów tzn. częstotliwość, szerokość pulsu lub natężenie pulsu jest modulowane. Ten sposób modulacji wywołuje wrażenia typu masażu. Czas zbiegu min. 15 minut.
Tabela 1. Porównanie parametrów prądów TENS .
|
Tens tradycyjny |
Tens niskiej częstotliwości |
Burst Tens |
Brief intense Tens „Hi- Fi” |
czas impulsu |
10-100μsec |
100-300μsec |
100-300μsec |
150-250μsec |
częstotliwość |
50-100Hz |
1-5Hz |
100-200Hz (w wybuchu) 2-4 wybuchy na sekundę |
60-100Hz |
Natężenie |
tylko odczuwalne, 3x próg wrażliwości |
próg tolerancji, 3-6x próg wrażliwości, powyżej progu motorycznego |
próg tolerancji, 3-6xpróg wrażliwości, powyżej progu motorycznego |
próg tolerancji, 3-6x próg wrażliwości, powyżej progu motorycznego |
czas leczenia |
od 30 minut do godzin |
20-45 minut |
20-45 minut |
15-20 minut |
Większość przezskórnych elektrycznych stymulacji nerwu ma charakter dwufazowy, ukształtowany w symetryczne lub asymetryczne pulsy. Obecnie stosuje się raczej pulsy o kształcie prostokąta.
Szerokość impulsu jest bardzo ważnym czynnikiem oddziaływującym na włókna nerwowe A beta. Badania kliniczne i testy laboratoryjne wykazały, że puls o szerokości 125 mikrosekund max. stymuluje włókna A beta, minimalne działając na włókna C i ruchowe. Częstotliwość pulsu jest innym bardzo ważnym parametrem niezbędnym dla optymalizacji stymulacji. Dla grubych czuciowych włókien nerwowych normalny zakres częstotliwości powodujący ich pobudzenie wynosi 50-100Hz. Wyższa częstotliwość może spowodować znużenie i nie zwiększa skutków stymulacji przeciwbólowej. Małe włókna nerwowe mogą być stymulowane przez niską częstotliwość 5-10Hz. Stąd też mamy podział na TENS wysokiej i niskiej częstotliwości.
Natężenie bodźca
Grube włókna nerwowe mają niższy próg pobudliwości niż cienkie włóna nerwowe, stopniowe zwiększanie od zera amplitudy bodźca (natężenia), powoduje najpierw pobudzenie większych a potem coraz mniejszych włókien nerwowych. Stąd też podstawową zasadą stosowania TENS w terapii bólu jest selektywne pobudzanie określonych włókien nerwowych. Bardzo istotne jest właściwe dawkowanie natężenia bodźca. Empirycznie stwierdzono, że natężenie stymulującego bodźca powinno się zwiększać do poziomu, który jest odczuwany jako brak komfortu, ale poniżej poziomu bólu. Może on wywoływać wrażenia mrowienia (jak w TENS-ie tradycyjnym) , ale nie powinny być one nieprzyjemne. Dla optymalizacji leczenia w czasie całego zabiegu odczuwanie stymulacji powinno być jednakowe. W TENS-ie niskiej częstotliwości natężenie jest na poziomie progu tolerancji wyzwalając rytmiczne skurcze mięśni.
23. Dobór TENS w zależności od natężenia bólu na skali VAS
określić plan leczenia, dostosować sposób leczenia i parametry lecznicze TENS (w zależności od oceny bólu na skali 0- 10).
0 - nie ma bólu; 10 - najgorszy ból, jaki można sobie wyobrazić
Skala 1-3 np. Tens ciągły impuls 0.1-0.3ms, częstotliwość 1-45Hz, lub Tens Hi-Fi, natężenie najwyższe tolerowane do uzyskania skurczu mięśnia..
Skala 4-7 np. Tens „burst” impuls 0.1-0.2 ms, częstotliwość pulsu 100Hz, częstotliwość uderzeń 2Hz, natężenie najwyższe tolerowane do uzyskania skurczu mięśnia.
Skala 8-10 np. Tens ciągły impuls 0.01-0.1 ms, częstotliwość 100Hz, natężenie najwyższe tolerowane, ale wrażenia czuciowe (mrowienie) nie mogą być odczuwane jako dyskomfort przez pacjenta.
24. Środki ostrożności przy stosowaniu tens
Istnieją okoliczności, które hamują i ograniczają stosowanie TENS. TENS jest absolutnie przeciwwskazany dla pacjentów z rozrusznikiem serca (zablokowanie rozrusznika). Ostatnio klinicyści podjęli próby zastosowania TENS z minitoringiem pacjenta (rozrusznik bipolarny) oraz dodatkowymi środkami ostrożności (bliskie umieszczenie elektrod, aby prąd nie rozpraszał się, elektrody umieszczone najdalej od serca, tak jak to jest tylko możliwe, (niskie natężenie). Umieszczenie elektrod nad zatoką szyjną może spowodować reakcję obniżenia ciśnienia. Ponieważ nie jest znane działanie TENS na embrion, nie należy stosować TENS u pacjentek w pierwszym trysemestrze ciąży. Ostrożność należy zachować również w następujących sytuacjach:
Przednia powierzchnia szyi. Stymulując ten obszar należy omijać zatokę szyjną.
Choroby serca. Należy unikać stymulacji przez klatkę piersiową.
Epilepsja. Należy unikać stymulacji na głowie i szyi pacjenta z epilepsją.
Na oczy. Skutek nieznany.
Powierzchnie śluzowe. TENS nie jest stosowany do leczenia tych powierzchni.
Nieodpowiedni pacjenci i dzieci.
Ubytki skóry.
Generalnie TENS jest bezpiecznym sposobem leczenia. Rzadko występujące szkodliwe skutki mogą wynikać z reakcji alergicznych na żel lub przylepce, złęj techniki aplikacji (utrata żelu, nieodpowiednie wyczyszczenie skóry, nierówny kontakt elektrod).
25. Rodzaje galwanizacji (niepełne) efekt polaryzacji i ułożenia wstępującego i zstępującego przepływu prądu
Działanie prądu stałego na organizm
↑ procesu dyfuzji (wyrównanie stężeń jonów po każdej stronie błony przepuszczalnej)
↑ procesu osmozy (proces przemieszczania się rozpuszczalnika w celu wyrównania poziomu stężeń substancji pomiędzy wnętrzem a zewnętrzną częścią komórki, co poprawia jej funkcje odżywczo - troficzne)
Przepływowi prądu elektrycznego towarzyszy polaryzacja jonowa (miejscowe grupowanie jonów wytwarzających różnice potencjału o znaku przeciwnym w stosunku do przyłożonego z zewnątrz napięcia). W czasie przepływu prądu stałego przez tkanki zachodzą zjawiska fizykochemiczne i fizjologiczne
Metody stosowania
przepływ prądu poprzeczny
przepływ prądu podłużny: zstępujący ± ↓, obniżenie pobudliwości, rozluźnienie mięśni, zmniejszenie bólu; wstępujący ↑, działanie pobudzające np. w niedowładach.
Polaryzacja: katoda pozyskuje elektrony (ujemna)
anoda traci elektrony (dodatnia
Wstępująca: zwiększenie pobudliwości OUN, wpływ na układ sercowo-naczyniowy: zwiększenie odpływu krwi żylnej z kończyn dolnych i narządów objętych „dorzeczem” żyły wrotnej, zwiększenie dopływu krwi tętniczej do płuc i kończyn górnych, zwiększenie odpływu krwi żylnej z serca i płuc.
Zstępująca: obniżenie pobudliwości OUN, wpływ na układ sercowo-naczyniowy: zwiększenie dopływu krwi z krążenia małego do serca, zwiększenie odpływu krwi żylnej z płuc i kończyn górnych, dopływ krwi tętniczej do narządów objetych „dorzecze” żyły wrotnej.
Przed zabiegiem należy sprawdzić stan krążenia!!!!!
26. Cele elektroterapii
działanie na objawy wtórne choroby lub urazu w celu łagodzenia odczuć bólowych, poprawy ukrwienia, zmniejszenia napięcia mięśni szkieletowych poprzecznie prążkowanych i gładkich, pobudzenia skurczu mięśni osłabionych i odnerwionych oraz osiągnięcia korzystnego punktu wyjścia do rozpoczęcia zabiegów fizjoterapeutycznych.
27.Reakcje zachodzące pod anodą i katodą w czasie przepływu prądu
Katoda Anoda
Wzrost ph (odczyn zasadowy) spadek ph (odczyn kwaśny)
Wzrost napięcia mięśni spadek napięcia mięśni
Depolaryzacja włókien nerwowych hiperpolaryzacja wł. Nerwowych
Intensywne zaczerwienienie skóry mierne zaczerwienienie skóry
Lekki obrzęk wysuszanie skóry
Zabiegi wykonywane z wykorzystaniem prądu stałego:
galwanizacja
jonoforeza
kąpiele elektryczno - wodne
Przed zabiegiem należy dokumentować: dane osobowe, rozpoznanie (choroba podstawowa, współistniejące), sposób wykonania zabiegu, dawka.
28.Przeciwwskazania do elektroterapii i środki ostrożności
Przeciwwskazania
pacjenci z rozrusznikiem serca (zabiegi na klatce piersiowej i tułowiu, częstotliwość 10-60 Hz szczególnie niebezpieczna)
infekcje i procesy zapalne w stanie ostrym
zakrzepowe zapalenie żył
zagrożenie zatorem
choroby z możliwością krwawień
ciąża (rejon brzucha i dolnego odcinka kręgosłupa)
zaburzenia czucia
ból o nieznanej etiologii
aktywny nowotwór w obszarze leczenia
gruźlica
choroby przebiegające z gorączką
uszkodzenia skóry
powierzchowne implanty metalowe
miażdżyca zarostowa tętnic w okresie II b- IV wg. Fontaine'a
nie wolno stosować elektrostymulacji przez mózg
nie wolno stosować elektrostymulacji, jeżeli w pobliżu działają urządzenia o wysokiej częstotliwości (diatermia krótkofalowa lub mikrofalowa)
częstotliwości (diatermia krótkofalowa lub mikrofalowa)
Środki ostrożności
nie wolno zostawiać pacjentów bez opieki w czasie zabiegów elektrostymulacji
zabiegi należy wykonywać na stole wyłożonym materiałem nieprzewodzącym
elektrody należy umieszczać w taki sposób, aby unikać stymulacji w rejonie zatoki tętnicy szyjnej
u pacjentów z chorobami serca nie jest zalecane układanie elektrod w rejonie serca na klatce piersiowej
należy ograniczać natężenie prądu z komponentem galwanicznym przy stosowaniu elektrod o małej powierzchni
w razie zgłoszenia pieczenia przez pacjenta należy bezwzględnie przerwać zabieg
elektrody należy stosować zgodnie z zaleceniami producenta i wymieniać okresowo, w zależności od zużycia, utrata właściwości elektrycznych przez elektrody grozi poparzeniem pacjenta.
29.Na czym polega jonoforeza
Zabieg elektroleczniczy polegający na wprowadzeniu do tkanek jonów działających leczniczo siłami pola elektrycznego. Jony o takim samym ładunku, jak elektroda po którą się znajdują, zostają odpychane od niej. Zjawisko to powoduje przemieszczanie leków w postaci jonów do skóry. Podstawy fizykochemiczne - jak w prądzie stałym.
depolaryzacja ⇒grubych włókien nerwowych→ skurcz mięśni
30.mechanizm działania i parametry mikroprądów
Współcześnie wzrosło także zainteresowanie wykorzystaniem w elektroterapii przerywanego prądu stałego o niskim natężeniu, określanego jako MENS (mikroamperażowa elektryczna stymulacja nerwów), Micro-TENS lub LIDC (prąd stały o niskim natężeniu). Prąd ten, w porównaniu z tradycyjną elektroterapią, w której natężenie prądu określa się w miliapmerach, charakteryzuje się zastosowaniem natężenia prądu mierzonego w mikroamperach (10-800 μA). Amplituda mikroprądu jest tak mała, że w czasie stymulacji nie jest on odczuwany przez pacjenta. Współczesne urządzenia wytwarzają mikroprądy w postaci impulsowej jednokierunkowej lub dwukierunkowej. Bezpieczną i komfortową terapią mikroprądem stosuje się w kontroli bólu ostrego i chronicznego, w celu przyspieszenia regeneracji tkanek, zwiększenia tempa gojenia ran i zrostu kości. W czasie stymulacji mikroprądem nie występują efekty uboczne i powikłania.
Mechanizm działania mikroprądu nie jest jeszcze dokładnie wyjaśniony. Jedna z hipotez mówi o tym, że przywraca on biologiczną, elektryczną równowagę tkanek niezbędną do pobudzenia procesów gojenia. Zewnętrzna powierzchnia błony komórkowej posiada ładunek pozytywny, a wewnętrzna negatywny. Spoczynkowa różnica potencjałów wynosi około 50 mV. Kiedy komórka jest uszkodzona potencjał w tej części staje się bardziej negatywny, dlatego też prąd płynie do tego obszaru. Zjawisko to zmierzył Matteucci (1938) i Bois- Reymond (1843), a prąd nazwano „prądem uszkodzenia”. Generowany jest on zarówno w czasie uszkodzenia pojedynczej komórki, jak również tkanek. Doświadczalnie stwierdzono, że natężenie „prądu uszkodzenia” mieści się w zakresie od 10 do 30μA, więc jest to mikroprąd. Uważa się, że „prąd uszkodzenia” wspomaga zdrowienie komórek i tkanek w żywym organizmie. Dlatego też nieinwazyjnie aplikowany mikroprąd może uzupełniać i wspomagać naturalne funkcje „prądu uszkodzenia”. Eksperymentalne badania potwierdziły, że dzięki zastosowaniu mikroprądów zwiększa się produkcja ATP, synteza protein i aktywny transport aminokwasów i dzięki temu wspomagane są procesy regeneracji komórek i tkanek w żywym organizmie. Elektrony, jako integralna część wielu skomplikowanych reakcji zachodzących w żywym organizmie, pełnią również funkcję transportującą dla ATP. Kalkulacje wskazują, że w czasie aplikacji mikroprądem o natężeniu 10μA powstaje 6.3x1012 elektronów na sekundę. Ten przepływ elektronów działa na reakcje chemiczne w żywym organizmie.
Działania przeciwbólowego mikroprądu nie można wyjaśnić za pomocą mechanizmów „bramki kontrolnej”, czy teorii zwiększania produkcji endogennych substancji tłumiących ból, jak to ma miejsce w przypadku zastosowania prądów, których amplitudę mierzy się w miliamperach. Uważa się, że działanie przeciwbólowe mikroprądu można wyjaśnić za pomocą następujących hipotez:
A. Mikroprąd rozprzestrzenia się wzdłuż naczyń krwionośnych mających mały opór elektryczny. Dzięki przepływowi elektronów usprawnia się w naczyniach włosowatych krążenie krwi. Równocześnie przyspiesza się rozpad kwasu mlekowego i substancji uwrażliwiających receptory bólowe (np. bradykinina, histamina). Produkty rozpadu są również szybciej eliminowane dzięki zwiększonemu przepływowi krwi. Zmniejszenie dolegliwości bólowych następuje bezpośrednio po stymulacji. Na podstawie badań klinicznych proponuje się następujące parametry lecznicze mikroprądu: natężenie 300μA lub wyższe, czas impulsu 1-50msec, częstotliwość 200Hz lub wyższa.
B. W połączeniu z powyższym procesem wytwarzane jest ATP i zachodzi synteza protein, co przyspiesza proces zdrowienia tkanek, a naturalną jego konsekwencją jest zmniejszenie dolegliwości bólowych. W tym przypadku konieczny jest dłuższy czas terapii, aby uzyskać powyższe efekty kliniczne. Proponuje się następujące parametry lecznicze mikroprądu: natężenie 10μA-200μA, czas impulsu 200msec lub dłuższy, częstotliwość 0.3-1.0Hz.
Mikroprąd wykorzystywany jest również w celu przyspieszenia tempa gojenia ran, chociaż przedstawione w literaturze przedmiotu wyniki badań są bardzo różnorodne i często niekompletne.
Mikroprąd może powodować reakcje niepożądane w postaci pieczenia lub zaczerwienienia u pacjentów z wrażliwą skórą. W takim przypadku należy przerwać leczenie a pacjenta skierować do dermatologa. Po wyleczeniu podrażnień można kontynuować leczenie ostrożnie dawkując amplitudę mikroprądu. Terapia MENS jest przeciwwskazana u pacjentów z rozrusznikiem serca, w czasie infekcji, u pacjentów z gorączką powyżej 38°C, u kobiet ciężarnych, na brzuch w czasie menstruacji, w obszarze głowy, u dzieci poniżej 3 roku życia. Polaryzację elektrody czynnej należy dostosowywać w zabiegach podobnie jak w stymulacji wysokonapięciowej. W przypadku stosowania mikroprądu w postaci dwukierunkowej polaryzacja nie ma znaczenia w czasie zabiegu.
Terapia MENS zawiera zwykle dwie następujące po sobie fazy leczenia. W fazie pierwszej głównym celem jest szybkie zmniejszenie dolegliwości bólowych, w fazie drugiej- przyspieszenie procesu gojenia tkanek objętych procesem chorobowym. Czas zabiegu wynosi od 15 do 30 minut. Faza pierwsza trwa 15 minut, faza druga od 5 do 10 minut. Ilość sesji leczniczych należy dostosować do stanu leczonej tkanki. Zabiegi można wykonywać raz dziennie w ciągu 10 dni do 1,5 miesiąca. Po uzyskaniu zamierzonych efektów terapeutycznych wskazane jest kontynuowanie leczenia jeszcze przez 5-10 dni. W przypadku szczególnie ostrych dolegliwości bólowych terapię mikroprądem można łączyć z TENS-em. W takiej sytuacji w fazie pierwszej elektrostymulacji stosuje się TENS, w fazie drugiej mikroprąd o parametrach przyspieszających zdrowienie tkanki. W czasie zabiegów można stosować elektrody płaskie, które układa się wokół miejsc zmienionych chorobowo (lokalnie) oraz elektrody punktowe do stymulacji specyficznych punktów stymulacyjnych.
31.Rodzaje prądów stosowanych w terapii
Prąd stały galwaniczny
Przerywany prąd stały: daję serie impulsów lub faz, o pewnym kształcie, powtarzający się z pewną częstotliwością. Ustalony czas trwania impulsu, kształt i częstotliwość mają określone nazwy.
Długi czas trwania impulsu (1ms lub więcej)
impuls prostokątny: są to impulsy o czasie trwania między 1ms a 600ms oddzielone przerwą od 1ms do kilku sekund, mogą stymulować nerwy ruchowe i mogą być stosowane do stymulacji odnerwionych mięśni.
impulsy akomodacyjne: trójkątne, trapezoidalne, wolnowzrastające- synonimy impulsów eksponencjalnych. Relatywnie długi czas trwania impulsu (600 do 1000ms) czas przerwy od pół do kilku sekund. Stosowany do selektywnej stymulacji tkanki mięśniowej (różnica między akomodacją mięśni i nerwów).
Krótki czas trwania pulsu (1ms i mniej)
Prądy typu faradycznego: impuls o czasie 0,1-1ms, powtarzany z częstotliwością 30-100Hz. Przy częstotliwości 100Hz cykl wynosi 10ms, wtedy czas pulsu=1ms, a czas przerwy=9ms. Impulsy te mogą mieć jeden kierunek przepływu (przerywany prąd stały o krótkim czasie pulsu) lub mogą być również dwufazowe. Oryginalnie prąd powstawał w zwoju faradycznym, nierównozmienny, nierówny w kształcie→skurcze tężcowe→faradyzm.
TENS-impulsy jednofazowe lub w większości dwufazowe, symetryczne i asymetryczne w kształcie, czas pulsu 0,01-0,3ms, częstotliwość 2-200Hz , najczęściej stosowana do 100Hz.
Prądy równo zmienne (przemiennie zmienne)
Prądy sinusoidalne: fala w kształcie sinusoidy, przy f=50Hz→100 impulsów, fazy po 10ms każda, 50 w jednym kierunku i 50 w drugim kierunku. Stymuluje nerwy ruchowe i czuciowe (napięcie prądu stosowanego terapeutycznie ok. 80V).
Prądy diadynamiczne: wyprostowany, sinusoidalnie zmienny prąd of=50Hz lub 100Hz o czasie impulsu 10ms oraz ich kombinacje. Stosowany głównie w Europie.
Prądy „rosyjskie”: prąd zmienny o sinusoidalnej fali o f=2500Hz zastosowany w 50 wybuchach na sekundę tj. 10ms wybuchów w 25 cyklach każdy, 10ms przerwy między nimi. Każdy dwufazowy impuls trwa tylko 0,4ms potrzebuje prądu o wysokim natężeniu, aby wywołać skurcz mięśni .
Prądy interferencyjne: prądy zmienne o f=4000Hz (lub wyższej w zależności od producentów). Kiedy dwa obwody prądy o niewielkiej różnicy częstotliwości działają w tym samym czasie i w tym samym miejscu, powstaje trzeci prąd umożliwiający różny poziom stymulacji.
Prądy wielkiej częstotliwości: zbyt szybkie zmiany, aby mogły stymulować nerwy lub mięśnie, wytwarzane jest ciepło.
PRĄDY NISKIEJ CZĘSTOTLIWOŚCI 0-1000Hz (typu faradycznego, TENS, sinusoidalne, diadynamiczne)
PRĄDY ŚREDNIEJ CZĘSTOTLIWOŚCI 1000Hz-100000Hz (interferencyjne (techniki dwupolowe [premoduowany] i czteropolowe [klasyczna interferencja, dipol vector, izoplanar], prądy falujące, rosyjska stymulacja, impulsowy jednokierunkowy średniej częstotliwości)
PRĄDY WIELKIEJ CZĘSTOTLIWOŚCI 100000Hz i więcej (diatermia krótkofalowa)
32.Zmiany miejscowe pod wpływem prądu stałego
Stymulacja czuciowa. W czasie przepływu prądu świadomie odczuwa się łagodne mrowienie i ukłucia, które w razie wzrostu natężenia prądu mogą przejść w pieczenie lub irytację. Jest to błąd w sztuce!!!
W skórze pod elektrodami dochodzi do krótkotrwałego zwężenia, a potem rozszerzenia naczyń krwionośnych. Przekrwienie, czyli rumień galwaniczny jest intensywniejszy pod katodą, mniejszy pod anodą. Występuje również nieznacznie wokół elektrod. Czas- około 1.5-2h. Spowodowany jest przez uwolnioną z magazynów tkankowych histaminą, zwiększa się przepuszczalność błon komórkowych oraz resorpcja.
Rozszerzeniu ulegają również naczynia głębiej położonych mięśni, w wyniku drażnienia odpowiednich receptorów układu autonomicznego w skórze. Występuje wzrost przepływu krwi w całym segmencie, w którym wykonuje się zabieg. Poprawa krążenia korzystnie wpływa na odżywienie tkanek.
Przyspieszenie procesów regeneracji (gojenie ran i odleżyn) → mikroprąd.
Działanie przeciwbólowe. Starsze teorie: zmiana pobudliwości pod anodą - hyperpolaryzacja, anelektronus. Pod katodą zwiększenie pobudliwości - katelektronus. Nowe teorie: odpychanie pod anodą jonów wodoru i potasu wpływa na zmniejszenie bólu.
33. Sposoby aplikacji prądów stosowanych terapeutycznie
Stymulacja punktów wrażliwych.
MTP (powierzchowne punkty spostowe)
punkty akupunkturowe
Stymulacja nerwów (punkty stymulacyjne nerwów).
Stymulacja mięśni (punkty motoryczne mięśni. Poprzeczna, podłużna).
Stymulacja segmentarna.
Stymulacja transregionalna (przykręgosłupowa, lokalna np. stawów, przykurcze, stany przeciążeniowe tkanek miękkich).
34. W jaki sposób prądy stosowane w terapii zmniejszają ból
Efekty stymulacji prądami niskiej i średniej częstotliwości można podzielić następująco:
lokalne biochemiczne zmiany, powstałe w wyniku działania prądów o jednym kierunku przepływu,
wyładowania w receptorach i w nerwach, które zależnie od ich funkcji mogą powodować zmiany w różnych częściach ciała. Konsekwencją stymulacji włókien efferentnych jest skurcz mięśni. Skutki stymulacji włókien afferentnych omówię poniżej.
Afferentne przewodzenie potencjałów czynnościowych przez drogi wstępujące zwykle powoduje wzrost wrażeń czuciowych. Równocześnie inne czuciowe informacje, szczególnie związane z bólem, mogą być zmienione. W dodatku, przez mechanizmy odruchowe można wpływać na aktywność somatyczną i neurowegetatywną. Omawiając dokładnie różne formy elektroterapii należy rozróżnić kilka grup afferentnych włókien nerwowych. Określenie grube włókna nerwowe jest przeznaczone dla włókien typu Ia i Ib z grubą osłonką mielinową (mięśniowe). Średnio grube włókna nerwowe to włókna typu II i IIa. Cienkie włókna nerwowe to włókna typu IIIb z osłonką mielinową i włókna typu IV bez osłonki mielinowej.
Wpływ na ból i aktywność sympatycznego układu nerwowego
Obwodowa stymulacja grubych włókien nerwowych typu Ia i Ib nie działa na transmisję bólu i aktywność neurowegetatywną.
Stymulacja średnio-grubych włókien nerwowych hamuje transmisję bólową zgodnie z teorią „bramki kontrolnej” Malzacka i Walla. Stymulacja cienkich włókien nerwowych może wywołać efekt znieczulenia dzięki aktywacji zstępującego endogennego systemu, modulującego ból (aktywacja endorfin). Zmniejszenie przewodzenia informacji bólowej ma oddziaływanie na aktywność układu sympatycznego, na poziomie segmenternym i generalnie. Aktywność włókien typu IV może spowodować zwiększenie niespecyficznego pobudzenia w systemie nerwowym. Zmniejszenie aktywności włókien typu IV może ten stan pobudzenia zredukować. Jeżeli segmentarne rozregulowanie zmniejszy się, troficzny stan organów obwodowych ulegnie poprawie i zostanie zmniejszona wrażliwość receptorów. Dzięki tym zmianom zostanie zredukowany również ból.
MECHANIZMY ZMNIEJSZENIA BÓLU ZA POMOCĄ PRĄDU ELEKTRYCZNEGO - PODSUMOWANIE
Przez wzmożone ukrwienie hormony tkankowe (bradykinina, serotonina, histamina, prostaglandyna), pobudzające receptory bólowe, zostają szybciej usunięte z uszkodzonej tkanki.
Anolelektronus pod anodą (przy stosowaniu prądu stałego) wg starych teori powoduje zmniejszenie pobudliwości błon receptorów bólowych, wg nowych na zmniejszenie bólu wpływa odpychanie pod anodą jonów wodoru i potasu.
Teoria bramki kontrolnej wg Melzacka i Walla (1965) i jej modyfikacje. Hamowanie presynaptyczne - stymulacja mechanoreceptorów w skórze (wł.A β, niski próg pobudliwości) powoduje neuralne hamowanie impulsacji bólowej w rogach tylnych rdzenia kregowego przewodzonej przez włókna niemielinizowane, co w konsekwencji powoduje zmniejszenie bólu. Hamowanie postsynaptyczne, aktywacja zstępujących dróg hamujących i wytwarzanie enkefalin i zmniejszenie percepcji bólu.
Edogenne wytwarzanie substancji tłumiących ból (endorfin). Mechanizm SPA.
Zmniejszeine wzmożonej aktywności układu sympatycznego (podsystem odpowiadający za obkurczenie naczyń krwionośnych.
Zmniejszenie potencjału czynnosciowego we włóknach przewodzących ból (blok).
Efekt plateau prądów interferencyjnych może powodować stan trwałej deplaryzacji komórek, które nie będą reagować na bodźce.
Stymulacja mięśni (pojedyncze niezbyt silne skurcze)wytworzenie pompy mięśniowej, co usprawnia krążenie i pozbycie się substancji uwrazliwiających receptory bólowe.
W czasie zwiększenia aktywności układu sympatycznego (podsystemu zwężającego naczynia krwionośne) w skórze i w nie aktywnych mięśniach przepływowi elektronów usprawnia się w naczyniach włosowatych krążenie krwi.
35.W jaki sposób prądy stosowane w terapii usprawniają krążenie
Różne stany patofizjiologiczne mają źródło w słabym lokalnym krążeniu. Logiczne wydaję się z terapeutycznego punktu widzenia, że aby uzyskać efekt leczniczy należy usprawnić ten czynnik. Krążenie reaguje na różne czynniki zewnętrzne i jednym z nich jest również prąd. W wyniku działania różnych prądów naukowcy znaleźli wiele pozytywnych rezultatów elektrostymulacji. Należą do nich: zwiększenie temperatury w skórze, zwiększenie lokalnego krążenia, leczenie niedokrwienia przeszczepionej skóry, szybsze leczenie chronicznych wrzodów skóry, choroby Raynauda, polineuropatii cukrzycowej, zabezpieczenie przed odleżynami. Powyższe wyniki można wyjaśnić w różnorodny sposób.
Przekrwienie w wyniku zmian chemicznych powstające w czasie działania prądu o jednym kierunku przepływu jest bardzo dobrze znane. Działa głównie na skórę, w mniejszym stopniu na mięśnie położone głębiej.
Naczynia krwionośne są zwężone, kiedy aktywność sympatycznego układu nerwowego jest zwiększona. W wyniku działania bodźca elektrycznego aktywność zmniejszy się, zwężenie naczyń słabnie, co wpływa na relatywne zwiększenie krążenia w tkankach.
Inną konsekwencją normalizacji zwiększonej aktywności neurowegetatywnej jest redukcja napięcia unoszących mięśni szkieletowych. Ustąpienie ciśnienia krwi w naczyniach mięśni występuje głównie w kapilarach.
Powstałe w czasie stymulacji skurcze mięśni wpływają również pozytywnie na krążenie. Mechaniczne bodźce (rytmiczny ruch) i chemiczne bodźce (produkty metaboliczne) oddziaływają pozytywnie na poprawę krążenia.
Stymulacja powoduje wzrost wydzielania polipeptydu jelitowego działającego na naczynia (VIP) z pęcherzyków w obwodowych komórkach nerwowych. Ten ostatnio odkryty neurotransmiter powoduje relaksację w mięśniach gładkich ścian naczyń krwionośnych.
36.Efekty działania traberta
*galwaniczny→ istotna ciągła częstotliwość→ adaptacja→ zwiększenie natężenia 3-7 razy→wysokie natężenie→chronić przed pieczeniem!!!
*częstotliwości
depolaryzacja⇒ średnio-grubych włókien nerwowych→ mocne wrażenie wibracji „coś ciężkiego leży na plecach”
⇓stymulacja afferentnych wł.nerwowych w dermatomach i miotomach
⇓zmniejszenie odczucia bólu
hamowanie tonicznych wyładowań układu sympatycznego
37.Metodyka zabiegu za pomocą prądu trabert
1. Ułożenie E1 wielkość elektrod 7x9 cm, ułożenie podłużne, pacjent leży przodem, odpowiednia pozycja zmniejszająca lordozę szyjną,
elektroda cranial (dogłowowo): os occipitale
elektroda caudal (doogonowo): 3 cm poniżej
choroby szyjno-czaszkowe→ katoda w pozycji „cranial”, stymulacja n.occipitalis major w wypadku potylicznych bólów głowy, powoduje zmniejszenie transmisji bólowej na poziomie szyjnym, impulsy nerwowe są w tym samym czasie przekazywane przez podłużne, wewnątrz rdzeniowe połączenia do kojarzonego rogu bocznego z k.układu sympatycznego w wyższym poziomie piersiowym, co powoduje lokalne zmniejszenie chronicznie zwiększonej aktywności w sympatycznym układzie nerwowym. Druga elektroda ma bezpośrednio hamujący wpływ na sympatyczną regulację obszaru szyjno-głowowego w tym samym wyższym poziomie piersiowym.
zaburzenia w kk. górnych → katoda w pozycji „caudal”, kojarzony poziom unerwienia somatycznego.
2.Ułożenie E2 wielkość elektrod 9x11cm
elektroda cranial: na poziomie C7
elektroda caudal: 3cm poniżej
zaburzenia: głowa, szyja, obr. barkowa, kończyny górne→ katoda w pozycji „cranial”, poziom somatycznego unerwienia tego obszaru, anoda na poziomie unerwienia sympatycznego.
zaburzenia w wyższych segmentach klatki piersiowe, zaburzenia kążenia w kończynach górnych→ katoda w pozycji „caudal” na poziomie unerwienia sympatycznego.
3.Ułożenie E3 wielkość elektrod 9x11cm, wskazane do leczenia zaburzeń tułowia. Pozycja katody jest zależna od lokalizacji nerwów rdzeniowych odpowiadających segmentowi, w którym zachodzi zaburzenie.
4.Ułożenie E4 wielkość elektrod 10x13cm, ochrona przed zwiększeniem lordozy lędźwiowej- podłożenie poduszki pod brzuch,
elektroda „caudal” ułożona poprzecznie przez kość krzyżową powyżej szpary pośladkowej, elektroda „cranial” ułożona podłużnie 3cm powyżej
bóle dolnego odcinka kręgosłupa, obręczy biodrowej i miednicy, zaburzenia krążenia w kończynach dolnych→ katoda w pozycji „cranial”, na kojarzonym poziomie unerwienia sympatycznego.
dolegliwości kk. dolnych→ katoda w pozycji „cauda” na poziomie unerwienia somatycznego
Dawkowanie:
*natężenie prądu: odpowiednie do mocnego odczuwania wibracji, brzęczenia, po adaptacji→ zwiększenie natężenia od 3 do 7 razy; limit: 0,2 mA na pow. w cm2
*czas zabiegu: 15 minut,
*częstotliwość leczenia: 6-8 razy, jeżeli wrażliwość skóry na to pozwala w zależności od celów i efektów leczniczych. W przypadku wystąpienia zmian skórnych pod wpływem prądu należy zastosować podobne leczenie wykorzystując prądy IF o parametrach 20Hz-20Hz, stosując szybkie i gwałtowne zmiany częstotliwości.
*efekty terapeutyczne są zauważalne już po pierwszym leczeniu, lub po 2-3 sesji leczniczej. Jeżeli nie ma pozytywnych efektów, nie należy kontynuować leczenia.
Sposoby aplikacji:
-miejscowe,
-segmentarne.
Termin terapia segmentarna wymaga wyjaśnienia. Jakakolwiek stymulacja afferentnych włókien nerwowych ma następstwa w procesach informacji bólowej na poziomie rdzenia kręgowego, gdzie wchodzą włókna nerwowe. W tym samym czasie stymulacja ta oddziaływuje na sympatyczną regulację w segmencie należącym do poziomu rdzeniowego. Aplikacja zwana jest segmentarną, jeżeli pożądany jest wpływ w segmencie, bez lokalnych efektów po stronie stymulacji. W przypadku wielu stanów patologicznych użyteczne jest zastosowanie terapii segmentarnej do hamowania trwającej, chronicznie zwiększonej aktywności układu sympatycznego. Może to być dokonane przez stymulację średnio-grubych włókien nerwowych wchodzących do rdzenia kręgowego na poziomie, skąd wychodzą sympatyczne włókna nerwowe biegnące do powierzchni zmienionej chorobowo. Chcąc stosować terapię segmentarną bardzo ważna jest znajomość, z którego poziomu rdzenia kręgowego unerwiane są sympatycznie poszczególne rejony naszego ciała. Sympatyczne neurony znajdują się tylko w rogach bocznych (jądra pośrednio-boczne) na poziomie rdzeniowym C8-L2.
Z anatomicznego punktu widzenia rogi boczne zorganizowane są w specyficzny sposób. W bocznej części składaja się z małych teleskopowych kolumn ciał komórkowych neuronów przedzwojowych. W części środkowej zlokalizowane są przedzwojowe neurony dla naczyń. Nieznacznie bardziej bocznie znajdują się przedzwojowe neurony dla narządów tułowia, a najbardziej bocznie dla kończyn. W dogłowowej części rogów bocznych rdzenia kręgowego ich organizacja jest nieznacznie zróżnicowana. Znajdują się tam sympatyczne włókna nerwowe regulujące pracę oka (centrum rzęskowo-rdzeniowe), szerokość źrenicy, włókna nerwowe gałki ocznej o oczodołu. Od Th1 w dół obowiązuje zasada wcześniej omówiona. Struktura autonomicznego układu nerwowego jest anatomicznie różna od somatycznego układu nerwowego: somatyczna kontrola naszego ciała ma miejsce we wnętrzu rdzenia na całej jego długości, autonomiczna regulacja zaś tylko w ograniczonej jego części. Segmenty szyjne nie posiadają rogów bocznych. Istnieje interesująca hipoteza mówiąca o tym, że w czasie rozwoju embrionalnego kończyn bardzo duże zwiększenie rogów brzusznych spowodowało na poziomie szyjnym i lędźwiowym, zmniejszenie przestrzeni i „przesunięcie” komórek rogów bocznych z omawianych obszarów w kierunku odcinka piersiowego i górnego lędźwiowego. W tym samym czasie nowe rogi boczne uformowały się odpowiednio dla kończyn. Dlatego też komórki rogów bocznych dla naczyń i tułowia (tzw. autochtoniczne komórki rogów bocznych), jak i komórki rogów bocznych należące do segmentów, z których rozwijają się kończyny (tzw. allochtoniczne lub migracyjne komórki rogów bocznych) są na tym samym poziomie piersiowego odcinka kręgosłupa. Dalsze komórki są położone bocznie naprzeciwko autochtonicznych komórek rogów bocznych.
38. Środki ostrożności w prądach jednokierunkowych
- sprawdzić przed leczeniem wrażliwość skóry w miejscu aplikacji (czucie dotyku, temepartury)
- dokładne sprawdzić skórę, miejsca o obniżonej oporności zabezpieczyć wazeliną,
-stosować podkłady o grubości 2-4 cm, dobrze nasączone wodą, dokładnie z jednakowym naciskiem przylegające do leczonej powierzchni, w razie potrzeby w czasie zabiegu należy dodać wody do podkładów,
-chronić skórę po leczeniu: posypać talkiem lub posmarować maścią łagodzącą.
39. Opisz parametry i skutki działania prądów DD
Termin prądy diadynamiczne wprowadził francuski lekarz P.Bernard. W prądach diadynamicznych wyróżnia się dwie składowe: galwaniczną i zmienną, gdyż wyprostowany jednopołówkowo prąd sinusoidalnie zmienny o częstotliwości 50Hz nałożono na prąd galwaniczny. Czas trwania każdego impulsu wynosi 10ms i jest równy czasowi przerwy. W określaniu typów prądów diadynamicznych przyjęły się skrócone nazwy wywodzące się z języka francuskiego. Prąd MF (monophase fixe) jest to jednopołówkowo wyprostowany prąd zmienny o częstotliwości 50Hz. Prąd DF (diphase fixe) jest to dwupołówkowo wyprostowany prąd zmienny o częstotliwości 100Hz. Prąd CP (courte periode) cechuje się naprzemiennym występowaniem prądu MF i DF, czas trwania każdego z nich wynosi 1 sec. Prąd LP (longue periode) powstaje przez nałożenie na prąd MF takiego samego prądu, lecz o zmodulowanej amplitudzie i przesuniętego w fazie o 180 stopni. Czas trwania zmodulowanej części prądu MF wynosi 10 sekund, a części niezmodulowanej 6 sekund. Prąd RS (rhytme syncope) powstaje przez przerywanie co 1 sekundę prądu MF, z przerwą trwającą również 1 sekundę. Prąd MM (monophase module) jest to prąd MF zmodulowany w amplitudzie. Obwiednia modulacji ma kształt połówki sinusoidy, a czas trwania modulacji wynoszący 10 sekund jest równy czasowi przerwy. Prąd CP-ISO jest to prąd, w którym w czasie trwania fazy DF zwiększona jest siła prądu (ustawianie ręczne w %). Prąd ten jest mniej agresywny w odczuciach pacjenta niż prąd CP. Dobierając w terapii odpowiednie prądy diadynamiczne konieczne jest kierowanie się ich specyficznymi właściwościami. Prąd DF o częstotliwości 100Hz, ma wysoki komponent galwaniczny Pacjent w czasie stymulacji odczuwa delikatne wibracje. Stosuje się go w pierwszej fazie leczenia, w przypadku silnego bólu, dla pacjentów o dużej wrażliwości, rozpoczyna się nim sesję leczniczą. Może być również stosowany, ze względu na stałą wysoką częstotliwość, w celach diagnostycznych dla lokalizacji powierzchni o zwiększonej pobudliwości. Prąd MF mimo niskiej komponenty galwanicznej (niższa częstotliwość) powoduje mocniejsze odczucia u pacjenta niż prąd DF i mniejsze zagrożenie występowania pieczenia pod elektrodami. Prąd ten jest preferowany przez pacjentów, którzy w czasie stymulacji prądem DF odczuwają nieprzyjemne drażnienie. Prąd CP z gwałtownie zmieniającą się częstotliwością powoduje u pacjentów najbardziej agresywne odczucia ze wszystkich prądów diadynamicznych. Nie należy stosować prądu CP u pacjentów zbyt wrażliwych lub w ostrym stadium schorzenia. Szczególnie wskazany jest dla pacjentów niezbyt wrażliwych lub opornych na terapię. Działając prądem CP uzyskuje się silne przekrwienie, prawdopodobnie wskutek wpływu na mechanizm pompy naczyniowo-mięśniowej, obniżenie napięcia mięśniowego, zmniejszenie bólu i zwiększenie resorpcji krwiaków i obrzęków. Prąd LP charakteryzujący się spokojnymi zmianami częstotliwości jest odczuwany przez pacjentów jako bardzo przyjemny. Stosowany jest u pacjentów bardzo wrażliwych, dla których prąd CP jest zbyt silny. Czas leczenia za pomocą prądów DD wynosi od 3 do 10 minut. Dłuższe czasy zabiegów mogą zwiększyć niebezpieczeństwo wystąpienia pieczenia. Zabieg leczniczy składa się z sekwencji prądów diadynamicznych np.: aplikacja prądem DF trwająca 1-2 minuty, następnie CP od 3 do 7 minut. Jeżeli pacjent jest bardzo wrażliwy lub dolegliwości są bardzo silne, prąd DF łączy się z prądem LP. Prądy diadynamiczne z bazą prądu galwanicznego (basis 2-4 mA) mają zwiększony efekt galwaniczny w tkankach, jakkolwiek równocześnie powodują nieprzyjemne odczucia pacjenta i niebezpieczeństwo wystąpienia uszkodzeń w skórze, w wyniku reakcji elektrochemicznych zachodzących pod katodą i anodą. Stosując każdy rodzaj prądu diadynamicznego, nawet przy niewielkim wzroście natężenia prądu, pacjent bardzo szybko odczuwa wrażenie mrowienia. Według Bernarda nie należy w czasie zabiegu zwiększać amplitudy stosowanego prądu, aby nie wywołać nieprzyjemnych odczuć. Należy raczej skrócić czas leczenia w wypadku wystąpienia adaptacji lub dobrać inną sekwencję prądów. Prąd MF występujący w postaci zmodulowanej (RS, MM) może być stosowany do stymulacji mięśni. Stymulacja mięśni wymaga wyższej amplitudy prądu, więc w związku z komponentem galwanicznym tego prądu, nie jest on raczej do tego celu wskazany.
Prądy diadynamiczne są szczególnie odpowiednie do leczenia dolegliwości małych stawów. Można je również stosować w terapii segmentarnej w leczeniu odruchowej dystorfii, czy w leczeniu półpaśca (herpes zoster).
40.Wymień i opisz działania prądów średniej częstotliwości Ifwg Nemeca Ifizoplanar IF dipol dwupolowa Kotsa impulsowy średniej częstotliwości
Prądy interferencyjne są to prądy średniej częstotliwości (4000Hz) zmodulowane w amplitudzie z małą częstotliwością. Terapeutyczne zastosowanie prądów średniej częstotliwości zapoczątkował austriacki lekarz Hans Nemec. Terapia interferencyjna polega na równoczesnym aplikowaniu na ciało pacjenta prądów z dwóch niezależnych obwodów, które nieznacznie różnią się częstotliwością. W wyniku nałożenia się prądów w tkance pacjenta (interferencji) powstaje nowy rodzaj prądu. Nazwa prąd interferencyjny, choć używana od lat nie określa prawidłowo tego typu prądu. Jego właściwa nazwa powinna brzmieć „niską częstoliwością amplitudowo modulowany sinusoidalnie zmienny prąd średniej częstotliwości”. Określenie to jest jednak zbyt długie, skomplikowane i niepraktyczne w codziennym zastosowaniu. dlatego też dalej w tekście będziemy posługiwać się zwyczajowo przyjętą nazwą prąd interferencyjny. Oporność pojemnościowa tkanek zmniejsza się w miarę zwiększania częstotliwości stosowanego prądu. Działając na skórę prądem o częstotliwości 4000Hz, z związku z jej zmniejszonym oporem, tkanki głębiej położone mogą być łatwiej stymulowane. Pod elektrodami zachodzą te same procesy chemiczne (brak bieguna negatywnego i pozytywnego). Pobudzenie włókien nerwowych za pomocą prądów średniej częstotliwości następuje w wyniku sumowania, zwanego też efektem Gildemaistera. Wymagane jest zaistnienie kilku okresów prądu zmiennego, aby doszło do oczekiwanego stopnia pobudzenia (zjawisko Gildemaistra). W czasie aplikacji symetrycznego prądu zmiennego średniej częstotliwości wpływ negatywnej połowy okresu (efekt katodowy) powoduje rozluźnienie błon komórkowych (lokalne ujemne naładowanie), natomiast podczas działania anodowej połówki fali naładowanie ujemne wygasa. Teoretycznie dzięki równej wartości względem linii zerowej nie powinien powstawać jakikolwiek stan pobudzenia. W praktyce efekt katodowy jest silniejszy, gdyż anodowe wzmocnienie wymaga pod względem termochemicznym dłuższego czasu niż katodowe rozluźnienie. Dochodzi więc do asymetryczności, po katodowej połowie fali pozostaje nadwyżka depolaryzacji na błonie komórkowej i jest gromadzona aż do wytworzenia potencjału akcyjnego. Prądy interferencyjne średniej częstotliwości charakteryzują następujące parametry:
AMF (amplitudowo modulowana częstotliwość) odnosi się do różnicy w częstotliwości prądów między dwoma obwodami. Wybieramy taką wartość tego parametru, jaką chcemy uzyskać w tkance w zależności od celów leczniczych.
Spektrum, jest to różnica między najwyższą a najniższą wartością AMF, np. AMF 10Hz, spektrum 50Hz, oznacza, że częstotliwość zmienia się w zakresie od 10Hz do 60Hz i wraca z powrotem do 10Hz.
Czas przemiatania (sweep time) jest to czas, w którym zachodzą zmiany częstotliwości. Niska wartość czasu przemiatania powoduje, że stymulacja ma agresywniejszy charakter. Wyższa wartość czasu przemiatania powoduje, że terapia ma łagodny charakter.
Czas zbaczania (contour) określa, w jakim procencie czasu przemiatania zachodzą zamiany częstotliwości od AMF do AMF+spektrum. Tzb 100% oznacza, że zmiany częstotliwości zachodzą stopniowo, przez cały czas przemiatania. Tzb 1% oznacza, że zmiany częstotliwości zachodzą gwałtownie (1% z czasu przemiatania).
Kąt określony w stoniach, występuje tylko w IF-Dipol, pozwala terapeucie wybrać kierunek działania bodźca w tkance pacjenta.
Parametry dobiera się w zależności od stanu pacjenta i ostrości jego dolegliwości. W stanach ostrych wskazane jest stosowanie AMF powyżej 100Hz, spektrum 10-50Hz, czas przemiatania reletywnie długi (powyżej 5 sekund), czas zbaczania powyżej 50%, zabiegi można powtarzać 2 razy dziennie, stosując relatywnie krótki czas trwania zabiegu. W stanach o umiarkowanej ostrości symptomów wskazane jest stosowanie częstotliwości w zakresie 10-50Hz, spektrum 10-50Hz, krótki czas przemiatania (1-2 sekundy), czas zbaczania poniżej 50%, zabiegi z relatywnie długim czasem trwania można stosować 3-4 razy w tygodniu.
Prądy interferencyjne mogą być generowane w technice dwupolowej i czteroplowej. Spośrod technik czteropolowych wyróżnia się:
klasyczną interferencję Nemeca,
IF-Izoplanar,
IF-Dipol vector.
W klasycznej interferencji 100% modulacja amplitudy zachodzi w dwóch uprzywilejowanych kierunkach, na dwusiecznej kątów utworzonych przez linie łączące środki elektrod zabiegowych. Mimo korzystnych właściwości tego prądu posiada on ograniczoną wartość terapeutyczną w związku z bardzo czasochłonnym układaniem elektrod i kalkulowaniem, gdzie zajdzie stuprocentowy efekt terapeutyczny i czy obejmie on obszar zmieniony chorobowo.
W prądzie IF-Izoplanar głębokość modulacji wynosi 100% w każdym miejscu między elektrodami, bodziec elektryczny jest jednakowy we wszystkich kierunkach. Stwarza to możliwość wykorzystania tej metody w stymulacji dużych powierzchni, objętych zmianami chorobwymi i leczenia trudnych do zlokalizowania zmian chorobowych, szczególnie w stanie ostrym. Jest to najłagodniejszy sposób terapii ze wszystkich technik czteropolowych.
W prądzie IF-Dipol, 100% modulacji amplitudy zachodzi tylko w jednym kierunku o kształcie wektora. W kierunku prostopadłym do wektora modulacja ma wartość zero. Metoda statyczna stosowana jest do lokalizacji i leczenia zmienionych chorobowo tkanek o przebiegu podłużnym (nerw kulszowy, mięśnie prostowniki lub zginacze nadgarstka). W czasie wyszukiwania optymalnego ustawienia wektora należy manualnie zmieniać jego pozycję, poprzez dostosowanie ustawienia kątowego. Po dokładnym ustawieniu właściwej pozycji wektora (pacjent odczuwa mrowienie wzdłuż przebiegu nerwu lub skurcz mięśni) i zanotowaniu ułożenia elektrod, należy rozpocząć terapię. Zastosowanie automatycznej rotacji pozwala uzyskać efekt obniżenia wzmożonego napięcia mięśniowego i usprawnienie krążenia, szczególnie w obszarze krzyżowania się mięśni biegnących w różnych kierunkach. Dłuższy czas rotacji charakteryzuje się silniejszym działaniem niż krótki czas rotacji.
Prąd IF-2 jest to dwupolowy prąd średniej częstotliwości, który w literaturze określany jest również jako premodulowany prąd interferencyjny. Interferencja między dwoma obwodami prądu powstaje wewnętrznie w urządzeniu. Modulacja amplitudy zachodzi tylko w jednym obwodzie (liniowa superprojekcja lub liniowa interferencja). Główną korzyścią wynikającą z techniki dwupolowej jest jej łatwość zastosowania. Właściwości interferencji liniowej niewiele różnią się od interferencji prostopadłej. Zasady kalkulowania częstotliwości, modulacja amplitudy i AMF są takie same. Więcej uwagi wymaga omówienie zmian natężenia prądu i głębokości modulacji. W interferencji liniowej maksymalna amplituda jest sumą dwóch oryginalnych amplitud Imax=2I. Gęstość jest większa pod elektrodami niż w tkankach głębiej położonych. W przypadku techniki czteropolowej maksymalne natężenie pod elektrodami jest nieznacznie niższe. Różnica ta nie ma większego znaczenia w terapii, gdyż generalnie pacjenci dobrze tolerują ten rodzaj prądu. Głębokość modulacji jest 100% we wszystkich kierunkach. Prąd ma wartość maksymalną wzdłuż linii łączących elektrody i wartość zero w kierunku prostopadłym do tych linii. Technika dwupolowa jest prostsza w użyciu ze względu na dużą łatwość objęcia działaniem leczniczym małego obszaru zmienionego chorobowo. Stosowanie wysokiego natężenia prądu nie powoduje niebezpieczeństwa uszkodzeń elektrochemicznych skóry.
Sposoby aplikacji
punkty bolesne lub spustowe
nerwy
przykręgosłupowa
transregionalna
na mięśnie
Prądy falujące średniej częstotliwości
Prąd falujący średniej częstotliwości jest to dwupolowy prąd interferencyjny, gdzie interferencja zachodzi wewnętrznie w elektrostymulatorze, zmodulowany do niskiej częstotliwości. Prąd ten jest często porównywany z falującym prądem neofaradycznym, lecz jest bardziej przyjazny dla pacjenta, gdyż nie ma komponentu galwanicznego i nie wywołuje w czasie stymulacji zmian elektrochemicznych pod elektrodami. Producenci w swoich urządzenich oferują użytkownikom dwa rodzaje falujących prądów średniej częstotliwości, różniące się częstotliwością prądu nośnego. Jeden prąd ma częstotliwość 4000Hz, drugi 2500Hz, zwany dalej prądem Kotza lub Rosyjską stymulacją.
Prąd falujący o częstotliwości nośnej 4000Hz powoduje zmniejszenie odczuć bólowych, usprawnia krążenie i wywołuje skurcze mięśni. Skurcze mięśniowe wyzwolone przez zmodulowaną do niskiej częstotliwość nośną 2500Hz, są silniejsze niż skurcze wyzwolone przez częstotliwość 4000Hz.
ROSYJSKA STYMULACJA- PRĄD KOTSA
Przez wiele lat do NMES mięśni normalnie unerwionych stosowano prąd neofaradyczny (prąd typu faradycznego, czas pulsu 0.5-1 msec). Dr Kots wygłosił szereg wykładów i przeprowadził również wiele ćwiczeń praktycznych będąc na wymianie naukowej na Uniwersytecie Concordia w Kanadzie (Sympozjum ES mięśni szkieletowych, 6-15 grudzień 1977). W swoim doniesieniu dr Kots przedstawił zastosowanie prądu zmiennego o sinusoidalnym kształcie fali, f=2500 Hz zmodulowanej do częstotliwości 50Hz, tzn. 10ms wybuch, 10 ms przerwa między każdym wybuchem, każdy dwufazowy puls trwa 0,4 msec.
Dr Kots jako pierwszy zastosował do stymulacji mięśni prawidłowo unerwionych prądu zmiennego średniej częstotliwości. W porównaniu z poprzednią stymulacją za pomocą prądu typu faradycznego, dzięki stymulacji za pomocą prądu zwanego prądem Kotsa lub „Rosyjską stymulacją” uzyskuje się silny skurcz mięśniowy (10-30% silniejszy niż skurcz dowolny), stymulacja jest odbierana przez pacjenta bez uczucia dyskomfortu, gdyż jest to prąd dwufazowy i nie występuje polaryzacja.
Zastosowanie do stymulacji mięśni prądu średniej częstotliwości 2500Hz, zmodulowanej do częstotliwości 50 Hz, wyzwala silny skurcz mięśnia lub grupy mięśni poprzez aktywację grubych zstępujących włókien nerwowych oraz dzięki zablokowaniu cienkich wstępujących włókien nerwowych ma działanie przeciwbólowe w obszarze stymulacji. Efekt przeciwbólowy nie łączy się z wrażeniami związanymi ze skurczem stymulowanych mięśni. Maksymalne skurcze mięśniowe powinny trwać 10-15 sekund, dlatego też dr Kots zastosował czas „on” wynoszący 10 sekund, a optymalny czas przerwy „off” 50 sekund. Podstawową zasadę stymulacji dr Kotsa zawiera reguła: czas skurczu 10 sec, czas odpoczynku 50 sec, 10 skurczów w czasie stymulacji. Głębokość penetracji zależy od zastosowanego natężenia prądu. Zabiegi należy wykonywać 5 razy w tygodniu, najlepiej przed snem. Nie stosować przed ćwiczeniami, gdyż można spowodować zmęczenia mięśni. Za pomocą elektrostymulacji próbujemy zwiększyć pojemność CUN przez rekrutację większej ilości dróg nerwowych do mięśni. Ilość sesji leczniczych zależy od celu terapii.
Dr Kots w celu zwiększenia szybkości ruchu mięśni zdrowych zaproponował 10-15 sesji leczniczych, w celu zwiększenia siły 20-25 sesji, w celu zwiększenia wytrzymałości 35 lub więcej sesji. Każda z nich zawiera 10 skurczów według wcześniej podanej formuły.
„Rosyjską stymulację” można również stosować w leczeniu urazów tkanek w celu osiągnięcia efektu przeciwbólowego lub przekrwienia. Jeżeli celem zabiegu jest działanie przeciwbólowe należy stosować formułę: czas „on” 12 sec, czas „off” 8 sec, czas zabiegu 15- 20 minut, natężenie zwiększane jest do momentu uzyskania słabych skurczów. Poprawę krążenia uzyska się stosując: czas „on”2 sec, czas „off” 2 sec, czas stymulacji 7-10 minut, natężenie zwiększane jest do momentu uzyskania słabych skurczów (zrost kości). Czasy „on” i „off” mogą być nieznacznie dłuższe, jeżeli stymulujemy większą partię mięśni. NMES za pomocą prądu Kotsa może być również stosowana w leczeniu płaskostopia i skolioz (niewielki kąt skrzywienia do 15 stopni, bez rotacji). Połączenie NMES z innymi metodami leczniczymi, szczególnie z ćwiczeniami leczniczymi zwiększa skuteczność stosowanych metod leczniczych i przyspiesza czas powrotu do zdrowia i sprawności pacjenta.
Tabela 5. Przykładowe parametry lecznicze stymulacji mięśni w przypadku atrofii.
STOPNIE ATROFII |
SILNA |
ŚREDNIA |
MAŁA |
CZĘSTOTLIWOŚĆ w Hz |
3-10 |
10-30 |
30-50 |
„ON” TIME |
5 |
5-10 |
10-15 |
„OF” TIME |
25-50 |
20-30 |
10-30 |
CZAS ZABIEGU |
5-10 |
15 |
15 |
ILOŚĆ SESJI DZIENNIE |
3-4 |
3-4 |
1-2 |
41.Mechanizm działania mikroprądów
Mechanizm działania mikroprądu nie jest jeszcze dokładnie wyjaśniony. Jedna z hipotez mówi o tym, że przywraca on biologiczną, elektryczną równowagę tkanek niezbędną do pobudzenia procesów gojenia. Zewnętrzna powierzchnia błony komórkowej posiada ładunek pozytywny, a wewnętrzna negatywny. Spoczynkowa różnica potencjałów wynosi około 50 mV. Kiedy komórka jest uszkodzona potencjał w tej części staje się bardziej negatywny, dlatego też prąd płynie do tego obszaru. Zjawisko to zmierzył Matteucci (1938) i Bois- Reymond (1843), a prąd nazwano „prądem uszkodzenia”. Generowany jest on zarówno w czasie uszkodzenia pojedynczej komórki, jak również tkanek. Doświadczalnie stwierdzono, że natężenie „prądu uszkodzenia” mieści się w zakresie od 10 do 30μA, więc jest to mikroprąd. Uważa się, że „prąd uszkodzenia” wspomaga zdrowienie komórek i tkanek w żywym organizmie. Dlatego też nieinwazyjnie aplikowany mikroprąd może uzupełniać i wspomagać naturalne funkcje „prądu uszkodzenia”. Eksperymentalne badania potwierdziły, że dzięki zastosowaniu mikroprądów zwiększa się produkcja ATP, synteza protein i aktywny transport aminokwasów i dzięki temu wspomagane są procesy regeneracji komórek i tkanek w żywym organizmie. Elektrony, jako integralna część wielu skomplikowanych reakcji zachodzących w żywym organizmie, pełnią również funkcję transportującą dla ATP. Kalkulacje wskazują, że w czasie aplikacji mikroprądem o natężeniu 10μA powstaje 6.3x1012 elektronów na sekundę. Ten przepływ elektronów działa na reakcje chemiczne w żywym organizmie.
Działania przeciwbólowego mikroprądu nie można wyjaśnić za pomocą mechanizmów „bramki kontrolnej”, czy teorii zwiększania produkcji endogennych substancji tłumiących ból, jak to ma miejsce w przypadku zastosowania prądów, których amplitudę mierzy się w miliamperach. Uważa się, że działanie przeciwbólowe mikroprądu można wyjaśnić za pomocą następujących hipotez:
A. Mikroprąd rozprzestrzenia się wzdłuż naczyń krwionośnych mających mały opór elektryczny. Dzięki przepływowi elektronów usprawnia się w naczyniach włosowatych krążenie krwi. Równocześnie przyspiesza się rozpad kwasu mlekowego i substancji uwrażliwiających receptory bólowe (np. bradykinina, histamina). Produkty rozpadu są również szybciej eliminowane dzięki zwiększonemu przepływowi krwi. Zmniejszenie dolegliwości bólowych następuje bezpośrednio po stymulacji. Na podstawie badań klinicznych proponuje się następujące parametry lecznicze mikroprądu: natężenie 300μA lub wyższe, czas impulsu 1-50msec, częstotliwość 200Hz lub wyższa.
B. W połączeniu z powyższym procesem wytwarzane jest ATP i zachodzi synteza protein, co przyspiesza proces zdrowienia tkanek, a naturalną jego konsekwencją jest zmniejszenie dolegliwości bólowych. W tym przypadku konieczny jest dłuższy czas terapii, aby uzyskać powyższe efekty kliniczne. Proponuje się następujące parametry lecznicze mikroprądu: natężenie 10μA-200μA, czas impulsu 200msec lub dłuższy, częstotliwość 0.3-1.0Hz.
Mikroprąd wykorzystywany jest również w celu przyspieszenia tempa gojenia ran, chociaż przedstawione w literaturze przedmiotu wyniki badań są bardzo różnorodne i często niekompletne.
Mikroprąd może powodować reakcje niepożądane w postaci pieczenia lub zaczerwienienia u pacjentów z wrażliwą skórą. W takim przypadku należy przerwać leczenie a pacjenta skierować do dermatologa. Po wyleczeniu podrażnień można kontynuować leczenie ostrożnie dawkując amplitudę mikroprądu. Terapia MENS jest przeciwwskazana u pacjentów z rozrusznikiem serca, w czasie infekcji, u pacjentów z gorączką powyżej 38°C, u kobiet ciężarnych, na brzuch w czasie menstruacji, w obszarze głowy, u dzieci poniżej 3 roku życia. Polaryzację elektrody czynnej należy dostosowywać w zabiegach podobnie jak w stymulacji wysokonapięciowej. W przypadku stosowania mikroprądu w postaci dwukierunkowej polaryzacja nie ma znaczenia w czasie zabiegu.
Terapia MENS zawiera zwykle dwie następujące po sobie fazy leczenia. W fazie pierwszej głównym celem jest szybkie zmniejszenie dolegliwości bólowych, w fazie drugiej- przyspieszenie procesu gojenia tkanek objętych procesem chorobowym. Czas zabiegu wynosi od 15 do 30 minut. Faza pierwsza trwa 15 minut, faza druga od 5 do 10 minut. Ilość sesji leczniczych należy dostosować do stanu leczonej tkanki. Zabiegi można wykonywać raz dziennie w ciągu 10 dni do 1,5 miesiąca. Po uzyskaniu zamierzonych efektów terapeutycznych wskazane jest kontynuowanie leczenia jeszcze przez 5-10 dni. W przypadku szczególnie ostrych dolegliwości bólowych terapię mikroprądem można łączyć z TENS-em. W takiej sytuacji w fazie pierwszej elektrostymulacji stosuje się TENS, w fazie drugiej mikroprąd o parametrach przyspieszających zdrowienie tkanki. W czasie zabiegów można stosować elektrody płaskie, które układa się wokół miejsc zmienionych chorobowo (lokalnie) oraz elektrody punktowe do stymulacji specyficznych punktów stymulacyjnych.
43.Stymulacja mięśni porażonych wiotko
Odnerwione mięśnie różnią się od mięśni unerwionych min. reakcją na bodziec elektryczny. Mięsień bez funkcjonalnego zabezpieczenia przez nerw, do skurczu może być pobudzony przez bezpośrednią stymulację włókien mięśniowych. W związku z tym istnieją różnice między stymulacją przez nerw i bezpośrednią stymulacją odnerwionego mięśnia.
Tkanka mięśniowa jest mniej pobudliwa niż nerw, więc konieczny jest większy ładunek elektryczny do jej stymulacji. Potwierdzeniem tej tezy jest krzywa I\t dla odnerwionych mięśni. Impuls prostokątny z dostosowanym natężeniem prądu będzie stymulował odnerwione mięśni, jeżeli będzie miał odpowiedni czas trwania np. więcej niż 30ms. Większy prąd jest konieczny dla krótszego czasu pulsu, aby wywołał on skurcz mięśni.
Jeżeli wiązka nerwów motorycznych stymulowana jest w punkcie motorycznym powoduje ona równoczesną stymulację wielu jednostek motorycznych, każda z nich aktywuje wiele włókien mięśniowych co z kolei wyzwala synchroniczny skurcz dużej partii mięśnia. Dowodem na to jest pojedyncze drgnięcie, seria drgnięć lub skurcze tężcowe, jeżeli natężenie jest wystarczająco wysokie. Jeżeli nie ma unerwienia, pojedyncze włókna mięśniowe są stymulowane, gdy gęstość prądu płynącego przez nie osiągnie odpowiednią intensywność, więc skurcz powoli rozciągnie się przez mięsień. Zakres skurczu i relaksacji w odnerwionych włóknach mięśniowych jest niższy niż w normalnych mięśniach. Skutki te przyczyniają się do rozróżnienia jakości skurczu zwanego czasem „pełzanie jak skurcz”.
Nerw jest zdolny do akomodacji zmian jonowych przez błonę komórkową, pod warunkiem, że zmiany te nie są zbyt szybkie. Tkanka mięśniowa ma mniejszą zdolność do akomodacji niż tkanka nerwowa, także całkiem powolne zmiany mogą stymulować włókna mięśniowe. Właściwość ta umożliwia selektywną stymulację mięśni, w przeciwieństwie do stymulacji tkanki nerwowej, stosując wolnowzrastający puls o kształcie trójkąta.
PRZYCZYNY REDUKCJI LUB UTRATY WOLNEJ SIŁY MIĘŚNIOWEJ
Uszkodzenie górnego neuronu ruchowego.
2. Uszkodzenie dolnego neuronu ruchowego.
3. Uszkodzenie mięśni.
4. Brak połączenia nerwowo mięśniowego.
5. Funkcjonalne zaburzenia.
ad.1. W przypadku uszkodzenia górnego neuronu ruchowego nie ma zmian w dolnym neuronie lub w mięśniach, które mogłyby zmieniać reakcje elektryczne. Czasami nerwy lub mięśnie mają wzmożoną pobudliwość i reagują na niższe natężenie prądu.
ad.2. Uszkodzenie dolnego neuronu ruchowego może obejmować zarówno komórki rogów przednich, włókna korzeni nerwowych lub nerwy obwodowe. Uszkodzenia obejmujące włókna nerwowe można podzielić na trzy grupy:
Neuropraxia (pierwszy stopień uszkodzenia)- jest czasowa utrata funkcji nerwu bez trwałych zmian strukturalnych, powstała w wyniku ucisku lub zgniecenia. Stymulacja w proksymalnej części od uszkodzenia nie daje reakcji w postaci skurczu, stymulacja w dystalnej części od uszkodzenia powoduje skurcz mięśnia unerwianego przez dany nerw. Rodzaje neuropraxii: fizjologiczny blok, fizjologiczny blok i odnerwienie.
Axonotmesis ( drugi stopień uszkodzenia) powstaje, jeżeli ucisk na nerw jest długotrwały i silny, następuje przerwanie wypustek osiowych bez naruszenia osłonek, co daje dobre warunki do regeneracji. Może być ona utrudniona, jeżeli powstaną zwłóknienia w osłonkach nerwu. Reakcja zwyrodnienia. Skurcz mięśni może być wyzwolony przez bezpośrednią stymulację mięśni stosując długi czas impulsu.
Neurotmesis ( trzeci stopień uszkodzenia) przerwanie ciągłości włókien i osłonki nerwu. Obwodowy odcinek aksonu ulega zwyrodnieniu (wallerowskie).Reakcja zwyrodnienia.
Wszystkie typy uszkodzeń nerwów mogą być częściowe lub całkowite, mogą występować w kombinacji np. neoropraxia i axonotmesis. Jeżeli wszystkie włókna nerwowe zaopatrujące mięsień są uszkodzone występuje reakcja charakteryzująca całkowite odnerwienie, jeśli tylko część włókien jest uszkodzonych występuje reakcja częściowego odnerwienia. Reakcje obserwowane w wyniku uszkodzenia rogów przednich rdzenia kręgowego zależą od rozległości uszkodzenia.
ad.3. Redukcja lub osłabienie dowolnych skurczy mięśni może wynikać z osłabienia lub uszkodzenia mięśni bez zwyrodnienia nerwów ruchowych. Reakcja na elektrostymulację jest normalnego typu, ale o mniejszej sile. Jeżeli w czasie uszkodzenia nastąpi utrata tkanki mięśniowej, nie ma reakcji na prąd elektryczny. Brak reakcji może powstać w takich stanach jak: niedotlenienie z przykurczu lub w miopatiach.
ad.4. Brak połączenia nerwowo mięśniowego może powstać w myasthenia gravis, zmniejszając dowoloną siłę w wyniku braku przewodzenia. Stosujemy inne metody niż elektrostymulację.
ad.5. Utrata zdolności dowolnych skurczy może wynikać z histerycznego porażenia co nie zmienia reakcji.
STAN ODNERWIENIA
Kiedy jest przerwana ciągłość włókna nerwowego powstaje zwyrodnienie wallerowskie poniżej od miejsca uszkodzenia i powyżej do pierwszego węzła Ranviera ( około 14 dni). Jeżeli będziemy stymulować nerw poniżej uszkodzenia przed upływem powstania całkowitej degeneracji, bodziec może spowodować powstanie normalnej reakcji w mięśniu w postaci skurczu. W związku z tym, nie jest możliwe przeprowadzenie pełnego badania uszkodzenia przed upływem 3 tygodni od podejrzewanego czasu uszkodzenia. Testy przeprowadzane przed tą datą mogą dać użyteczne informacje. Jeżeli występuje degeneracja włókna nerwowego jego reakcja 3-4 dni po uszkodzeniu jest zmniejszona lub jej nie ma. Zmiany reakcji w czasie stymulacji mięśni mogą być obserwowane pod koniec pierwszego tygodnia i wskazują, że w nerwie powstają zmiany degeneracyjne. Ostateczna rozległość uszkodzenia w tym stanie nie może być oceniona. Reakcja wskazująca częściowe odnerwienie pokazuje, że jakieś włókna nerwowe degenerują, ale nie pokazuje jak wiele włókien jest objętych tym procesem i kiedy zostanie zakończony.
44. promieniowanie laserowe rodzaje mechanizm działania efekty terapeutyczne
LASER - urządzenie do generacji lub zwiększania promieniowania elektromagnetycznego skali optycznej. Praca laserów opiera się na zjawisku stymulowanego (przymusowego) promieniowania, wykrytego przez Einsteina w 1916 roku. Doszedł on do wniosku, że pobudzone atomy w czasie współdziałania z promieniowaniem elektromagnetycznym mogą wysyłać fotony nie tylko spontanicznie, ale i planowo, zwiększając strumień świetlny. W laserze promieniowanie ma zamierzony (planowy lub wymuszony) charakter. Generacja fotonów odbywa się zgodnie w kierunku i wg fazy. Zasadniczy schemat lasera obejmuje substancje aktywne, w których określona ilość atomów znajduje się w stanie pobudzonym; system napompowania w celu dania energii do strefy aktywnej oraz system rezonansowy.
Rezonator optyczny składa się z dwóch luster, z których jedno jest półprzeźroczyste. System rezonansowy służy do wielokrotnego przepływu fotonów w środowisku aktywnym i ich zderzania z pobudzonymi atomami, co doprowadza do wymuszonej emisji nowych fotonów. Ich strumień lawinowo narasta i wychodzi przez półprzeźroczyste lustro w postaci monochromatycznego koherentnego światła.
Promieniowanie laserowe - promieniowanie elektromagnetyczne skali optycznej posiada właściwości:
Koherentność (uporządkowana, stała faza fotonów)
Monochromatyczność (zbiór fal o jednej określonej długości)
Polaryzacja i ukierunkowanie, co pozwala stworzyć duża koncentrację energii
Bardzo mała rozbieżność (skolimowanie)
Substancje aktywne - stanowią podstawową część źródła promieniowania. Atomy substancji aktywnych posiadają określone poziomy energii i możliwości uporządkowanego wytwarzania fotonów. Znane jest około 100 substancji aktywnych. Wśród nich wyróżnia się:
Twarde (rubin syntetyczny, kryształ, szkło barytowe z domieszką neodymu)
Gazowe (hel, neon, ksenon, krypton, azot, dwutlenek węgla, tlen i ich rózne mieszanki)
Płynne (dielektryki płynne, aktywowane elementami rzadko występującymi, roztwory barwników organicznych)
Półprzewodnikowe (arsenek galu, seleno-ołowiowy i inne)
RODZAJE LASERÓW
Lasery diagnostyczne - do diagnostyki stanu organizmu.
Lasery terapeutyczne - do terapii schorzeń, dzielą się na stymulacyjne i chirurgiczne.
Lasery stymulacyjne i diagnostyczne są to lasery małej mocy.
Podział laserów według stanu skupienia i rodzaju substancji czynnej lub materiału aktywnego lasera.
Lasery gazowe: molekularny CO2, atomowy He-Ne, jonowe Ar (argonowy) i Kr (kryptonowy).
Lasery cieczowe (w terapii hematoporfirynowej): barwnikowe, chelatowe.
Lasery stałe:
krystaliczne (z domieszkami jonów metali lub pierwiastków ziem rzadkich) itrowo-aluminiowe YAG,
półprzewodnikowe: ośrodek czynny stanowi złącze półprzewodnikowe (dioda).
Podział ze względu na moc lasera:
małej mocy, „zimne”
energetyczne
Biostymulacja laserowa: lasery gazowe i półprzewodnikowe:
miękki (soft), helowo-neonowe, promieniowanie czerwone, długość fali 632 nm, niskoenergetyczny, praca ciągła, moc średnia rzadko powyżej 100mW
średnioenergetyczne (mid), promieniowanie podczerwone, długość fali ok. 900 nm, półprzewodnikowe, moc od jednostek do dziesiątek wat, promieniowanie impulsowe.
Najbardziej „twarde” jest promieniowanie ultrafioletowe, najbardziej „miękkie” podczerwone. Im krótsza fala tym większa moc energetyczna fotonów (kwantów), tj. naświetlanie jest bardziej twarde. Promieniowanie laserowe z zakresu ultrafioletu może zakłócać silne wewnątrz-molekularne więzi, co zawęża jego skalę terapeutyczną. Przy dużych dawkach najmocniej działa na kwasy nukleinowe, enzymatyczną aktywność białek w wyniku czego możliwe są mutacje i zanik komórek. Trudna do określenia jest granica między działaniem aktywizującym a hamującym i szkodliwym. Bardzo szeroka jest możliwość wykorzystania terapeutycznego promieniowania laserowego czerwonego i podczerwonego, u podstaw którego leży możliwość aktywacji enzymów, które dają odzew na zupełnie słabe działanie energetyczne.
Jest to kluczowe ogniwo w biostymulującym efekcie laseroterapii.
EFEKTY DZIAŁANIA WIĄZKI LASEROWEJ
Fototermiczne - koagulacja lub odparowanie tkanki absorbującej światło. Impulsy laserowe o czasie trwania ok. 0.5 ms lub dłuższe.
Fotodynamiczne - „mikrowybuch” tkanki po wpływem krótkich, intensywnych impulsów laserowych o czasie krótszym od 0.2 ms.
Fotochemiczne - bezpośrednie rozrywanie wiązań chemicznych lub reakcje chemiczne ze związkami wcześniej wprowadzonymi do tkanek (metoda PDT).
Biostymulacja laserowa - stymulacja aktywności komórkowej tkanki pod wpływem wiązki laserowej o bardzo małej mocy (LLLT).
Selektywna fototermoliza - zastosowanie wiązki laserowej o takiej długości fali i takim czasie trwania, które maksymalnie podgrzeją wybrana tkankę przy najmniejszych zniszczeniach tkanek otaczających.
BIOSTYMUACJA LASEROWA
Terapia laserem niskoenergetycznym o małej gęstości mocy w tkance P<200mW/cm2 , będąca elementem światłolecznictwa.
Zmiana aktywności komórek i tkanek pod wpływem naświetlania słabą wiązką laserową o długości fali od 600 do 1100 nm.
Przyrost temperatury tkanek naświetlanych jest mniejszy od 1°C.
Prawo Arndta-Shultza: słabe i umiarkowane bodźce pobudzają aktywność fizjologiczną, silne opóźniają, bardzo silne hamują.
Na poziomie subkomórkowym:
Aktywowanie składników łańcucha oddechowego (np. oksydazy cytochromowej, atepazy)
Przyspieszanie reakcji utleniania i redukcji w mitochondriach i cytoplazmie
Wzrost przepuszczalności błony komórkowej (pompa sodowa - potasowa)
Poprzez zwiększenie fosforylacji oksydatowej białek komórkowych zwiększa się synteza DNA i RNA, co w efekcie powoduje zwiększenie produkcji białka (enzymów, hormonów, mediatorów międzykomórkowych, kolagenu).
Na poziomie komórkowym (zmiana ładunku pola elektrycznego komórki, zmiana jej potencjału, zwiększenie aktywności rozrodczej) i tkankowym (zmiana ph płynu międzykomórkowego, aktywności morfofunkcyjnej i mikroobiegu)
Osteoklasty: stymulacja lizy kości w miejscach uszkodzenia (np. na granicy jej złamania), co jest przygotowaniem do dalszego działania osteoblastów.
Osteoblasty: stymulacja produkcji tkanki kostnej, czyli regeneracji np. w miejscu złamania lub w osteoporozie. Przyspieszenie czynności makrofagów i zwiększenie ich czynności żernych, wzrost produkcji cytokinin i prostoglandyn, poprawa czynności mikrokrążenia i neoangiogenezy.
Komórki krwi: uwalnianie histaminy z granulocytów, serotoniny z płytek krwi, ułatwianie fagocytozy, zwiększenie produkcji kolagenu z fibroblastów.
Komórki nerwowe: zahamowanie degeneracji Wallera neurytów i przyspieszenie ich regeneracji, zmniejszenie obrzęku neuronów, zmniejszenie cech stanu zapalnego, co w efekcie daje normalizację przewodnictwa nerwowego.
Czynniki ograniczające wnikanie światła w skórę: opalenizna, zwiększona warstwa tłuszczu, filtry optyczne w kosmetykach.
Czynniki zwiększające wnikanie światła w skórę: bardzo jasna karnacja, ucisk aplikatora, większa średnica wiązki.
Niezbędne warunki powodzenia biostymulacji laserowej: prawidłowe rozpoznanie, zastosowanie lasera o odpowiedniej długości fali, wybór właściwego miejsca naświetlania, sposób naświetlania, aplikacja odpowiedniej dawki energii, właściwy dobór serii zabiegów.
KLUCZOWE OGNIWA W BIOSTYMULUJACYM EFEKCIE TERAPEUTYCZNYM LASEROTERAPII
Aktywacja enzymów→zwiększenie bioenergetycznych i biosyntetycznych procesów w komórkach→wzrost poziomu ATP. Zwiększa się ilość węglowodanów, białek, kwasów nukleinowych. Procesy regeneracji najwyraźniej widoczne są w tkance kostnej, łącznej, nabłonkowej, mięśniowej, nerwowej.
Stymulacja hematopoezy→zwiększenie liczby elementów morfologicznych krwi, zmian aktywności czynników krzepnięcia krwi, obniżenie OB.
Aktywacja systemu odpornościowego.
Stymulacja mikrokrążenia.
Najbardziej widoczne efekty kliniczne powstają przy napromieniowaniu miejscowym. Powstają następujące reakcje:
Regeneracyjne
Odpornościowo -stymulujące
Przeciwzapalne
Odczulające
Polepszające mikrokrążenie
Przeciwobrzękowe
Kojące ból
46.Cele elektrodiagnostyki i metody elektrodiagnostyki
Elektrodiagnostyka jest metodą diagnostyczną obejmującą badanie pobudliwości nerwów
i mięśni przy użyciu prądu stałego i prądów impulsowych. Celem elektrodiagnostyki jest wykazanie zmian pobudliwości zachodzących w nerwie lub w mięśniu w stanach chorobowych. Na podstawie badań elektrodiagnostycznych można :
ustalić lokalizację procesu chorobowego (czy proces chorobowy dotyczy nerwu czy mięśnia)
ocenić stopień uszkodzenia układu nerwowo-mięśniowego
wnioskować o rokowaniu
ustalić dobór właściwego leczenia
monitorować proces leczenia
ocenić ciągłość nerwu
ocenić ciągłość ścięgna mięśnia przy świeżych urazach.
Fizjologiczne podstawy elektrodiagnostyki
Wszystkie komórki organizmu wykazują zjawiska elektryczne, głównie w obrębie błony komórkowej. Błona komórkowa wykazuje dużą oporność dla przepływu przez nią prądów jonowych z uwagi na swoją warstwę lipidową. W wyniku swojej izolacyjnej funkcji błona komórkowa stanowi miejsce rozdziału ładunków dodatnich (na zewnątrz błony) i ładunków ujemnych (wewnątrz komórki). Ta różnica potencjału elektrycznego zwana krótko potencjałem błonowym występuje we wszystkich komórkach, a w komórkach nerwowych
i mięśniowych określanych mianem komórek pobudliwych jest podstawą właściwości fizjologicznych związanych z ich pobudliwością. Przez pobudliwość rozumie się zdolność komórki do reagowania na bodźce. Ujemny potencjał spoczynkowy komórki nerwowej wynosi średnio -70 mV, a w komórkach mięśni poprzecznie prążkowanych wynosi od
-80 mV do -90 mV.
Komórki nerwowe i mięśniowe nie tylko wykazują potencjał spoczynkowy, ale ponadto posiadają zdolność zmiany potencjału błonowego pod wpływem różnych bodźców działających na błonę komórkową. W miejscu zadziałania bodźca błona komórkowa ulega depolaryzacji. Jeżeli depolaryzacja błony komórkowej osiągnie wartość progową (-55 mV) to dochodzi do wyzwolenia potencjału czynnościowego, którego wartość szczytowa wynosi
+35 mV. Samoczynnie rozprzestrzeniający się potencjał czynnościowy wzdłuż włókna nerwowego nosi nazwę impulsu nerwowego.
W zasadzie każde bodźce chemiczne lub fizyczne (w tym impulsy elektryczne) jeśli tylko działają odpowiednio długo i z odpowiednim natężeniem powodują pobudzenie komórki czyli zmianę polaryzacji błony komórkowej. Jest to fundamentalna zasada na której opiera się elektrodiagnostyka.
Współczesne techniki diagnostyczne dają możliwość wykorzystania dwóch sposobów oceny funkcjonowania tkanek pobudliwych : poprzez pomiar potencjałów generowanych w trakcie pobudzenia tkanki nerwowej i mięśniowej (EKG, EEG, EMG) oraz poprzez stymulację tych tkanek odpowiednimi impulsami elektrycznymi i ocenę rezultatów tej stymulacji. Obecnie elektromiografia należy do rutynowo stosowanych metod diagnostycznych. Rozkwit metod elektrodiagnostycznych opartych na stymulacji tkanek pobudliwych impulsami prądu elektrycznego nastąpił po II wojnie światowej. Metody te są znacznie tańsze, prostsze i doskonale nadające się do wstępnej diagnozy oraz monitorowania procesu leczenia. Spośród wielu stosowanych testów na uwagę zasługuje kilka, które
w praktyce lekarskiej i rehabilitacyjnej dostarczają wielu cennych informacji dotyczących wstępnej diagnostyki, prognozowania oraz oceny postępów procesu leczniczo-rehabilitacyjnego.
Wszystkie metody stosowane w elektrodiagnostyce układu nerwowo-mięśniowego można podzielić na metody jakościowe i ilościowe.
47.Wartość diagnostyczna krzywej I/t
wykrywanie obecności lub niebecności pobudliwych włókien nerwowych w mięśniu
(określony kształt krzywej, obecność węzła, jego pozycja jest odbiciem ilości odnerwionych włókien).
wykrywanie sygnałów reinerwacji w mięśniu.
określenie wartości chronaksji i reobazy .
monitorowanie progresji uszkodzenia ( zdrowienie lub regresja).
określanie czasu użytecznego (najkrótszy czas trwania impulsu o danym natężeniu, powodujący min. skurcz mięśnia).
Krzywą I/t wyznacza się stymulując tkanki pobudliwe impulsami prostokątnymi oraz trójkątnymi przy czym oba wykresy nanosimy na ten sam formularz, celem porównania przebiegu obu krzywych. Przygotowanie pacjenta do zabiegu :
część ciała poddana testowi powinna być dobrze ustabilizowana a mięśnie rozluźnione
mięsień poddawany testowi powinien być ogrzany (ciepła woda, ruchy bierne lub czynne)
skóra pod elektrodami powinna być odtłuszczona (np. spirtusem salicylowym)
przebarwienia i niewielkie ubytki skórne należy okryć warstwa wazeliny kosmetycznej
podkłady pod elektrodami dobrze zwilżone w celu zmniejszenia oporności skóry
elektrodą czynną jest zwykle elektroda punktowa połączona z katodą, którą za pośrednictwem podkładu lub żelu przewodzącego pobudza się punkty motoryczne mięśni lub nerwów
główka elektrody czynnej (płaska o średnicy 12 lub 20 mm, lub kulkowa) powinna być zawsze skierowana prostopadle do powierzchni skóry
przesuwając elektrodę po skórze powinno się wywierać równomierny docisk, gdyż
w przypadku niewłaściwego dolegania może nastąpić miejscowe nadmierne zagęszczenie prądu odczuwane przez pacjenta jako bardzo nieprzyjemny bodziecelektrodę bierną połączoną z anodą, umieszcza się przy badaniu mięśni w obrębie kończyny górnej na obręczy barkowej lub karku, a badając mięśnie kończyny dolnej w okolicy lędźwiowej
W tym miejscu należy wspomnieć, że do wyznaczenia krzywej I/t w przypadku dużych mięśni (posiadających kilka punktów motorycznych) lub grup mięśniowych stosuje się metodę dwubiegunową. Metoda ta polega na ułożeniu dwóch płaskich, wielkością dobranych do wielkości mięśnia elektrod na przeciwległych biegunach brzuśca mięśniowego. Elektroda ułożona obwodowo połączona jest z ujemnym biegunem źródła prądu (katoda).
Przed przystąpieniem do właściwego zabiegu musimy ustalić lokalizację punktu motorycznego. W tym celu używamy impulsu prostokątnego o czasie trwania 100 - 300 ms. Miejsce stymulacji gdzie najłatwiej uzyskujemy skurcz mięśnia bez zbytniego dociskania elektrody czynnej określamy jako punkt motoryczny. Bardzo pomocne jest zaznaczenie flamastrem położenia punktu aby przy każdej próbie stymulować to samo miejsce. Jest rzeczą niezwykle istotną aby zachować stały docisk i umiejscowienie elektrody czynnej w trakcie testu, który składa się z kilku prób. Przy znalezieniu punktu motorycznego nerwu lub mięśnia pomocne mogą być tablice topograficzne punktów motorycznych. Badanie rozpoczyna się od impulsu o szerokości 1000 lub 500 ms. Zdaniem wielu autorów można jednak zrezygnować z drażnienia impulsami prostokątnymi o wartości czasu impulsu powyżej 300 ms, gdyż nie zaobserwowano różnic w poziomie reobazy dla przedziału czasu impulsu od 250 - 1000 ms. Jako stałe kryterium przyjmuje się stwierdzony wizualnie lub wyczuwalny palpacyjnie minimalny skurcz mięśnia. Minimalny skurcz mięśnia wskazuje na najmniejszą wartość natężenia prądu przy danym czasie trwania impulsu. Te zależne od siebie wartości nanosi się na układ współrzędnych gdzie na osi odciętych (Y) znajdują się wartości natężenia prądu wyrażone w mA a na osi rzędnych (X) znajdują się wartości czasu impulsu wyrażone w ms. W celu dokładnego wyznaczenia przebiegu krzywej I/t nanosi się na wspomniany układ współrzędnych co najmniej 6 pomiarów wartości natężenia prądu dla czasów impulsów w zakresie od 300 do 0,1 ms.
48. narysuj i scharakteryzuj krzywa IT
KRZYWA I/t MIĘŚNIA PRAWIDŁOWO UNERWIONEGO
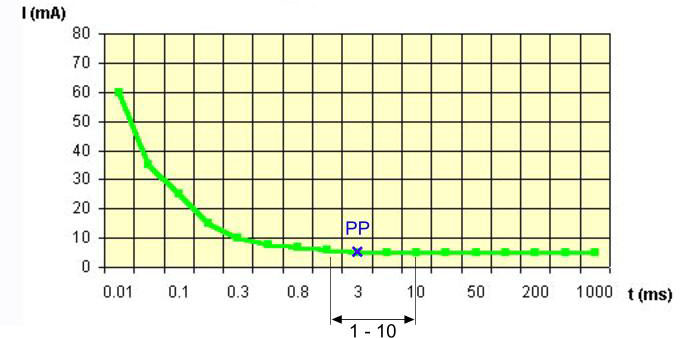
poziomym przebiegiem krzywej określającym wartość reobazy w zakresie impulsów długich
przy wartościach impulsów 10 - 30 ms krzywa wznosi się tworząc hiperbolę, gdyż impulsom krótkim czasie trwania do wywołania skurczu mięśnia potrzebne są wyższe wartości natężenia prądu
kąt hiperboli jest rozwarty
wartość czasu użytecznego, czyli graniczna wartość impulsu o natężeniu reobazy, który jeszcze wywołuje skurcz mięśnia przesunięta jest w lewą stronę na osi rzędnych
z przebiegu krzywej i/t wyznaczonej za pomocą impulsów trójkątnych odczytujemy progową wartość akomodacji, czyli minimalne natężenie prądu potrzebne do wywołania skurczu przy czasie trwania impulsu wynoszącym 1000 ms (tzw. reobaza dla trójkąta). Wartość tego parametru dla zdrowego mięśnia jest trzy-, czterokrotnie większa od wartości reobazy wyznaczonej prze impulsy prostokątne, ponieważ prawidłowo unerwione włókna mięśniowe posiadają zdolność akomodacji, czyli niereagowania skurczem na wolno narastającą wartość natężenia w impulsach trójkątnych
impulsy trójkątne o czasie trwania 10 - 30 ms tracą swoje właściwości eksponencjonalne czyli upodabniają się do impulsów prostokątnych. Przy tak krótkich czasach narastania prądu w impulsach trójkątnych zdrowy mięsień będzie odpowiadał skurczem podobnie jak na impulsy prostokątne dlatego od tego momentu obie krzywe będą przebiegać podobnie.
wartości parametrów dla prawidłowo unerwionego mięśnia : reobaza 2 - 10 mA, chronaksja 0.1 - 1 ms, czas użyteczny 10 - 30 ms.
KRZYWA I/t MIĘŚNIA CZĘŚCIOWO ODNERWIONEGO
wykres powstaje z nałożenia na siebie dwóch krzywych : patologicznej i fizjologicznej, co świadczy o występowaniu tylko częściowego uszkodzenia unerwienia mięśnia
początkowo niska reobaza jest wynikiem obniżenia progu pobudliwości ulegających degeneracji odnerwionych włókien mięśniowych, które na impulsy elektryczne o niższych wartościach reagują wcześniej w stosunku do miocytów prawidłowo unerwionych
na wykresie krzywej obserwujemy próg załamania zwany węzłem krzywej patologicznej
część wykresu na prawo od węzła ilustruje odnerwione włókna mięśniowe
część wykresu na lewo od węzła ilustruje włókna unerwione prawidłowo
stosunek jednej części do drugiej określa w przybliżeniu stopień degeneracji mięśnia
położenie węzła niesie ze sobą bardzo ważną informacje diagnostyczną tzn. im bardziej na prawo zlokalizowany jest węzeł tym lepsze rokowanie i odwrotnie
w trakcie leczenia można przeprowadzać za pomocą krzywej i/t monitorowanie efektów terapii, tzn. przemieszczenie węzła w prawo świadczy o reinerwacji mięśnia, zaś przemieszczenie w lewo sugeruje dalej postępującą degenerację
KRZYWA I/t MIĘŚNIA ODNERWIONEGO
wykres krzywej przesunięty jest w prawo i ku górze
wartości reobazy i chronaksji są podwyższone ponieważ do pobudzenia odnerwionych miocytów potrzebne są bodźce o większym ładunku elektrycznym
czas użyteczny przesunięty jest w prawo i może wynosić nawet 250 ms
stymulacja impulsami o czasie trwania mniejszym niż 50 ms może okazać się niemożliwa, ponieważ wysokie natężenie prądu potrzebnego do wywołania skurczu mięśnia będzie boleśnie odczuwane przez pacjenta
krzywa dla impulsów trójkątnych, będzie wykazywać obniżenie wartości progu akomodacji, ponieważ odnerwione miocyty wykazują słabszą zdolność adaptacyjną
w stosunku do narastających wartości natężenia prądu
49.Parametry do stosowania stymulacji mięśni porażonych wiotko
CZAS.
Bardzo ważne jest, aby rozpocząć elektroterapię możliwie jak najszybciej, gdyż maksymalna atrofia powstaje w ciągu pierwszych 3 miesięcy po uszkodzeniu.
CZAS I KSZTAŁT IMPULSU, CZĘSTOTLIWOŚĆ I CZAS PRZERWY.
w przypadku utraty ciągłości aksonu i degeneracji wallerowskiej stosujemy impuls eksponencjalny o długim czasie trwania (2000ms)- powstaje żwawy skurcz, przy małym natężeniu prądu, mały dyskomfort dla pacjenta.
Fizjologiczny blok- 10-100ms impuls prostokątny.
fizjologiczny blok i odnerwienie (axonotmesis i neurotmesis)- 100-2000ms impuls trójkątny lub trapezowy.
Regeneracja- nie należy stosować prądu typu faradycznego z max. skurczami.
Używamy do stymulacji impuls prostokątny o długim czasie trwania. Zachować ostrożność, aby nie przedawkować zbyt dużego natężenia prądu.
RODZAJE SKURCZÓW
Badacze uważają, że 2-3 cykle dziennie z max. izometrycznymi skurczami dają korzystny efekt w opóźnianiu atrofii. Bardzo ważne, aby nie stosować zbyt wysokiego natężenia dla pulsu o długim czasie trwania, gdyż może to spowodować szkodliwe efekty w metabolizmie i dożywieniu mięśni. Potwierdzono doświadczalnie, że optymalnym poziomem leczenia jest 20-30 skurczów, powtarzanych dwa razy dziennie. Alternatywną metodą jest stosowanie 90-200 skurczów dziennie. Bardzo ważna jest faza odpoczynku między skurczami (cas trwania przerwy jest od 3 do 5 razy dłuższy niż czas trwania skurczu) oraz między grupami skurczów- około 1 minuty. Jeżeli zakładamy wykonanie 20-30 skurczów w czasie jednego zabiegu grupujemy je po 10 z 1-2 minut przerwy między nimi. Ogromną uwagą należy zwrócić na fakt, aby mięsień nie zmęczył się. Cały czas należy obserwować skurcz. Jeżeli wykonujemy 90-200 skurczów dziennie grupujemy je w serie po 30 skurczy.
CZĘSTOTLIWOŚĆ ZABIEGÓW
Efektywność leczenia zależy od jego częstotliwości. Uważa się, że należy zabiegi wykonywać 2-3 razy dziennie. Dzięki zastosowaniu indywidualnych stymulatorów i przyuczaniu rodziny pacjenta zabiegi można wykonywać również w domu.
SELEKCJA MIĘŚNI
Stymulacja powinna być stosowana, jeżeli istnieje szansa wyzdrowienia mięśni. Są one minimalne, jeśli upłynęło około 12 miesięcy od urazu lub choroby. Maksymalne skurcze łatwiej uzyskać w małych mięśniach niż w dużych. Małe mięśnie łatwiej ulegają zwłóknieniu i potrzebują dłuższego czasu do wyzdrowienia. Mięśnie głębiej położone są trudniejsze do wyizolowania, do czego potrzebne jest większe natężenie prądu. Są również mniej podatne na zwłóknienia.
RELACJA MIĘDZY DŁUGOŚCIĄ I NAPIĘCIEM MIĘŚNIA
Pozycja początkowa mięśni powinna być następująca: mięsień powinien być rozciągnięty i dobrze podparty, aby chronić go przed nadmiernym rozciągnięciem i ruchem izotonicznym w czasie skurczu. Pozycja mięśnia razem z umiarkowanym oporem zabezpiecza ruch z maksymalnym napięciem, które jest optymalnym czynnikiem opóźniającym atrofię. Maksymalny skurcz izometryczny w tej pozycji hamuje rozwój zwłóknienia.
OCENA
Badania powinny być przeprowadzane co najmniej raz w tygodniu. Oceniamy wolne skurcze mięśniowe, czucie, krzywą I\t, EMG , wartość chronaksji, skurcz pod wpływem prądu galwanicznego, aby ocenić zdrowienie bądź regres. Czas użyteczny i chronaksja uzyskane z krzywej I\t mogą pomóc w doborze czasu pulsu do leczenia.
TEMPERATURA
W celu dobrania minimalnego natężenia prądu do uzyskania max. skurczu należy koniecznie ogrzać mięśnie przed stymulacją (ciepła kąpiel, owinięcie w ręcznik). Wzrost temperatury obniża wartość reobazy.
OPÓR SKÓRY
Duży opór skóry może spowodować ból i dyskomfort pacjenta. Zmniejszamy go przez umycie skóry i usunięcie łuszczącego się naskórka.
OPUCHLIZNA
Należy zmniejszyć opuchliznę przed stosowaniem stymulacji, gdyż jej obecność powoduje wzrost natężenia prądu.
50.Chronaksja reboza współczynnik akomodacji
Reobaza jest miarą pobudliwości tkanki odpowiadającą najmniejszej wartości natężenia impulsu prostokątnego o czasie trwania 1000 ms, która powoduje reakcję tkanki pobudliwej. Wartość reobazy wyraża się w mA(C.C w obwodzie pacjenta prąd jest niezależny w pewnych zakresach od rezystancji skóry i tkanek). Duże wartości reobazy świadczą o małej pobudliwości.. Reobaza wyznacza się stosując katodę w punkcie motorycznym nerwu lub stosując technikę dwupolową. Normalna wartość reobazy wynosi od 2 do 18mA. Przykładowe wartości reobazy w różnych mięśniach: deltoid 5mA, triceps 5mA, frontalis 4mA. Wartość reobazy zależy od wielu czynników:
oporność skóry i tkanek podskórnych: dłoniowa część ręki i podeszwowa część stopy, mają dużą oporność skóry i potrzebują większego natężenia prądu. Powstające zmiany troficzne pod wpływem odnerwienia w skórze w wyniku utraty nerwów sympatycznych powodują, że skóra staje się sucha i łuskowata, co powoduje wzrost wartości reobazy.
opuchlizna i zapalenie powodują utrudnione przejście impulsu nerwowego do błony mięśniowej. Zbyt wysokie natężenie prądu powoduje nieprzyjemne odczucia pacjenta.
temperatura zmienia wartość reobazy. Ciepło obniża a zimno zwiększa wartość reobazy.
pozycja stymulującej elektrody- reobaza ma minimalną wartość, jeżeli elektroda czynna- katoda znajduje się w punkcie motorycznym lub umieszczona jest w dystalnej części mięśnia w technice dwupolowej.
Z badań klinicznych można wysnuć następujące wnioski:
degeneracja-po około10 do 15 dni po uszkodzeniu wartość reobazy zwiększa się.
odnerwienie obniża wartość reobazy do około 60% normalnej wartości. Często zdarza się, że wartość reobazy jest podwyższona, co jest wynikiem działania wielu czynników powodujących wzrost reobazy.
częściowe odnerwienie- generalnie nie powoduje zmian reobazy.
Chronaksja jest miarą pobudliwości tkanek wyrażającą się najkrótszym czasem impulsu prądu stałego o natężeniu równym podwójnej reobazie, który powoduje reakcję tkanki np. skurcz mięśnia lub powstanie impulsu w nerwie. Wartość chronaksji wyrażamy w ms. Im wartość chronaksji jest większa tym pobudliwość tkanki jest mniejsza. Oba parametry można odczytać z krzywej I/t. To właśnie wartość chronaksji ma kolosalny wpływ na obraz przebiegu krzywej I/t. Normalne wartości chronaksji są mniejsze niż 1ms ( stosując do badań aparaturę o stałym prądzie w obwodzie pacjenta). Nerwy obwodowe mają wyższą chronaksję, ponieważ zawierają włókna czuciowe i ruchowe. Po urodzeniu chronaksja jest 10 -krotnie wyższa od normalnej wartości. W 3 miesiącu życia jej wartość obniża się, potem znów staje się wyższa. Między 18 a 20 miesiącem życia chronaksja powraca do normalnej wartości. Mięśnie proksymalne mają wyższą chronaksję niż mięśnie dystalne. Mięśnie twarzy mają bardzo niski ten wskaźnik. Wiele różnych czynników może wpływać na wartość tego wskaźnika pobudliwości:
struktura skóry- zmienia wartość chronaksji oraz powoduje trudność w jej określeniu.
ischemia podnosi próg pobudliwości i obniża pobudliwość mięśni. Chronaksja wzrost o 100% pod wpływem tego stanu.
opuchlizna powoduje trudności w określeniu chronaksji.
zmęczenie-jeżeli mięsień jest zmęczony, wartość chronaksji zwiększa się podwójnie, potem powraca do normalnej wartości.
pozycja stymulującej elektrody- jeżeli nie jest ona umieszczona w punkcie motorycznym nerwu, to wartość chronaksji jest około 10 razy większa , niż w wypadku umieszczenia elektrody w punkcie motorycznym nerwu. Szczególnie w małych mięśniach niepoprawne umieszczenie elektrody powoduje zmianę wartości chronaksji.
Z klinicznych studiów można wysnuć następujące wnioski:
fizjologiczny blok nie pokazuje zmian, jeżeli nie jest długotrwający.
odnerwienie powoduje wzrost chronaksji w całym zajętym mięśniu. Wzrost chronaksji sięga od 50 do 200 razy w stosunku do normalnej wartości, czyli do 25ms. Jej wartość spada do 15ms przez 30-40 dni po odnerwieniu.
re-inerwacja- progresywny spadek wartości chronaksji, nie poprzedza on zdrowienia i nie daje wskazań zdrowienia.
uszkodzenie korzeni nerwowych- wzrost chronaksji w mięśniach unerwianych przez dany korzeń.
obwodowa neuropatia spowodowana infekcją, toksycznymi substancjami, przemysłowymi uszkodzeniami przyczynia się do zwiększenia pobudliwości nerwu następującego przez obniżenie poziomu pobudliwości.
miopatie- nie powodują znaczących zmian.
Współczynnik akomodacji
Różnice jakie obserwuje się w reakcji mięśnia na impulsy prostokątne i trójkątne są podstawa do oznaczenie tzw. współczynnika akomodacji. Współczynnik ten określa zdolność do przystosowania (akomodacji) mięśnia do wolno narastającego prądu w impulsie trójkątnym. Innymi słowy mówi on ile razy większego natężenia impulsu trójkątnego należy użyć w stosunku do impulsu prostokątnego aby uzyskać progowy skurcz mięśnia przy czasie trwania obu impulsów równym 1000 ms. Współczynnik akomodacji to iloraz wartości progowej akomodacji (mA) przez reobazę (mA). Wartość współczynnika akomodacji dla zdrowego mięśnia mieści się w zakresie 4 - 6, dla mięśnia częściowo odnerwionego między 2 - 4, a dla całkowicie odnerwionego wynosi 1 - 2.
Wyszukiwarka
Podobne podstrony:
egzamin 27,06
Egzamin (27 06 2005)
EGZAMIN 27
Narloch egzamin 27 03 2011
egzamin 2 termin 27 06 2005 id Nieznany
Pytania z PKM i pomp EGZAMIN, IŚ Tokarzewski 27.06.2016, V semestr COWiG, PKM (Podstawy konstrukcji
Pytania z endokrynologii1, RADIOLOGIA, RADIOLOGIA EGZAMIN, EGZ UPORZĄDK TESTY 27-12-10
Teoria egzamin 16.09, 27-29, Zadanie 27
wentylacja coś jest ale słabe, IŚ Tokarzewski 27.06.2016, V semestr COWiG, WiK (Wentylacja i Klimaty
2012 Egzamin 2 rozwiazaniaid 27 Nieznany (2)
27 12 10 01 12 07 egzamin analiza 2009 2
Rozwiązanie zadania nr 27 chyba, egzamin na rzeczoznawcę majątkowego, 2008
27 12 10 01 12 48 egzamin analiza 2009 1
GW - 27, Geodezja PW, Stare dzieje, Egzamin inż, GW - odpowiedzi
Wszystkie pytania, IŚ Tokarzewski 27.06.2016, V semestr COWiG, WiK (Wentylacja i Klimatyzacja), Wykł
Egzamin z RP2 27 stycznia 2009 p1 id 153386
więcej podobnych podstron