Sprawozdanie ,,C2”
|
─ćWICZENIE ,,C2” POMIAR CIEP┼üA W┼üA┼ÜCIWEGO POWIETRZA METOD─ä ROZ┼üADOWANIA KONDESATORA.
|
||
FIZYKA I ROK
|
OCENA Z KOLOKWIUM |
OCENA ZE SPRAWOZDANIA |
OCENA KOŃCOWA |
|
|
|
|
I.WST─śP TEORETYCZNY
Równanie stanu gazu doskonałego:
Przemian─Ö izotermiczn─ů (T = const) opisuje prawo Boyle'a i Mariotte'a:
Dla ustalonej porcji gazu iloczyn ci┼Ťnienia i obj─Öto┼Ťci jest w ustalonej temperaturze wielko┼Ťci─ů sta┼é─ů
p1V1 = p2V2 = const
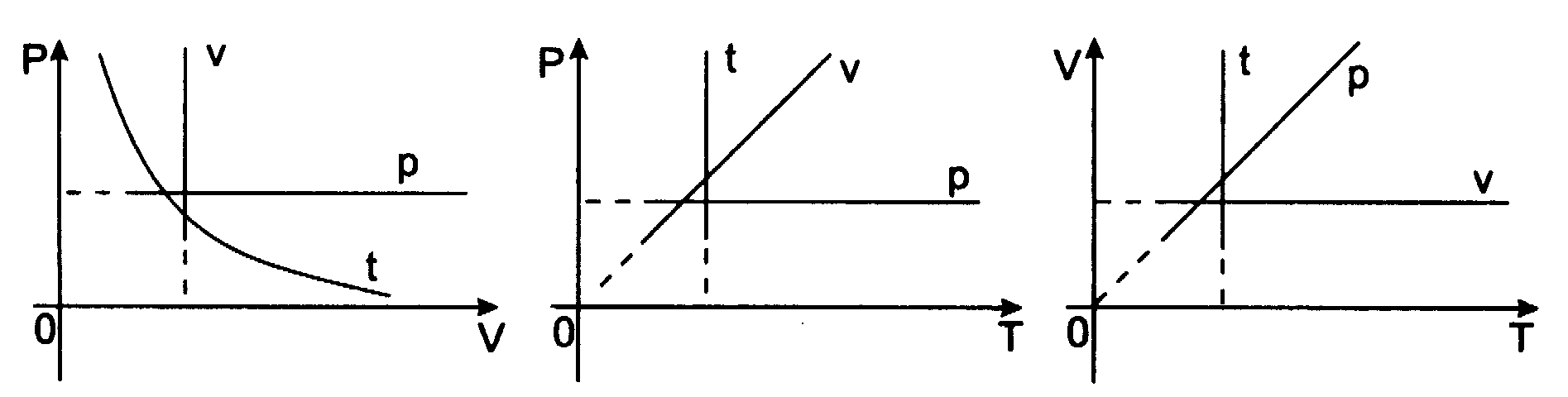
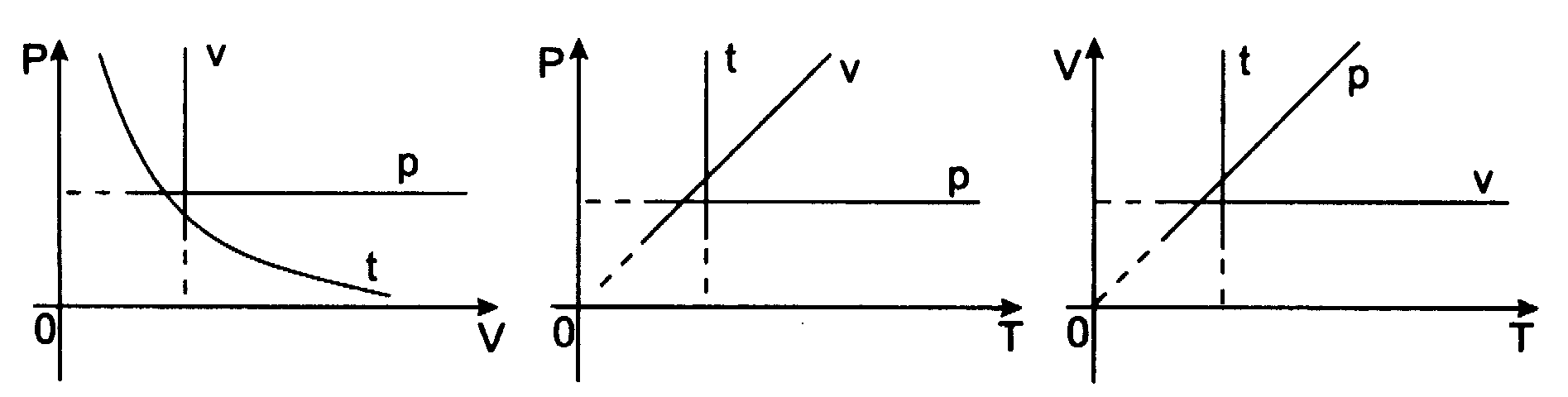
Przemian─Ö izobaryczn─ů opisuje prawo Gay - Lussaca:
Dla ustalonej porcji gazu pod sta┼éym ci┼Ťnieniem wzrost temperatury o 1oC powoduje wzrost obj─Öto┼Ťci gazu o
obj─Öto┼Ťci, jak─ů zajmowa┼é gaz w temperaturze 0oC
V - obj─Öto┼Ť─ç gazu w temperaturze t (oC) V0 - obj─Öto┼Ť─ç gazu w temperaturze 0oC
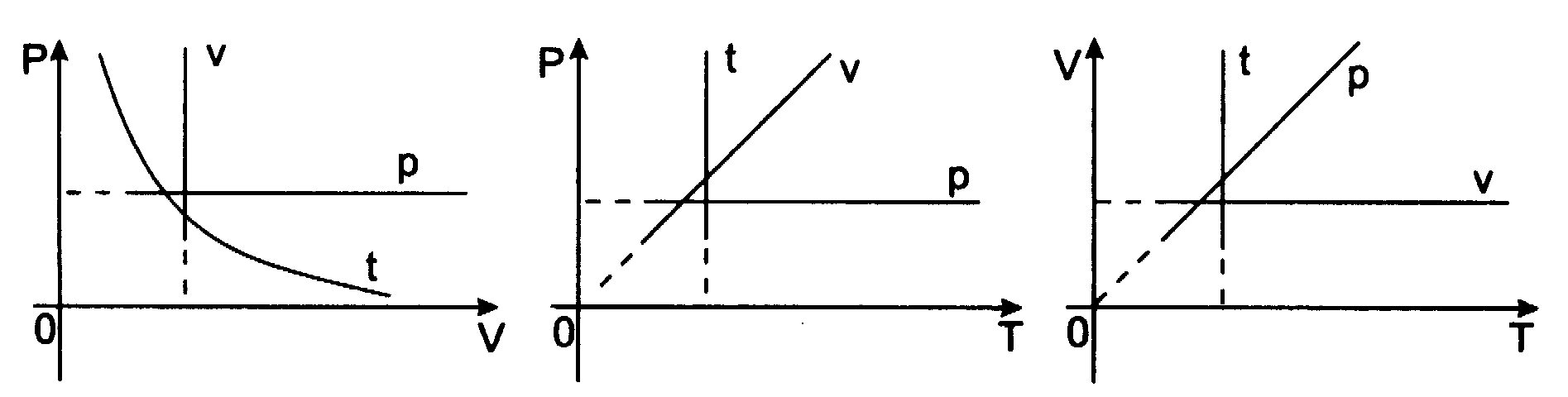
Przemian─Ö izochoryczn─ů (V = const) opisuje prawo Charlesa:
Dla ustalonej porcji gazu w sta┼éej obj─Öto┼Ťci wzrost temperatury o 1oC powoduje wzrost ci┼Ťnienia gazu o
ci┼Ťnienia, jakie mia┼é gaz w temperaturze 0oC
p - ci┼Ťnienie w temperaturze t
p0 - ci┼Ťnienie w temperaturze 0oC
Prawo Gay - Lussaca i Charlesa uzyskuj─ů posta─ç, gdy temperatur─Ö podajemy w skali Kelwina:
T - odpowiada temperaturze t
T0 - odpowiada temperaturze 0oC
Pierwsza zasada termodynamiki - zmiana energii wewnętrznej ciała równa jest algebraicznej sumie pracy wykonanej nad ciałem przez siły zewnętrzne i ciepła wymienionego z otoczeniem
ΔEk = W + Q
ΔEk - zmiana energii wewnętrznej
W - wykonana praca
Q - ciepło wymienione z otoczeniem
Zasada ta stwierdza, że dostarczone ciepło dQ może być wykorzystane na wzrost energii wewnętrznej dE i wykonanie przez gaz pracy dW.
dQ = dE + dW = dE + pdW
Podczas ogrzewania cia┼éa z zachowaniem sta┼éej obj─Öto┼Ťci, ciep┼éo musi by─ç dostarczone jedynie na wywo┼éanie przyrostu energii wewn─Ötrznej, zwi─ůzanego ze wzrostem temperatury, natomiast podczas ogrzewania pod sta┼éym ci┼Ťnieniem gaz si─Ö rozszerza i wykonuje prace (dVÔëá0), co wymaga dostarczenia wi─Ökszej ilo┼Ťci energii potrzebnej zar├│wno na wzrost energii wewn─Ötrznej, jak i wykonanie pracy.
Ciep┼éo molowe - to ilo┼Ť─ç ciep┼éa potrzebna do ogrzania 1 mola substancji o 1 Kelwin. Ciep┼éo molowe przy sta┼éej obj─Öto┼Ťci wnosi:
n - liczba moli
i - liczba stopni swobody
┼Ürednia energia cz─ůsteczki gazu jest proporcjonalna do temperatury:
i - liczba stopni swobody
k - stała Boltzmana
Dla gazu jednoatomowego i = 3 (do opisu tego gazu wystarczy znajomo┼Ť─ç trzech sk┼éadowych pr─Ödko┼Ťci). Dla gazu dwuatomowego, i = 5, gdy┼╝ ruch takiej cz─ůsteczki opisuj─ů trzy sk┼éadowe pr─Ödko┼Ťci ruchu ┼Ťrodka masy i dwie sk┼éadowe zwi─ůzane z ruchem obrotowym.
Dla gazu dwuatomowego energia wewn─Ötrzna wyniesie:
N - liczba Avogadro
Nk = R - stała gazowa
Dlatego te┼╝ ciep┼éo molowe przy sta┼éej obj─Öto┼Ťci wyniesie:
Zasada ekwipartycji energii - gdy liczba punkt├│w jest bardzo du┼╝a i obowi─ůzuje mechanika Newtonowska, w├│wczas wszystkie wyrazy tj.
, maj─ů tak─ů sam─ů warto┼Ť─ç i ta warto┼Ť─ç zale┼╝y wy┼é─ůcznie od temperatury.
Innymi s┼éowy dost─Öpna energia zale┼╝y wy┼é─ůcznie 0od temperatury i rozk┼éada si─Ö w r├│wnych porcjach na wszystkie sposoby, w jakie mo┼╝e j─ů absorbowa─ç cz─ůsteczka. Ka┼╝dy z takich sposob├│w absorbcji energii nazywany stopniami swobody.
Kondensatorem - nazywamy taki uk┼éad przewodnik├│w, w kt├│rym obecno┼Ť─ç jednego wp┼éywa na obecno┼Ť─ç drugiego przewodnika. Tworz─ůce go przewodniki nazywamy ok┼éadkami kondensatora.
Pojemno┼Ťci─ů kondensatora - nazywamy stosunek zgromadzonego na nim ┼éadunku Q do r├│┼╝nicy potencja┼é├│w mi─Ödzy jego ok┼éadkami. Wielko┼Ť─ç ta jest sta┼éa dla danego kondensatora, je┼Ťli znajduj─ůce si─Ö w pobli┼╝u na┼éadowane lub uziemione przewodniki nie zmieniaj─ů po┼éo┼╝enia. Wielko┼Ť─ç ta informuje nas, jaki ┼éadunek wprowadzi─ç na ok┼éadki, by napi─Öcie mi─Ödzy nimi wynosi┼éo 1V. Jednostk─ů pojemno┼Ťci w uk┼éadzie ,,SI” jest
(jeden Farad)
W uk┼éadzie pomiarowym nast─Öpuje roz┼éadowanie kondensatora przez opornik (kt├│ry, w tym przypadku stanowi spirala), znajduj─ůcy si─Ö w naczyniu z gazem (naczynie Dewara). Wzrost temperatury spirali powoduje wzrost temperatury gazu w wyniku czego, gaz zwi─Öksza swoj─ů obj─Öto┼Ť─ç i ci┼Ťnienie. Wzrost ci┼Ťnienia mierzymy za pomoc─ů manometru rt─Öciowego. Przy du┼╝ej obj─Öto┼Ťci naczynia w stosunku do obj─Öto┼Ťci manometru przemian─Ö mo┼╝emy uzna─ç za przemian─Ö izochoryczn─ů, zgodnie z zale┼╝no┼Ťci─ů:
U - napi─Öcie
C - pojemno┼Ť─ç kondensatora
Przyrosty ci┼Ťnienia zale┼╝─ů liniowo do U2, za┼Ť wsp├│┼éczynnik kierunkowy (nachylenia) tej prostej:
pozwala obliczy─ç CV:
II.CZ─ś┼Ü─ć PRAKTYCZNA
Warto┼Ťci ustalone:
V = 0,5 ┬Ě 10-3 m3
C = 5000
1000╬╝F = 0,005F
T = 296 K
p = 735 ┬Ě 10-3 m ┬Ě 9,81
┬Ě 13609
= 98060,76
Wyniki otrzymane podczas przeprowadzania do┼Ťwiadczenia zestawi┼éem w tabeli nr. 1:
Tab. 1
L.p |
U [V] |
U2 - xi [V] |
p [mm H2O] |
Ôłćp - yi [Pa] |
xiyi |
xi2 |
yi2 |
1 |
12 |
144 |
0,0065 |
66,217 |
953,248 |
20736 |
4384,70 |
|
|
|
0,007 |
|
|
|
|
2 |
14 |
196 |
0,0115 |
110,3625 |
21631,05 |
38416 |
12179,90 |
|
|
|
0,011 |
|
|
|
|
3 |
16 |
256 |
0,0017 |
167,751 |
42944,256 |
65536 |
28140,40 |
|
|
|
0,0172 |
|
|
|
|
4 |
18 |
324 |
0,024 |
240,345 |
77871,78 |
104976 |
577657,72 |
|
|
|
0,025 |
|
|
|
|
5 |
20 |
400 |
0,029 |
289,395 |
115758 |
160000 |
83749,45 |
|
|
|
0,030 |
|
|
|
|
6 |
22 |
484 |
0,037 |
367,875 |
178051,5 |
234256 |
135332,02 |
|
|
|
0,038 |
|
|
|
|
7 |
24 |
576 |
0,044 |
441,45 |
254275,2 |
331776 |
194878,1 |
|
|
|
0,046 |
|
|
|
|
8 |
26 |
676 |
0,055 |
549,36 |
371367,36 |
456976 |
301796,41 |
|
|
|
0,057 |
|
|
|
|
9 |
28 |
784 |
0,067 |
664,6275 |
521067,96 |
614656 |
441729,71 |
|
|
|
0,0685 |
|
|
|
|
ԳŠ|
|
3840 |
|
2897,383 |
1583920,354 |
2027328 |
1779848,40 |
Obliczam współczynnik a i b:
Wyznaczam odchylenie standardowe od warto┼Ťci a:
Wyznaczam odchylenie standardowe od warto┼Ťci b:
Wyznaczam prost─ů teoretyczn─ů:
y = ax + b Ôćĺ y = 0,89x - 60
x = 0 ; y = - 60
x = 790 ; y = 643,1
Wyznaczam proste y1, y2:
y1 = (a + Sa)x + (b + Sb) y2 = (a - Sa)x + (b - Sb)
x = 0 ; y1 = 12151,85 x = 0 ; y2 = -12271,185
x = 790 ; y1 = 13036,65 x = 790 ; y2 = 12270,525
Obliczam ciep┼éo w┼éa┼Ťciwe ze wzoru:
Wyznaczam niepewno┼Ť─ç ciep┼éa w┼éa┼Ťciwego metod─ů r├│┼╝niczki zupe┼énej:
Wyznaczam niepewno┼Ť─ç procentow─ů pomiaru ciep┼éa w┼éa┼Ťciwego:
Wnioski:
Celem do┼Ťwiadczenia by┼éo wyznaczenie ciep┼éa w┼éa┼Ťciwego powietrza metod─ů roz┼éadowania kondensatora. B┼é─Ödy obliczeniowe powsta┼éy na skutek niedok┼éadno┼Ťci przyrz─ůd├│w pomiarowych. Pomimo to wyniki s─ů obarczone do┼Ť─ç ma┼é─ů niepewno┼Ťci─ů ok. 3,31%.
1
Wyszukiwarka
Podobne podstrony:
Wyznaczanie ciep┼éa w┼éa┼Ťciwego powietrza metod─ů roz┼éadowania, Studia, Pracownie, I pracownia
18, Cw 18 - Pomiar ciepla wlasciwego cieczy w stalym cisnieniu metoda elektryczna, Jacek Konikowski
Pomiar ciep┼éa w┼éa┼Ťciwego cia┼é sta┼éych
POMIAR CIEPŁA WŁAŚCIWEGO CIAŁ STAŁYCH
Pomiar pr─Ödko┼Ťci d┼║wi─Öku w powietrzu metodami rezonansow─ů, Quinckego i przesuni─Öcia?zowego
WYZNACZANIE CIEPŁA WŁAŚCIWEGO CIECZY METODĄ ELEKTROKALORYMETRU
38 Oznaczanie ciep┼éa w┼éa┼Ťciwego cieczy metod─ů kalometryczn─ů
Furma┼äski P Izolacje cieplne, mechanizmy wymiany ciep┼éa, w┼éa┼Ťciwo┼Ťci cieplne i ich pomiary
18, Wyznaczanie ciep┼éa w┼éa┼Ťciwego cieczy w sta┼éym ci┼Ťnieniu metod─ů elektryczn─ů, Artur Grudzi┼äski
SPR26, Studia, Pracownie, I pracownia, 26 Wyznaczanie ciep┼éa w┼éa┼Ťciwego cia┼é sta┼éych metod─ů kaloryme
Wyznaczenie ciep┼éa w┼éasciwego, Studia, Pracownie, I pracownia, 26 Wyznaczanie ciep┼éa w┼éa┼Ťciwego cia┼é
26 Wyznaczanie ciep┼éa w┼éa┼Ťciwego cia┼é sta┼éych metod─ů kalorymetryczn─ů G Szcze┼Ťniak
C1 - Wyznaczanie ciepła topnienia lodu metoda kalorymetryczn, Sprawozdania
Wyznaczanie ciepla wlasciwego cial stalych metoda kalorymetryczna
Wyznaczanie ciep┼éa w┼éa┼Ťciwego, Pollub MiBM, fizyka sprawozdania
C5 Wyznaczanie ciep┼éa w┼éa┼Ťciwego metod─ů klorymetryczn─ů
wi─Öcej podobnych podstron