Imię i nazwisko: Łukasz Chłopczyński
Wydział : Biotechnologii i nauk o żywności
Kierunek : Biotechnologia
Grupa : IV
Ćwiczenie nr 22
Tytuł ćwiczenia: Hydroliza estru w środowisku zasadowym.
Data wykonania ćwiczenia....................
Data oddania sprawozdania..................
Data zwrotu sprawozdania....................
Data ponownego oddania sprawozdania..............
Wstęp teoretyczny:
Hydroliza estru, octanu etylu, w środowisku zasadowym zachodzi zgodnie z równaniem:
CH3COOC2H5 + OH- → CH3COO- + C2H5OH (1)
Reakcja hydrolizy zapisana schematem (1) jest procesem złożonym i wieloetapowym.
Dodanie do układu jonów hydroksylowych znacznie przyśpiesza reakcję. Wpływ jonów OH- ma dwojaki charakter, gdyż są one zarówno katalizatorem i substratem reakcji. W reakcji hydrolizy ujemne jony wodorotlenowe, które są silniejszym nukleofilem niż cząsteczka H2O, są przede wszystkim reagentem, a ich stężenie zmienia się w trakcie reakcji
Hydroliza estru w środowisku zasadowym jest reakcją drugiego rzędu, a jej szybkość zależy od stężenia estru CH3COOC2H5 i jonów OH-, zgodnie ze schematem (1). Szybkość tej reakcji można wyrazić za pomocą szybkości przyrostu stężenia produktów:
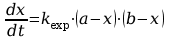
gdzie: kexp jest stałą szybkości, wyrażoną w dm3mol-1s-1
a jest początkowym stężeniem jonów hydroksylowych OH-
b jest stężeniem początkowym estru CH3COOC2H5
x jest stężeniem każdego z produktów reakcji, jonów octanowych lub alkoholu,
które jest równe ubytkowi stężenia estru
(a-x) i (b-x) oznaczają stężenie jonów hydroksylowych i estru w chwili t.
Rozwiązanie równania różniczkowego (2) metodą całkowania przez ułamki proste, prowadzi do zależności liniowej (3), w której współczynnik kierunkowy prostej jest równy (a – b) k .
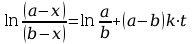
Szybkość reakcji chemicznej: wyraża szybkość przybywania lub ubywania składnika w wyniku przebiegu reakcji chemicznej. Jednostka to masa/(objętość*czas) np. mol/(m3s). Szybkość reakcji definiuje się pochodną stężenia po czasie. Dla reakcji
![]()
szybkość jest wyrażona tak :
![]()
Jeżeli w równaniu występują współczynniki stechiometryczne, to będą występowały także w mianowniku wyrażenia na szybkość - choć nie zawsze muszą im ściśle odpowiadać.
Z drugiej strony eksperymentalnie dowiedziono, że szybkość reakcji można wyrazić tak :
v = k[A]n[B]m
Rząd reakcji: to nazwa wartości wykładników występujących przy stężeniach związków chemicznych.
Np: w poniższym równaniu :
![]()
zewnętrzny rząd reakcji wynosi (n+m+p).
Gdy można opisać zmianę stężenia substratu A równaniem:
![]()
to względny rząd zewnętrzny dla substratu A wynosi 0; gdy stężenie to zmienia się zgodnie z równaniem:
![]()
to względny rząd zewnętrzny dla substratu A wynosi 1; gdy poprawne jest równanie:
![]()
to względny rząd zewnętrzny dla substratu A wynosi 2; I wreszcie, gdy zmiany stężenia substratów A i B są zgodne z równianiem:
![]()
Czynniki wpływające na szybkość reakcji: Zbadanie danej reakcji od strony kinetycznej polega zazwyczaj na ustaleniu zależności tempa powstawania produktów (i ubytku substratów) od temperatury, ciśnienia, rodzaju rozpuszczalnika, rodzaju i stężenia katalizatora oraz wyjściowych proporcji substratów. Następnie próbuje się uzyskane dane zracjonalizować poprzez napisanie matematycznego równania kinetycznego reakcji oraz ustaleniu mechanizmu reakcji.
Równanie kinetyczne to zazwyczaj równanie różniczkowe opisujące dokładnie zmiany stężenia molowego substratów w czasie zachodzenia reakcji chemicznej.
Najczęściej przyjmuje ono postać:
![]()
gdzie
[A], [B], [C], [D]... - stężenia lub aktywności molowe (w przypadku roztworów) lub ciśnienia cząstkowe (w przypadku gazów) substratów uczestniczących w reakcji
n,m,p,q - wykładniki potęgowe dobierane zwykle empirycznie, choć czasami też na podstawie znajomości mechanizmu, zwane często rzędem reakcji.
Równania tego rodzaju rozwiązuje się przez rozdzielenie różniczek i całkowanie w odpowiednich granicach, otrzymując konkretne wzory wiążące stężenia substratów z czasem przebiegu reakcji. Np dla reakcji samorzutnego rozkładu:
![]()
przy założeniu, że jej rząd względem substratu wynosi 1 równanie przybiera postać:
![]()
po rozdzieleniu zmiennych przyjmuje ono postać:
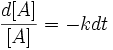
całkując wyrażenie stronami w granicach od [A]0 (stężenie początkowe w chwili t0) do [A] (stężenie w chwili t):
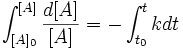
otrzymujemy ogólną zależność możliwą do zastosowania w praktyce do np: obliczenia stężenia substratu po 10 min od rozpoczęcia reakcji:
![]()
Cel ćwiczenia: Oznaczenie stałej szybkości reakcji hydrolizy estru katalizowanej jonami OH-.
Wyszukiwarka
Podobne podstrony:
Konspekt ćw 1
konspekt ćw. 9, Udostępnione, Dietetyka
konspekt ćw 10
konspekt cw 3 1 programowanie liniowe
konspekt cw 5 3 Zad 3 MRP
konspekt cw 5 2 Zad 2 MRP
konspekt cw 4 programowanie sieciowe
Konspekt ćw I 3 Usytuowanie płodu w macicy
KONSPEKT CW 1
Konspekt ćw. 4, Udostępnione, Dietetyka
Konspekt ćw 8
konspekt ćw 8
Konspekt cw 2
Konspekt ćw VI 1a Partogram
Konspekt ćw.kor, College, Pedagogika, rok III, Gimnastyka korekc. - kompens
Konspekt ćw - kolana szpotawe, AWF Wychowanie fizyczne, metodyka wychowania fizycznego
konspekt ćw 2, Ćwiczenia
konspekt ćw pływanie, fizjoterapia
konspekt cw 5 1 Zad 1 MRP
konspekt cw 1 planowanie, sterowanie