KINETYKA REAKCJI CHEMICZNYCH
Kinetyka chemiczna zajmuje się badaniem szybkości reakcji chemicznych. Badania takie, oprócz ustalenia jak długo daną reakcję należy przeprowadzać, często dostarczają informacji na temat jej mechanizmu.
Szybkość reakcji określa liczba cząsteczek (moli), które przereagowały w jednostce czasu lub liczba cząsteczek (moli) powstałego w jednostce czasu produktu). Czyli im większe jest stężenie substratów tym większa jest szybkość reakcji.
Matematycznie wyraża to pochodna stężenia produktu lub substratu po czasie:
dc dx
v = - ----- = -----
dt dt
![]()
gdzie: c -stężenie substratu, x - stężenie produktu.
K- stała szybkości reakcji - współczynnik proporcjonalności miedzy szybkością reakcji, a iloczynem stężeń reagentów (stężeniem reagenta).
k = v gdy cA, cB, ...= 1 mol /l
Wartość k zależy od temperatury.
W stałej temperaturze wartość „k” dla danej reakcji w każdym momencie czasu jest stała. Stała szybkość wzrasta wraz z temperaturą.
Wykładniki potęgowe α, β, χ noszą nazwę rzędu reakcji w stosunku do reagentów A, B, C, a ich suma
n = α + β + χ to ogólny rząd reakcji (może być ułamkowy lub zerem, zwykle są liczbami całkowitymi zawartymi w przedziale od
-2 do 2)
Rekcja pierwszego rzędu - reakcja której szybkość oznaczona eksperymentalne jest proporcjonalna do stężenia substratów w pierwszej potędze.
dc
- ----- = k1c
dt
Np. rozpad pierwiastków promieniotwórczych , izomeryzacja.
N2O5→N2O4 + 1/2O2, którego przebieg wyraża równanie kinetyczne:
d[N2O5]
v = - -------- = k1[N2O5]
dt
Szybkość reakcji I rzędu A → B + C jest proporcjonalna do aktualnego stężenia cząsteczek reagujących w danym środowisku reakcji (w pierwszej potędze)
Rekcja drugiego rzędu - reakcja, której szybkość oznaczona eksperymentalne jest proporcjonalna do stężenia wszystkich substratów (dwóch).
A + B = C + D + ….
CA = CB
v = k × CA × CB = k × CA 2
I- + ClO- → IO- + Cl-
Przy stałej wartości pH odpowiada jej równanie kinetyczne
d[I- ]
v = - -------- = k2[I- ][ ClO- ]
dt
[I- ]=[ ClO- ]=c
dc
- ----- = k1c2
dt
Analogicznie: reakcje III rzędu v = k1c3
reakcje n-tego rzędu v = k1cn
Cząsteczkowość reakcji - liczba cząsteczek biorąca udział w elementarnym procesie chemicznym (najwolniejszy etap reakcji)
W reakcjach prostych rząd reakcji jest równy cząsteczkowości. W rekcjach przebiegających etapami rzędowość najczęściej nie odpowiada cząsteczkowości.
H2 + J2 = 2HJ
n = 1 + 1
CH3COOC2H5 + NaOH → CH3COONa +C2H5OH
n =
2Fe3+ + Sn2+ → 2Fe2+ + Sn4+
NO +O3 → 2NO2 +O2
2NO +O2 → 2NO2
Z równania stechiometrycznego nie można ogólnie biorąc (wyjątki stanowią reakcje proste) wyciągnąć wniosków o rzędowości i cząsteczkowości reakcji. Rząd reakcji obok wartości całkowitych dodatnich może przyjmować wartości ujemne , ułamkowe i zero. Jest to bardzo skomplikowany mechanizm.
Na szybkość reakcji ma wpływ kilka czynników:
Natura substancji reagujących;
Temperatura (wzrost temperatury o 100C powoduje wzrost szybkości reakcji od 2 do 4 razy)
Aby zaszła reakcja chemiczna, drobiny substratów muszą mieć energię wystarczającą do tego, by nastąpiło tzw. zderzenie aktywne tych drobin. Energia ta, inna dla różnych reakcji, nosi nazwę energii aktywacji danej reakcji.
Ze względu na efekt energetyczny reakcje dzielimy na:
- reakcje egzoenergetyczne, w wyniku których wydziela się energia,
- reakcje endoenergetyczne, przebiegające z pochłanianiem energii z otoczenia.
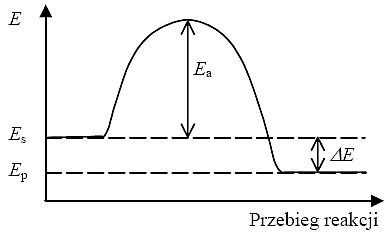
Przebieg reakcji egzoenergetycznej
przedstawia wykres:
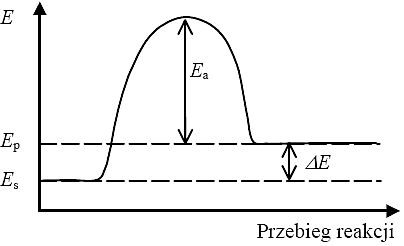
Przebieg reakcji endoenergetycznej przedstawia wykres:
gdzie:
Es - energia substratów,
Ep - energia produktów,
Ea - energia aktywacji danej reakcji,
∆E - energia wydzielona lub pochłonięta w wyniku reakcji.
Stężenie (szybkość procesu elementarnego jest proporcjonalna do stężeń substratów tego procesu podniesionych do odpowiednich potęg)
Ciśnienie (w przypadku gazów)
Obecność katalizatora
Szybkość reakcji odwracalnych
Często reakcje zachodzą również w kierunku przeciwnym. Np. reakcja tworzenia i rozpadu jodowodoru, zachodząca w podwyższonej temperaturze w fazie gazowej.
Reakcja H2 + J2 = 2HJ
Przebiega jako reakcja rzędu drugiego z równaniem kinetycznym
v+ = k+ [H2 ] [J2]
W miarę jednak gromadzenia się coraz większych ilości jodowodoru, dostrzegalny jest także jego rozkład:
2HJ→ H2 + J2
Którego szybkość jest dana wzorem
v- = k- [HI]2
Szybkość z jaką wzrasta stężenie jodowodoru w układzie, stanowi różnicę szybkości tworzenia, v+, i szybkości rozpadu jodowodoru, v-
V = v+ - v- = k+ [H2 ] [J2] - k- [HI]2
Wartość v+ jest największa w chwili początkowej, gdy mamy największe stężenia substratów. W miarę ich wyczerpywania maleje.
Odwrotnie jest z szybkością v- , która w chwili początkowej jest równa zeru ze względu na brak HI w mieszaninie, a następnie wzrasta. W chwili gdy obie szybkości się zrównają, wartość v staje się równa 0.
V = v+ - v- = k+ [H2 ] [J2] - k- [HI]2 = 0 stężenie przestaje się zmieniać.
Przekształcając to równanie możemy zapisać:
[HI]2 k+
---------------- = ----- = K (k+/k- osiąga stałą wartość K)
[H2 ] [J2] k-
Jest to równanie wyrażające prawo działania mas dla reakcji odwracalnej.
Prawo działania mas sformułowane przez Guldberga i Waagego mówi, że substancje reagują tak długo, dopóki stosunek iloczynu stężeń molowych substratów nie osiągnie w stałej temperaturze stałej wartości K zwanej stałą równowagi chemicznej.
Duża wartość K oznacza, że substraty przereagowały w znacznym stopniu w danej temperaturze - równowaga przesunięta jest w prawo.
Mała wartość K oznacza, że substraty przereagowały nieznacznie - równowaga przesunięta nieznacznie w prawo.
W układzie znajdującym się w stanie równowagi nie ustają procesy chemiczne, które były czynne przed osiągnięciem stanu równowagi. Równowagę cechuje równoczesne zachodzenie z jednakową szybkością reakcji w dwóch przeciwnych kierunkach .
Wpływ czynników zewnętrznych na równowagę chemiczną
Do czynników wpływających na równowagę chemiczną należą: temperatura, stężenie reagentów, ciśnienie (dla reakcji przebiegających w fazie gazowej).
Zasada przekory - jeżeli na jakiś układ w stanie równowagi działa czynnik zewnętrzny (ciśnienie, stężenie, temperatura) i stara się ten stan zmienić to układ działa w kierunku osłabiającym to działanie prowadząc do ponownego osiągnięcia stanu równowagi.
Stan równowagi:
Zmiana stężenia - wzrost stężenia substratów powoduje przesunięcie równowagi w prawo
Zmiana temperatury - wzrost temperatury przesuwa równowagę reakcji endotermicznej w prawo (+∆E), egzotermicznej w lewo ( -∆E).
Zmiana ciśnienia - wzrost ciśnienia nie wpływa na stan równowagi, gdy objętość substratów i produktów jest jednakowa. W przypadku, gdy objętość substratów jest większa od objętości produktów, wzrost ciśnienia spowoduje przesunięcie równowagi w prawo.
Katalizator jest to substancja, która przyspiesza reakcję chemiczną, a po zakończeniu reakcji pozostaje w niezmienionym stanie. Z tego względu nie uwzględnia się go w równaniu stechiometrycznym, podającym zawsze tylko symbole i liczbę cząsteczek substratów i produktów końcowych reakcji. Zjawisko przyspieszania reakcji chemicznych przez katalizatory nazywamy katalizą.
Katalizator nie ulega trwałej przemianie chemicznej w wyniku reakcji. Nie znaczy to jednak, że w niej nie uczestniczy. Katalizator wpływa na przebieg reakcji zmieniając jej mechanizm. Jego działanie opiera się na powstawaniu w reakcji z substratem przejściowego związku chemicznego lub struktury nadcząsteczkowej, która jest nietrwała, dzięki czemu reaguje dalej z wytworzeniem produktu końcowego i odtworzeniem wyjściowego katalizatora:
Reakcja bez katalizatora:
A + B → AB
Reakcja z katalizatorem:
A + K → AK (produkt przejściowy)
AK + B → AB + K (produkt końcowy + odtworzony katalizator)
W obecności katalizatora bariera energetyczna (energia aktywacji) ulega obniżeniu i większa liczba cząsteczek jest zdolna do wejścia w reakcje.
Jeśli związek przyspieszający reakcję zużywa się w jej wyniku nazywany jest inicjatorem, a nie katalizatorem.
Odwrotnością katalizatorów są inhibitory - katalizatory spowalniające przebieg reakcji np. polimeryzacji, kondensacji itp.
Reakcje autokatalityczna - reakcja w której powstający produkt działa katalizująco na pozostałe substraty, np. jonu manganu (II) w reakcji między jonem nadmanganianowym (VII) i kwasem szczawiowym.
2MnO4- + 5H2C2O4 + 6H+ → 2Mn2+ + 10 CO2 + 8H20 katalizator
Katalizator dzięki tworzeniu związku przejściowego powoduje zmniejszenie energii aktywacji reakcji chemicznej, nie wpływa jednak na położenie jej równowagi, gdyż energia aktywacji jest jednakowa niezależnie od kierunku przebiegu reakcji. Katalizator może zwiększać selektywność reakcji, jeżeli zwiększa szybkość tworzenia się produktu głównego, a nie przyspiesza lub słabiej przyspiesza reakcje uboczne.
![]()
Wyszukiwarka
Podobne podstrony:
04 Kinetyka reakcji chemicznych i kataliza
Zatrucia pokarmowe o etilogii chemicznej sciaga, Farmacja, bromatologia
1 4 Kinetyka reakcji chemicznych Odpowiedzi
KATALIZA HOMOGENICZNA - REFERAT, KATALIZATORY- to substancje, które modyfikują kinetykę reakcji chem
04 Kinetyka reakcji chemicznych i kataliza
KINETYKA REAKCJI CHEMICZNYCH(1)
1 4 Kinetyka reakcji chemicznych Odpowiedzi
SYMULACJA KINETYKI ZŁOŻONYCH REAKCJI CHEMICZNYCH, sprawozdanie symulacja
SYMULACJA KINETYKI ZŁAOŻONYCH REAKCJI CHEMICZNYCH
06 Kinetyka reakcji enzymatycznych
w5 wzor reakcja chemiczna ilościowo
4 Badanie kinetyki reakcji zmy Nieznany (2)
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
kinetyka reakcji enzymatycznych I
BADANIE WP YWU ST ENIA NA SZYBKO REAKCJI CHEMICZNYCH
Noworyta, inżynieria bioreaktorów, równania kinetyczne reakcji
Jak w prosty sposób zapisać przebieg reakcji chemicznych
Jak uzgadniać równania reakcji chemicznych
więcej podobnych podstron