OBLICZENIA:
1. Obliczam napięcie powierzchniowe dla każdego roztworu:
a) obliczam napięcie powierzchniowe wody, korzystając ze wzoru:
σw = [72,9 - 0,155 (t - 18)] ⋅ 10-3
temperatura wynosi 20oC, więc t = 273 K, czyli:
σw= 0,0726 N/m
b)obliczam gęstości roztworów zastosowanych w doświadczeniu:
Dla mydła przyjmujemy gęstość taką sama jak dla wody, czyli d = 0, 998 g/dm3
c) tabelka wyników:
roztwór |
stężenie c |
|
ilość kropel |
|
napięcie powierzchniowe σ [N/m] |
|||
|
|
|
|
gęśtośc d [g/dm^3] |
|
|||
|
|
ln c |
pomiar 1 |
pomiar 2 |
pomiar 3 |
średnia |
|
|
woda |
|
|
65 |
64 |
65 |
64,7 |
0,998 |
0,0726 |
siarczan (IV) amonu |
0,5 |
-0,69315 |
65 |
66 |
66 |
65,7 |
1,03765 |
0,074335434 |
|
1,5 |
0,405465 |
66 |
67 |
66 |
66,7 |
1,09895 |
0,077546546 |
|
2,5 |
0,916291 |
68 |
68 |
68 |
68 |
1,16025 |
0,08030693 |
|
3 |
1,098612 |
67 |
67 |
67 |
67 |
1,1909 |
0,08365865 |
|
3,5 |
1,252763 |
67 |
68 |
67 |
67,8 |
1,22155 |
0,084799231 |
roztwór mydła |
0,01 |
-4,60517 |
62 |
62 |
63 |
62,7 |
0,998 |
0,074915789 |
|
0,02 |
-3,91202 |
68 |
68 |
68 |
68 |
0,998 |
0,069076765 |
|
0,05 |
-2,99573 |
103 |
102 |
104 |
103 |
0,998 |
0,045604078 |
|
0,06 |
-2,81341 |
107 |
106 |
107 |
106,7 |
0,998 |
0,04402268 |
|
0,08 |
-2,52573 |
128 |
122 |
126 |
125,3 |
0,998 |
0,037487789 |
Do obliczenia napięcia powierzchniowego roztworów skorzystałam ze wzoru:
![]()
[N/m],
Gdzie: δw - gęstość wody,
nwi n - liczby kropel wody i substancji badanej,
d i dw - gęstości wody i substancji badanej.
2. Sporządzam wykresy:
3. Obliczam nadmiar powierzchniowy:
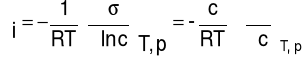
,
Gdzie: R- stała gazowa, R= 8,314 J/(K*Mol)
T- temperatura, T= 273 K.
Nadmiar powierzchniowy dla roztworu siarczanu (VI) amonu wynosi:
Γ= - 1/RT * 0,0052 = -2,29 * 10-6 [mol/m2]
Nadmiar powierzchniowy dla roztworu mydla wynosi:
Γ= - 1/RT * (-0,019) = 8,37 * 10-6 [mol/m2]
4. WNIOSKI
Siarczan (VI) amonu (elektrolit) powoduje zwiększenie napięcia powierzchniowego. Zależność ta dąży do prostoliniowej. Im większe stężenie, tym efekt wzmocnienia napięcia powierzchniowego. Mydło natomiast (surfaktor) obniża znacznie napięcie powierzchniowe. Jak widać na wykresie jest to zależność niemal prostoliniowa.
Wynika stąd, ze dla elektrolitów efekt zmiany napięcia powierzchniowego jest mniejszy niż dla surfaktantów. Spowodowane jest to tym, że środki powierzchniowo czynne tworzą błonki na granicy faz, natomiast stężenie elektrolitu jest mniej więcej stałe w swojej objętości.
![]()
Wyszukiwarka
Podobne podstrony:
91, CHEMIA FIZYCZNA SPRAWKA 4 SEM
41, CHEMIA FIZYCZNA SPRAWKA 4 SEM
chemia fizyczna 21, CHEMIA FIZYCZNA SPRAWKA 4 SEM
OPRACOWANIE WYNIKÓW, CHEMIA FIZYCZNA SPRAWKA 4 SEM
Fizyczna strona główna czysta, CHEMIA FIZYCZNA SPRAWKA 4 SEM
204, CHEMIA FIZYCZNA SPRAWKA 4 SEM
fizyczna 99, CHEMIA FIZYCZNA SPRAWKA 4 SEM
sprawozdanie nr 27, CHEMIA FIZYCZNA SPRAWKA 4 SEM
fizyczna ćw. 23, CHEMIA FIZYCZNA SPRAWKA 4 SEM
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
28fizyczna, inżynieria materiałowa - semestr 4, Inżynieria Materiałowa pwr - semestr 4, Chemia Fizyc
spr 8.5 obliczenia1, semestr 4, chemia fizyczna, sprawka laborki, 8.5
6, semestr 4, chemia fizyczna, sprawka laborki, 6.11
moje 4, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
sekuła, inżynieria materiałowa - semestr 4, Inżynieria Materiałowa pwr - semestr 4, Chemia Fizyczna,
fizyczna 2011 egzamin - teoria, technologia chemiczna, chemia fizyczna2010-2011, sem 4, fizyczna egz
więcej podobnych podstron