"'3
ROZ1'ło..-ł
ło..-łnnłrn no n •.• oni~" ,fnz
ft>n..-ł'1ITil.ino
'1110"'",+"1110 ałakt~l""'na
;;J.~.~ _
·.n._uu·
u~u..!....!..n..u.
•• u
6.5.
"5..I."""."j
~a
'; ł'UU,yuJ.!!~u ,.,(.1.
..•. .:7 •... ,..,. •• ".~
.•.. ' ~.J'""L.
}'M"""i,,ł
~.
~·:.W:;'·~.f:;2·S;;;o._
r:\jS!5~Z~·>:i;
.... %.i..\.-k:~
'ni$l
Ci$lcrł$l 7$17n$l(,:7('\n('\ '<naile'l(
.
h't .'tO'''!:
~~~h~~~~'
~ ~r
~
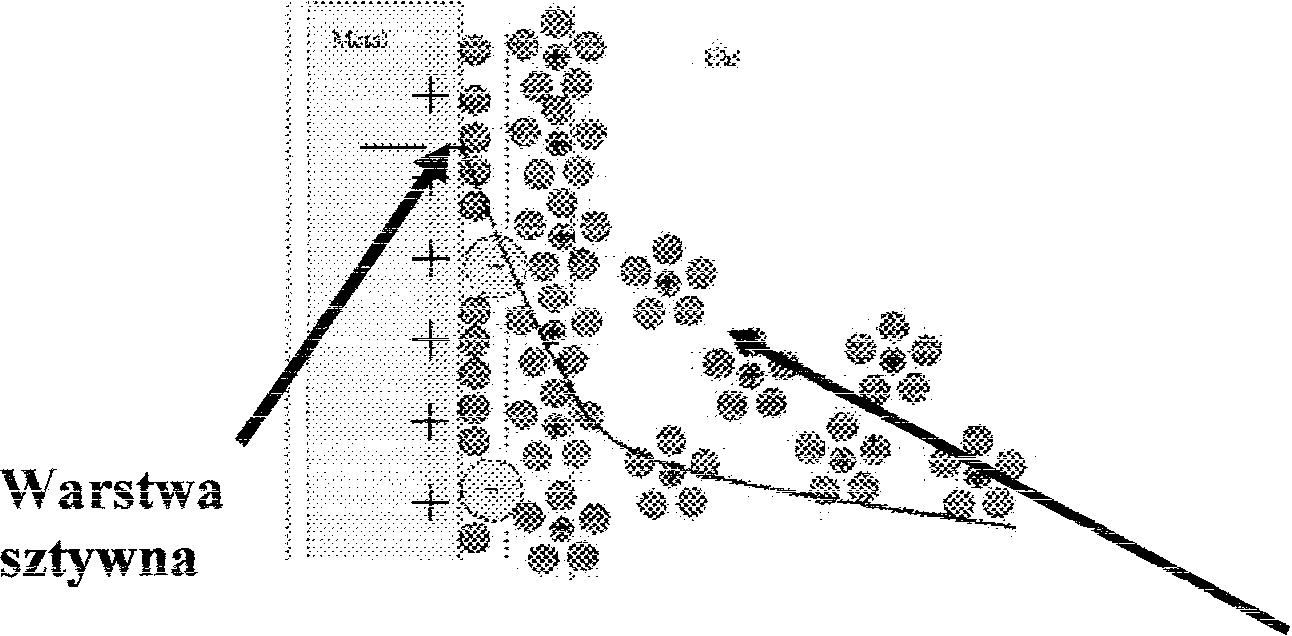
potencjału
w warstwie podwójnej. WarsPNa ta powstała wskutek nagromadzenia
się elektronów na powierzchni metalu (gęstość ładunku
• •............... f' .. ;:r'·'
.
PłaszcZ"v'zna
H~oltza
-'
.......
)00.
Dci.kgkWarstwa
rozmyta
Ładunek
elektrol1Ó\V
ró\~vno\vażony
jest ładun_ ... ~iem cząsteczek i
jonóvl
nagromadzon)'ch
Vi
vvarst,~vie
podwójnej.
Przyczyny
powstawania podwójnej warstwy elektrycznej:
Elektrony
lub jony mogą przechodzić samorzutnie z jednej fazy do drugiej, w
wyniku czego jedna faza wykazuje niedomiar,
a
druga nadmiar ładunków określonego znaku.
Wybiórcza
adsorpcja jonów jednego fOr'ł7aju,
powodująca nagromadzenie się ładunków jednego znaku '.xl
sąsiedztwie
granicy faz.
Adsorpcja
polarnych cząstek rozpuszczalnika lub substancji rozpuszczonej, w
taki sposób, że dipole orientują się na granicy
faz.
RTI
a -
=
o+-n~
. nF a
MO
-
norm~lnv
poten"'1"'}
e1pktrr.du
t1
nr.tenciał
e1ektrorłv
.•...•.
.LL ••••. .,L ..•. j
•.
..LvJa~ L
••••• );.&.L~
J, :J~.ł''"''''
LL:!
.
oL
..••.• ~j
w
roztworze o aktywności jonów metalu a~v1n+
= l
R
-
stała
gazowa,
T
- temperatura
[K], F
- stała
Faradaya,
N
-
liczba
elektronów biorących udział w reakcji.
aMO
= const.
= l
RTł
E=Eo+-
na'1/H
nF
""
R
=
8,31441 J ·K-] . mol-l
F=
96486,7
C· mol-l
(T=
298
K)
22
L
I
E
E
E
O
![]()
![]()
![]()
![]()
![]()
![]()
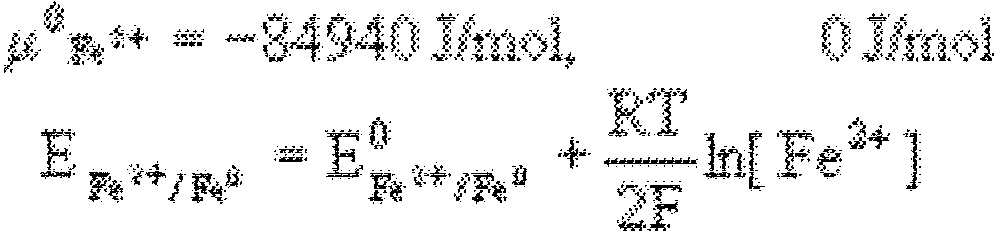
{j
tJ.."
~~Jl
m.
:
~~' ..
![]()
35~Potencjai standardowy.
Potencjał standardowy mOŻna obliczyć z danych termodynamicznych -standardowych potencjałów chemicznych substancji biorących udział w reakcji elektrochemicznej posługując się ró\\'tlaniem:
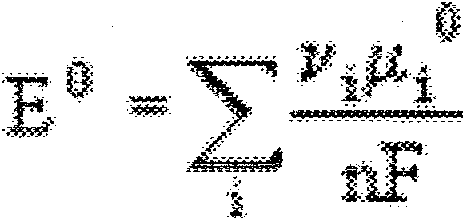
Vi ~ liczba moli
Pn;yklad
Oblicz potencjał elektrody żelaznej zakładając, że na jej powierzchni ustala się równowaga: ~I~ e: ::;:~:::; :F e-:~?-t· --i"·-2;;t; wiedząc że:
2' 96500 C- tr1<>1
![]()
![]()
![]()
~'t'ff<~~i"~
••.• -r--'"T~
.•.• """"T"
•• rT'~~"ńt
;t;:·4
1E .. 3 0 •. 91 u~~
-:
-~)ł
41 ~
'{'A4 ,{ 'i -{'.<ii -1 '1
-n.,4:B j
E .•....•.... JV """ --'1';, '
~o;u;. '"'.::~"'j~\ 1
'l
.B,571 ,./'/
-J),Mi ,/'
~ .//
·iJ/;e 'i // ..
-{~. 5~~ -1 /-r/.--' ••..
-,3, '3i~ l~~'-m 'i'~.5'
,.,/
/ /~.
j/< ,..r-'-
/ ./
,,. ,/ ,/
.-0"-"
....
36.SEIVI ogp,Jwa stężeniowego.
SFM=EI-E2
Potencjał pojedynczej elektrody możemy mierzyć przy pomocy ogniwa w którym jedną z elektrod jest elektroda wzorcowa, elektroda o znanym,. niezmiennym w czasie potencjale, zwanym potencjałem odniesienia.
23
![]()
Szereg napięciowy metali inaczej szereg elektrochemiczny to zestawienie, w którym maleje aktywność metali, a więc rośnie ich potencjał standardowy F, Metal bardziej aktywny wypiera metal
m
"e';
aktywnv '7 r"zLtWOru J"ego ""iI")
PunktetYl
"rlnip"ipnl"a
dla teg" '7p"tau1I"enl"
>l iesLt ełeJ.rfT"rl>l
. .lo- J ..LJ •••• .ł."'" U'.....,..A. • ..L . ..1....1.. .•• '-" •••••.•• .LI._u .•• _ .•• '-" L...l_U", 'Ii, .•..•. _ J .1 .,L'Jo...""'''''',,",,_
wodorowa, ktÓrej potencjał przyjmuje się za zero fi!J = O
Oto szereg ważniejszych metali (wraz z SEM H21H+):
![]()
L
i K
N~
Ca Mo-
Al
7n Cr
Ff" Crlu·
Co
Nt ~n
Ph H
Cu.
Ho A
a AU
_-1 ~~_~~~_.L ~ __ ~~~,="",="",_~~.L_t\.._
Własności wynik..ające z szeregu napięciowego metali:
l. Każdy metal o niższym potencjale normalnym wypiera z roztwom metal wyższym potencjale.
R
llJn
in nip AOhlr''71!
l'itnwr'ńuJ i hlJrl'/n'AJr'O' lAJ
ktńrlJ nip lAJl!nilJrnin innll/"h
metnfi '7
HJorlnllr'h rO'J'hAJorńlAJ
v~-C"_ ~_ 16-$''''''- U·l .J-~J ~j> ••.•••• 'r"',-",.., '</ ••.••. .-J"' .•.... ~r •••.... ',.1· •... "' •......••...•••.•..... '''.J'r",;;.rl-J~ •. 6 •. S • .!' •... '. 'I ••.••...•• ,,-1' ••• ;;. ~I.J_.- • .- _o," •...... ''"1
g
'~
."iaVl" •. ",ah«h"o
ma re"lT"ifT'" ",nA"proH,,,A"'''CfT
.In ntrzymanl'a '''nAnroflfnlkó',v ur'eaJ.·voie FHa'fTtle'" i
.t..I ytvl
)')iu~vltlJtrJ' 441"'.-;/1,.4
~ t'Jlv""t
f •... uu..~lf
u w-v v ~ I
nvu.v t
vI J'
:Y'u-
III ól
~ l-
be!)!l, które reagąją z wodą na gorąco, mogą wypierać w temperaturze pokojowej inne metale z roztworu). Glin nie wydziela z roztworó~1/ zawierającychjony Fe2+, Zn2+, Pb2+ i Cu2+ metali, ponieważ ulega pasywacji pokry,va się łvarstewką ochronna swojego tlenku,
2. Ivletale o ujemnych potencjałach normalnych mogą \\'Ypierać wodór. Metale te są metalami aktywnymi, naz~y'vvane nieszlachetnymi.
Reakcja przebiega tym mniej enert-:ricznie, im bliższy zera jest potencjał nonnalny rnetali F!
3. Metale o dodatnich potencjałach normalnych nie wypierają wodom z kwasów, Metale te nazywane są metalami szlachetnymi.
metale szlachetne reagują z kwasami tlenowymi z wykorzystaniem ich właściwości utleniających 4. Im bardziej ujemny potencjał normalny metalu, tym większa jest jego zdolność do utleniania się (oddawania elektronów)
5. Im bardziej dodatni potencjał normalny metalu, tym większa jest jego zdolność do redukcji (do przyjm.owania elektronów).
38.Elektroda wodorowa.
Elektroda wodorowa jest wzorcową elektrodą w skali potencjałów redoks, Przyjęto jej potencjał standardowy za zero F = O. Potencjały innych elektrod odnoszą się do potenclału tej elektrody.
'Vyróż..nia się standardową elektrodę wodorową (SEW) pracującą w warunkach standardowych i normalną elektrodę wodorową (NE\V) pracującą w warunkach normalnych.
24
E
1Ckr+~(\,.l~
'n~,.l~~~"'a· II clcktro..l~
~l~+'~~n'~ ,1 ~~~h"~~,,lrl'
n'od~~' ~I
-'i.
ut..lVu..a \I\lV\..!ViVt"H:·.
1/ l..1.
Ua PJ.ULJ..L1.Vna,
b.</ p~V1...LV..LL..}n..
lo''''
iV.U
.. -l,.,,/J
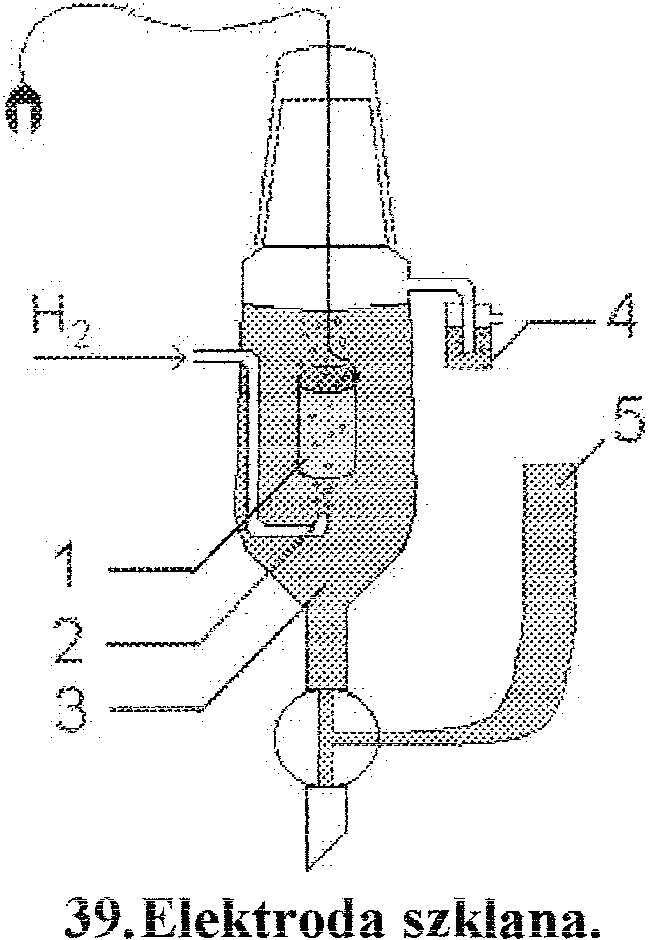
roztwór kwasu, 4) płuczka blokująca dostęp tlenu, 5) zbiornik z zapasem elektrolitu.
Elektroda szklana, najbardziej popularna elektroda jonoselektyvlna, służąca do pomiaru pH
M
1
(k ł·
lo r
. b 'k·" . ci .
ci . k'
., ,
roztworu .. emorana w szta_cle .. Llstej an_ l) WYKonana Jest z o_powle_.mego sz fa przemKamego
tylko dla jonów hydroniowych.
Wewnątrz bańki szklanej znajduje się roztwór o określonej aktywności tych jonów, do którego wprowadzona jest elektroda kalomelowa lub chlorosrebrowa, spełniająca rolę kontaktu elektrycznego. Stosunek aktywności jonów wodorowych po obyd\,"'U stronach batiki szklanej (określony poprzez pomiar siły elektromotorycznej) pozwala wyznaczyć pH roztworu.
Elektroda szklana jest odporna na działanie metali ciężkich, utleniaczy i reduktorów, może być tak..że stosowana w roztworach niewodnych.
40. Ogniwo galwan.iczne.
Ogniwo galwaniczne - ogniwo, w którym źródłem prądu są reakcje chemiczne zachodzące między elektrodą, a elektrolitem. Dwie elektrody zanurzone w elektrolicie (półogniwa) tworzą ogniwo galwaniczne. Różnica potencjałów elektrod to siła elektromotoryczna ogniwa (SEM).
Praktycznym przykładem naj prostszego ogniwa są dwie blaszki z różnych materiałów (np. miedź i nikiel) przedzielone papierem nasączonym elektrolitem (słoną wodą a nawet śliną).
I
nt
:..,.~..,. +1"01,.-...;...,.
;
.•...•. ~..,. __
P1!,:
.•• ...-T.o, _
• t - :
.... nIF", ...,
;r. _
;....,..., n ~'"';nT...,:r; ; ~ ~
...,:..,. n •....• ~ ....• ;n+""; ...-!
" nlvJv LQ.fi.Lv POjęV1v u~ ••• wa pasozy nn .. Ł~eU, a Wl'2C ognIWa. l1VjQ.VVlająve6o "lit' ;;Q.1llVI"LIHC vv
niezamierzonym miejscu i powodującego niekorzystne skutki np.:
25
• korozia metali - nasożvtnicze ogniwo noiawia sie tVp. na zanieczvszczonY'ch i \.vihwtnvch
~ J...J . .:l J I", ,.r '--' .J
połączeniach dwóch różnych metali lub np. pomiędzy kadłubem statku zanurzonego w
elektrolicie (wodzie morskiej), a elementami wykonanymi z innych metali (np. śrubą)
szumy elektryczne - mikroogniwa na zabrudzonych stykach
• ogniska zapalne - ogniwa tworzące się na implantach wewnątrz organizmu
Przykłady ogniw galwanicznych: • ogniwo Daniella
l!< ogniwo Lec1anchego
ogni\vo ołowiov/e
ogniwo Volty
ogniwo Westona
![]()
![]()
![]()
![]()
![]()
![]()
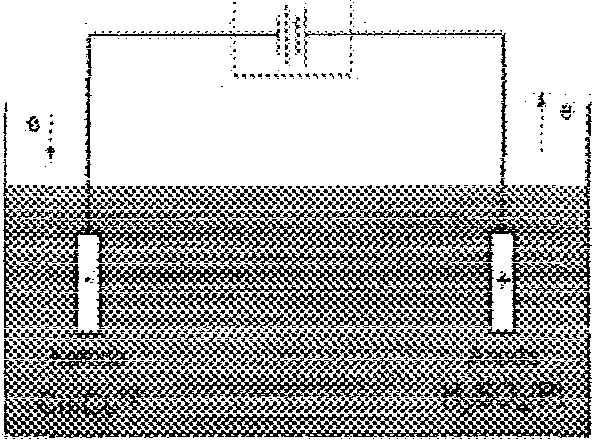
\V przypadku Ogniwa Daniella obie przestrzenie elektrodowe są rozdzielone przy pomocy diafragmy, warstv'vy o przewodnictwie jono'v'vym, zapobiegającej mieszaniu się roztworów znajdujących się po obu j ej stronach.

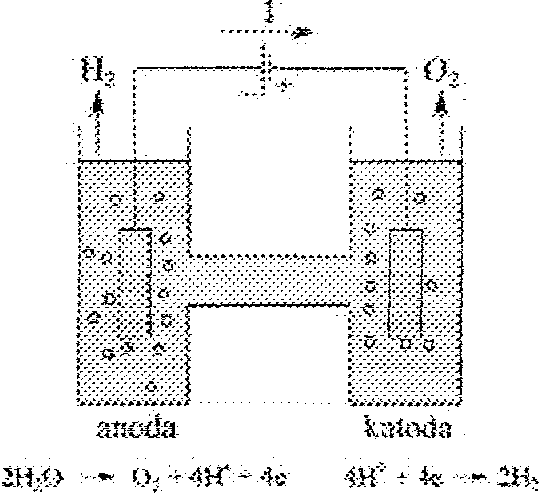
Ogni'\vo \vodoro\vo=tlcno\vc jako ogni\vo gal\varucznc i jako ogni\VO elektrolityczne
41. Ogniwo elektrochemiczne.
Ogniwo elektrochemiczne, ogniwo galwaniczne, układ służący do zamiany energii procesów elektrochemicznych na energię elektryczną.
Ogniwo elektrochemiczne składa się z dwóch układów redoks wraz z zanurzonymi w nich elektrodami (są to tzw. półogniwa) oraz drutu łączącego elektrody. Układy te mogą znajdować się w tym samym roztworze (wówczas zanurzone są w nim dwie różne elektrody) lub w różnych roztworach, przedzielonych porowatą przegrodą albo połączonych kluczem elektrolitycznym.
Wielkością charakteryzującą dane ogniwa jest wartość jego siły elektromotorycznej (SEM). Zgodnie z konwencją elektrodę ujemną (o niższym potencjale) umieszcza się w schematach ogniw po lewej
26
stronie, elektrodę dodatnią (o vvyższym potencjale) - po prawej. W ogniwach anodą nazwano elektrodę ujemną, katodą - elektrodę dodatnią. Na anodzie zawsze zachodzi utienianie.
Do najbardziej popularnych w laboratorium ogni\v elektrochemicznych należą:
o
;"70
flant'ella
t. \7n,iL~nSO
.. !!r",so
.
.lC"t-l-\ t7nak!
"7nacza
gran;"''''' r"a7
zna'k II ;""8+
- uw •...•• \-JL< ii 4(aqY''V •..• 4(aqy •..• \' J \ ••• 1- V"U U"-'Y", - J"-' •
symbolem klucza elektrolitycznego),
- ogniwo Westona (-)Cd(Hg)/CdS04(aq) /1H~S04,Hg(+) (tzw. ogniwo normalne, gdy roztwór CdS04 jest nasycony), które stanowi wzorzec SEM,
- ogniwo Volty (-)Zn/Zn2+, H2S04/R2/Cu(+).
Rozróżnia się ogniwa elektrochemiczne:
1) t"'r\rzpnl'a (chem;p7np) - U7 ogn;''';e 7achod71' rpa1.r'~;a tnvorzpnl' '" 7U';"'7k-U Cllel"1;p7neno (110 w
..I.. yy'I.J ..•.. .• :.0. J..l. ..t.VL..J...I....I..'-' VV .l..l-'-l'Y..t.· L..i. L..1 ..•••.••••••..••• ""--'-"1 LV; ...., ~ L..J.l'''..L~L..J..I.'''' .J.. .l.'-'L..J..I..1. f"MI ..•
"''' oJ •••• '-- .ł
ogniwie elektrochemicznym (+ )Pt, HzltICliClz, Pt( -) powstaje HCI),
2) stężeniowe - zbudowane z d,,·!óch jednakowych półogniw różniących się tylko stężeniarl1i reagentów,
3) amalgamatO\ve - tworzywem elektrod są dwa różne amalgamaty.
Ogni\.va elektrochemiczne wykorzvstvwane oraktvcznie jako źródła energii elektrycznej to: akumulatory różnych rodzajów, L~cl~ncheg~ suche ogniwo elektrochemiczne (- )Zn/Zn2+, NH.1CI("u~'lnvlnO,_ C(+) oraz oQniwo elektrochemiczne naliwowe. np. (-)Ni. H,,/l~aOH_ O,,/NiO, Ni(+).
, , •..•• 1./ - -7 .•..... - - Q - - 1 -,~ .•.. / J"" :J"" '. ;J
w których na elektrodzie ujemnej zachodzi elektrochemiczne utlenianie paliwa, na elektrodzie
dodatniej - redukcja utleniacza, co sumarycznie jest równoważne reakcji spalania konwencjonalnego paliwa (np. wodoru w tlenie). Sprawność przekształcania energii w takich ogniwach elektrochemicznych jest bliska 100%, dlatego znajdują one zastosowanie w napędzie pojazdów kosmicznych oraz dla celów militarnych.
Powstaumn;p lo1.ralnvt'h nem;Ul plpldrochpm;p7mlch J'est orzut'zun", korozi; o char",t--terze
"'''",.-...L'''''' ..L""- .J ••••• .l-.l-"-'"~.l-L"" .•••.•• __ .I."'!o.-L.I.- .l..I.'-'J. .•. ..I.......,L..l.L.l.J. "'.1..1 '.1- l .•. ..I.~.L .i- J.J.. .•. .1.- L&...l. .•••.
elektrochemicznym (pÓłogniwo, SEM).

Opis; Ogniwo elektrochemiczne: 1 - elekiroda, 2 - row'iór elektrolitu, 3 - klucz elektrolityczny, 4 - przewód łączący elektrody
42 1>~a"·7fi FaraAa"'a
__ ~ .•. , •. ,..,. u ~ ,u j la"
masa substaIlcji rn uczestniczącej w reakcji elektrodowej jest proporcjonalna do przepływającego ładunku:
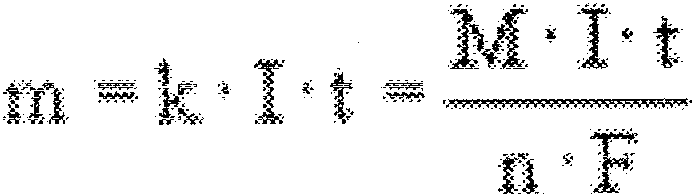
gdzie:
m = masa substancji (g),
M = gFdllloatom, gramocząsteczka da..lcj substancji (glmol),
l = natężenie prądu płynącego przez granicę faz elektroda/elektrolit (A), t = czas (s),
27
n = ilość elektronów wymienianych w czasie procesu elektrodowego, F = 96485 CI równoważnik - stała Faradaya,
43.Akumulator ołowiowy.
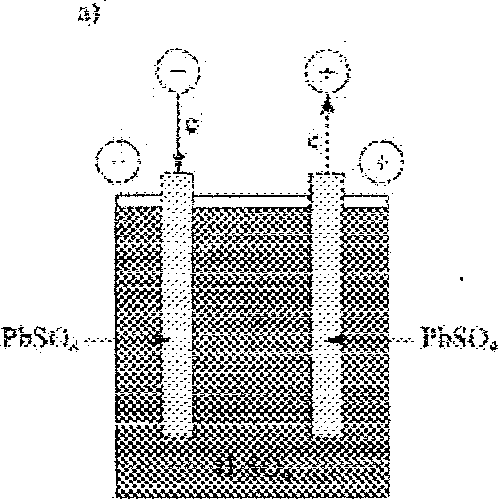
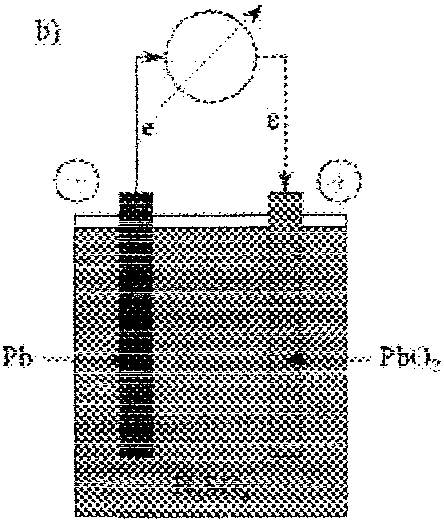
a) Proces ładowania (praca akumulatora jako elektrolizera):
1
7
"l' ", " "".',
t tv
,
,c' ''''''b
,:. "If.r,'·'.".l (_ \ i-' ~',' , ,..' ) f': ......; .;.c"',
...•••... t;_,,; __ ,. '\. .••• " .•. ~_ "l' .:>!> ",,":>0"0" .• >,' & ,
![]()
![]()
(1.31:<)
![]()
![]()
![]()
![]()
f] """,\
~'.i - • , '-\l
![]()
44.lVIetody optyczne.
• Spektrofotometria absorpcyjna w zakresie widzialnym i nadfiolecie (UV -Vis)
•
•
Spektrofotometria \v podczerwieni (IR.) Spektroskopia Ramanowska Nefelometria i turbidy!uetria
Analiza fluorescencyjna
Spektralna analiza emisyjna
Abs"rp"",;n" ""'eHrome+rl'a atom"H7" fA' fi. S)
1'-'i-' Vi '-'JJ!'H.!. up fi.~ .l.i l- L .u.vvvu. '- AL ~~
45.Promieniowanie ełektromagnet-jczne, cechy promieniowania.
Promieniowanie elektromagnetyczne, jest to forma energii występującej Vi postaci fal elektromagnetycznych, które rozchodzą się z prędkością c = 3 x 108 m/s,
Podstawowe cechy promieniowania elektromagnetycznego: długość fali l [m l,
częstość drgań na sei0 .. .mdę n [1/s],
częstość drgań na centymetr (liczba falowa) n [lIcm}.
n = clI [lis],
n = 1/1 [l/cm]
Na korpuskularną i falową naturę promieniowania
l'ielTt~AmaanAtvczneo<" Hl"Ir"""";A z"l",z'nos'c' Pl"",,..Ir,, ""lrre61a;"ca v-«-' 1-,,"!cl V.l.H o '!'Vl'J ---'_1. _[5.\..1 n u.n ... UL.;uJ~ 'I.-!1-V----'_..l - ~ U-!·1..lVl.'\.Y· V1.~ u :Ją' (.
wielkość energii pojedynczego kwa.l1tu promieniowania (fotonu):
E=hxn=hxnxc=hxc/l
gdzie: 11 - stała Plancka
28
Zmianę energii cząstki, towarzyszącą pochłanianiu lub oddawaniu energii ~na wyraża prawo Bor.ra:
DE = Ek - Ep = h x n = h x n x c = 11 x clI [1] DE> O promieniowanie jest pochłaniane przez układ DE < O promieniowanie jest oddawane przez układ
46.Absorbancja, transmitancja.
Absorbancia, jest to wielkość absorpcj~ wartość absorpcji; A [liczba bezwymiarowa].
Absorpcia. iest to przekształcenie enercii promieniowania wskutek oddziaływania z materia <pochłanianie) w inne formy enendi
Transmitancia, jest to wielkość transmisji, \vartość transmisji; T [%].
Transmisia, jest to przejście promieniowania przez dane środowisko, bez zmiany promieniowania (inaczej przepuszczalność) .
47.GęstoŚć promieniowania, natężenie promieniowania.
Gę.~t.Q_Ść promieniQwania, jest to energia lub proporcjonalna do niej liczba fotonów
m
,...t..rom"'tuc~nuch
7"'UT"'rt'" "T
~1 m1
llirh>fiu nan"-om''''''''''Ua''''''y'' '","',...7e,i
"tę';'""""
ohiet"S'Cl'OUT'"
.' .i. __ lU .l.J..t.,ł,.J L...i J j. L..1u,vv u.. i.-U vW .1...1.-' '-i..i.it.-U •• i-'W. p.l .1..U,-V.i.j...i.~ v\' .i...LVbV, J..U.U':"'IL..1 J lJ " ••••••. u •..•. v..,.. \....fJ ••. ~ . vv""
fotonów; p = lic (I = pc, w próZni.).
Natężenie promieniowania, jest to energia przechodząca w ciągu l s przez 1 m2 powierzchni prostopadłej do kierunku biegu promieniowania; w przypadku p. monochromatycznego może być rozumiane jako liczba fotonów przechodzących w przeciągu l s przez l 1112 powierzchni I.
48.Spektroskopia, spektrofotometria.
SpektrQ~l(Qpia; Zajmuje się oddziaływanieiĄ między promieniowaniem elektromagnetycznym a mat"'rJ'ą kto 're poleg'" ",'" no,...hł<>"'l'anł'U ,...z".;;,.. "",,,rgl'!' (ah"orn,...'<» nr7ez mater'ę ill"b "rlrl"'''T<>nl'U pr7ez
.. CLl "v~ 'i.i: ..l . u.. ..l~U.fI Vi U.1.1. V 't"iVV..l ,"",.J._J __ ~.J. \ ViJ A YVJLl. ł"..lL.i" - ..l.l ..i j .lU '\.J~\,..i.uY"va -..lL.i
materię części energii w postaci promieniowania (emisja). Tu istotne jest ok..reślel1ie rodzaju przejść i właściwe ich przyporządkowanie odpowiednim pasmom czy liniom.
Spektroskopia zajmuje się badaniami podstawo"-'Ymi dotyczącymi cząsteczek. Obejmują one: l. Eksperymentalne otrzymywanie różnych typów widm.
Przeprowadzanie ich analizy.
Zaproponowanie schematu poziomów energetycznych charakteryzujących badany układ.
Obliczanie (VI tych przypadkach, gdy jest to możliwe) teoretycznych energii przejść i porównanie z danymi doświadczalnymi.
Określanie (wyznaczanie) parametrów spektrochemicznych w oparciu o zweryfikowane przez obliczenia teoretyczne dane eksperymentalne.
Spektrofotometria; Zajmuje się określaniem stężenia lub zawartości atomów lub cząsteczek w danym układzie absorbującym czy emitującym, tj. stanowi podstawę ilościowej analizy chemicznej. \V tym przypadku nie jest istotny rodzaj oddziaływania z materią, lecz podanie dokładnej D.lnkcji oheślającej natężenie widma od stężenia.
![]()
układzie absorbującym czy emitującym, tj. stanowi podstawę ilościowej analizy chemicznej VI tym przypadku nie jest szczególnie interesujące określenie rodzaju przejścia lub właściwe przyporządkowanie im danych linii czy pasm, natomiast istotne jest podanie dokładnej fun.1<.cji określającej zależności natężenia widma od stężenia.
29
49.Poziomy elektronowe.
Poziomy elektronowe - wynikające z ruchu elek1:ronów względem jąder. Energia przejść między
n"z;om<>m~ "t"J:7A'!:"J:TnAtr"7'ny""h no"'9J1A1r AL:~1r+rr'\"O"'"J..T'li7r-h ;ect 1'""7ęril1 rł71ec1atl(A.,,-';7 ~ t.,,!Q10r-,;! A\T {"\ nf"'\"'n:Tct~1~ce łI\.j l .lJ.J.-'l·P .1 ~V~~V.ljYl-J~jj ""'1 ł/l.- \V.n.Jł'\.. ""'l",j:\.j"i,--jj.ł.JVVYV łJ oJ\. lLi l.-+\'. ~L.Jł_~Jj<-t\.1 VVY J. L.J'J~\,VJ ""~, v jJ,.1 V 'I' L"'iLY-Jq
widmo jest widmem rentgenowskim (elektrony powłok K, L). Natomiast rząd wielkości energii przejść między poziomami powłok zewnętrznych jest równy tylko kilku eV, a powstające widmo optyczne przypada na zakresy: widzialny i nadt10letu (częściowo także bliskiej podczerwieni)
50. Poziomy oscylacyjne.
Poziomy oscylacyjne cząsteczek - związane z oscylacyjnym ruchem jąder w cząsteczkach wokół położeń równowagowych (ruch ten jest w przybliżeniu mchem harmonicznyw), Energie ry'ch drgań \vynosza 0.02 - 0.05 eY a wiec odoowiednie orzeiścia zachodzace oomiedzy noziomami
•• " •• .!. .ł-~' "J.. •.. .1
o
la""J·
•.• vml' wyst"' ..... ,,;" ,,, z"trr"'Sl'e
..... "rł"z"'rwl·enl· Pr~",;6";,, t'"
bada s;'" •.•... "'t"rł"ml· sp"'ktr"str"p;;
w-
l. ~y UJ' .u 'rpuJ'Ł ,"y ufi...l~ pvu .••... ~ 1.. L..'""J~\".tl.a '"" ly lU"" vu..u.u. v" V 1"--V H
podczenvieni ramanowskiej_ Poziomy te można również określić pośrednio, badając przejścia elektronowo oscylacyjne (tzw. widma wibronowe) w zakresach widzialnych i nadfioletu. Struktura
e
·lpktronou7{)
~ oo:rvl?r"y'J· na ty'Trh ,vitłm if':<ct 7\"ią7?na 7
f9.ktem ip.
nr7p.ikr:l·om
elektron{)'F'Tm '"
_.l<-oto,. .l<- ~' ••• '-' ..., .•.••. J __ .l<- .•. _ ..•....•.. ".l<-~ .l<-.l<- J _u •••..•.•..• ~·v ..•..•....• _ ..•...•..•....•..•.. _.l<- ••• _ ..•.. , ...••...•• _ .t' ..•....•.....•••.•. J'-'- •.....•...•...•.. 'LJ).y) .l<- .•..•. ~'"
cząsteczce towarzyszy zmiana energii oscylacyjnej (a także, choć w znacznie mniejszym stopniu,
... ")
•.•.•• -i-~ ~ •••••• .F"'~ .. _.,-""4.",,, ., .• _ .•.••.•
L,ffilana en",roilll..naVJJllI;;J .
51.Poziomy rotacyjne.
Poziomy rotacyjne cząsteczek - z-wiązane z obrotowym ruchem cząstek. W przybliżeniu ruch ten
m
'
na (dl"
"'7""t~"'7lri
ni~1;n;ou7~i\ r,,'T'I''''Z' "'e' ialr"
n'''Oh
"HTObod
•.• " c;<>.ł<>
ri"okoła trz~"h Ul'7aJ'emnie
..•...•.. , .i.u, VL-<~i..>L-,"",""'L. .. U .. ",,-.i.. .1. .••.•• .i.J...i.i 'iV'""'JJ .i.VL...iY·vu '"' J .i."""-...ł .i.'>A.V .i. ~V'i' .i.fl..j .l.i"..i,.l.~ '-io'\...l' V fi.. ••••• V.i..i. VVL...i . .i..i .i.
prostopadłych os~ charakteryzujących się trzema momentami bezwładności. Zmiany energii w tych
p
""'adk",,11
•. " r7erlu· "ł'amltro' UT
""T c~"l'l'
m-
'1'es7c~'"
";ę
Ul
""'r;:;~lll'Cach
01rrJO
1
(){) _ () 1 " •.•..• -1
J:ł<1rJ"''''';a
J p ""VI. ~'t l.Lll:U u. J.."- VV ~ v, L.... J J.. J..J.. Ll L....'1:.":'J.. _ V'r' 5 _ I."-VJ.. .J.. VV V. J.. \".1.1..1.1 • .J.....IU.UU.H . .l.
widm rotacyjnych prowadzi się więc w zakresie dalekiej podczerwieni, a nawet w zakresie mikrofalm'Yym. P07iomy rotacyjne mozna tez oheślić w widmach oscylacyjno-rotacyjnych w zakresie bliskiei Dodczerwieni oraz w szczególnych Drzypadkach_ w widmach elektronowo- rotacyinych .
.J .I.. ....., ~ .i. ~ ~ -'..; -'
52. Prawa absorpcji: Bouguera-Larnberta, Beera.
Prawo Bouguera-Lamberta
Wiązka światła monochromatycznego po przejściu przez jednorodny ośrodek absorbujący o grubości b ulega osłabieniu wg rÓ'w11ania:
l = I . e·kh o
[
A =ln~=k·b J
gdzie: k - współczynnik absorpcji, charakterystyczny dia danej suhstancji
A = log l~ = a . b
- 1
gdzie: a = 0,4343 k
Prawo Beera:
Jeśli współczynnik absol pcji rozpuszczalnika jest równy zeru, to wiązka światła monochromatycznego po przejściu przez jednorodny roztwór substancji absorbującej o stężeniu c i o grubości b ulega osłabieniu wg równania:
l - l . e-kbc - o
W formie logarytmicznej zależność ta ma postać:
A
lo
1..
= log -' := a· (J • C T
1.
gdzie: a = 0,4343 k
30
Wyszukiwarka
Podobne podstrony:
chemia fizyczna laboratoria, 52, 97
Chemia Bionie wyk1
chemia powt
W 4 S 52(APP 2)KOLORY I SYMBOLE
Wykład Chemia kwantowa 11
wyklad z czwartku chemia fizycz dnia19 marca
chemia(1) 3
Chemia węglowodory
Chemia organiczna czesc I poprawiona
ERGONOMIA chemia
chemia organiczna wykład 6
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Chemia procesu widzenia