Właściwości termodynamiczne substancji rozpuszczonych w roztworze opisują cząstkowe molowe funkcje termodynamiczne. Do badania procesów równowagowych stosuje się najczęściej cząstkowe molowe entalpie swobodne składników, zwane potencjałami chemicznymi μi:
![]()
gdzie μi - potencjał chemiczny składnika i, μio - potencjał standardowy składnika i, R - stała gazowa, T - temperatura w skali bezwzględnej. Jak widać z powyższego równania aktywność jest miarą różnicy potencjału chemicznego substancji w roztworze i potencjału standardowego tej substancji. Jeżeli za stan standardowy przyjąć stan hipotetyczny , w którym stężenie substancji jest równe na przykład 1 mol/dm3 i w którym roztwór wykazuje własności roztworu nieskończenie rozcieńczonego, to aktywność będzie miarą pracy, jaką trzeba wykonać, aby 1 mol substancji przenieść z roztworu idealnego do rzeczywistego o danym stężeniu. Dla tak dobranego stanu standardowego aktywność można wyrazić jako:
![]()
Czynnik f nosi nazwę współczynnika aktywności. W przypadku roztworów elektrolitów wprowadza się pojęcie aktywności jonowych. Zgodnie z równaniem aktywność i-tych jonów jest równa zmianie entalpii swobodnej roztworu, do którego w warunkach stałej temperatury, ciśnienia i bez zmiany liczby moli innych składników dodano jeden mol jonów danego rodzaju. Ponieważ jednak musi być zachowany warunek elektroobojętności roztworu, określa się jedynie potencjał chemiczny i aktywność elektrolitu jako całości. Jeśli na przykład elektrolit dysocjuje według równania:
![]()
przy czym n+z+ = n- z-= ne jest wartościowością elektrochemiczną elektrolitu to za aktywność elektrolitu przyjmuje się średnią geometryczną aktywności jonów, oznaczaną jako a+:
![]()
gdzie n=n++n- oznacza liczbę jonów tworzących się w wyniku dysocjacji. Analogicznie określa się średnie jonowe stężenie elektrolitu c+ oraz średni jonowy współczynnik aktywności f+ : ![]()
![]()
W roztworach silnie rozcieńczonych (dla których stosuje się teoria Debye'a-Hückela) średnie współczynniki aktywności można obliczyć teoretycznie z równania:
![]()
gdzie: A - stała zawierająca przenikalność dielektryczną rozpuszczalnika, temperaturę, wynosząca 0.509 mol-1/2dm3/2 dla roztworów wodnych w temperaturze 298 K, z+, z- - wartościowości jonów, I - siła jonowa określona następującą zależnością:
![]()
Jeśli uwzględni się rozmiary jonów, to średnie współczynniki aktywności można wyliczyć z następującej zależności:
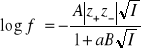
Dla elektrolitów 1-1 wartościowych równanie to stosuje się do stężeń nie przekraczających 0.1 M. Stała B zawiera stałe uniwersalne, przenikalność dielektryczną rozpuszczalnika i temperaturę, natomiast wielkość a przedstawia efektywną średnicę jonów, tj. najmniejszą odległość, na jaką mogą się zbliżyć jony różnoimienne. Jest to parametr empiryczny, zależny od rodzaju elektrolitu.
Dalsze rozszerzenie zakresu stosowalności równania Debye'a-Hückela jest możliwe przez wprowadzenie dodatkowej poprawki związanej z siłą jonową roztworu:
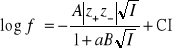
C jest współczynnikiem empirycznym.
Równanie jest nazywane równaniem Debye'a-Hückela-Brönsteda.
Teoria Debye'a-Hückela zwana jest też Teorią Elektrolitów Mocnych i tłumaczy nieprawidłowości w stężonych roztworach elektrolitów mocnych. Elektrolity mocne są zdysocjowane w każdym rozcieńczeniu. Oznacza to, że wszystkie cząsteczki np. kwasu HCl, niezależnie czy jest to kwas stężony czy rozcieńczony, ulegają rozpadowi na jony.
W roztworze elektrolitu mocnego pod wpływem oddziaływania elektrostatycznego dookoła każdego jonu powstaje tzw. chmura jonowa o ładunku przeciwnym do ładunku jonu i porusza się ona w polu elektrycznym w kierunku przeciwnym. Teoria mocnych elektrolitów w pierwotnej postaci stanowi przybliżony opis rozcieńczonych roztworów elektrolitów, dla roztworów bardziej stężonych lub mieszanin różnych elektrolitów wymaga dodatkowych uściśleń.
Jedną z najbardziej dokładnych metod wyznaczania średnich współczynników aktywności jonów elektrolitu jest pomiar siły elektromotorycznej ogniw zbudowanych z elektrod, z których jedna jest odwracalna względem kationu a druga względem anionu tego elektrolitu.
Korzystając z definicji średniej jonowej aktywności i średniego jonowego współczynnika aktywności, oraz z faktu, że dla elektrolitu 1-1 wartościowego średnie stężenie jonów jest równe stężeniu analitycznemu c, równanie można zapisać następująco:
![]()
Jeżeli wyznaczymy siłę elektromotoryczną ogniwa przy różnych stężeniach molowych kwasu i jeżeli znamy standardową siłę elektromotoryczną ogniwa, możliwe jest wyznaczenie z równania średnich jonowych współczynników aktywności kwasu dla badanych stężeń. Standardową siłę elektromotoryczną ogniwa można wyznaczyć z danych doświadczalnych. Przekształcając równanie do postaci:
![]()
oraz zamieniając logarytmy naturalne na dziesiętne i podstawiając
![]()
według równania Debye'a-Hückela-Brönsteda, otrzymujemy ostatecznie
![]()
Wykres zależności lewej strony równania od stężenia w zakresie niskich stężeń jest linią prostą, która na osi rzędnych odcina wartość Eo.
Wyszukiwarka
Podobne podstrony:
Fizyczna ćw 4, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
teoria 1, fizyczna, chemia fizyczna, Fizyczna, laborki
Fizyczna ćw 6, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
spr10 teoria, fizyczna, chemia fizyczna, Fizyczna, laborki
ćw 10, fizyczna, chemia fizyczna, Fizyczna, laborki
Chemia fizyczna - Ćw. 1 - Lepkość, Chemia fizyczna AGH laborki, lab 1
ćw 10, fizyczna, chemia fizyczna, Fizyczna, laborki
cw 2, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
hydroliza estrów wstep i teoria, fizyczna, chemia fizyczna, Fizyczna, laborki
Chemia fizyczna - Ćw. 18 - Elektroliza, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
spektro ćw. 1, fizyczna, chemia fizyczna, Fizyczna, laborki
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Korelacja liniowa, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
ogniwa galwaniczne, fizyczna, chemia fizyczna, Fizyczna, laborki
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
więcej podobnych podstron