Wyznaczanie termodynamicznych parametrów reakcji chemicznej z pomiarów SEM ogniwa. |
|
|
Marcin Górski |
Data: |
|
Mirosław Dziergowski |
Zaliczenie: |
|
Cel ćwiczenia.
Celem ćwiczenia jest wyznaczenie zmiany funkcji Gibbsa (ΔG), zmiany entalpii (ΔH) i entropii (ΔS) reakcji zachodzącej w ogniwie Clarka.
Zasada pomiaru.
Pomiary SEM ogniwa należy przeprowadzić w 5-6 różnych temperaturach. Ogniwo termostatować około 20 minut w określonej temperaturze, po czym zmierzyć SEM za pomocą miliwoltomierza cyfrowego.
Budowa ogniwa Clarka.
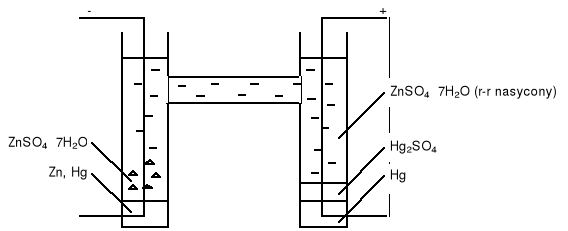
Wyniki pomiarów.
t [oC] |
SEM [V] |
3 |
1,446 |
10 |
1,439 |
17 |
1,432 |
24 |
1,423 |
31 |
1,415 |
38 |
1,405 |
45 |
1,396 |
52 |
1,389 |
Obliczenia.
Wyznaczenie współczynnika temperaturowego ogniwa.
Wspólczynnik temperaturowy ogniwa wyznaczamy znajdując równanie opisujące SEM ogni-wa od temperatury. Wykresem tej zależności jest linia prosta. Równanie prostej odczytujemy z załączone-go wykresu.
E(T) = -0,00117T + 1,769
Współczynnik temperaturowy ogniwa wynosi: = -0,00117 [V/K]
Obliczenie ΔG, ΔH i ΔS reakcji zachodzącej w ogniwie Clarka w temp. 25oC.
E(298) = -0,00117⋅298 + 1,769 = 1,42034 [V]
Obliczenie ΔG w temp. 25oC.
Zmianę funkcji Gibbsa dla reakcji zachodzącej w ogniwie Clarka obliczamy z zależności:
ΔG = -nFE
gdzie,
n - ilość elektronów przeniesionych przez granicę faz (dla badanej reakcji n = 2),
F - stała Faradaya (równa 96490 C/mol),
E - SEM ogniwa.
ΔG = -2⋅96490⋅1,42034 = -274097 [J/mol] = -274,01 [kJ/mol].
Obliczenie ΔH w temp. 25oC.
ΔH = 2⋅96490⋅[298⋅(-0,00117)-1,42034] = -341382 [J/mol] = -341,382 [kJ/mol].
Obliczenie ΔS w temp. 25oC
ΔS = 2⋅96490⋅(-0,00117) = -225,79 [J/mol].
Wnioski.
Reakcja zachodząca w ogniwie:
Na podstawie wyników pomiarów oraz sporządzonego wykresu wynika, że zmiana SEM ogniwa w badanym zakresie temperatur jest liniowa. Ze wzrostem temperatury siła elektromotoryczna ogniwa maleje.
Potencjał termodynamiczny jest funkcją, której wartość oblicza się, aby uzyskać informacje o tym, czy dana reakcja może zachodzić w określonych warunkach. Ze znaczą wydajnością mogą zachodzić tylko takie procesy, w których następuje zmniejszenie potencjału termodynamicznego, tzn. takie, w których ΔG<0.
W temperaturze 298K zmiana potencjału termodynamicznego dla reakcji biegnącej w ogniwie Clarka wynosi ΔG=-274,01 [kJ/mol] i jest wartością ujemną. Oznacza to, że powyższa reakcja jest procesem samorzutnym i możliwym do zrealizowania w tych warunkach.
Zmiana entalpii w temperaturze 298K dla tej reakcji jest równa: ΔH=-341,382 [kJ/mol]. Ponieważ ΔH<0 oznacza to, że reakcja jest egzotermiczna, czyli z wydzieleniem ciepła do otoczenia.
Zmiana entropii układu, w którym zachodzi reakcja chemiczna, nie świadczy jednoznacznie o kierunku przebiegu przemiany samorzutnej. W każdej przemianie obowiązuje warunek wzrostu entropii, ale dotyczy on całkowitej zmiany entropii układu wraz z otoczeniem. Entropia całkowita musi rosnąć.
Wyszukiwarka
Podobne podstrony:
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
SEM ogniwa2, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
Adsorpcja jodu na wŕglu, technologia chemiczna, chemia fizyczna, srawozdania
Korozja metali, technologia chemiczna, chemia fizyczna, srawozdania
Punkt izoelektryczny, technologia chemiczna, chemia fizyczna, srawozdania
Liczby przenoszenia, technologia chemiczna, chemia fizyczna, srawozdania
Ciep-o spalania, technologia chemiczna, chemia fizyczna, srawozdania
Ciecz-cia-o sta-e, technologia chemiczna, chemia fizyczna, srawozdania
Szeregi Hoffmeistera, technologia chemiczna, chemia fizyczna, srawozdania
Napiŕcie powierzchniowe, technologia chemiczna, chemia fizyczna, srawozdania
Kriometria, technologia chemiczna, chemia fizyczna, srawozdania
Si-a jonowa, technologia chemiczna, chemia fizyczna, srawozdania
Ciep-o rozpuszczania, technologia chemiczna, chemia fizyczna, srawozdania
Zadania sem.2, Technologia chemiczna, Chemia fizyczna, Egzamin, zadana na egzamin
Egzamin(zad.) sem.3, Technologia chemiczna, Chemia fizyczna, Egzamin
Zadania sem.4, Technologia chemiczna, Chemia fizyczna, Egzamin, zadana na egzamin
Egzamin(pyt.) sem.3, technologia chemiczna, chemia fizyczna
fizyczna 2011 egzamin - teoria, technologia chemiczna, chemia fizyczna2010-2011, sem 4, fizyczna egz
więcej podobnych podstron