GERL cd.
Każda błona systemu GERL jest asymetryczna (asymetria cis-trans).
Zasada transportu pęcherzykowego gwarantuje zachowanie orientacji błon.
Ciała białkowe to magazyny białka otoczone dwuwarstwą lipidową; ciała olejowe otoczone są jednowarstwą.
Ruch od ER do AG nazywamy anterogradowym, a odwrotny - retrogradowym.
Polisomy (wiele rybosomów połączonych razem) to główna postać, w jakiej występuja rybosomy na RER.
Pęcherzyki oderwane od ER zawierające białko wędrują dalej do AG, gdzie białko dojrzewa (dołączane są reszty cukrowe, lipidowe lub inne; zmienia się też struktura przestrzenna białka).
Ekstensyna transportowana jest pęcherzykowo do ściany komórkowej.
Istnieje możliwość zmiany liczby diktiosomów (mogą się rozrywać).
Przy użyciu izotopów radioaktywnych można śledzić obieg substancji wewnątrz systemu GERL.
Przekazywanie zawartości pomiędzy cysternami następuje na drodze pęcherzykowej. Możliwe jednak, że transport może odbywać się na zasadzie dynamiki całego układu; nowe pęcherzyki tworzą nową cysternę i całość przesuwa się; na stronie trans cysterna ulega rozpadowi. Taka sytuacja oznaczałby, że zawartość pęcherzyków w zasadzie nie zmienia lokalizacji (nie przechodzi pomiędzy cysternami) - można to porównać do mikrotubuli, która budowana jest z coraz to nowych heterodimerów.
Białka receptorowe umieszczone na plazmalemmie muszą być transportowane w specyficzny sposób (bo muszą być odpowiednio zorientowane na powierzchni błony komórkowej.
Kierunek wędrówki pęcherzyków zależy od etykiet białkowych na powierzchni pęcherzyków. Białka z grupy SNARE rozpoznają miejsce, do którego ma trafić pęcherzyk.
V-SNARE (vesicule SNARE) - białko na pęcherzyku; rozpoznaje błonę docelową
T-SNARE (target SNARE) - białko rozpoznające białka V-SNARE
Połączenie V-SNARE i T-SNARE powoduje zlanie się obu błon w miejscu połączenia.
Lizosomy
Markerem lizosomów jest kwaśna fosfataza (jeden z enzymów wewnątrz liposomu).
Lizosomy są szczególnymi pęcherzykami odpączkowującymi od strony trans AG.
Zawierają hydrolazy; ich funkcją jest degradacja makrocząsteczek wchłoniętych do komórki.
Nowo syntetyzowane enzymy są znakowane specjalną resztą cukrową (tak, aby mogły być związane do błony przy pomocy specyficznego receptora), we wnętrzu AG enzym łączony jest z przyszłą błoną lizosomu. Dopóki jest on związany z błoną, nie ma właściwości hydrolitycznych. Gdy lizosom odrywa się od AG, następuje aktywacja pomp protonowych (zakwaszanie środowiska wewnątrz lizosomu), białko enzymatyczne odłącza się od receptora błonowego i następuje podział lizosomu na dwie części (jedna zawiera enzym, a druga receptor, który wędruje do AG - taki komórkowy recycling :P)
Białka z grupy COP
COP1 - odpowiada za transport retrogradowy (od AG do ER)
COP2 - odpowiada za transport anterogradowy
Endocytoza receptorowa
Pęcherzyki sekrecyjne docierające do błony komórkowej wbudowują swoją błonę do plazmalemmy (powiększenie powierzchni). Aby błona nie pękła, równolegle biegną procesy odwrotne (endocytoza). Oba te procesy zapewniają ciągły ruch systemu GERL.
Proces endocytozy prowadzony jest tylko na niektórych obszarach błony.
Połączenie się ligandu z receptorem powoduje rozpoczęcie wpuklania błony; bierze w tym udział białko markerowe - klatryna.
Triskeliony klatryny budują kosz klatrynowy wokół pęcherzyka.
Przewężenie szyjki dołka opłaszczonego powodujeinne białko - dynamina.
Kosz klatrynowy zapobiega pęknięciu pęcherzyka w cytoplazmie.
Z pęcherzykiem endosomalnym łączy się lizosom dając endosom wtórny, który traci klatkę klatrynową..
Klatka klatrynowa jest podobna do struktury węgla C60 (fullerenu) - piłka złożona z 12 pentagonów zamykających heksagony w kulę.
Klatryna jest białkiem zbudowanym z 6 łańcuchów (struktura 4-rzędowa); ramiona triskelionów są elastyczne (mogą tworzyć 5 lub 6-kątne elementy).
Mikrosomy
Otoczone są pojedynczą błoną elementarną.
Często zawierają inkluzje krystalicznego białka.
Wyróżniamy:
Peroksysomy: liściowe, glioksysomy, brodawek korzeniowych
Sferosomy - rezerwy energetyczne komórek (silnie załamują światło)
Hydrogenosomy - prowadzą oksydację pirogronianu
Glikosomy - katalizują beztlenowy rozkłąd glukozy
Peroksysomy
Peroksysomy są bardzo podobne do lizosomów (bark różnic strukturalnych).
Białka peroksysomów mają skłonność do krystalizacji.
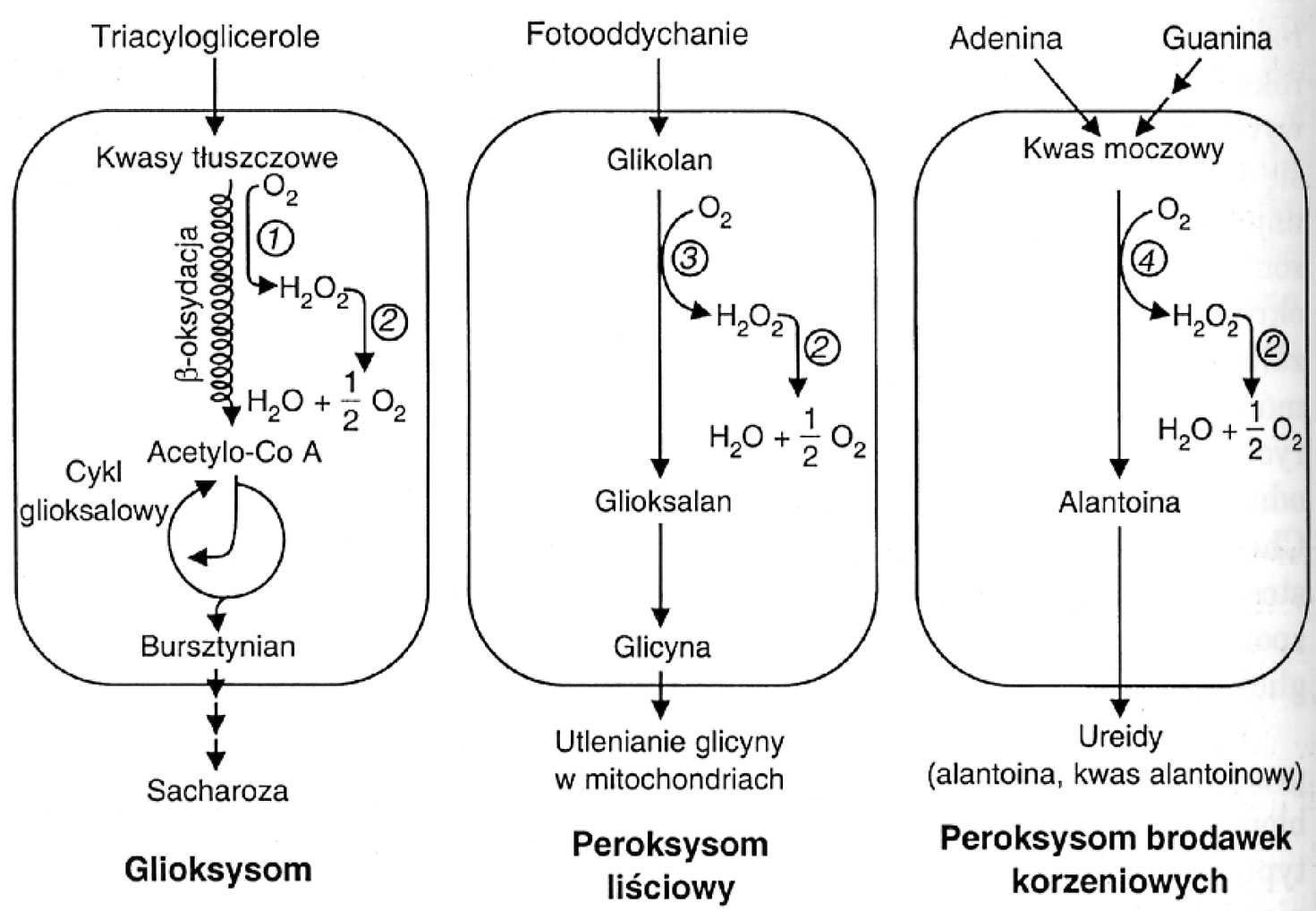
Peroksysomy mogą mieć różny charakter. Peroksysomy liściowe utylizują tlen powstały w procesie fotosyntezy; w komórkach brodawek korzeniowych obrabiają związki azotowe.
U zwierząt peroksysomy występują w dużych ilościach w wątrobie i nerkach; u glonów i roślin - w komórkach prowadzących fotosyntezę.
Markerem peroksysomów jest rozkładająca nadtlenek wodoru katalaza (stanowiąca do 15% składy białkowego peroksysomu). Występuje ona wraz z licznymi oksydazami generującymi nadtlenek wodoru; w ten sposób komórka jest odizolowana od toksycznego tlenu i wody utlenionej.
Peroksysomy wspomagają pracę mitochondriów.
Triton WR-1339 - detergent akumulujący się w lizosomach i zwiększający ich ciężar.
Peroksysomy różnią się od lizosomów wrażliwością na inny detergent - digitoninę; aby wyzwolić katalazę z peroksysomu trzeba użyć około 10 razy więcej digitoniny niż jest potrzebne do wyzwolenia kwaśniej fosfatazy z lizosomu. Gdyby obie substancje były w takich samych pęcherzykach, zostałyby uwolnione przy tym samym stężeniu detergentu.
Jeśli peroksysomy zawierają rdzeń krystaliczny, łatwo je odróżnić na zdjęciach TEM; jeśli nie mają rdzenia, stosuje się test DAB (reakcję z diaminobenzydyną).
W reakcji DAB, po utlenieniu diaminobenzydyny przez katalazę, powstaje polimer łączący się z czterotlenkiem osmu (standardowa substancja kontrastująca)
W komórkach roślin rdzeń krystaliczny peroksysomu tworzy katalaza (marker peroksysomów).
W komórkach zwierząt rdzeń peroksysomu tworzy oksydaza moczanowa (nieregularny kryształ).Urikaza - oksydaza moczanowa przeprowadza w peroksysomach oksydację produktów przemiany kwasów nukleinowych (puryny) i niektórych białek.
Funkcje peroksysomów:
Metabolizm nadtlenku wodoru.
Detoksykacja komórki (utlenianie różnych substancji).
Oksydacja kwasów tłuszczowych.
Metabolizm związków azotu.
Katabolizm substancji niezwykłych np. D-aminokwasów albo ksenobiotyków (alkany), np. teflonu.
U grzybów w peroksysomach znajdują się enzymy pozwalające na rozkład krótkołańcuchowych węglowodorów. Może się to przyczyniać do oczyszczania wycieków ropy.
Metabolizm H2O2:
RH2 + O2 oksydaza R + H2O2
2H2O2 katalaza O2 + 2H2O (rozkład katalityczny)
RH2 + H2O2 R + 2H2O (rozkład peroksydacyjny - wzmocnienie detoksyfikacji)
Detoksykacja komórki
W rozkładzie peroksydacyjnym H2O2 donorami organicznymi elektronów są metanol, etanol, kwas mrówkowy, formladehyd, fenole, związki nitrowe; ich oksydacja odtruwa komórki.
Proces utlenienia związków organicznych przez peroksysomy nie wiąże się z magazynowaniem energii; wydzielane jest ciepło.
W procesie fotorespiracji peroksysomy są niezbędne.
Peroksysomy regulują ciśnienie tlenu i jego zawartość w komórce.
Utlenianie związków organicznych nazywamy respiracją; respiracja peroksysomów liściowych to fotorespiracja, bo jest ona związana z zagospodarowywaniem tlenu wydzielonego w procesie fotosyntezy.
Mitochondria rozpoczynają respirację, a w momencie, gdy ulegają wysyceniu, ich funkcję przejmują peroksysomy.
Utlenianie kwasów tłuszczowych
W komórkach zwierzęcych utlenianie kwasów tłuszczowych (β-oksydacja) zachodzi w mitochondriach i peroksysomach (długi łańcuch skracany jest w peroksysomach do łańcucha 16-węglowego; krótkie łańcuchy wędrują do mitochondriów). W komórkach roślin natomiast β-oksydację prowadzą tylko peroksysomy.
Glioksysomy
W komórkach roślinnych specjalne peroksysomy zwane glioksysomami przeprowadzają konwersję lipidów w węglowodany podczas kiełkowania nasion roślin oleistych (soja, orzeszki ziemne, słonecznik), gdzie materiałem zapasowym w komórkach liścieni lub endospermu są kropelki tłuszczu (trójglicerydy). Dzieje się to przy udziale typowo roślinnych enzymów.
Glioksysomy są nietrwałe; czynne w czasie kiełkowania siewki (1-2 tygodnie), następnie przekształcają się w peroksysomy liściowe. Spektrum enzymów zmienia się w ontogenezie.
Peroksysomy brodawek korzeniowych
W peroksysomach brodawek korzeniowych znajdują się aminotransferazy; dzięki czemu może tam zachodzić degradacja lub tworzenie aminokwasów.
Biogeneza peroksysomów
Powstają poprzez podział (są uważane za najstarsze endosymbionty komórki eukariotycznej; oksydaza D-aminokwasowa jest być może dowodem tego, że peroksysomy są najstarszymi endosymbiontami).
Białka peroksysomowe są dostarczane posttranslacyjnie, ich transport do wewnątrz odbywa się z użyciem energii z ATP.
Białka peroksysomowe są syntetyzowane na rybosomach cytoplazmatycznych; muszą być zaopatrzone w sekwencję sygnałową SKL zbudowaną z trzech aminokwasów.
S - small uncharged (mały, nienaładowany) - seryna, prolina, alanina
K - kation charged (+) - lizyna, arginina
L - lipidlike (hydrofobowy) - metionina, leucyna
Pozbawienie sygnału SKL powoduje pozostanie białka w cytozolu, natomiast dołączenie sygnału SKL do obcego białka pozwala wprowadzić je do peroksysomu (uniwersalizm SKL polega na tym, że można tą drogą wprowadzać bardzo różne białka; podany tutaj przykład z lucyferazą, świetlikami i transgenicznym tytoniem
Adrenoleukodystrofia - defektywne białko integralne błony peroksysomu nie pozwala na transport do wnętrza kwasów tłuszczowych, które nagromadzając się w płynach ustrojowych niszczą osłonki mielinowe nerwów.
wykład # 8 25.01.2006
1
Wyszukiwarka
Podobne podstrony:
ekologia, Temat 8, Rolnictwo ekologiczne (biologiczne, organiczne lub biodynamiczne) oznacza system
Rośliny okopowe, Rośliny korzeniowe, Rośliny korzeniowe: główną częścią użytkową jest mięsisty korze
Using biological models to improve innovation systems
Biologia komórki roślinnej, Biologia komórki roślinnej #1, Biologia komórki roślinnej prof
Biologia komórki roślinnej, Biologia komórki roślinnej #1, Biologia komórki roślinnej prof
Wykład 5, Biologia UWr, II rok, Biologia Komórki Roślinnej
Biologia komórki roślinnej, Biologia komórki roślinnej #3, Reakcja grawitropijna
KOMÓRKI ZWIERZĘCE I ROŚLINNE, Edukacja xD, Biologia, Referaty
Przestrzenna organizacja komorki, biologia, Biologia roślin
cwiczenia - notatki, II ROK, III SEMESTR, Biologia komórki roślinnej
Cytokineza zwierząt i roślin, Biologia komórki
Budowa komórki roślinnej, matura, biologia r
Różnice w budowie między komórką roślinną a zwierzęcą, BIOLOGIA MOJE PRYWATNE
BKR-wykłady, Biologia komórki roślinnej
Pytania na egzamin, pytania - biologia komórki roślinnej 2007, 1
BIOLOGIA, komorki rosline i zwierzece
więcej podobnych podstron