Opracowanie wyników pomiarów Michał Michalak
Na podstawie wyznaczonej masy wody mw oraz jej gęstości dw w danej temperaturze pomiaru t, obliczam objętość piknometru V, korzystając z zależności:
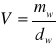
gdzie:
mw = 20,4752 [g] - masa wody
t = 22 [oC] - temperatura pomiarów
dw = 0,997770 [g cm-3]
![]()
2. Znając masy poszczególnych cieczy organicznych ms i ich mieszanin m1,2 oraz objętość piknometru, wyznaczam gęstości ds. i d1,2 wszystkich badanych cieczy korzystając ze wzoru: ![]()
. Obliczenia przedstawiam dla metanolu oraz mieszaniny metanol-dioksan:
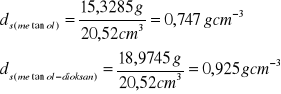
Pozostałe wyniki obliczeń zamieściłem w tabeli poniżej.
3. Obliczyłem refrakcję właściwą poszczególnych substancji organicznych rs oraz ich mieszanin r1,2, korzystając ze wzoru:![]()
gdzie:
r - refrakcja właściwa
n - współczynnik załamania światła
d - gęstość
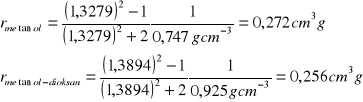
4. Obliczam refrakcję molową poszczególnych substancji Rs na postawie wzoru: ![]()
,
gdzie:
R - refrakcja molowa
M - masa molowa
![]()
5. Korzystając z tabeli „Wartości refrakcji atomowych wraz z poprawkami na szczególne ugrupowania atomowe dla linii D widma sodu”, obliczyłem wartość refrakcji molowej RD dla każdego składnika mieszaniny:
RD(metanol) = RD(węgiel) + 4*RD(wodór) + RD(tlen w grupie OH)
RD(metanol) = 2,418cm3mol-1 + 4*1,100 cm3mol-1 + 1,525 cm3mol-1= 8,343 cm3mol-1
6. Obliczam ułamki molowe x1 i x2 składników poszczególnych mieszanin, wykorzystując zależność: x1 + x2 = 1 oraz przekształcając wyrażenie:

gdzie:
x1 - ułamek molowy metanolu w mieszaninie metanol-dioksan
x2 - ułamek molowy dioksanu w mieszaninie metanol-dioksan
7. Obliczyłem ułamki wagowe w1 i w2 składników poszczególnych mieszanin:
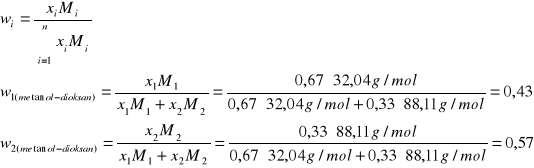
gdzie:
w1 - ułamek wagowy metanolu w mieszaninie metanol-dioksan
w2 - ułamek wagowy dioksanu w mieszaninie metanol-dioksan
8. Wyniki obliczeń umieszczam w poniższych tabelach:
Tabela wyników obliczeń dla czystych substancji organicznych
Substancja czysta |
M [g mol-1] |
ms [g] |
ds [g cm-3] |
rs [cm3 g-1] |
Rs [cm3 mol-1] |
RD [cm3 mol-1] |
Metanol |
32,04 |
15,3285 |
0,747 |
0,272 |
8,701 |
8,343 |
Etanol |
46,07 |
15,3914 |
0,750 |
0,294 |
13,549 |
12,961 |
Dioksan |
88,11 |
21,1810 |
1,032 |
0,244 |
21,538 |
22,894 |
Toluen |
92,14 |
17,1034 |
0,833 |
0,349 |
32,139 |
30,925 |
Tabela wyników obliczeń dla mieszanin dwuskładnikowych
Mieszanina |
m1,2 [g] |
d1,2 [g cm-3] |
r1,2 [cm3 g-1] |
x1 |
x2 |
w1 |
w2 |
w1 |
w2 |
Metanol + Dioksan |
18,9745 |
0,925 |
0,256 |
0,67 |
0,33 |
0,42 |
0,58 |
0,43 |
0,57 |
Metanol + Toluen |
16,3899 |
0,799 |
0,323 |
0,58 |
0,42 |
0,47 |
0,53 |
0,33 |
0,67 |
Etanol + Dioksan |
18,8334 |
0,918 |
0,262 |
0,51 |
0,49 |
0,42 |
0,58 |
0,35 |
0,65 |
Etanol + Toluen |
16,3810 |
0,798 |
0,331 |
0,49 |
0,51 |
0,47 |
0,53 |
0,33 |
0,67 |
Celem ćwiczenia było wyznaczenie refrakcji molowych czystych substancji organicznych oraz ich mieszanin dwuskładnikowych dwuskładnikowych stałym stosunku molowym na podstawie pomiarów współczynnika załamania światła oraz gęstości badanych związków organicznych. Uzyskane dane pozwalają określić skład molowy i wagowy badanych mieszanin.
Refrakcja molowa jest w przypadku związków kowalencyjnych wielkością addytywną. Tak jest i w przypadku tych związków, ponieważ wszystkie one posiadają wiązania kowalencyjne.
Obliczone przeze mnie wartości refrakcji molowej są praktycznie takie same jak otrzymane z wartości tablicowych (różnica wynosi do 1,5 cm3 mol-1). Różnice te, chociaż niewielkie mogą być spowodowane błędami podczas przeprowadzania pomiarów.
3
Wyszukiwarka
Podobne podstrony:
31 Refrakcja roztworów dwuskładnikowych związków oganicznyc
Identyfikacja roztworów związków nieorganicznych
ZWIĄZKI REFRAKCYJNE I METODY ICH USUWANIA ZE ŚCIEKÓW, Technologia Wody i Ścieków
Identyfikacja roztworów związków nieorganicznych
Pomiar współczynnika załamania światła oraz wyznaczanie stężenia roztworów metodą refraktometryczną
Pomiar współczynnika załamania światła oraz wyznaczenie stężenia roztworów metodą refraktometryczną
Identyfikacja roztworów związków nieorganicznych
ZWIĄZKI REFRAKCYJNE I METODY ICH USUWANIA ZE ŚCIEKÓW, Technologia Wody i Ścieków
2 Związki refrakcyjne stosowane w ekstrakcji
D19240168 Rozporządzenie Ministra Spraw Wewnętrznych z dnia 31 stycznia 1924 r w przedmiocie wyłącz
biofiza cw 31
31 NIEDZIELA ZWYKŁA B
izomeria zwiazkow organicznych
31 czwartek
Ostre Zatrucie Związkami Rtęci
3 ch org zwiazki funkcyjne
7 władza w bliskim związku
więcej podobnych podstron