Nazwa wydziału:
Wydział Metale Nieżelazne
|
Tytuł ćwiczenia:
Otrzymywanie cynku poprzez elektrolize ZnSO |
Nr ćwiczenia:
2 |
Rok studiów: III Specjalność: Przeróbka Plastyczna
|
Imię i nazwisko:
1. Marek Ćmiel 2. Marcin Dereń
|
Nr Grupy:
5 |
Data oddania:
19.11.2003
|
Ocena: |
|
1.Wstęp teoretyczny
Związek pomiędzy masą produktów elektrolizy , oraz prądem elektrolizy opisuje prawo Faradaya, można je przedstawić w postaci równania:
m = k*I*t
Do wydzielenia 1 gramorównoważnika produktu elektrolizy potrzeba 95000 C , można wyliczyć występujący w powyższym równaniu współczynnik proporcjonalności k (zwany równoważnikiem elektrochemicznym) :
k = M / F
M oznacza ciężar równoważnikowy rozpatrywanego produktu elektrolizy . Równania powyższe wskazują , że mając natężenie prądu oraz czas elektrolizy można wyliczyć masę produktów elektrolizy.
W praktyce masa wydzielonego produktu może być mniejsza niż wyliczona . Przyczynami tego mogą być : nieuwzględnienie w wyliczeniach reakcji ubocznych (równoczesne wydzielanie się na elektrodzie 2 lub więcej produktów elektrolizy; reakcje wtórne pomiędzy produktami elektrolizy a otoczeniem) ; tak zwane zwarcia i ucieczki prądowe.
Stosunek masy wydzielonej do masy wyliczonej z prawa Faradaya , nazywa się wydajnością prądową elektrolizy η . Wielkość tę mnoży się często przez 100 i wyraża w procentach. Można ją również obliczyć jako stosunek ilości ładunków , teoretycznie potrzebnych do wydzielania otrzymanej ilości produktu: m'/ M F , do ilości ładunków , która rzeczywiście przepływa przez układ I t:
![]()
Tak więc stosując prawo Faradaya dla celów praktycznych zapisujemy je często w postaci:
![]()
W przypadku tego równania wydajność nie może być wyrażona w procentach. W procesie elektrolizy wyróżnia się wydajność anodową i katodową.
Otrzymywanie cynku metodą elektrohydrometalurgiczną (elektrolityczną) obejmuje następujące podstawowe operacje:
przygotowanie koncentratów do ługowania;
ługowanie roztworem kwasu siarkowego;
oczyszczenie roztworów;
elektrolizę oczyszczonego roztworu;
przetapianie i odlewanie cynku katodowego.
Materiałami wyjściowymi do procesu otrzymywania cynku elektrolitycznego są wyprażone koncentraty blendowe oraz spiekany tlenek cynku po uprzednim zmieleniu.
Proces ługowania cynku polega na jego rozpuszczeniu w kwasie siarkowym wg reakcji:
![]()
W procesie ługowania prażonych koncentratów cynkowych do roztworu przechodzi około 90% całej ilości cynku zawartego w prażonce. Roztwór siarczanu cynkowego wlewa się bez przerwy do wanny elektrolitycznej. Po włączeniu wanny do prądu elektrycznego następuje w niej proces elektrolizy roztworu. Proces zachodzący podczas przepływu prądu można przedstawić następująco wg reakcji:
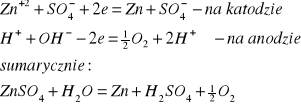
Po procesie katody wyjmuje się, utworzoną na nich warstwę osadu cynku zdziera się z blachy aluminiowej i przetapia. Cynk zdarty z katod nie jest jeszcze produktem końcowym, zawiera bowiem w swych porach wtrącenia elektrolitu, a ponadto ma dużą skłonność do utleniania się. Chcąc usunąć te wady cynku katodowego, przetapia się go w piecach płomiennych lub elektrycznych (indukcyjnych), a następnie odlewa płyty stanowiące produkt końcowy wysokiej jakości.
Opis wykonania ćwiczenia.
Elektrolity zawierające 100 [g/dm3] Zn oraz 30, 60 i 120 [g/dm3] H2SO4 wlaliśmy do wanienek elektrolitycznych. Zważone i wysuszone katody aluminiowe umieściliśmy w elektrolizerze. Elektroliza została przeprowadzone przy prądzie o natężeniu 1[A] przez okres 20 minut, kontrolując pomiar co 5 minut napięcie w każdej wanience. Po 20 minutach ,elektroliza została przerwana. Katody ostrożnie przemyliśmy wodą, potem alkoholem i po osuszeniu zważyliśmy. Katody zostały ponownie umieszczone w wanienkach i pomiar został powtórzony pomiar dla natężeń prądu 1,5[A] oraz 2[A]. Po zakończeniu ostatniego pomiaru została zmierzona powierzchnia czynna a osad cynku rozpuszczony w kwasie azotowym.
Schemat aparatury przedstawia rysunek:
3.Obliczenia:
I Naczynie nr.1 - 30 [g/dm![]()
] H![]()
I |
t |
U |
Uśr |
waga katod |
ilość Zn |
i |
[A] |
[min] |
[V] |
[V] |
[g] |
[g] |
[A/m2] |
1 |
5 |
3 |
2,925 |
mo |
0,325 |
196,08 |
|
10 |
2,9 |
|
31,245 |
|
|
|
15 |
2,8 |
|
m1 |
|
|
|
20 |
3 |
|
31,57 |
|
|
1,5 |
5 |
2,90 |
2,938 |
mo |
0,500 |
294,12 |
|
10 |
3,05 |
|
31,57 |
|
|
|
15 |
3,05 |
|
m1 |
|
|
|
20 |
2,75 |
|
32,07 |
|
|
2,5 |
5 |
2,9 |
2,963 |
mo |
0,325 |
490,20 |
|
10 |
2,95 |
|
32,07 |
|
|
|
15 |
2,95 |
|
m1 |
|
|
|
20 |
3,05 |
|
32,395 |
|
|
gdzie: I - natężenie prądu podczas procesu elektrolizy [A]
t - czas trwania procesu elektrolizy [min]
U- napięcie prądu podczas procesu elektrolizy [V]
U![]()
- średnie napięcie podczas procesu przy danym natężeniu [V]
m![]()
- waga początkowa katody przed rozpoczęciem kolejnego etapu procesu [g]
m![]()
- waga końcowa katody po zakończeniu kolejnego etapu procesu [g]
ilość Zn = m![]()
- m![]()
[g]
II Naczynie nr.2 - 60 [g/dm![]()
] H![]()
I |
t |
U |
Uśr |
waga katod |
ilość Zn |
i |
[A] |
[min] |
[V] |
[V] |
[g] |
[g] |
[A/m2] |
1 |
5 |
3,05 |
3,048 |
mo |
0,294 |
196,08 |
|
10 |
3,05 |
|
31,043 |
|
|
|
15 |
3,04 |
|
m1 |
|
|
|
20 |
3,05 |
|
31,337 |
|
|
1,5 |
5 |
3,30 |
3,163 |
mo |
0,523 |
294,12 |
|
10 |
3,25 |
|
31,337 |
|
|
|
15 |
3,20 |
|
m1 |
|
|
|
20 |
2,90 |
|
31,86 |
|
|
2,5 |
5 |
3,2 |
3,075 |
mo |
0,329 |
490,20 |
|
10 |
3,1 |
|
32,228 |
|
|
|
15 |
3,1 |
|
m1 |
|
|
|
20 |
3,1 |
|
32,885 |
|
|
III Naczynie nr.3 - 120 [g/dm![]()
] H![]()
I |
t |
U |
Uśr |
waga katod |
ilość Zn |
i |
[A] |
[min] |
[V] |
[V] |
[g] |
[g] |
[A/m2] |
1 |
5 |
3,15 |
3,1 |
mo |
0,321 |
196,08 |
|
10 |
3,1 |
|
31,953 |
|
|
|
15 |
3,1 |
|
m1 |
|
|
|
20 |
3,05 |
|
32,274 |
|
|
1,5 |
5 |
3,20 |
3,075 |
mo |
0,403 |
294,12 |
|
10 |
3,15 |
|
32,274 |
|
|
|
15 |
3,10 |
|
m1 |
|
|
|
20 |
2,85 |
|
32,677 |
|
|
2,5 |
5 |
3,1 |
3,050 |
mo |
0,488 |
490,20 |
|
10 |
3,1 |
|
32,228 |
|
|
|
15 |
3,1 |
|
m1 |
|
|
|
20 |
3,1 |
|
32,885 |
|
|
I |
Nr |
zużycie mocy |
Uzysk teoretyczny |
Uzysk praktyczny |
Wydajność |
[A] |
naczynia |
[kWh/ton] |
[g] |
[g] |
[%] |
1 |
1 |
3000,0 |
0,407 |
0,325 |
79,95 |
1,5 |
|
2937,0 |
0,610 |
0,5 |
82,00 |
2 |
|
6071,8 |
0,813 |
0,325 |
39,97 |
1 |
2 |
3454,6 |
0,407 |
0,294 |
72,32 |
1,5 |
|
3022,9 |
0,610 |
0,523 |
85,77 |
2 |
|
6231,0 |
0,813 |
0,329 |
40,47 |
1 |
3 |
3219,1 |
0,407 |
0,321 |
78,97 |
1,5 |
|
3815,1 |
0,610 |
0,403 |
66,09 |
2 |
|
4166,7 |
0,813 |
0,488 |
60,02 |
Przykładowe obliczenia.
Przykład obliczeń dla naczynia pierwszego natężenie prądu 1 [A ]:
![]()
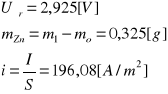
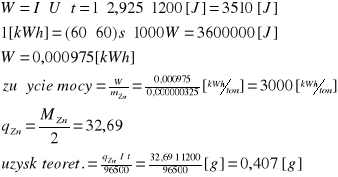
wydajność=![]()
4. Wnioski:
Uzysk praktyczny cynku różni się znacznie od teoretycznego wyliczonego z prawa Faraday`a gdyż elektrolit użyty do procesu nie jest zupełnie czysty. Domieszki w nim zawarte negatywnie wpływają nie tylko na uzysk cynku, ale również powodują straty energii.
Wydzielenie się cynku na anodzie jest silnie związane z nadnapięciem wodoru. Z przeprowadzonego doświadczenia zauważyć można ,że im gęstość prądu jest większa tym proces jest bardziej wydajny. Związane jest to z tzw. Nadnapieciem wodoru przy większej gęstości prądu wodór osiąga większe nadnapiecie i w ten, że sposób umożliwia intensywne wydzielanie cynku.
Z wykresów można zaobserwować że wydajność rośnie wraz ze wzrostem gęstości kwasu lecz po przekroczeniu pewnej wartości stężenia kwasu wydajność malej. Związane jest to z rozpuszczaniem wydzielonego na katodzie cynku przez pozostający w elektrolicie kwas.
Napięcie wzrasta wraz ze wzrostem stężenia kwasu oraz ze wzrostem gęstości prądowej. Gęstość prądu ma znaczny wpływ na wartość zużytej energii , im większa jest gęstość tym zużycie energii wzrasta.
6
Wyszukiwarka
Podobne podstrony:
spr 4 - Kapilarność gruntu - ostateczne, IŚ Tokarzewski 27.06.2016, V semestr ISiW, Geotechnika, Lab
ostateczna lista, Dokumenty- spr
opracowane pytania prawo karne-wersja ostateczna, Różne Spr(1)(4)
spr 4 - Kapilarność gruntu - ostateczne, IŚ Tokarzewski 27.06.2016, V semestr ISiW, Geotechnika, Lab
Prezentacja konsument ostateczna
WYKŁAD PL wersja ostateczna
13 G06 H04 ostateczna wersjaid 14452 ppt
Prezentacja harcerstwo ostateczne 3
rodowiskowe uwarunkwania zdrowia i choroby ostateczny 1
rehabilitacja chorego nieprzytomnego ostateczna wersja[1]
OSTATECZNA Łukowska, M (2011) Mechanizmy kontroli głębokości zanurzenia przestrzennego w środowisko
Ostateczny porządek Świata wg żydów
plan wypowiedzi ostateczny, szkoła
sciaga ostateczna, Edukacyjnie, K, Kosmetologia, Technik usług kosmetycznych, bakteriologia
test b - odpowiedzi ostateczne 30[1].06.07, Fizjologia Pracy Prof.Łaszczyca
Memling Hans sąd ostateczny
wersja b eko ostateczna
więcej podobnych podstron