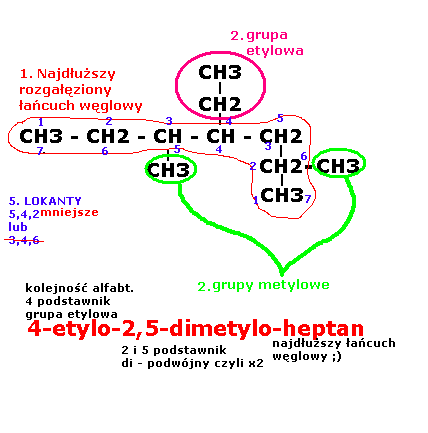
PRZYKŁAD: (numerki postępowania według instrukcji powyżej)
CHEMIA ORGANICZNA
POJĘCIA:
wzory strukturalne - rysuje się wszystkie atomy i zaznacza się wszystkie wiązania występujące w cząsteczce.
np.
wzory pół strukturalne - atomy wodoru połączone z tym samym atomem węgla zapisuje się razem, podając ich liczbę w dolnym indeksie tj. We wzorach sumarycznych
np. CH3 - (CH2)4-CH3
wzory szkieletowe - nie zapisuje się symbolami atomu węgla i wodoru, tylko zaznacza się wiązania C-C. Nie przedstawia prostego łańcucha węglowego,ale pokazuje jego “wygięcia” przy każdym atomie węgla. Zatem poprawniej oddaje rzeczywistą strukturę tych związków.
np. /\/\/ (tj. Pokazujesz tylko wiązania pomiędzy węglami (C-C), ale zamiast prostych kresek - rysujesz krzywe / ;))
węglowodory - związki organiczne zbudowane tylko z węgla i wodoru nazywamy węglowodorami.
Alkany - czyli węglowodory nasycone, to węglowodory,w który cząsteczkach atomy węgla są połączone tylko wiązaniami pojedynczymi.
szereg homologiczny - to grupa związków o podobnej budowie i właściwościach, których cząsteczki różnią się o jedną lub więcej grup -CH2-. Związki należące do danego szeregu homologicznego to homologi. Właściwości fizyczne i chemiczne homologów zmieniają się systematycznie ze wzrostem długości łańcucha węglowego.
Izomeria - cząsteczki alkanu o tym samym wzorze sumarycznym, ale o różnej budowie łańcucha węglowego są względem siebie izomerami szkieletowymi.
izomeria szkieletowa - jest jednym z przykładów izomerii konstytucyjnej (strukturalnej). Izomery konstytucyjne różnią się między sobą konstytucją czyli kolejnością i sposobem powiązania atomów w cząsteczce.
Najważniejsze postulaty teorii strukturalnej.
Atomy węgla w związkach organicznych są IV wartościowe, czyli mogą wiązać się z innymi atomami i wiązaniami.
Atomy węgla mogą łączyć się między sobą wiązaniami pojedynczymi , podwójnymi tworząc łańcuchy proste i rozgałęzione oraz pierścienie.
Wiązania niewykorzystane do łączenia z sąsiednimi atomami węgla służą do przyłączenia innych pierwiastków np. Wodoru (1 wiązanie) lub tlenu (2 wiązania).
Alkany
Reakcja Wurtza jest to reakcja halogenków alkilowych z sodem (Na) prowadząca do wychładzania łańcucha węglowego.
Metan
Reakcje następcze to takie reakcje, w których produkt pierwszej z nich jest substratem w drugiej, produkt drugiej, jest substratem w 3 itd., przy czym w każdej z tych reakcji 2 substrat jest ten sam.
Reakcja substytucji inaczej podstawienia jest to proces polegający na zastępowaniu atomów lub grup atomów w cząsteczce związku organicznego atomami (grupami atomów) innych pierwiastków.
Reguły nazewnictwa alkanów.
należy wybrać w cząsteczce najdłuższy, nie rozgałęziony łańcuch węglowy i jest to tzw. Łańcuch główny.
Pozostałe atomy węgla tworzą tzw. Łańcuchy boczne, które traktuje się jako podstawniki łańcuchów bocznych. Podstawniki te nazywamy grupami alkinowymi:
•CH4 - metan CH3 - grupa metylowa -> metyl
• CH3-CH3 - etan CH3-CH2 - grupa etylowa -> etyl
• CH3-CH2-CH3 - butan CH3-CH2-CH3 - grupa butylowa -> butanol
Liczbę jednakowych podstawników określa się przedrostami: di - , tri - , tetra -
Podstawniki wymienia się w kolejności alfabetycznej
Położenie grup alkinowych w łańcuchu głównym określa się podając lokanty czyli numery atomów węgla łańcucha głównego, z którymi są związane. Numeracje wybiera się tak aby lokanty były jak najmniejsze.

PRZYKŁAD: (numerki postępowania według instrukcji powyżej)
Właściwości fizyczne:
Metan* |
Alkany* |
Alkeny |
Alkiny |
Benzen |
•bezbarwny gaz •słabo rozpuszczalny z H2O •palny •nie odbarwia wody bromowej ani roztworu manganianu (VII) potasu •cząsteczka ma kształt czworościanu foremnego incz. Tetraedru, w którego centrum znajduje się a.C, a w 4 narożach znajduje się a.H •wiązania C-H są to wiązania kowalencyjne spolaryzowane w b.niewielkim stopniu ze względu na małą różnicę elektroujemności pomiędzy a. C i H |
• 4 pierwsze alkany są w temp. Pokojowej gazami, alkany zaw. Od 5-15 a. C to ciecze, a alkany o 16 a. C i więcej ciała stałe • słabo rozp. Się w H2O, zaś b.dobrze w roztworach hydrofobowych (nie polarnych) •nie reagują z rozp. w H2O bromem i nie utleniają się pod wpływem manganianu (VII) potasu •są mało reaktywne ze względu na brak polarności wiązań •gęstość i temp. Wrzenia alkanów wzrasta stopniowo ze wzrostem długości łańcucha C
|
•bezbarwne •bezwonne •najmniejsze są gazami, większe cieczami, a największe ciałami stałymi •nie rozp. Się w H2O |
•Bezbarwne •bezwonne •najmniejsze są gazami, przy czym ich lotność maleje wraz ze wzrostem rozmiarów cząsteczki •nie rozp. Się w H2O •acetylen spala się b.kopcącym płomieniem niż etylen, ponieważ wiązania wielokrotne nie sprzyjają całkowitemu spalaniu |
•Bezbarwna, lotna ciecz o charakterystycznym zapachu •nie rozp. W H2O (jest od niej lżejszy) •doskonały rozpuszczalnik dla substancji hydrofobowych |
*METAN TO ALKAN!
WŁAŚCIWOŚCI CHEMICZNE
Metan |
Alkany |
Alkeny |
Alkiny |
Benzen |
|
|
•Reakcje spalania •reakcja addycji (bromu) |
•odbarwiają wodę bromową i roztwór manganianu (VII) potasu •addycja wodoru (H) inaczej reakcja uwodnienia •addycja chlorowodoru •addycja wody |
•Nie odbarwia wody bromowej ani wodnego roztworu manganianu (VII) potasu (KMgO4) •substytucja bromu •reakcja niklowania czyli benzenu z kwasem azotowym (V) •addycja wodoru do benzenu |
Alkeny
Izomeria cis i trans jest to inaczej izomeria geometryczna.
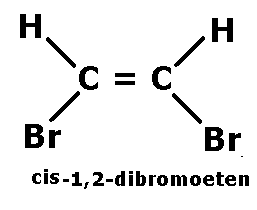
Izomery geometryczne, w których jednakowe podstawniki znajdują się po tej samej stronie wiązania podwójnego nazywamy izomerami cis.
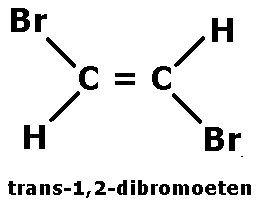
Jeżeli podstawniki są rozmieszczone po obu stronach wiązania to w nazwie izomeru pojawia się przedrostek trans.
Izomeria cis-trans występuje w cząsteczkach, w których nie ma możliwości obroty wokół wiązania, czyli w cząsteczkach, w których występuje wiązanie po2.
POŁOŻENIA PODSTAWNIKA LUB WIĄZANIA WIELOKROTNEGO
Izomeria położenia są to związki, które różnią się położeniem podstawnika (np. Atomu chlorowca lub grupy -OH) w cząsteczce.
![]()
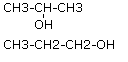
IZOMERIA ŁAŃCUCHOWA
Związki różnią się budową łańcucha węglowego (izomeria szkieletu węglowego) - związana jest ze zmianą długości łańcucha głównego i liczby podstawników.
IZOMERIA ZMIANY RODZAJU GRUPY FUNKCYJNEJ
Jeśli związek o tym samym wzorze sumarycznym tworzy związki zawierające różne grupy funkcyjne to taki rodzaj izomerii nazywamy izomerią zmiany grupy funkcyjnej.
Reakcja addycji (bromu)
Reakcja zachodzi łatwo i nie wymaga obecności światła wykorzystuje się ją do wykrywania obecności wiązań wielokrotnych, ponieważ roztwór bromu jest brązowy, a powstające bromopochodne są bezbarwne. Odbarwienie wody bromowej świadczy o obecności wiązań wielokrotnych.
REGUŁA MARKOWNIKOWA - mówi nam, że podczas addycji do niesymetrycznego alkenu atom H pochodzący z kwasu lub H20 przyłącza się do tego atomu C, który jest połączony z większą liczbą atomów H.
Alkiny
Acetylen był dawniej stosowany do oświetlenia pomieszczeń w tzw. Karbidówkach. Stosowano je w górnictwie, były to lampy z żywym płomieniem, przez to często dochodziło do wybuchu metanu zbierającego się w wyrowiskach.
Reakcja polimeryzacji polega na zerwaniu podwójnych wiązań i łączeniu wielu cząsteczek tzw. Monomeru w związek wielocząsteczkowy zawierający tysiące atomów węgla zwany polimerem.
Całkowite spalanie etynu następuje przy zwiększonym dopływie O2 np. Przy płomieniu palnika acetylenowo - tlenowego, którego temperatura osiąga ok. 3000*, co umożliwia spawanie i cięcie metali. (ACETYLEN Z POWIETRZEM MOŻE TWORZYĆ MIESZANINĘ WYBUCHOWĄ)
Benzen
Każdy atom węgla w pierścieniu benzenu wykorzystuje trzy ze swoich czterech elektronów walencyjnych na utworzenie pojedynczych wiązań kowalencyjnych z dwoma innymi atomami węgla i jednym atomem wodoru. Sześć pozostałych elektronów walencyjnych tworzy “rozmytą” na całą cząsteczkę chmurę elektronową wspólną dla wszystkich atomów węgla. O takiej strukturze mówi się, że są to zdelokalizowane wiązania podwójne.
Benzen jest doskonałym rozpuszczalnikiem dla substancji hydrofobowych. Ma właściwości toksyczne, rakotwórcze - jest niebezpieczny podczas wdychania oparów i zetknięciu ze skórą. Wchodzi w skład wielu związków, również naturalnych np. Tworzywa sztuczne, leki, barwniki.
Gaz ziemny i ropa naftowa
Źródłem węglowodoru jest przede wszystkim ropa naftowa, gaz ziemny i węgiel kamienny. Ropa jest mieszaniną węglowodorów nasyconych występujących w temperaturze pokojowej w stanie gazowym.
Ropa ma bardzo duże zastosowane biorąc pod uwagę inne surowce energetyczne. Wykorzystuje ona większą czystość i wydajność w st. Od np. Węgla. Wykorzystywana jest w przemyśle, w transporcie innych gałęziach gospodarki. W wyniku przeróbki uzyskujemy:
- paliwa
- rozpuszczalniki
- produkty parafinowe
- kosmetyki
- substancje wybuchowe i owadobójcze
- leki
Gaz ziemny stanowi najtańsze źródło energii spośród paliw przeznaczonych do użytkowania. Gaz ziemny jako paliwo jest wykorzystywany:
- do przygotowywania posiłków
- ogrzewania wody i pomieszczeń
- klimatyzacje
- ekologiczne paliwo do napędzania pojazdów samochodowych
Warunki bezpiecznego zastosowania:
- zabezpieczyć przed pożarem
- magazynowanie
- przechowywać z dala od źródeł ognia
- unikanie kontaktu ze skórą
- nie wdychać
- musi być utylizowany jako odpad niebezpieczny
- przechowywać w dobrze wentylowanym pomieszczeniu
Rafinacja ropy naftowej ma na celu przekształcać ropę na bardziej użyteczne produkty. Celem rafinacji jest oczyszczenie surowych produktów przeróbki zachowawczej i rozkładowej. Usuwa się przede wszystkim związki siarki, składniki kwaśne i zasadowe, żywice.
Ropa naftowa prawdopodobnie powstała z za dużej ilości szczątków organizmów żywych, które uległy przemianom w dawnych epokach geologicznych. Podczas destylacji frakcyjnej surowej ropy naftowej otrzymuje się następujące produkty: benzyna lekka i ciężka,ligroina, nafta, oleje naftowe, parafina, wazelina...
Największe zanieczyszczenie powoduje metan i węglowodory lekkie. Jednym z głównych skutków spalania węglowodorów są smog, kwaśne deszcze, ozon.
Kraking to rozbijanie długich łańcuchów węglowodorowych na krótsze. Stosuje się go odnośnie produktów przerobu ropy naftowej aby podnieść ich liczbę oktanową.
Reforming benzynu jest rodzajem przeróbki rozkładowej, który ma na celu podwyższenie liczby oktanowej benzynu destylacyjnych i rozkładowych. Istnieje kilka odmian procesu reformingu, w których uzyskuje się wzrost liczby oktanowej benzynu w wyniku reakcji cyklizacji, aromatyzacji, polimeryzacji i izomeryzacji pierwotnych składników surowca.
PRZYKŁADOWE ZADANIA + ROZWIĄZANIA
W dwóch zbiornikach znajdują się: etan i etylen. Jak je rozróżnić?
Odp. Porównaj właściwości:
etan - alkan
etylen - alken
Etan nie odbarwia wody bromowej ani wodnego roztworu manganianu(VII)potasu. Natomiast etylen odbarwia.
Ułóż równanie reakcji spalania:
propenu 2C3H6 + 3CO2 -> 6C + 6H2O
propynu C3H4 + 5/2O2 -> 3CO + 2H2O /*2
2C3H4 + 5O2 -> 6CO + 4H2O
prowadzące do wytworzenia CO2 lub CO lub C.
Podaj wzory strukturalne następujących związków:
3-metylo-1-yn
4-metylo-2,2-dimetylohept-3-en
Podane wzory przedstawiają różne związki czy ten sam?
CH3-CH2-C=-C-CH2-CH3 -> heks-3-yn
CH3-CH2-CH2-C=-C-CH3 -> heks-2-yn
izomery geometryczne
Odp. Różne