
Chemia organiczna
- podstawy
mgr inż. Karolina Kolasioska
Wydział Inżynierii Kształtowania Środowiska i Geodezji
Instytut Inżynierii Środowiska

Chemia organiczna
• dziedzina chemii, zajmująca się badaniem
budowy, właściwości oraz reakcji związków
chemicznych, zawierających węgiel, a także
opracowywaniem
różnorodnych
metod
syntezy tych połączeo. Ponadto związki
organiczne zawierad mogą atomy innych
pierwiastków, takich jak wodór, tlen, azot,
fosfor, krzem oraz siarkę.
2

Historia chemii organicznej
Friedrich Wöhler
W
roku
1828
Friedrich
Wöhler
przeprowadził syntezę mocznika ,
będącego
składnikiem
moczu
z
wykorzystaniem cyjanianu amonu
NH
4
OCN.
Reakcja ta stanowiła punkt zwrotny w
historii
chemii
organicznej
i
zapoczątkowała
dalsze
syntezy
coraz
bardziej
skomplikowanych
związków
występujących w naturze.
3

Początki chemii organicznej
Rok 1856 - William Henry Perkin- otrzymał
barwnik organiczny, nazwany później purpurą
Perkina.
Rok 1858- Friedrich August Kekule oraz
Archibald Scott Coupera, wykazali, że
czterowiązalne atomy węgla zdolne są do formowania trójwymiarowej siatki
(struktura diamentu) a dokładny wzór chemiczny danego związku może
zostad oszacowany na podstawie dokładnej analizy reakcji chemicznych,
którym on podlega. Ponadto Kekule jest odkrywcą poprawnej struktury
benzenu.
4
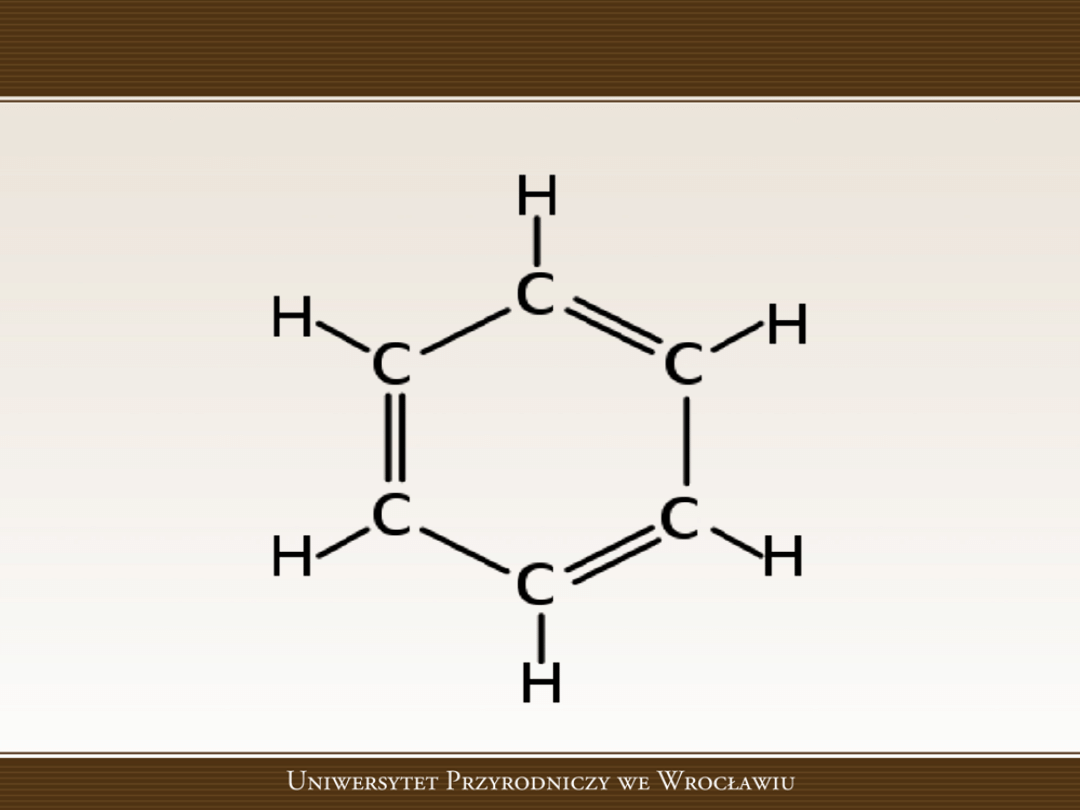
Benzen
5

Właściwości związków organicznych
• W przeważającej większości przypadków wiązania
występujące w związkach organicznych są wiązaniami
kowalencyjnymi
.
• Ponadto możliwe jest formowanie się wiązao
podwójnych
oraz
potrójnych,
których
obecnośd
prowadzi do zwiększenia stopnia nienasycenia związku.
• Znaczna częśd związków organicznych w temperaturach
powyżej 300 °C ulega topnieniu, sublimacji lub
rozkładowi.
6
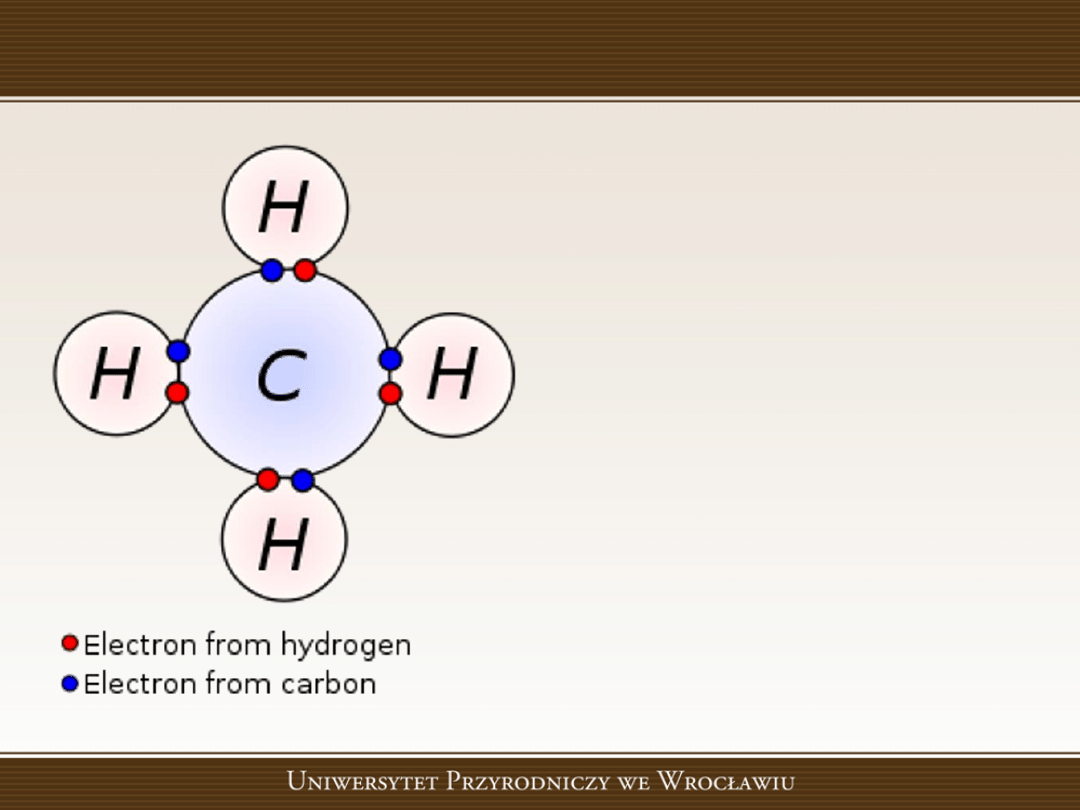
Struktura cząsteczki metanu
•
Rozkład par elektronów
pomiędzy
jądrami
atomowymi
atomów
węgla wodoru.
Należy
pamiętad,
że
wszystkie cząsteczki są
tworami
trójwymiarowymi.
7

Właściwości związków organicznych
• Obojętne związki organiczne wykazują z reguły niską
rozpuszczalnośd
w
wodzie,
a
dużo
lepiej
rozpuszczają się w rozpuszczalnikach organicznych
.
• Wyjątkami od tej reguły są związki organiczne o
charakterze jonowym, takie jak sole kwasów
karboksylowych, czwartorzędowe sole amoniowe lub
aminokwasy oraz niektóre związki o małej masie
molowej, takie jak kwas octowy czy formaldehyd.
8

Właściwości związków organicznych
• Związki
organiczne
rozpuszczają
się
w
rozpuszczalnikach
organicznych,
będących
albo
czystymi
substancjami
chemicznymi
takimi
jak
metanol czy toluen lub ich mieszaninami.
• Rozpuszczalnośd danego związku w określonych
rozpuszczalnikach
zależy
od
występowania
w
cząsteczce tego związku różnych grup funkcyjnych, a
także od budowy szkieletu węglowego.
9

Właściwości związków organicznych
• Dużo związków organicznych może formowad
kryształy.
• Zazwyczaj są to:
kryształy molekularne
kryształy jonowe
kryształy atomowe
10
Klasyfikacja związków organicznych
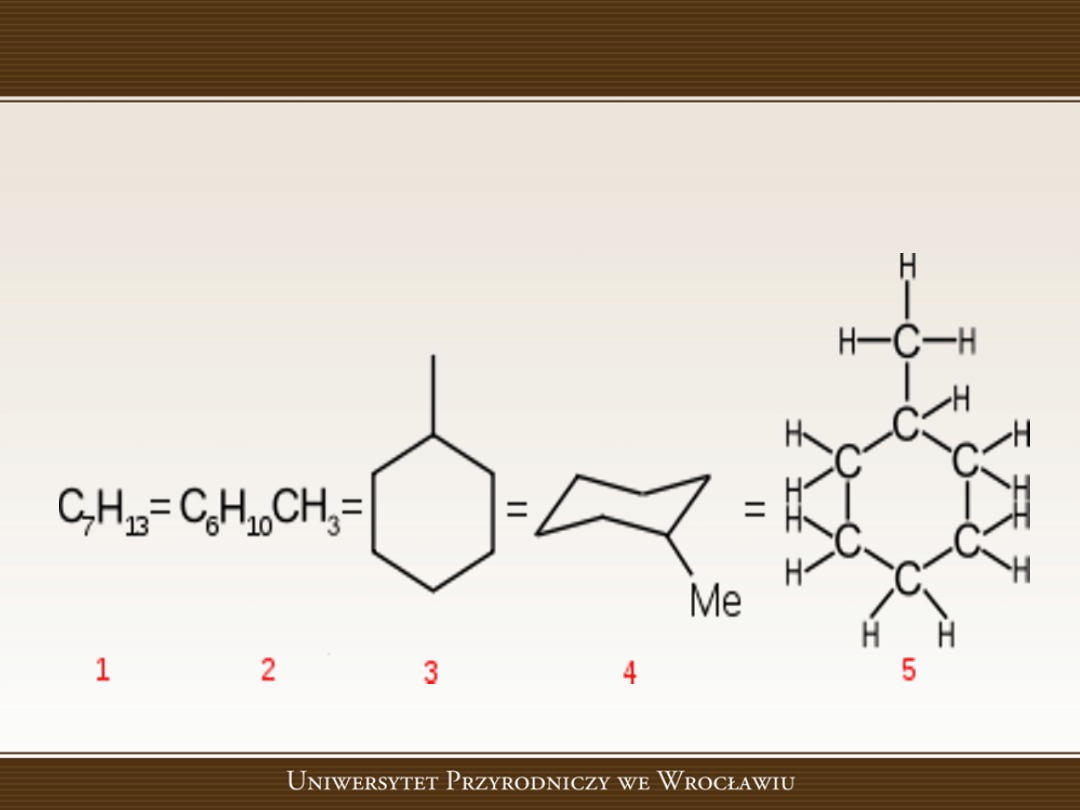
Nomenklatura
1- prosty wzór sumaryczny - METYLOCYKLOHEKSAN
2- rozwinięty wzór sumaryczny
3 –szkieletowy płaski wzór strukturalny
4- szkieletowy przestrzenny wzór strukturalny
5- pełny wzór strukturalny

Nomenklatura
W chemii organicznej zwykle dokonuje się tego przez podanie
wzoru strukturalnego.
Obecnie panuje tendencja do przedstawiania szkieletów
węglowych pod postacią kresek, symbolami oznacza się
jedynie atomy inne niż węgla i wodoru oraz grupy funkcyjne.
Zaistniała potrzeba opracowania uniwersalnej nomenklatury,
pozwalającej na nazwanie każdego związku organicznego,
niezależnie od stopnia skomplikowania jego cząsteczki.
IUPAC-
International Union of Pure and Applied
Chemistery - Międzynarodowa Unia Chemii Czystej i
Stosowanej)

Nomenklatura - IUPAC
Z powodu różnorodności związków organicznych
(zwłaszcza produktów naturalnych) w ramach
IUPAC powołano specjalną jednostkę nazwaną
Międzynarodową Unią Biochemii i Biologii
Molekularnej
, IUBMB w celu zajęcia się tym
problemem. W połowie XX wieku IUPAC
zaczęła rekomendowad bardziej uproszczone
nazewnictwo.

Nomenklatura
Metan
CH
4 zapis
CH
4
Etan C
2
H
6
inny zapis
CH
3
CH
3
Propan
C
3
H
8 zapis
CH
3
CH
2
CH
3
Butan
C
4
H
10 zapis
CH
3
CH
2
CH
2
CH
3
Pentan C
5
H
12 zapis
CH
3
(CH
2
)
3
CH
3
Heksan
C
6
H
14 zapis
CH
3
(CH
2
)
4
CH
3
Heptan
C
7
H
16 zapis
CH
3
(CH
2
)
5
CH
3

Chemia organiczna- definicja
CHEMIA ORGANICZNA – CHEMIA ZWIĄZKÓW
PIERWIASTKA WĘGLA
WYJĄTKI: TENEK WĘGLA(II) TLENEK WĘGLA (IV)
KWAS WĘGLOWY + SOLE KWASU WĘGLOWEGO

CZĄSTECZKA - izomeria
Pod pojęciem izomerii (iso-mer - taki sam skład) rozumiemy
zjawisko występowania różnych związków, o różnych
właściwościach chemicznych i fizycznych a o takim samym
składzie pierwiastkowym i masie cząsteczkowej
. Podziału
izomerii na typy i rodzaje dokonujemy w oparciu o rodzaj
różnic
między
izomerami.
Bez
względu
jednak
na
zastosowany podział izomerami nazwad możemy jedynie
związki
o
takim
samym
składzie
pierwiastkowym
(jakościowym i ilościowym - identyczny wzór sumaryczny) i o
różnych właściwościach chemicznych lub fizycznych.

Izomery
Izomery strukturalne różnią się wzajemnymi
powiązaniami między atomami wchodzącymi
w skład cząsteczki, izomery przestrzenne mają
identyczna budowę jeśli chodzi o powiązania
między
atomami
-
jednak
różne
jest
usytuowanie
przestrzenne
tych
atomów
względem siebie. Podział na poszczególne
grupy ma jak zwykle charakter umowny.
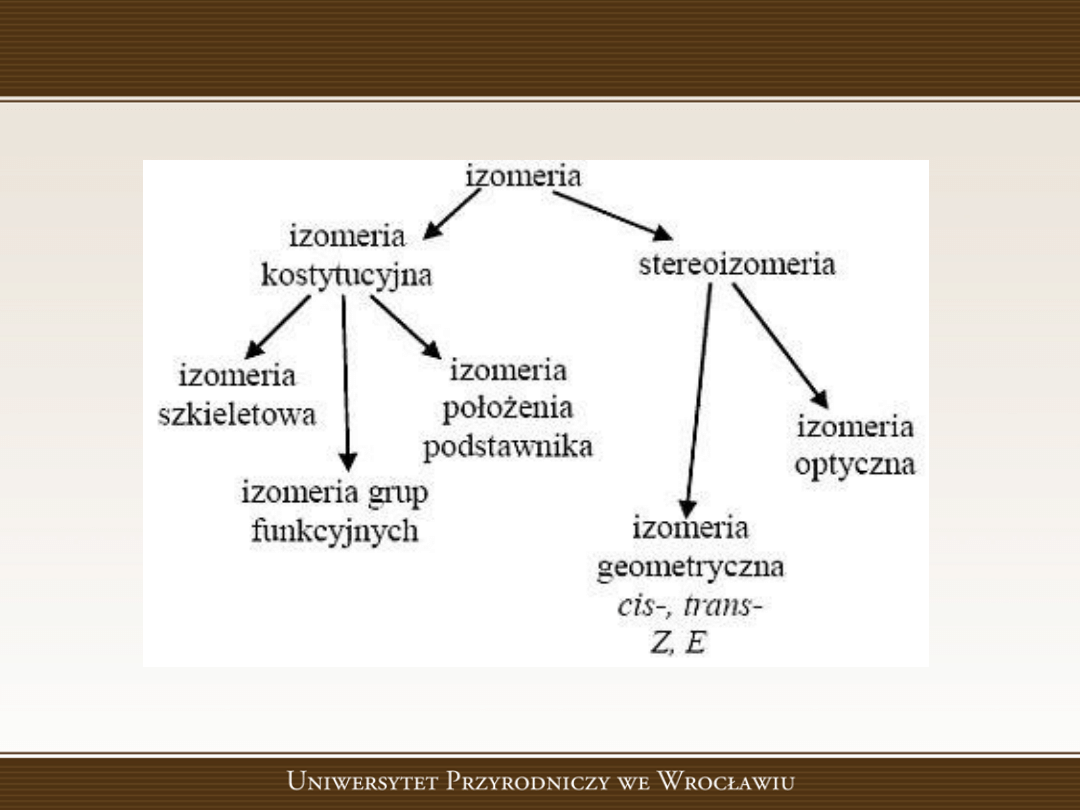
Rodzaje izomerii
Izomeria
Izomeria konstytucyjna dotyczy konstytucji
cząsteczki, czyli kolejności powiązania atomów
ze sobą.
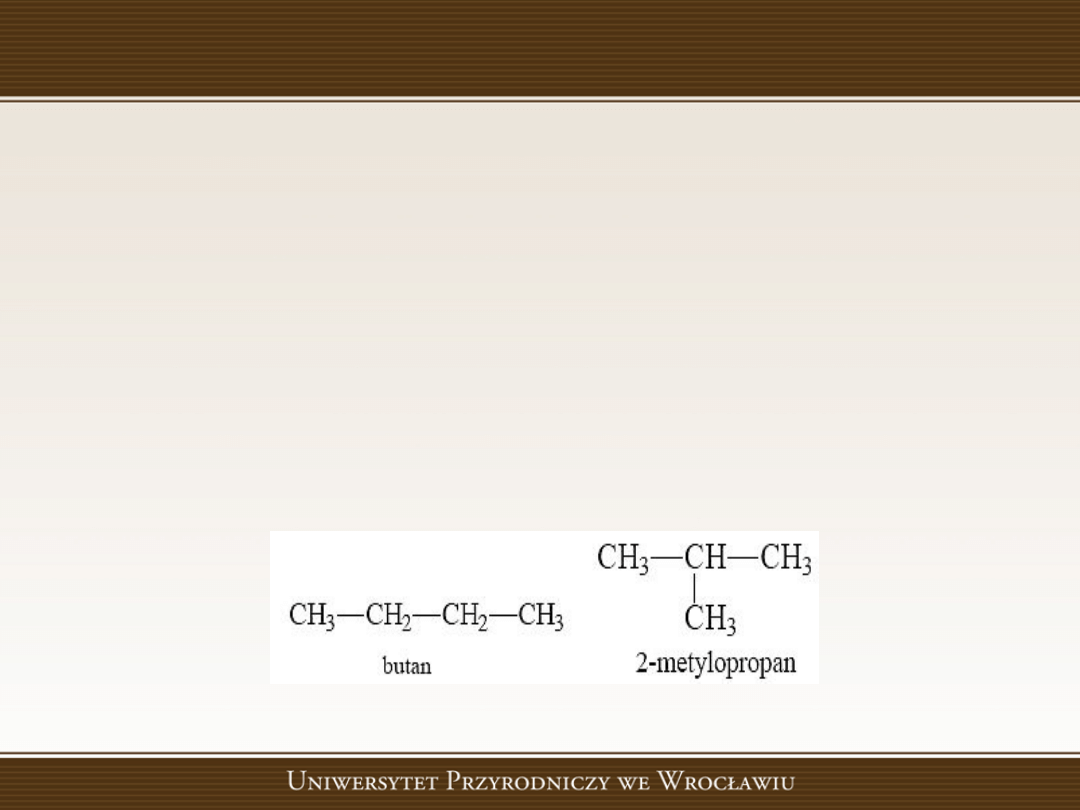
Izomeria szkieletowa dotyczy związków
różniących się szkieletem węglowym.

Izomeria położenia podstawnika
Kiedy
szkielety
węglowe
związków
są
identyczne, a podstawniki są połączone z
różnymi atomami węgla, to mamy do czynienia
z izomerią położenia podstawnika
.
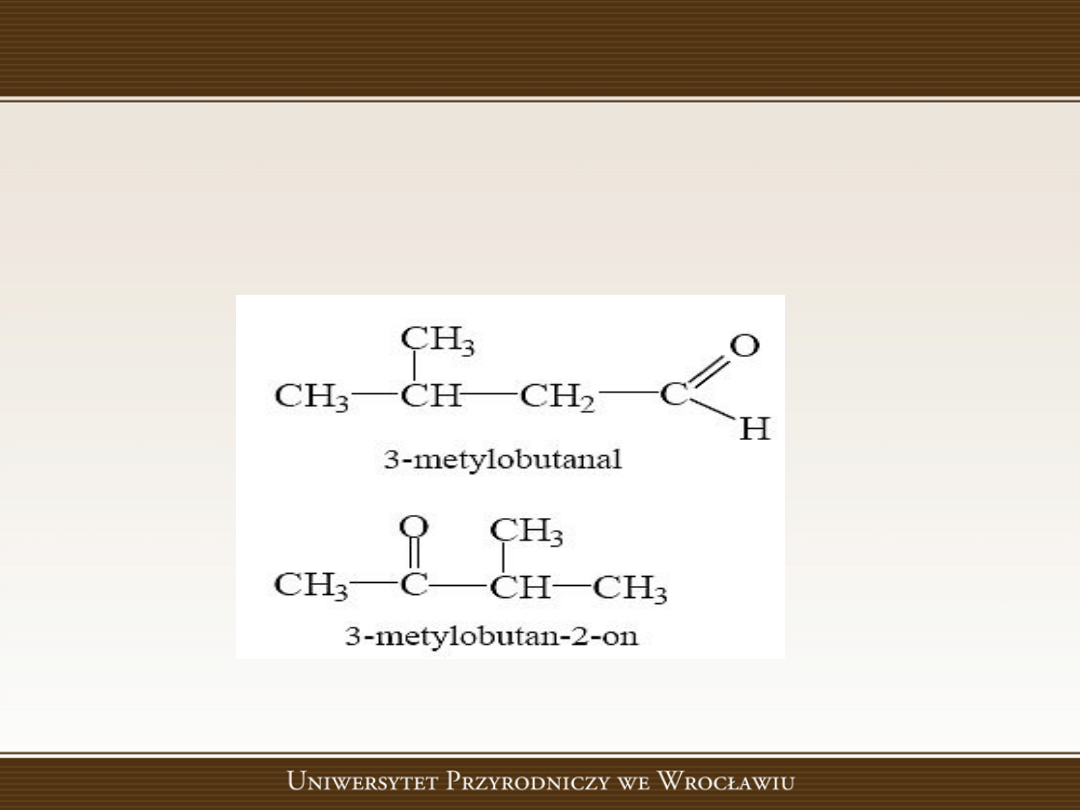
Izomeria grup funkcyjnych
Gdy izomery należą do różnych szeregów homologicznych,
czyli różnią się grupą funkcyjną, to mamy do czynienia z
izomerią grup funkcyjnych.

Wzory związków i szereg homologiczny
• Budowa związków organicznych określona jest przez
następujące zasady:
-
wszystkie atomy węgla w tych związkach są czterowartościowe
- atomy węgla łączą się ze sobą w łaocuchy proste i rozgałęzione
o dowolnej długości oraz w pierścienie,
- atomy węgla łączą się ze sobą i z innymi atomami, tworząc kowalencyjne
wiązania pojedyncze (wiązanie σ), podwójne (jedno wiązanie σ i jedno
wiązanie π) oraz potrójne (jedno wiązanie σ i dwa wiązania π),
- każdy związek organiczny charakteryzuje się właściwym sobie wzorem
określającym rodzaj i liczbę atomów oraz konstytucją cząsteczki, czyli
sposobem powiązania tych atomów ze sobą.

Szereg homologiczny
Wzory związków stosowane w chemii organicznej to,
podobnie jak w chemii nieorganicznej, wzory sumaryczne,
empiryczne (elementarne) i strukturalne, ale również wzory
strukturalne uproszczone (półstrukturalne, grupowe) oraz
wzory szkieletowe.
Szereg homologiczny to szereg związków o podobnych
właściwościach chemicznych, w którym każdy następny
związek jest większy od poprzedniego o grupę metylenową -
CH
2
-.
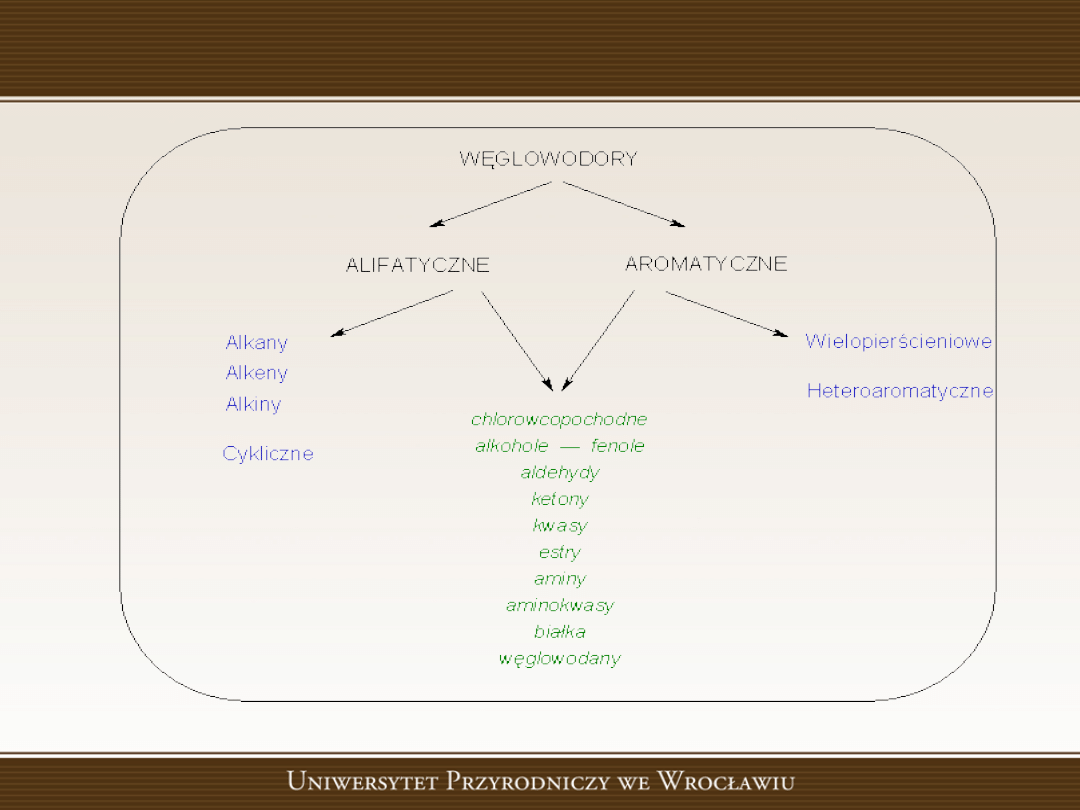
Podział węglowodorów
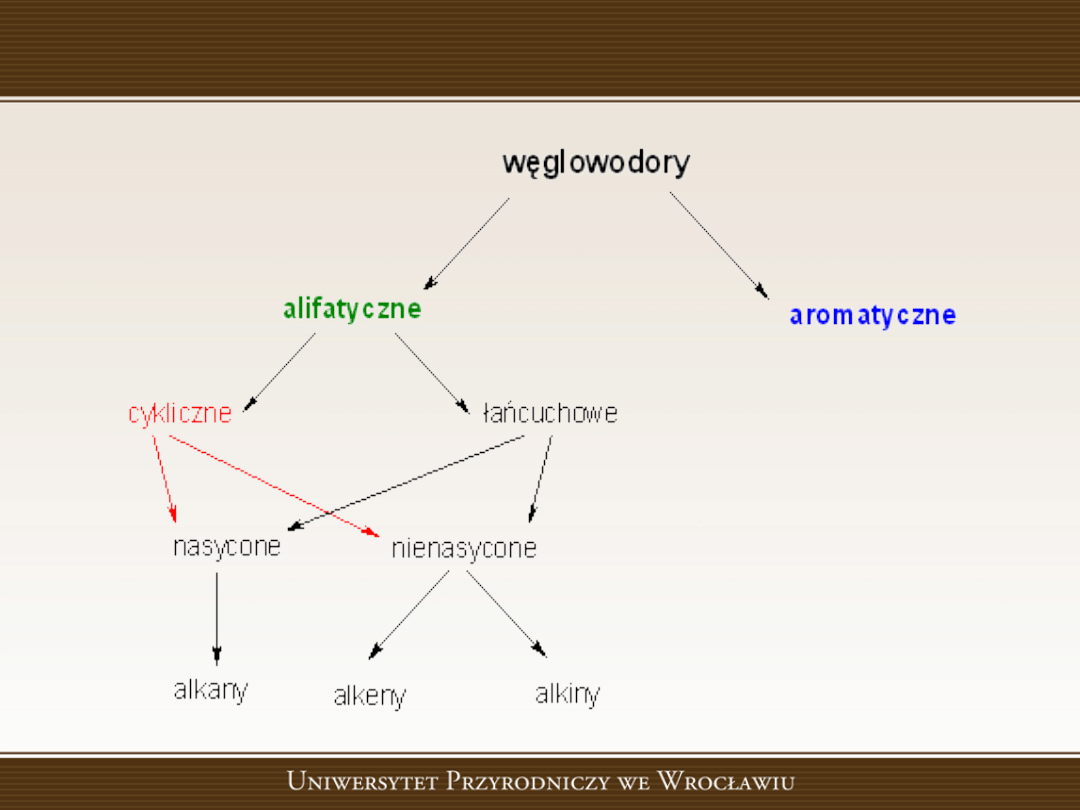
Węglowodory

Węglowodory nasycone
Węglowodory to związki węgla z wodorem.
Alkany
(parafiny,
węglowodory
alifatyczne
nasycone).
Wzór ogólny: C
n
H
2n+2
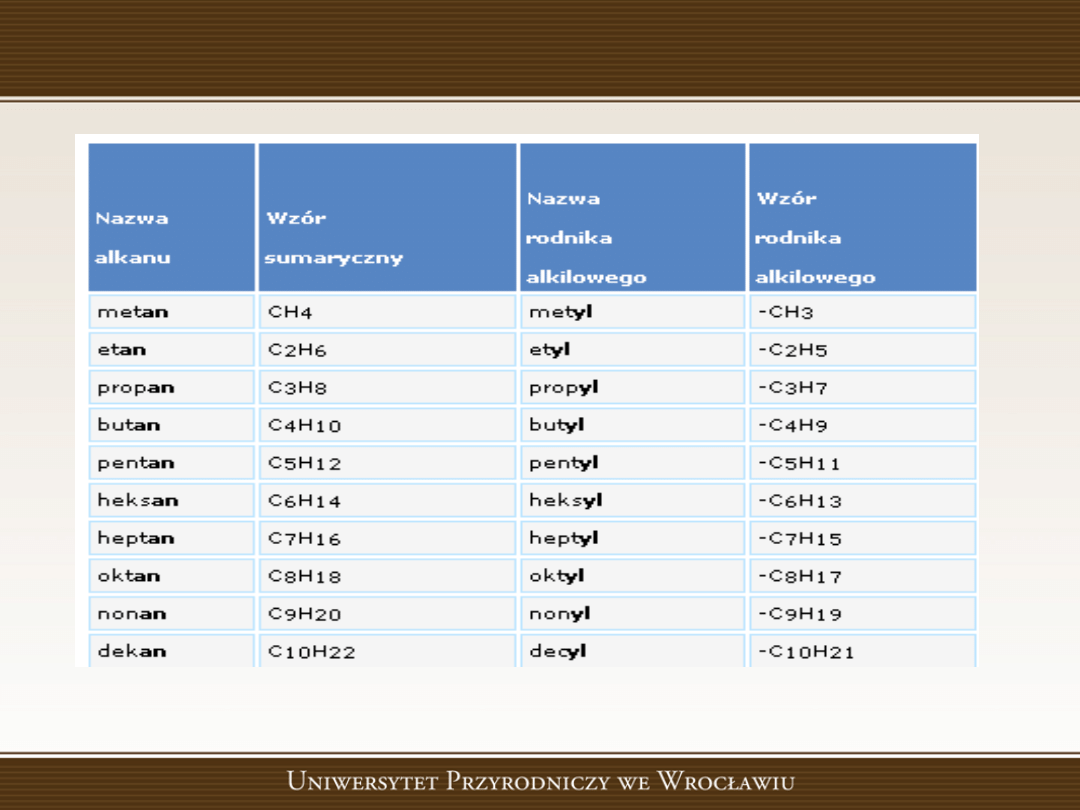
Szereg homologiczny alkanów
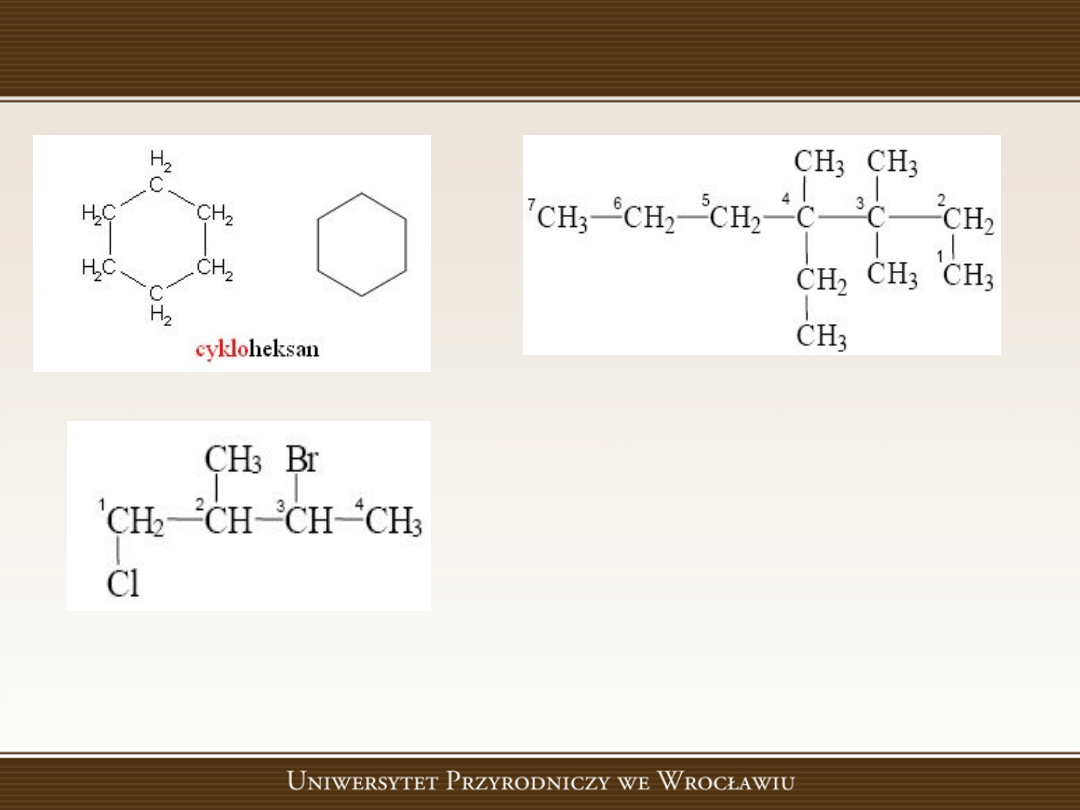
Przykład
4-etylo-3,3,4-trimetyloheptan
3-bromo-1-chloro-2-metylobutan

Alkany
•
, parafiny, nasycone węglowodory alifatyczne, o
ogólnym wzorze C
n
H
2n+2
(n - liczba naturalna). Alkany tworzą
szereg homologiczny. Mogą tworzyd łaocuchy proste i
rozgałęzione (odpowiednio nazywa się je n- lub izo-). Liczba
izomerów alkanów jest bardzo duża, np. dla wzoru C
7
H
16
wynosi 9, zaś dla C
19
H
42
-366 319; różnią się one
właściwościami nieznacznie i ich rozdzielenie jest nieraz
niemożliwe. Pierwsze cztery alkany (mające w cząsteczce 1-4
atomów węgla) są gazami, następnych 11 cieczami, wyższe są
ciałami stałymi. Ich cząsteczki są niepolarne.
nie
rozpuszczają się w wodzie.

Węglowodory nienasycone
• Alkeny (olefiny, węglowodory nienasycone z
jednym wiązaniem podwójnym).
Wzór ogólny: C
n
H
2n

Tworzenie nazw alkenów
W nazwach alkenów rdzeo pozostaje bez zmian (jak
w nazwach alkanów), natomiast koocówka zostaje
zmieniona na -en, np.
Nazwy bardziej rozbudowanych alkenów tworzy się
podobnie jak nazwy alkanów.
Należy jednak
pamiętad, że kierunek numerowania atomów węgla
w głównym łaocuchu musi byd taki, aby wiązanie
podwójne miało jak najniższy lokant. Lokant ten
umieszcza
się
przed
koocówką
-en.

Tworzenie nazw alkenów
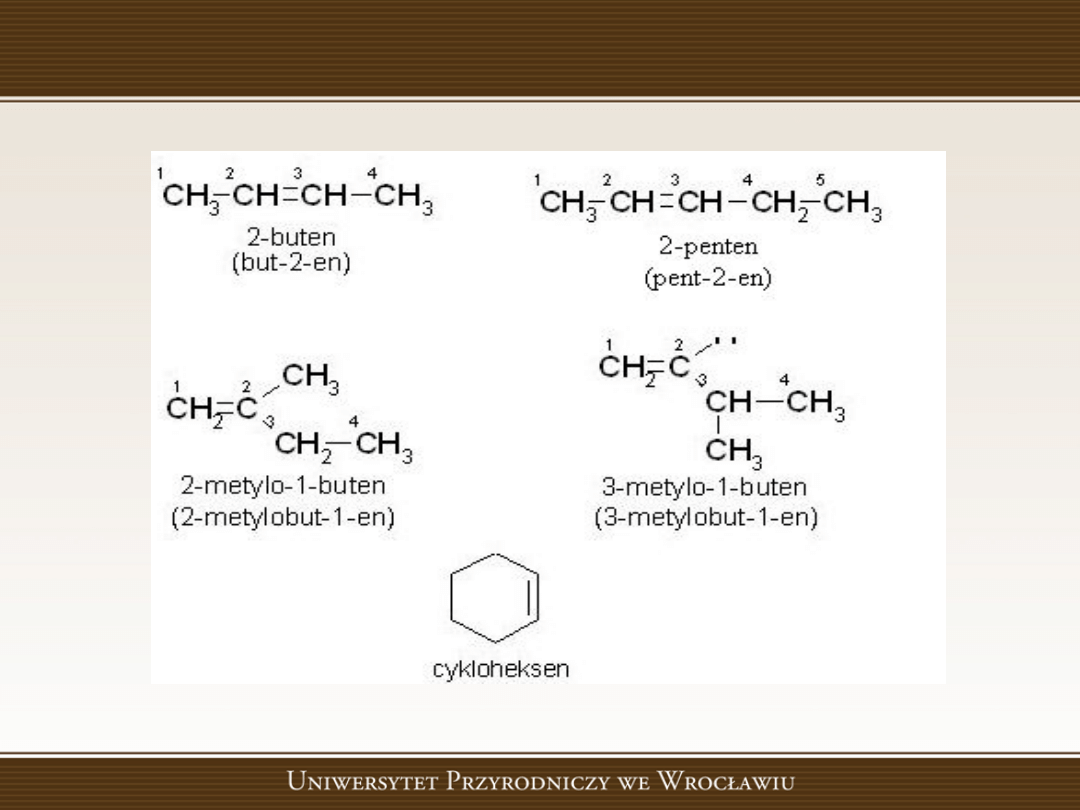
Przykłady

Otrzymywanie alkenów
• Alkeny otrzymuje się przede wszystkim z ropy
naftowej (destylacja frakcyjna ropy, a
następnie kraking katalityczny).
Można je również otrzymad w laboratorium w
reakcjach eliminacji.

Alkiny
Wzór ogólny: C
n
H
2n-2
W nazwach alkinów rdzeo pozostaje bez
zmian (jak w nazwach alkanów), natomiast
koocówka zostaje zmieniona na –yn.

Tworzenie nazw alkinów

Alkiny
• Alkiny, acetyleny, nienasycone węglowodory alifatyczne, o
ogólnym wzorze C
n
H
2n-2
(n jest liczbą naturalną większą od 1).
Alkiny tworzą szereg homologiczny.
• Cząsteczka alkinów zawiera wiązanie potrójne między
atomami węgla o hybrydyzacji sp
3
. Acetylen, metylo- i
etyloacetyleny są gazami, średnie alkiny - cieczami, wyższe
alkiny (od C
16
) - ciałami stałymi.
• Alkiny wchodzą łatwiej niż alkeny w reakcje addycji.
Specyficzne dla alkinów są reakcje podstawienia, w których
otrzymuje
się
acetylenki.
Alkiny
ulegają
reakcjom
polimeryzacji. Otrzymywanie homologów acetylenu: reakcja
chlorowcoalkanów na acetylenki, odwodornienie alkenów.
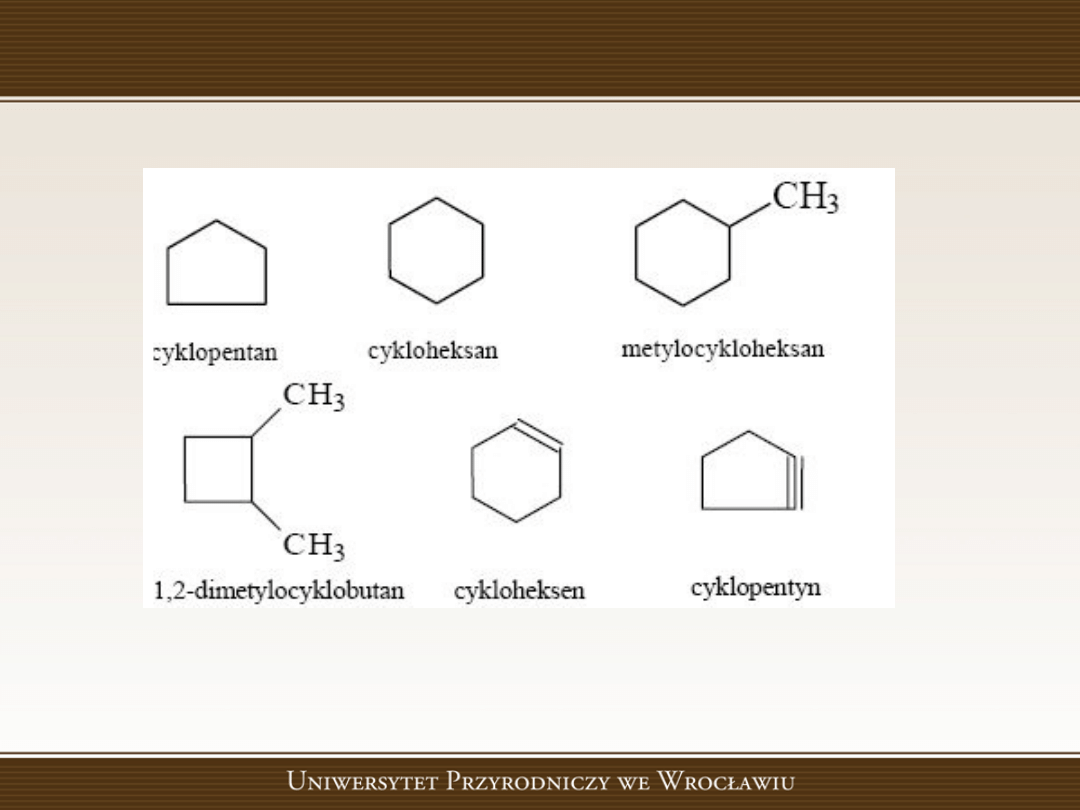
Węglowodory alicykliczne

Węglowodory aromatyczne
Związki aromatyczne to substancje, których
cząsteczki mają budowę pierścieniową i zawierają
wiązania zdelokalizowane, które łączą wszystkie
atomy tworzące pierścieo.
Przedstawicielami związków aromatycznych są
benzen oraz jego pochodne (np. ksyleny, tolueny),
antracen, naftalen.
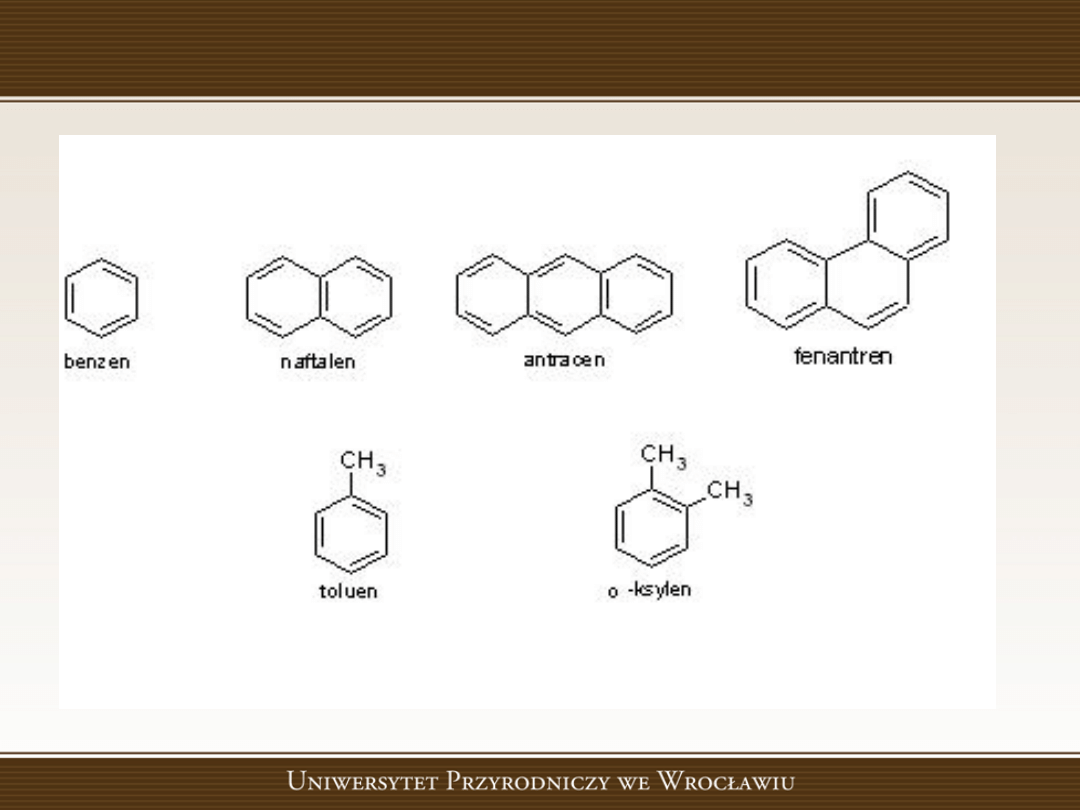
Przykłady
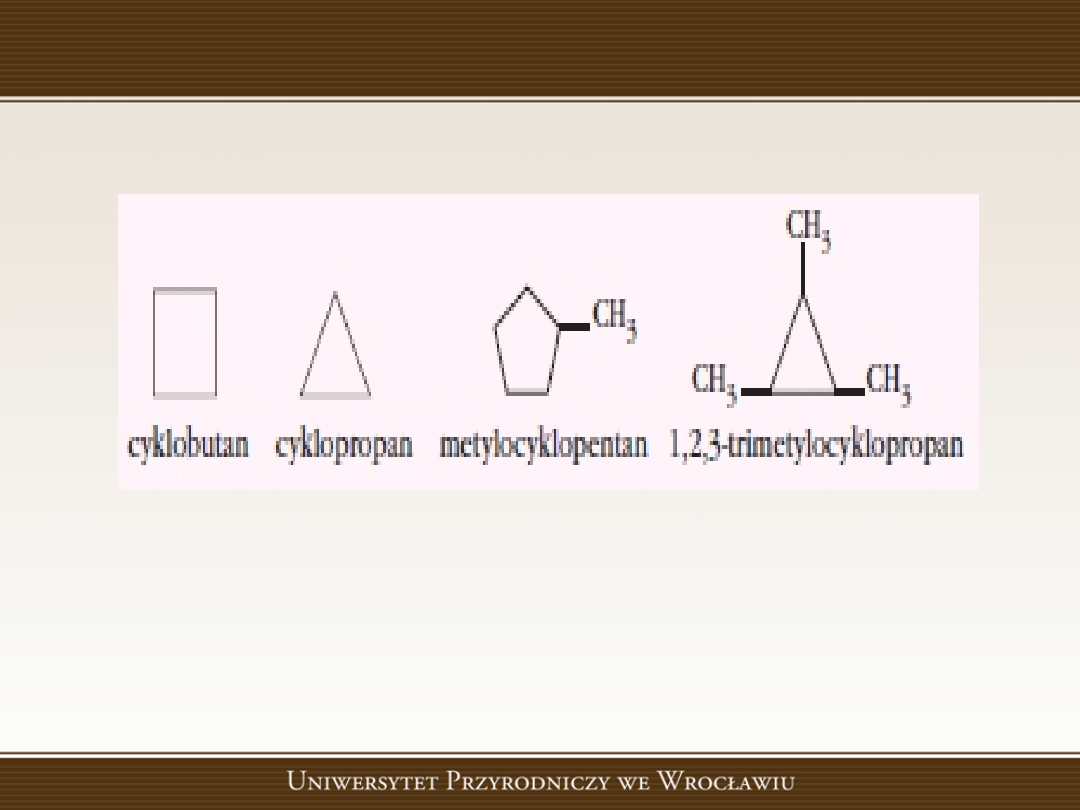
Węglowodory cykliczne

Związki heterocykliczne
Związki heterocykliczne to związki zawierające w
pierścieniu aromatycznym oprócz atomów węgla
również atomy innych pierwiastków (azotu, siarki lub
tlenu).
Pierścienie aromatyczne znajdują się również w
cząsteczkach zasad purynowych i pirymidynowych
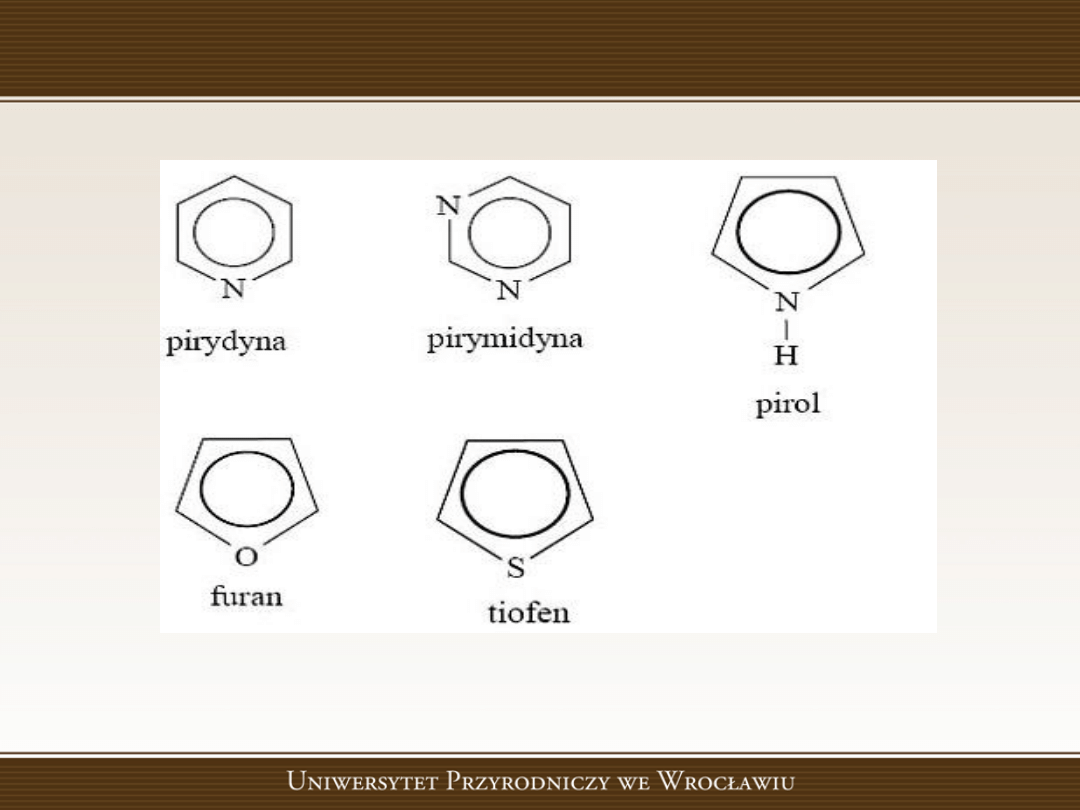
Związki heterocykliczne- przykłady

Jednofunkcyjne pochodne węglowodorów
• Aldehydy
• Ketony
• Alkohole
• Fenole
• Amidy
• Aminy
• Estry
• Kwasy karboksylowe
• Mydła
• Tłuszcze

Aldehydy
• Aldehydy,
związki
organiczne
zawierające
w
cząsteczce grupę karbonylową >C=O połączoną
przynajmniej z jednym atomem wodoru i jednym
podstawnikiem węglowodorowym. Aldehydy są
cieczami lub ciałami stałymi, z wyjątkiem aldehydu
mrówkowego, który jest gazem w temperaturze
pokojowej.
• Najważniejsze metody otrzymywania aldehydów: odwodornienie alkoholi
pierwszorzędowych, ozonoliza alkenów, hydratacja alkinów, utlenianie 1,2
-
dioli
octanem
ołowiu(II)
lub
kwasem
jodowym(VII).
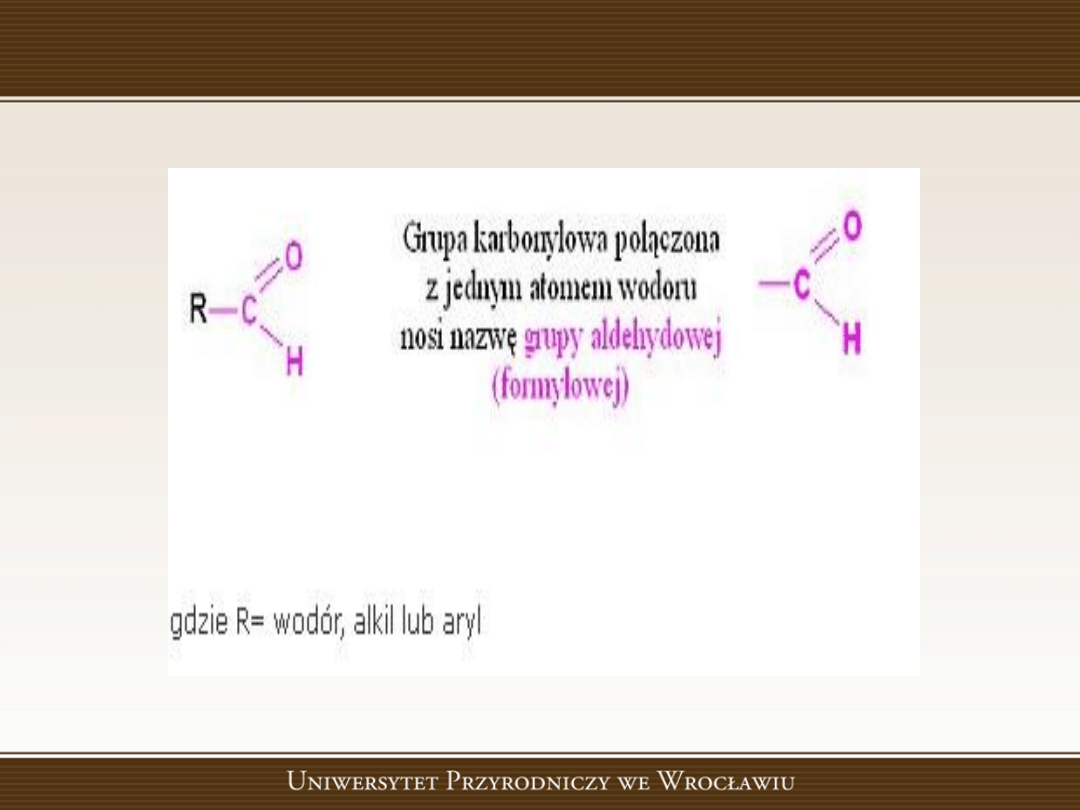
Aldehydy
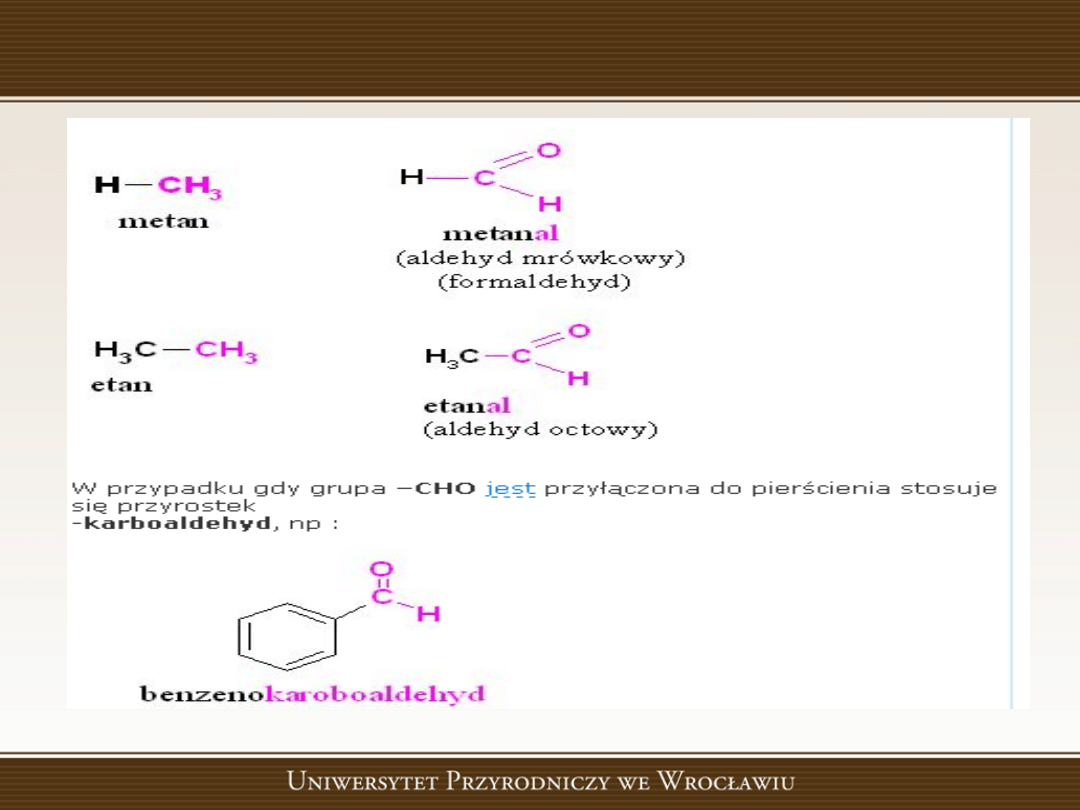
Aldehydy- przykłady

Ketony
Ketony – grupa związków organicznych
zawierających grupę ketonową, tj. grupę
karbonylową (C=O) połączoną z dwoma
atomami
węgla.
Proste
ketony,
będące
monokarbonylowymi pochodnymi alkanów,
noszą nazwę alkanonów i mają wzór ogólny
C
n
H
2n+2
CO

Przykłady ketonów
• Aceton ( propanon) C
3
H
6
O
• BMK- keton benzylowo-metylowy
• Benzochinon
• Ketozy

Alkohole
• Alkohole to związki zawierające grupę funkcyjną –OH
związaną z tetraedrycznym atomem węgla. Grupa –OH nosi
nazwę grupy hydroksylowej.
• R-OH
to
ogólny
wzór
alifatycznych
alkoholi
monohydroksylowych.
• Istnieją różnorodne sposoby klasyfikacji alkoholi, np. - w zależności od
tego, czy grupa –OH związana jest z pierwszorzędowym, drugorzędowym,
czy trzeciorzędowym atomem węgla wyróżniamy alkohole I-rzędowe, II-
rzędowe i odpowiednio III-rzędowe.

Przykłady alkoholi

Fenole
Fenole – związki organiczne zawierające grupy hydroksylowe
związane bezpośrednio z atomami węgla w pierścieniu
aromatycznym
(w
przeciwieostwie
do
alkoholi
aromatycznych, np. alkoholu benzylowego, w których grupa
hydroksylowa przyłączona jest do alkilowego atomu węgla).
Wykazują znacznie większą kwasowośd niż alkohole i mogą
tworzyd z mocnymi zasadami sole, fenolany.
Najprostszym fenolem z jedną grupą hydroksylową
jest fenol.
Ar-OH fenol
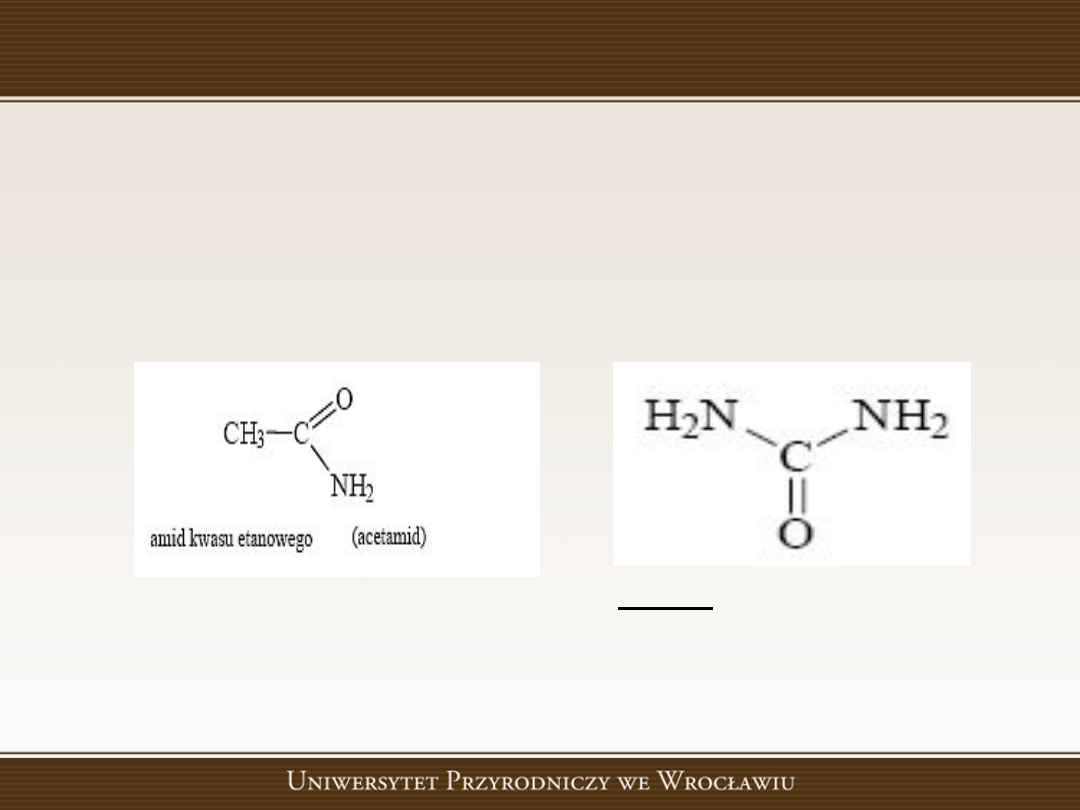
Amidy - pochodne kwasów karboksylowych
Pochodne kwasów karboksylowych, w
cząsteczkach których grupa aminowa (-NH
2
)
zastąpiła grupę hydroksylową (-OH).
Mocznik (diamid kwasu węglowego)
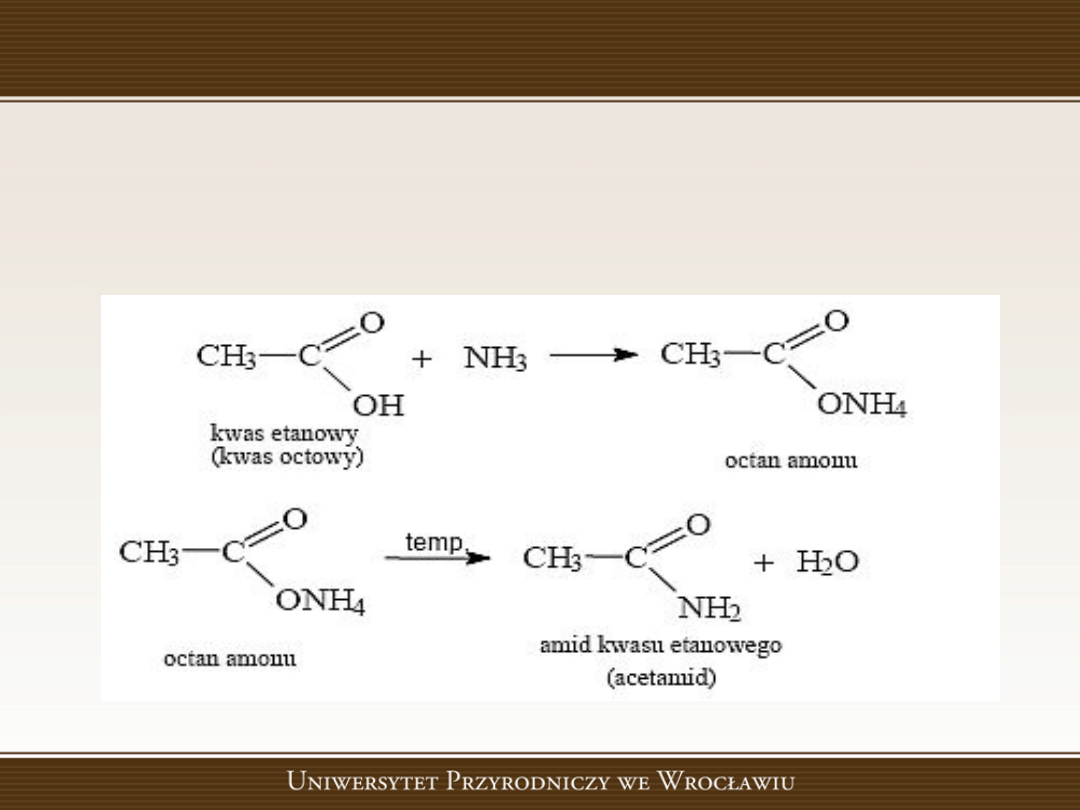
Amidy - pochodne kwasów karboksylowych
• Otrzymywanie
- w wyniku przeprowadzenia reakcji

Aminy - pochodne węglowdorów
To pochodne węglowodorów zawierające w
swojej cząsteczce grupę aminową.
Można je również traktowad jako pochodne
amoniaku.

Rzędowośd amin i przykłady
Rzędowośd amin określamy na podstawie
liczby atomów węgla połączonych z atomem
azotu.

Estry
• Estry powstają w reakcji kwasów karboksylowych z
alkoholami. Jako katalizator używany jest kwas
siarkowy (VI) - jako substancja silnie higroskopijna,
wiąże także wydzielającą wodę, uniemożliwiając tym
samym odwrotną reakcję, czyli rozpadu estru pod
wpływem
wody
na
alkohol
i
kwas.
Nazwy estrów tworzy się podobnie jak nazwy soli. Po nazwie reszty
kwasowej dodaje się nazwę podstawionej grupy węglowodorowej.
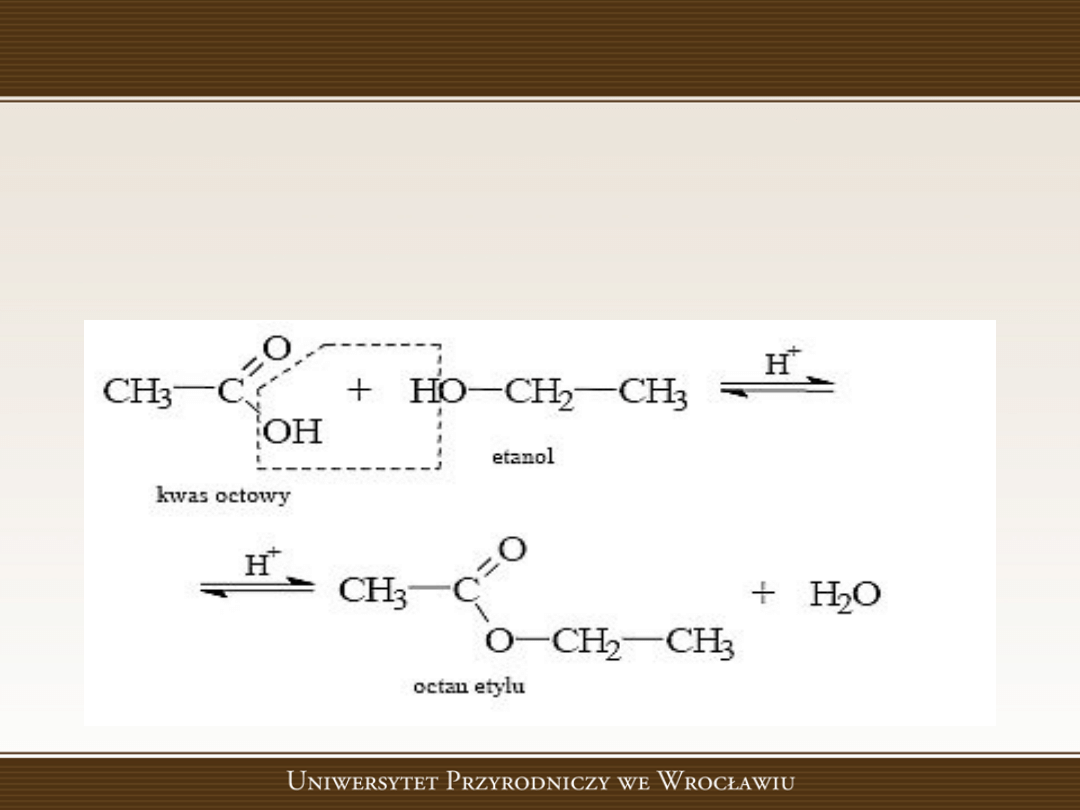
Estry
• Otrzymywanie
w reakcji estryfikacji, czyli reakcji kwasów z
alkoholami
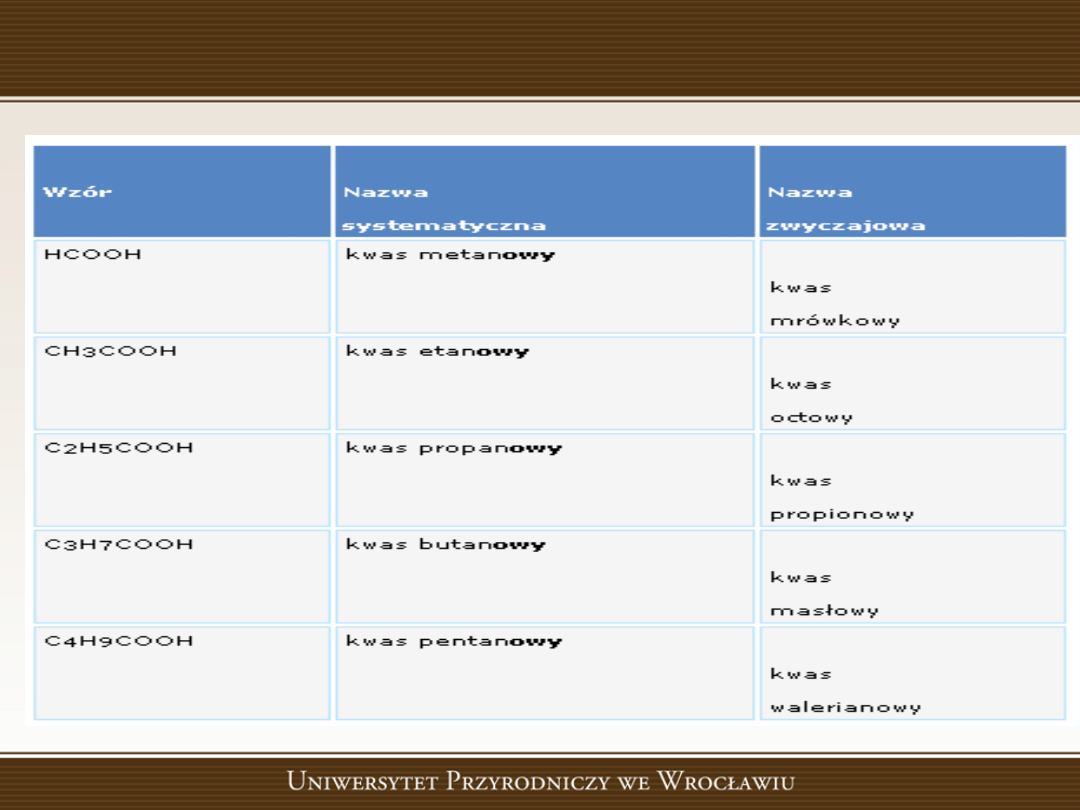
Kwasy karboksylowe – niższe
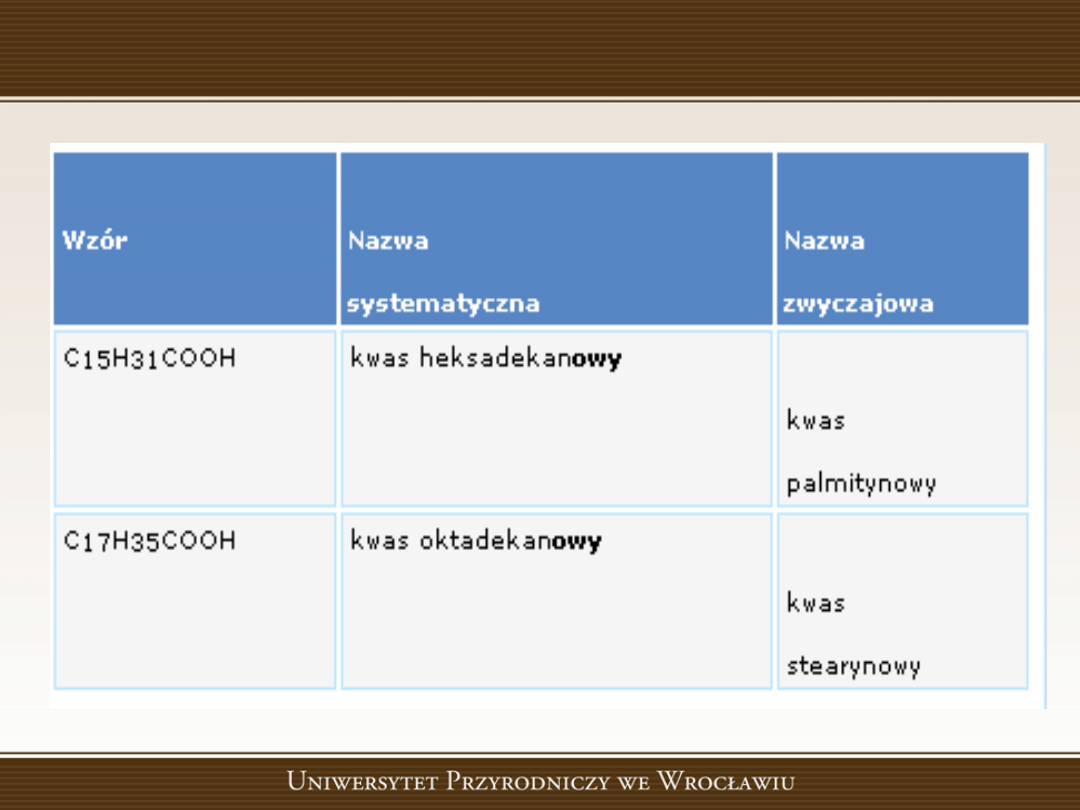
Kwasy karboksylowe – wyższe
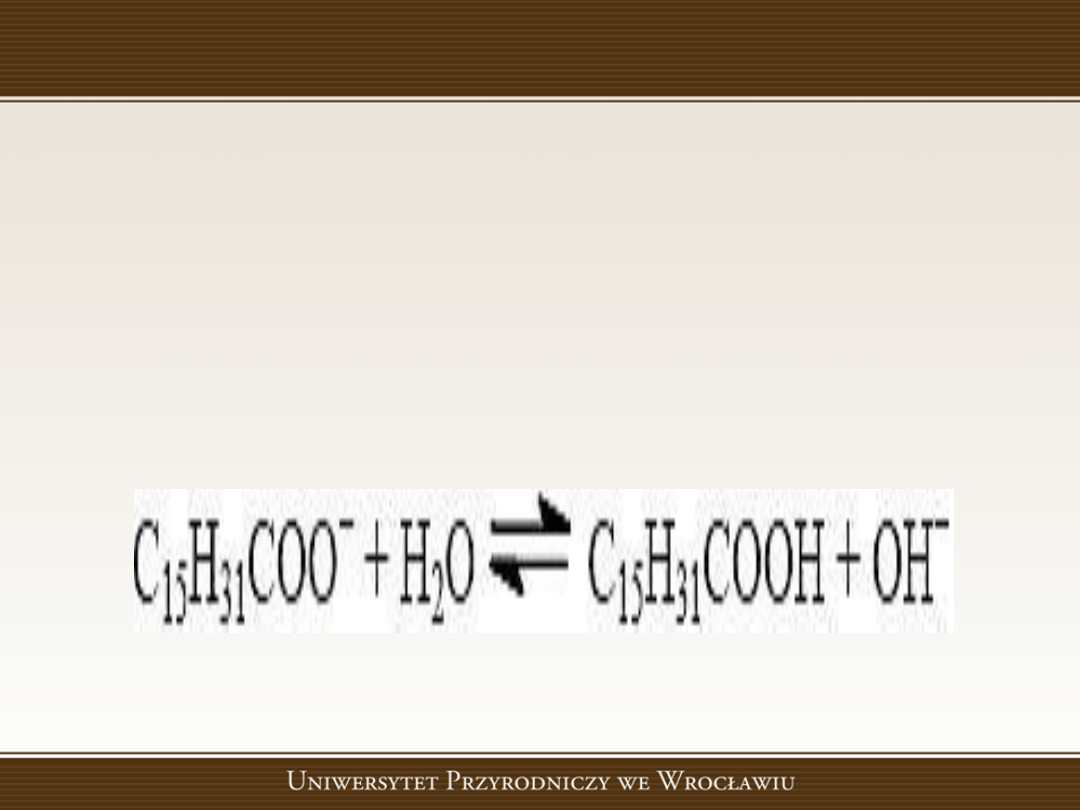
Mydła
Mydła (sole sodowe lub potasowe wyższych
kwasów karboksylowych), jako sole słabych
kwasów i mocnych zasad, w roztworach
wodnych ulegają hydrolizie, nadając tym
roztworom odczyn zasadowy:

Tłuszcze
To estry różnych alkoholi i kwasów
tłuszczowych. Biorąc pod uwagę skład można
dokonad ich podziału na:
a) tłuszcze proste – woski i tłuszcze właściwe (zbudowane
wyłącznie z alkoholu i kwasów tłuszczowych),
b) tłuszcze złożone – fosfolipidy i glikolipidy (zawierają
dodatkowo inny składnik, np. resztę kwasu fosforowego(V)
lub cukier).

Tłuszcze
Tłuszcze charakteryzują się następującymi
liczbami:
a) liczba kwasowa – liczba mg KOH potrzebna do zobojętnienia
wolnych kwasów tłuszczowych zawartych w 1 gramie
tłuszczu,
b) liczba jodowa – liczba g I2, która przyłącza się do
nienasyconych kwasów tłuszczowych, zawartych w 100
gramach tłuszczu,
c) liczba zmydlania – liczba mg KOH niezbędna do
przeprowadzenia całkowitej hydrolizy zasadowej 1 grama
tłuszczu.

Typy reakcji zachodzących z udziałem związków organicznych
1. Reakcje substytucji:
• wolnorodnikowej
• elektrofilowej
• nukleofilowej
2. Reakcje addycji elektrofilowej.
3. Reakcje eliminacji.
4. Reakcje polimeryzacji.
5. Reakcje polikondensacji.

Reakcje substytucji wolnorodnikowej
Reakcje substytucji wolnorodnikowej, w
których
następuje
podstawienie
atomu
wodoru lub innego atomu, przebiegające z
udziałem
wolnych
rodników
(drobin
posiadających niesparowany elektron).
Przykład
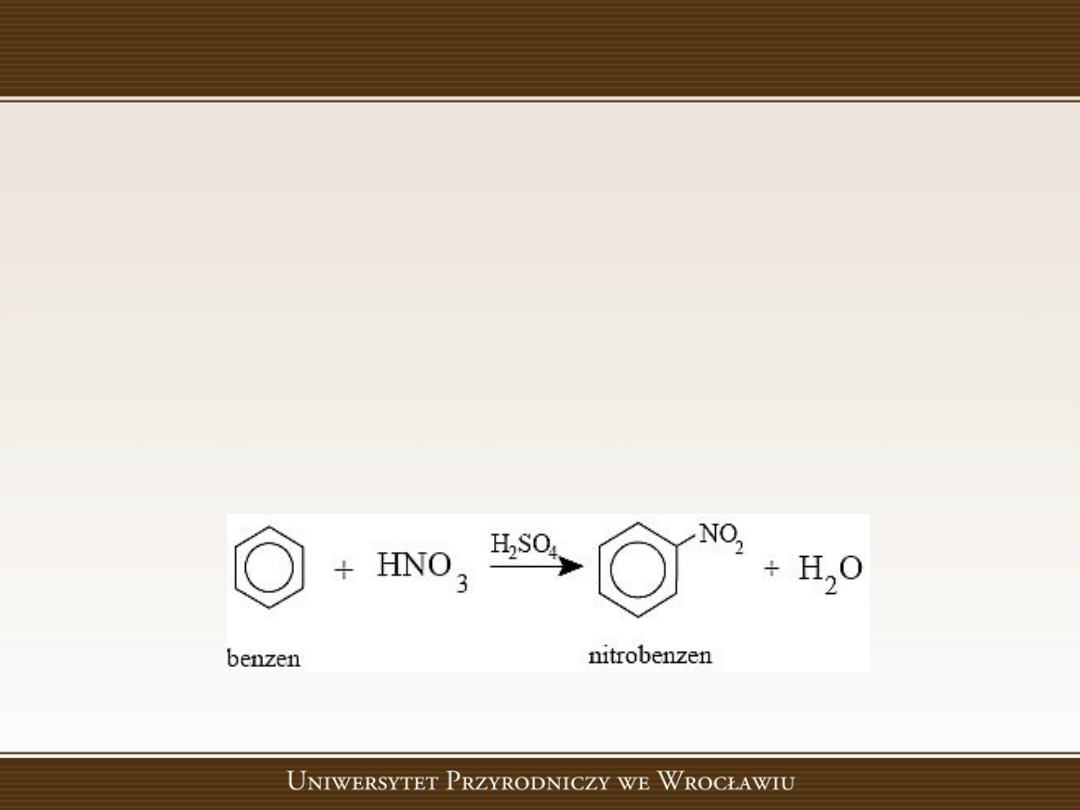
Reakcje substytucji elektrofilowej
Reakcje substytucji elektrofilowej, w których
następuje podstawienie atomu lub grupy
atomów przez czynnik elektrofilowy
(wykazujący powinowactwo do elektronów),
np. jon dodatni.
Przykład
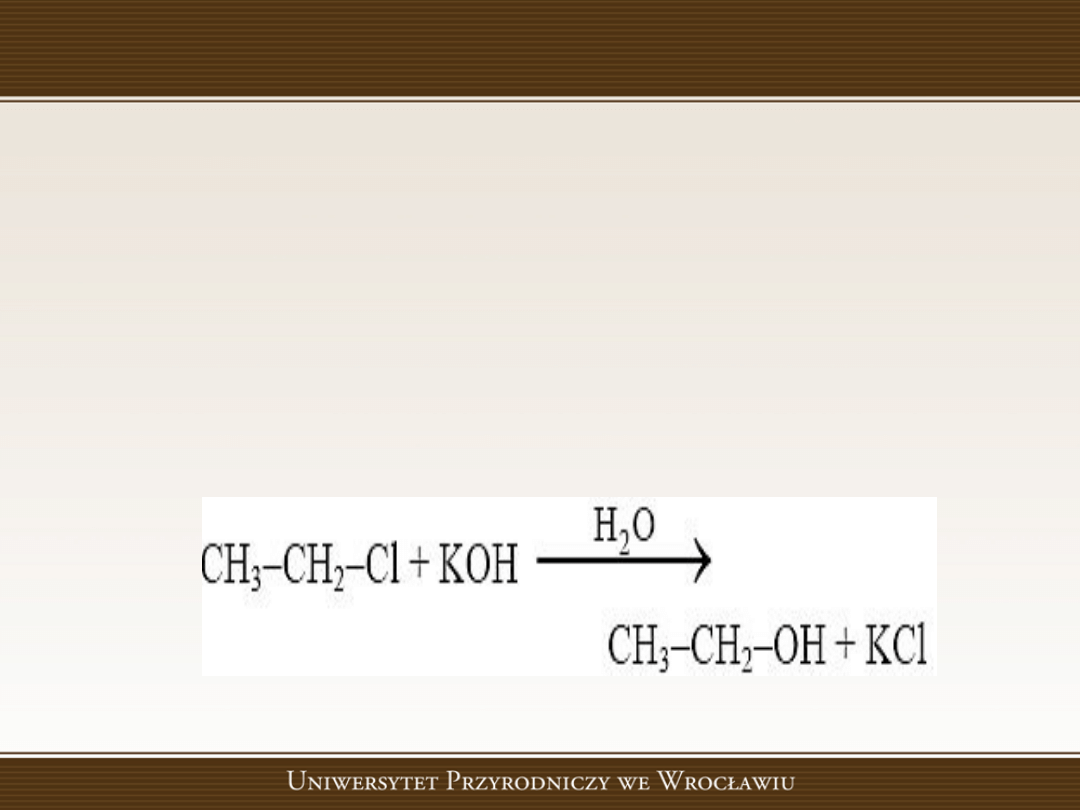
Reakcje substytucji nukleofilowej
Reakcje substytucji nukleofilowej, w których
następuje podstawienie atomu lub grupy
atomów
przez
czynnik
nukleofilowy
(posiadający nadmiar elektronów), np. jon
ujemny.
Przykład

Reakcje addycji elektrofilowej
Reakcje addycji elektrofilowej, w których
następuje przyłączenie do wiązania
wielokrotnego.
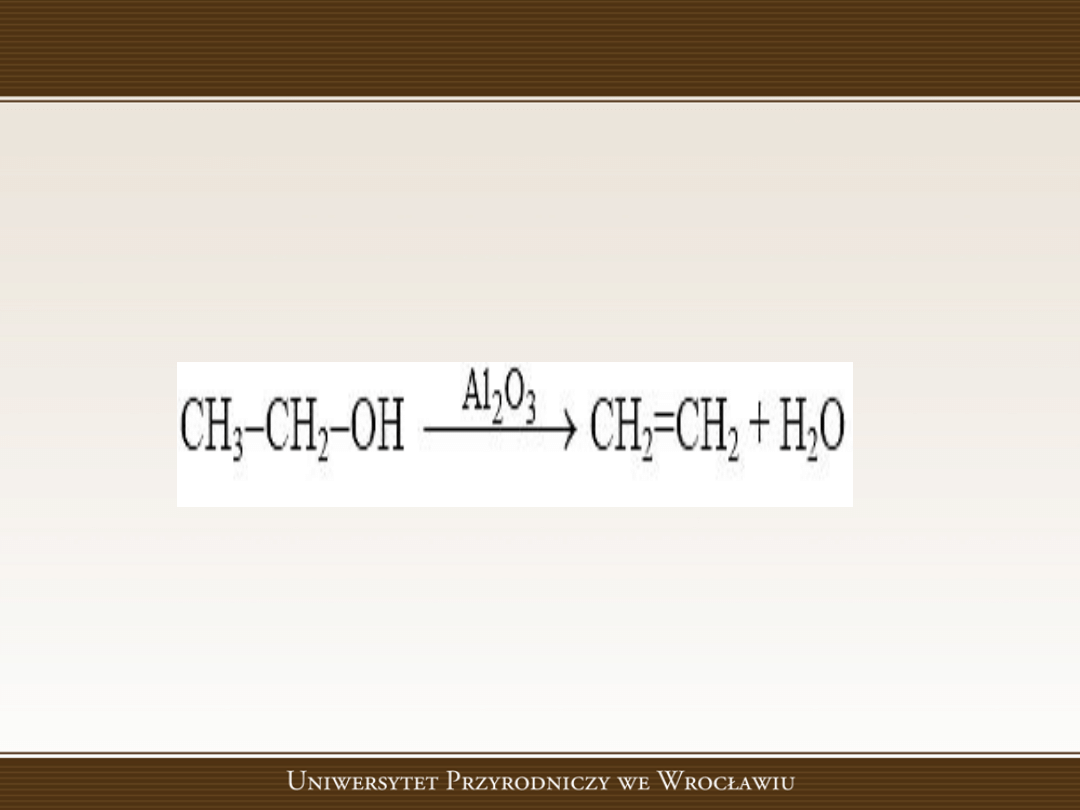
Reakcje eliminacji
Reakcje eliminacji, w których usuwany jest
fragment cząsteczki substratu i w produkcie
tworzy
się
wiązanie
wielokrotne.
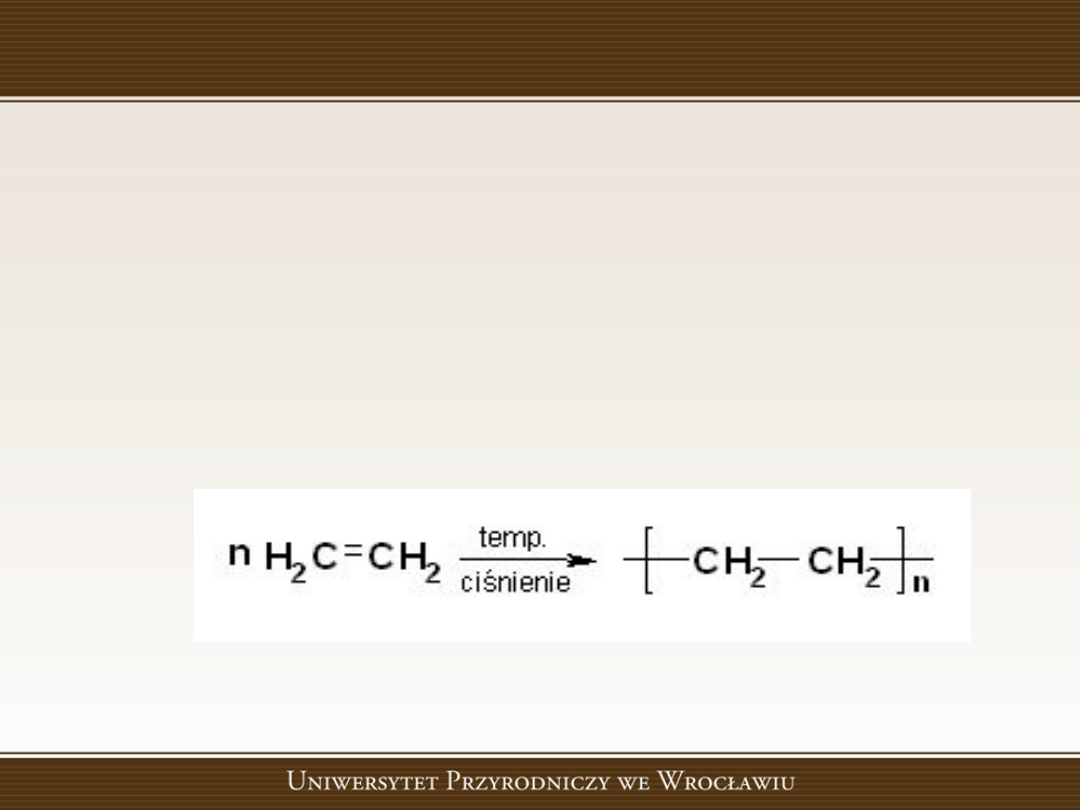
Reakcje polimeryzacji
Reakcje polimeryzacji są to polireakcje zachodzące z
rozerwaniem wiązao podwójnych lub nietrwałego
pierścienia
związku
małocząsteczkowego,
tzw.
monomeru, prowadzące do otrzymania produktu
wielkocząsteczkowego,
tzw.
polimeru,
bez
wydzielania
produktów
ubocznych.

Reakcje polikondensacji
Reakcje polikondensacji to polireakcje polegające na
kondensacji monomerów.
W reakcjach tych, w odróżnieniu od reakcji
polimeryzacji,
zawsze
obok
związku
wielkocząsteczkowego powstaje małocząsteczkowy
produkt uboczny, np. woda, amoniak, chlorowodór.
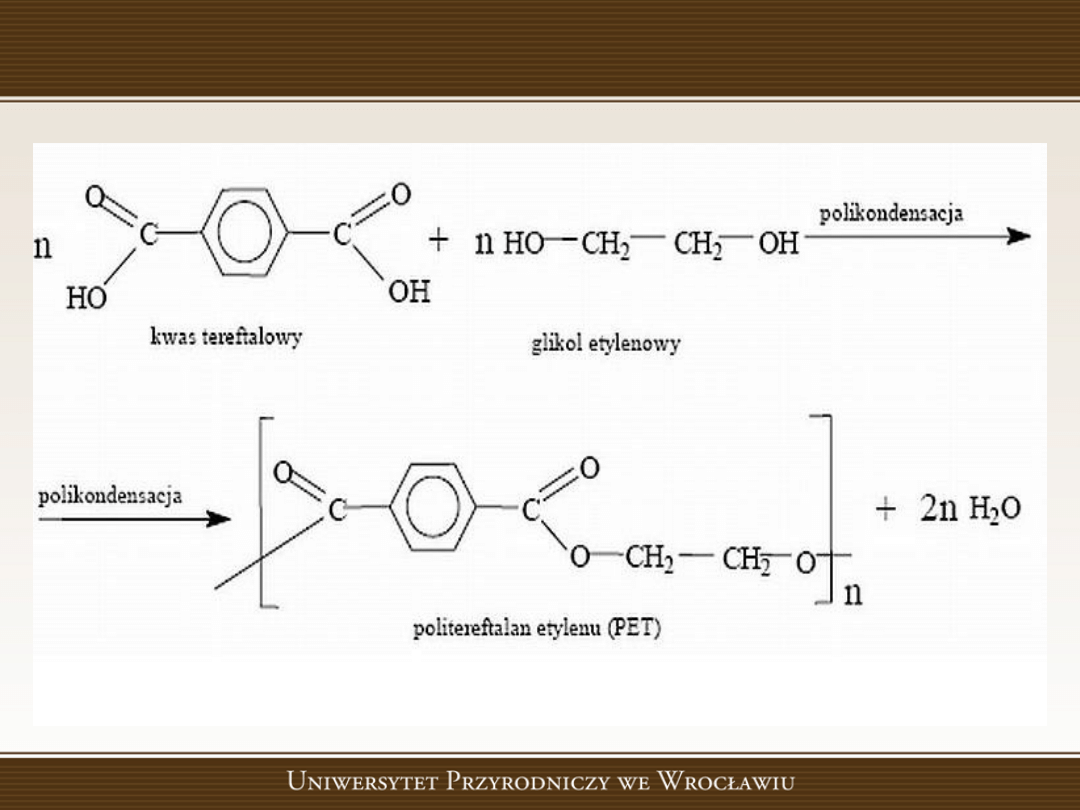
Reakcje polikondensacji

Dziękuję za uwagę
Wyszukiwarka
Podobne podstrony:
ACETANILID, technologia chemiczna, chemia organiczna 2003,2004
NITROANILINY, technologia chemiczna, chemia organiczna 2003,2004
Estry metylowe podstawionych kwasów benzoesowych, technologia chemiczna, chemia organiczna 2003,2004
ZWIĄZKI NATURALNE, technologia chemiczna, chemia organiczna 2003,2004
SYNTEZA GRIGNARDA, technologia chemiczna, chemia organiczna 2003,2004
aspiryna obliczenia - word 98-2003, chemia organiczna
Chemia organiczna - office 2003, Szkoła Rolnictwo studia, Szkoła, Materiały studia, materialy - biot
Chemia organiczna czesc I poprawiona
chemia organiczna wykład 6
Wykład 9 CHEMIA ORGANICZNA
Chemia Organiczna 4
Chemia organiczna IV
CHEMIA- CHEMIA ORGANICZNA, CHEMIA
więcej podobnych podstron