KINETYKA REAKCJI
ZADANIE 1
W zamkniętym reaktorze zmieszano znane ilości azotu i wodoru. Utrzymując wysoką, stałą temperaturę, mierzono zmiany stężeń azotu, wodoru i amoniaku aż do osiągnięcia przez układ stanu równowagi i pewien czas po tym momencie. Na podstawie wyników tych pomiarów wykonano wykres zależności szybkości reakcji od czasu.
Z poniższych wykresów wybierz ten, który ilustruje zmiany szybkości reakcji tworzenia amoniaku i szybkości reakcji rozkładu amoniaku w czasie opisanego eksperymentu (zaznacz wykres A, B, C lub D).
ZADANIE 2
Szybkość reakcji 2SO2 + O2→ 2SO3 wyraża się równaniem kinetycznym
v= k [SO2]2 [O2]. Oblicz, jak zmieni się szybkość tej reakcji, jeżeli do przeprowadzenia procesu, przy niezmienionej ilości reagentów, zastosuje się naczynie o trzykrotnie mniejszej objętości.
ZADANIE 3
Tlenek azotu(II) reaguje z tlenem, tworząc tlenek azotu(IV): 2NO + O2→ 2NO2
Szybkość tej reakcji opisuje równanie kinetyczne:
v = k [NO]2[O2]
Oblicz, ile razy należy zwiększyć stężenie tlenku azotu(II), nie zmieniając stężenia tlenu
i warunków przebiegu procesu, aby szybkość reakcji wzrosła czterokrotnie.
ZADANIE 4
Przeprowadzono doświadczenie zilustrowane poniższym rysunkiem
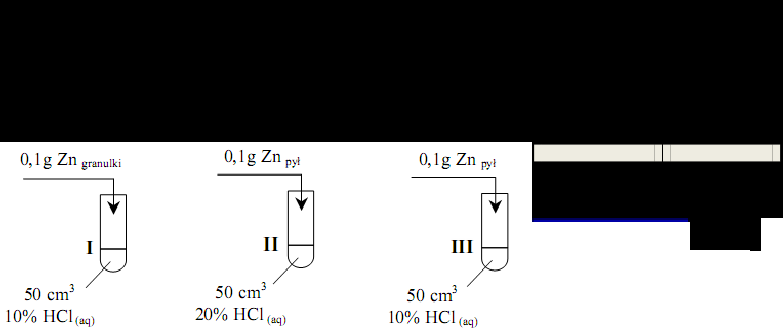
Cynk całkowicie przereagował we wszystkich probówkach, ale reakcje przebiegały z różnymi szybkościami (cynk roztworzył się w różnych czasach t).Przeanalizuj warunki doświadczenia i przyporządkuj czasy przebiegu reakcji (t1, t2 i t3) procesom zachodzącym w
probówkach I, II i III, jeżeli wiadomo, że t1 > t2 > t3.
PROBÓWKA |
CZAS |
I |
|
II |
|
III |
|
ZADANIE 5
Szybkość pewnej reakcji zachodzącej w fazie gazowej wyraża się równaniem kinetycznym
V= k [CA] 2 [CB]
Przedstaw zależność między początkową i końcową szybkością tej reakcji oraz oblicz, jak zmieni się szybkość reakcji, jeżeli przy niezmienionej ilości reagentów i niezmienionej temperaturze ciśnienie reagujących gazów zmaleje dwukrotnie.
ZADANIE 6
W silnikach spalinowych - w wysokiej temperaturze -przebiegają różne reakcje uboczne. Powstające spaliny w kontakcie z tlenem ulegają dalszym przemianom. Ze względu
na szkodliwość produktów, do najważniejszych należą procesy:
N2(g)+ O2(g) ↔ 2NO(g) ΔH=182,5kJ
2NO(g)+ O2(g)↔2NO2(g) ΔH=-114,1kJ
Określ, jak zmieni się (w układzie zamkniętym) ilość produktu w stosunku do ilości substratów
a) reakcji I, jeśli nastąpi wzrost temperatury………………………………………………………………………………………………………………………………………………………………………………...
b) reakcji II, jeśli nastąpi wzrost ciśnienia…………………………………………………………………………………………………………………………………………………………………………………………
ZADANIE 7
Oceń, jak wpływa na ilość amoniaku powstającego w wyniku reakcji syntezy
N2(g) + 3H2(g) ↔2NH3 ΔH =- 92,4 kJ
a)obniżenie ciśnienia,
b) podwyższenie temperatury,
c) wprowadzenie dodatkowej ilości azotu.
Informacja do zadania 3 i 4
Tlenek azotu(IV) o barwie brunatnej ulega
Częściowej dimeryzacji, tworząc bezbarwny N2O4. Prowadzi to do ustalenia równowagi opisanej równaniem:
2NO2(g) ↔N2O4(g)
ZADANIE 8
W celu określenia wpływu temperatury na stan równowagi tej reakcji przeprowadzono doświadczenie opisane poniżej. Zamkniętą probówkę zawierającą mieszaninę NO2 i N2O4
zanurzono w zlewce z lodem. Zauważono, że jej zawartość odbarwiła się. Następnie tę samą probówkę zanurzono w zlewce z gorącą wodą. Stwierdzono, że brunatne zabarwienie jej zawartości pojawiło się ponownie.
Sformułuj wniosek, w którym stwierdzisz, jak wzrost temperatury wpływa na
Ilość N2O4 w układzie
ZADANIE 9
Mając do dyspozycji zamknięte naczynie z tłokiem zawierające mieszaninę NO2
i jego dimeru, zaprojektuj doświadczenie pozwalające zbadać, jak zmiana ciśnienia wpływa na ilość N2O4 w układzie. W tym celu:
uzupełnij opis doświadczenia, wpisując w miejsce kropek odpowiednie wyrażenia wybrane spośród podanych poniżej.
Rozprężamy, sprężamy, zmniejsza się, zwiększa się, nie zmienia się, odbarwia się, przyjmuje brunatne zabarwienie.
1. Naciskając tłok naczynia, ……………………gaz. Objętość gazu …………………………, a zawartość naczynia …………
2. Zmieniając położenie tłoka …………………. Gaz - ciśnienie w naczyniu zmniejsza się. Objętość gazu ………………, a zawartość naczynia …………………………
b) podaj, jak zmiana ciśnienia wpływa na ilość N2O4 w opisanym układzie.…………………………………………………………………………………………………………………………………………………………………………………………………………
ZADANIE 10
Oceń, jak zmieni się (wzrośnie czy zmaleje) wydajność reakcji tworzenia SO2 zilustrowanej równaniem:
2H2S(g)+ 3O2(g) ⇄ 2SO2(g)+ 2H2O(g) ΔH = -1038 kJ
jeżeli w układzie będącym w stanie równowagi
a) podwyższymy temperaturę:
.....................................................................................................................................................
b) usuniemy część wody:
..............................................................................
Wyszukiwarka
Podobne podstrony:
Ćwiczenia do matury, matura, Zadania maturalne z gramatyki
A cw 2 koło 1 kinetyka reakcji zadania dodatkowe 2
KINETYKA REAKCJI zadania dodatkowe 2
06 Kinetyka reakcji enzymatycznych
4 Badanie kinetyki reakcji zmy Nieznany (2)
Zadanie z kartkówki z chemii, Inżynieria środowiska ZUT, Chemia
04 Kinetyka reakcji chemicznych i kataliza
kinetyka reakcji enzymatycznych I
Noworyta, inżynieria bioreaktorów, równania kinetyczne reakcji
7 BUDOWA ATOMU I PROMIENIOTW ôRCZO Ü ć zadania maturalne
alkohole - zadania, Matura, Chemia, zadania z organicznej
3 zestawy do matury ustnej, matura podstawowa ustna
kinetyka reakcji
15 Kinetyka reakcji 1 rzedu
Kinetyka reakcji inwersji sacharozy
więcej podobnych podstron