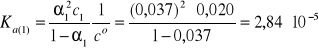
XIII. Równowagi w roztworach elektrolitów słabych
Miarą mocy słabego elektrolitu jest jego stała dysocjacji, która przy ustalonym składzie roztworu zależy tylko od temperatury. W ustalonej temperaturze stałe dysocjacji słabych elektrolitów zależą w pewnym stopniu od składu roztworu, mianowicie od rodzaju i stężenia soli obecnych
w roztworze.
Jako przykład rozpatrzymy dysocjację wodorotlenku amonu, NH4OH:
NH4OH ↔ NH4+ + OH- + ΔH
Dodatnia entalpia (ciepło) reakcji, ΔH = 6,2 kJ/mol, świadczy, że dysocjacja amoniaku jest reakcją endotermiczną. Zgodnie z regułą przekory wzrost temperatury powinien przesunąć stan równowagi
w tej reakcji na korzyść produktów, czyli jonów. Innymi słowy, wzrost temperatury powinien spowodować wzrost stałej dysocjacji wodorotlenku amonu. Istotnie, wzrost temperatury powoduje stosunkowo nieznaczny wzrost stałej dysocjacji amoniaku, która zależy również od stężenia chloranu(VII) sodu w roztworze (tabela 1).
Tabela 1. Stałe dysocjacji amoniaku (NH4OH) w roztworach wodnych
Temperatura, oC |
Stężenie NaClO4, mol/dm3 |
Kb |
0 10 25 25 25 40 |
0 0 0 1 2 0 |
1,4∙10-5 1,6∙10-5 1,8∙10-5 4,7∙10-5 4,0∙10-5 2,0∙10-5 |
Stałe dysocjacji słabych kwasów i zasad są tabelaryzowane, a odpowiednie tabele można znaleźć w podręcznikach i skryptach akademickich*, poradnikach fizykochemicznych i w Internecie.
*np.: Obliczenia w chemii nieorganicznej, praca zbiorowa, Oficyna
Wydawnicza Politechniki Wrocławskiej.
Zgodnie z prawem rozcieńczeń Ostwalda, stopień dysocjacji słabego elektrolitu zależy od jego stężenia w roztworze. W przeciwieństwie do stałych dysocjacji, stopień dysocjacji słabych elektrolitów nie jest obiektywną miarą ich mocy. Aby ocenić, który ze słabych elektrolitów jest mocniejszy, to stopnie dysocjacji porównywanych kwasów lub zasad muszą być wyznaczone przy ich jednakowych stężeniach w roztworach wodnych.
Przykłady
1. Stopień dysocjacji kwasu octowego, CH3COOH,
o stężeniu 0,020 mol/dm3 jest równy 3,7%. Z kolei stopień dysocjacji kwasu chlorowego(III), HClO2, o stężeniu 0,063 mol/dm3 wynosi 46,0%. Który z tych kwasów jest mocniejszym elektrolitem?
Kwas octowy (1):
CH3COOH ↔ H+ + CH3COO-
c1 = 0,020 mol/dm3, α1 = 0,037
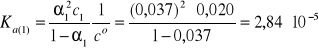
Kwas chlorowy(III), HClO2 (2):
HClO2 ↔ H+ + ClO2-
c2 = 0,063 mol/dm3, α2 = 0,460
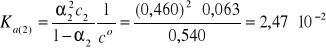
HClO2 jest mocniejszym kwasem od CH3COOH, ponieważ Ka(2) jest około trzech rzędów większą od Ka(1).
2. Dwa roztwory: roztwór HCl i roztwór HCN mają taką samą wartość pH = 4,26. Obliczyć pH tych roztworów po ich 25-krotnym rozcieńczeniu.
Kwas solny (1):
HCl → H+ + Cl-
[H+] = c1 = 10-4,26·co = 5,50·10-5 mol/dm3
c1' = c1/25 = 2,20·10-6 mol/dm3
pH' = -log (2,20·10-6) = 5,66
Kwas cyjanowodorowy (2):
HCN↔ H+ + CN-
pKa = 8,52, Ka = 10-8,52 = 3,02·10-9
[H+] = 10-4,26·co = 5,50·10-4 mol/dm3
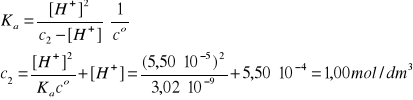
c2' = c2/25 = 0,0400 mol/dm3
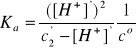
Założenie: c2' >> [H+]' (przynajmniej o dwa rzędy, czyli około 100 razy)
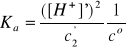
[H+]' = ![]()
mol/dm3
Założenie jest spełnione, ponieważ c2' jest 3636 razy większe od [H+]'.
pH' = - log 1,10·10-5) = 4,96
3. Obliczyć stopnie dysocjacji kwasu octowego (CH3COOH) w roztworach o stężeniach (cHA) równych 1,00; 0,50; 0,25; 0,10 i 0,010 mol/dm3.
pKa = 4,75, Ka = 10-4,75 = 1,78·10-5
CH3COOH ↔ H+ + CH3COO-
![]()
Stopień dysocjacji słabego kwasu można obliczyć ze wzoru uproszczonego
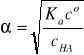
,
pod warunkiem, że stopień dysocjacji α ≤ 1%. Jeśli warunek ten nie jest spełniony, to dokładne obliczenie stopnia dysocjacji słabego kwasu wymaga rozwiązania równania kwadratowego zupełnego:
![]()
i wzięciu pod uwagę tylko dodatniego pierwiastka tego równania.
Wyniki obliczeń stopnia dysocjacji i pH roztworów kwasu octowego w zależności od jego stężenia zestawiono w tabeli 2.
Tabela 2. Wpływ stężenia CH3COOH na jego stopień dysocjacji
cHA, mol/dm3 |
α, % |
[H+], mol/dm3 |
pH |
1,00 |
0,42 |
0,00420 |
2,38 |
0,50 |
0,60 |
0,00300 |
2,52 |
0,25 |
0,84 |
0,00210 |
2,68 |
0,10 |
1,33 |
0,00133 |
2,88 |
0,010 |
4,13 |
0,00041 |
3,38 |
Jak widać wzrost rozcieńczenia kwasu octowego powoduje zwiększenie jego stopnia dysocjacji, ale równocześnie skutkuje zmniejszeniem stężenia jonów wodorowych
i wzrostem pH roztworu.
4. Obliczyć stopnie dysocjacji amoniaku w roztworach
o stężeniach (cBOH) równych 1,00; 0,50; 0,25; 0,10 i 0,010 mol/dm3.
pKb = 4,75, Kb = 10-4,75 = 1,78·10-5, pKw = 14,00
NH4OH ↔ NH4+ + OH-
![]()
Stopień dysocjacji słabej zasady można obliczyć ze wzoru uproszczonego
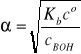
,
(pod warunkiem, że stopień dysocjacji α ≤ 1%) lub przez rozwiązanie równania kwadratowego zupełnego:
![]()
i wzięciu pod uwagę tylko dodatniego pierwiastka tego równania.
Wyniki obliczeń stopnia dysocjacji i pH roztworów amoniaku w zależności od jego stężenia zebrano
w tabeli 3.
Tabela 3. Wpływ stężenia NH4OH ma jego stopień dysocjacji
cBOH, mol/dm3 |
α, % |
[OH-], mol/dm3 |
pOH |
pH |
1,00 |
0,42 |
0,00420 |
2,38 |
11,62 |
0,50 |
0,60 |
0,00300 |
2,52 |
11,48 |
0,25 |
0,84 |
0,00210 |
2,68 |
11,32 |
0,10 |
1,33 |
0,00133 |
2,88 |
11,12 |
0,010 |
4,13 |
0,00041 |
3,38 |
10,62 |
Jak widać wzrost rozcieńczenia amoniaku powoduje zwiększenie jego stopnia dysocjacji, ale równocześnie skutkuje zmniejszeniem stężenia jonów wodorotlenowych, a w konsekwencji wzrostem pOH i zmniejszeniem pH roztworu.
XIII.1. Wpływ dodatku elektrolitów mocnych na równowagi w roztworach elektrolitów słabych.
Efekt wspólnego jonu.
Elektrolity słabe bardzo często występują
w roztworach w obecności elektrolitów mocnych, np. takich soli, które dysocjują na inne jony niż słabe kwasy lub zasady. Jako odpowiednie przykłady można wymienić NaClO4 - chloran(VII) sodu lub KNO3 - azotan(V) potasu:
NaClO4 → Na+ + ClO4-,
KNO3 → K+ + NO3-,
które pochodzą od mocnych kwasów i mocnych zasad (tzn. jako produkty reakcji zobojętniania mocnych kwasów mocnymi zasadami) i są stosowane do utrzymywania stałej siły jonowej (I) roztworu.
Z tego, o czym wspomniano wcześniej, takie sole
wpływają w pewnym stopniu na iloczyn jonowy wody (Kw) oraz na stałe dysocjacji (Ka) słabych kwasów, stałe dysocjacji (Kb) słabych zasad, a także na stałe innych równowag jonowych w roztworach elektrolitów. Jednak szczegółowe rozważania na ten temat, a mianowicie wpływu siły jonowej roztworu na współczynniki aktywności jonów, wykraczają poza ramy niniejszego wykładu.
Obecnie rozpatrzymy jak w procesie dysocjacji elektrolitycznej zachowują się słabe kwasy
i słabe zasady w obecności mocnych elektrolitów
o wspólnym jonie.
XIII.1.1. Słaby kwas HA o stężeniu cHA w obecności
mocnego kwasu HX o stężeniu cHX.
Wspólnym jonem dla obydwu kwasów w roztworze jest jon wodorowy.
HA ↔ H+ + A-
HX → H+ + X-
Dla reakcji dysocjacji słabego kwasu HA ustala się stan równowagi, a bilanse stężeń poszczególnych jonów oraz niezdysocjowanych cząsteczek słabego kwasu w tym roztworze są następujące:
[H+] = cHX + [H+]HA
[A-] = [H+]HA
[HA] = cHA - [H+]HA
Po podstawieniu tych stężeń do wyrażenia na stałą dysocjacji słabego kwasu otrzymujemy:
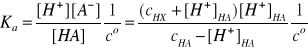
Z analizy otrzymanego wyrażenia wynika, że słaby kwas o danym stężeniu, występując w roztworze samodzielnie ma zawsze większy stopień dysocjacji niż wtedy, gdy towarzyszy mu mocny kwas.
Wniosek ten jest zgodny z regułą przekory, ponieważ dysocjacja mocnego kwasu zwiększa całkowite stężenie jonów wodorowych, czyli produktu odwracalnej reakcji dysocjacji elektrolitycznej słabego kwasu. Innymi słowy,
w obecności mocnego kwasu stan równowagi dysocjacji słabego kwasu jest przesunięty w lewo, to jest na korzyść jego niezdysocjowanych cząsteczek.
Przykłady
5. Jaki jest stopień dysocjacji 0,10M kwasu octowego
w roztworze w obecności 0,02 M kwasu solnego?
pKa = 4,55, cHA = 0,10 mol/dm3, cHCl = 0,02 mol/dm3

Komentarz: Obydwa założenia są bardzo dobrze spełnione. Stopień dysocjacji 0,10 M kwasu octowego w obecności 0,02 M HCl jest około 13 razy mniejszy niż wtedy, gdy 0,10 M roztwór tego kwasu nie zawiera kwasu solnego (porównaj wykład XII, rozwiązanie przykładu 1). O pH roztworu 0,10 M kwasu octowego i 0,02 M kwasu solnego decyduje głównie ten ostatni, ponieważ:
[H+] = cHCl + [H+]HA = 0,02 + 0,00014 ≈ 0.02 mol/dm3, to pH = 1,70.
6. Obliczyć pH roztworu H2SO4 o stężeniu 0,219 mol/dm3.
Kwas siarkowy(VI) jest mocnym kwasem dwuzasadowym dysocjującym w dwóch etapach zachodzących równocześnie:
H2SO4 → H+ + HSO4-, pierwszy etap (1)
HSO4- ↔ H+ + SO42-, drugi etap (2)
ck = 0,219 mol/dm3, pKa2 = 1,12.
Anion HSO4- jest kwasem średniej mocy, dlatego w drugim etapie dysocjacji H2SO4 ustala się stan równowagi ze stałą dysocjacji Ka2:
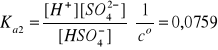
Bilans stężeń w stanie równowagi:
[H+]1 = ck
[H+]2 = [SO42-]
[H+] = [H+]1 + [H+]2 = ck + [H+]2
[HSO4-] = ck - [H+]2
Aby w roztworze H2SO4 obliczyć całkowite stężenie jonów wodorowych należy najpierw obliczyć z wyrażenia na Ka2 stężenie jonów wodorowych [H+]2 z drugiego etapu dysocjacji:
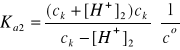
Po odpowiednim przekształceniu ostatniego wyrażenia uzyskuje się równanie kwadratowe zupełne względem [H+]2:
![]()
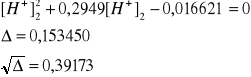
[H+]2 = [SO42-] = 0,0484 mol/dm3
[H+] = ck + [H+]2 = 0,219 + 0,0484 = 0,27 mol/dm3
pH = 0,57
Komentarz: Kwas siarkowy jest kwasem mocnym
tylko w pierwszym etapie dysocjacji i zachowuje się
w stosunku do jonów HSO4- tak, jak kwas solny względem kwasu octowego w poprzednim przykładzie. Innymi słowy, cząsteczki H2SO4, dysocjujące całkowicie w pierwszym etapie dysocjacji, hamują dysocjację jonów HSO4-. Efekt ten pogłębia się wraz ze wzrostem stężenia H2SO4, a przy jego wyższych stężeniach (poczynając od 1 mol/dm3) - stężenie jonów wodorowych pochodzi praktycznie z pierwszego etapu dysocjacji tego kwasu..
XIII.1.2. Słaba zasada BOH o stężeniu cBOH w obecności
mocnej zasady MOH o stężeniu cMOH.
Wspólnym jonem dla obydwu zasad w roztworze jest jon wodorotlenowy.
BOH ↔ B+ + OH-
MOH → M+ + OH-
Dla reakcji dysocjacji słabej BOH ustala się stan równowagi, a bilanse stężeń poszczególnych jonów oraz niezdysocjowanych cząsteczek słabej zasady w tym roztworze są następujące:
[OH-] = cMOH + [OH-]BOH
[B+] = [OH-]BOH
[BOH] = cBOH - [OH-]BOH
Po podstawieniu tych stężeń do wyrażenia na stałą dysocjacji słabej zasady otrzymujemy:
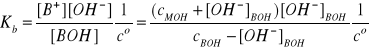
Z analizy wyprowadzonego wyrażenia wynika, że słaba zasada o danym stężeniu, występując
w roztworze samodzielnie ma zawsze większy stopień dysocjacji niż wtedy, gdy towarzyszy jej mocna zasada. Wniosek ten jest oczywiście zgodny z regułą przekory.
Przykład
7. Obliczyć stopień dysocjacji 0,50M NH4OH oraz pH
w roztworze zawierającym 0,05 M wodorotlenku sodu.
pKb = 4,33, pKw = 14,00, cBOH = 0,50 mol/dm3

Komentarz: Obydwa założenia są bardzo dobrze spełnione. W obecności 0,05 M NaOH stopień dysocjacji 0,50 M NH4OH jest około 11 razy mniejszy niż wtedy, gdy 0,50 M roztwór tej słabej zasady nie zawiera NaOH (porównaj wykład XII, rozwiązanie przykładu 2). O pH roztworu zawierającego 0,50 M NH4OH i 0,05 M NaOH decyduje głównie mocna zasada:.
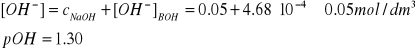
pH = pKw - pOH = 12,70.
XIII.1.3. Dysocjacja słabych elektrolitów w obecności
soli o wspólnym jonie. Roztwory buforowe
Roztwór zawierający słaby elektrolit oraz pochodzącą od niego sól nazywamy roztworem buforowym lub krótko buforem. Roztwory te mają bardzo duże znaczenie praktyczne, co ma związek
z ich właściwościami. Po pierwsze, pH roztworu buforowego zależy od stosunku stężeń słabego elektrolitu i jego soli i pozostaje praktycznie stałe w trakcie rozcieńczania. Po drugie, pH roztworu buforowego zmienia się stosunkowo nieznacznie po dodaniu niewielkich liczności mocnych kwasów lub mocnych zasad, co nazywamy efektem buforowania.
Wyróżniamy trzy typy roztworów buforowych:
roztwory buforowe kwasowe, np. bufor octanowy złożony z kwasu octowego - CH3COOH i octanu sodu - CH3COONa. Wspólnym jonem dla obydwu elektrolitów jest anion octanowy CH3COO-.
HA ↔ H+ + A-
NaA →Na+ + A-
roztwory buforowe zasadowe, np. bufor amonowy złożony z zasady amonowej - NH4OH oraz chlorku amonu - NH4Cl. Wspólnym jonem dla obydwu elektrolitów jest kation amonowy NH4+.
BOH ↔ B+ + OH-
BCl → B+ + Cl-
bufory solne zawierające dwie sole pochodzące od
słabych kwasów wieloprotonowych, np. bufor
fosforanowy zawiera dwie sole NaH2PO4 oraz
Na2HPO4, które są solami pochodzącymi od
kwasu fosforowego(V) - H3PO4. Pierwsza sól
dysocjuje dając anion H2PO4- :
NaH2PO4 → Na+ + H2PO4-
Anion H2PO4- zachowuje się jak słaby kwas, od którego formalnie pochodzi sól Na2HPO4:
H2PO4- ↔ H+ + HPO42-
Na2HPO4 → Na+ + HPO42-
Innym przykładem buforu solnego jest bufor węglanowy zawierający dwie sole NaHCO3 oraz Na2CO3, które są solami kwasu węglowego(IV) - H2CO3.
Dzięki wspomnianym wyżej układom obydwu buforów solnych, fosforanowego i węglanowego, znakomite właściwości buforujące ma krew, która utrzymuje stałą wartość pH = 7,30.
W dalszych rozważaniach bufory solne zostaną pominięte, ponieważ wykracza to poza ramy niniejszego wykładu.
Roztwór buforowy zawierający słaby kwas HA
o stężeniu cHA oraz sól NaA o stężeniu cs
HA ↔ H+ + A-
NaA →M+ + A-
Bilans stężeń anionów A- i cząsteczek HA
w roztworze:
[A-] = cs + [H+]
[HA] = cHA - [H+]
Po podstawieniu tych zależności do wyrażenia na stałą dysocjacji słabego kwasu otrzymujemy:
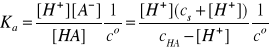
Roztwory buforowe kwasowe przygotowuje się tak, aby stężenia jego składników były odpowiednio duże
i spełniały następujące zależności:
cs >> [H+]
cHA >> [H+]
Wobec tego mamy:
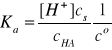
Ostatecznie po przekształceniu ostatniego wyrażenia otrzymujemy zależność:
![]()
z której wynika, że w wyniku rozcieńczenia roztworu stężenia jego składników będą mniejsze, równe odpowiednio cHA' i cs', ale stosunek tych stężeń będzie taki sam jak stosunek stężeń pierwotnych. Zatem rozcieńczenie roztworu buforowego kwasowego nie spowoduje zmiany jego pH.
Jak już powiedziano wcześniej, roztwory buforowe reagują niewielkimi zmianami pH na niewielkie dodatki mocnych kwasów lub mocnych zasad. Spróbujemy to wyjaśnić dokładniej. W tym celu oznaczymy początkowe liczności składników buforu kwasowego jako nHA i ns. Jeśli do tego buforu dodamy niewielką liczność kwasu solnego, nHCl, to reaguje on z solą słabego kwasu zgodnie
z równaniem reakcji:
NaA + HCl → NaCl + HA
w wyniku, czego liczność, a zatem i stężenie soli NaA w roztworze zmaleje, natomiast liczność i stężenie słabego kwasu HA wzrośnie, a pH nieznacznie zmaleje ponieważ:
ns >> nHCl i nHA >> nHCl,
ns' = ns - nHCl oraz nHA' = nHA + nHCl,
i dlatego nHA'/ ns' ≥ ns/ nHA.
Jeśli do buforu kwaśnego dodamy niewielką liczność wodorotlenku sodu, nNaOH, to reaguje on ze słabym kwasem zgodnie z równaniem reakcji:
HA + NaOH→ NaA+ H2O
w wyniku, czego liczność, a zatem i stężenie soli NaA
w roztworze wzrośnie, natomiast liczność i stężenie słabego kwasu HA zmaleje, a pH nieznacznie wzrośnie ponieważ:
nNaA >> nNaOH i nHA >> nNaOH,
nHA' = nHA - nNaOH oraz ns' = ns + nNaOH,
i dlatego nHA'/ nNaA' ≤ nHA/ nNaA
Roztwór buforowy zawierający słabą zasadę
BOH o stężeniu cBOH oraz sól BX o stężeniu cs
BOH ↔ B+ + OH-
BX → B+ + X-
Bilans stężeń kationów B+ oraz cząsteczek BOH
w roztworze:
[B+] = cs + [OH-]
[BOH] = cBOH - [OH-]
Po podstawieniu tych zależności do wyrażenia na stałą dysocjacji słabej zasady otrzymujemy:
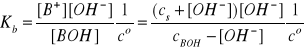
Roztwory buforowe zasadowe przygotowuje się tak, aby stężenia jego składników były odpowiednio duże
i spełniały następujące zależności:
cs >> [OH-]
cBOH >> [OH-]
Wobec tego mamy:
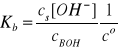
Po przekształceniu ostatniego wyrażenia uzyskujemy zależność:
![]()
Ponieważ [H+][OH-] = Kw, to:
![]()
Z ostatniego wzoru wynika, że rozcieńczanie buforu zasadowego nie powoduje zmian stosunku stężeń jego składników i nie powoduje zmian jego pH.
Zasadowy roztwór buforowy reaguje niewielkimi zmianami pH na dodatki niewielkich liczności mocnych kwasów i zasad ponieważ:
mocny kwas reaguje ze słabą zasadą BOH zgodnie z równaniem reakcji
BOH + HX = BX + H2O,
dlatego liczność słabej zasady w roztworze maleje.
mocna zasada reaguje z solą BX w myśl równania
reakcji
BX + NaOH = NaX + BOH,
dlatego liczność soli w roztworze maleje.
UWAGA:
Liczności mocnych kwasów lub mocnych zasad dodanych do roztworu buforowego nie mogą być większe od liczności jego składników, ponieważ zgodnie z podanymi reakcjami spowoduje to usunięcie któregoś z nich z roztworu. W efekcie dodania nadmiernych liczności mocnych kwasów lub zasad roztwór buforowy traci swoje charakterystyczne właściwości buforujące.
Pojemność buforu i zakres buforowania
Wrażliwość roztworu buforowego na dodatek mocnego kwasu lub mocnej zasady określa jego pojemność i zakres buforowania.
Pojemność buforu na kwas jest to liczność mocnego kwasu, jaką należy dodać do 1 dm3 roztworu buforowego, aby zmniejszyć jego pH o jednostkę. |
Pojemność buforu na zasadę jest to liczność mocnej zasady, jaką należy dodać do 1 dm3 roztworu buforowego, aby zwiększyć jego pH o jednostkę. |
Pojemność buforu nie zależy od rodzaju roztworu buforowego, ale od stężeń (lub liczności) jego składników i jest tym większa, im te stężenia (lub liczności) są większe.
Zakres buforowania również nie zależy od rodzaju roztworu buforowego i jest tym większy, im większe są liczności jego składników.
Podane niżej zależności wyznaczają zakresy buforowania roztworów buforowych.
W buforze kwasowym:
nHX = ns
nMOH = nHA
W buforze zasadowym:
nHX = nBOH
nMOH = ns
UWAGA KOŃCOWA:
Stopień dysocjacji słabego elektrolitu
w roztworze buforowym jest zawsze mniejszy od stopnia dysocjacji tego elektrolitu w roztworze nie zawierającym dodatku soli o wspólnym jonie.