Chemia, 2 rok studiów |
Julita Przeździecka Adrian Marzec |
Kielce 23.02.2010 |
Nr. 12 |
Wyznaczanie wzoru i stałej trwałości kompleksu aminasrebra (I) |
Ocena:
|
Wstęp teoretyczny:
Związki kompleksowe to grupa związków złożona z rdzenia ( część związku którą najczęściej stanowi jon metalu przejściowego lub ciężkiego metalu grupy głównej) oraz ligandów (skoordynowanych przez atom centralny jonów lub cząsteczek elektroobojętnych ułożonych w ściśle określonym porządku wokół jonu centralnego). Rdzeniem jest zwykle atom lub jon o strukturze elektronowej umożliwiającej przyjęcie par elektronowych i wytworzenie wiązania koordynacyjnego w którym jest akceptorem elektronów. Ligandami są cząsteczki lub jony dysponujące wolnymi parami elektronów które odgrywają rolę donorów par elektronowych. W wyniku utworzenia się związku kompleksowego atom centralny uzyskuje konfigurację elektronową najbliższego gazu szlachetnego (lub zbliżoną). Liczbę ligandów w cząsteczce podaję liczba koordynacyjna. Reakcje tworzenia się kompleksów w roztworach polegają w pełni prawu działania mas. Jeżeli jon centralny tworzy w reakcji z ligandem związek kompleksowy:
![]()
to stała równowagi tej reakcji, zwana stałą trwałości tego kompleksu wyrazi się wzorem:
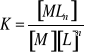
Gdy jon centralny M reaguje z m ligandami to reakcja przebiega stopniowo i powstają kompleksy pośrednie zanim osiągnięty zostanie kompleks koordynacyjnie wysycany. Stała trwałości ogólna będzie równa iloczynowi stałych trwałości tworzących się kompleksów. Stałe reakcji rozpadu kompleksu określane są jako stałe nietrwałości kompleksu a ich wartości są odwrotnością odpowiednich stałych trwałości.
Cel doświadczenia:
Wyznaczenie liczby koordynacyjnej jonu srebra (I) i stałej trwałości (K) kompleksu aminasrebra (I).
Wykonanie doświadczenia:
Przed przystąpieniem do wykonania doświadczenia myjemy szkło, płukamy wodą destylowaną a następnie wodą redestylowaną poczym suszymy szkło.
Do kolby stożkowej oznaczonej 1A odpipetowujemy 20 ![]()
roztworu ![]()
oraz 10![]()
roztworu amoniaku. Pipetami uzupełniamy Kolbe do 100![]()
wodą redestylowaną. Do roztworu z biurety dodajemy po kropli KB, aż do uzyskania pierwszego trwałego zmętnienia spowodowanego powstaniem AgBr. W Kolbie 1B stosujemy te same proporcje co w kolbie 1A przy czym ilość wody redestylowanej jest pomniejszona o ilość zużytego titrantu do miareczkowanie kolby 1A. Opisane czynności powtórzyć stosując w kolbach dane objętości w kolbach 2A i 2B po 20![]()
![]()
i 20 ![]()
amoniaku, a w kolbach 3A i 3B po 20![]()
![]()
i 30![]()
amoniaku. W kolbach 3A i 3B uzupełniamy do 100![]()
wodą redestylowaną.
Opracowanie wyników:
Stężenia równowagowe amoniaku, jonów bromkowych i jonów srebra (I)
VAgNO3 = 0,02 dm3
CAgNO3 = 0,01 M
n = 2*10-4 mol
Vk = 0,1 dm3
Ck = 2*10-3 M
Ponieważ używaliśmy zawsze takiej samej ilości AgNO3, o tym samym stężeniu wiec w każdej kolbce będzie takie samo stężenie jonów Ag+ .
Kolbka 1B
V NH3 = 0,01 dm3
C NH3 = 2M
n = 0,02 mol
Vk = 0,1 dm3
Ck = 0,2 M
Kolbka 2B
V NH3 = 0,02 dm3
C NH3 = 2M
n = 0,04 mol
Vk = 0,1 dm3
Ck = 0,4 M
Kolbka 3B
V NH3 = 0,03 dm3
C NH3 = 2M
n = 0,06 mol
Vk = 0,1 dm3
Ck = 0,6 M
Wartości log[Br-], log[NH3] oraz log[Ag+]
1B: log[NH3] = - 0,70 log[Br-]= - 3,96
2B: log[NH3] = - 0,40 log[Br-]= - 3,32
3B: log[NH3] = - 0,22 log[Br-]= - 3,00
log[Ag+] = - 2,70
Wykres zależności log[[Br-]=f(log[NH3])
W programie Excel wykonujemy wykres zależności log[[Br-]=f(log[NH3]), odczytujemy z niego współczynnik kierunkowy prostej - a.
tgα = a
a=2,0 ![]()
liczba koordynacyjna n = 2
stała trwałości (β) kompleksu aminasrebra (I)
Dzięki wartości przecięcia prostej z osią rzędnych obliczamy wartość K.
log const.= - 2,52
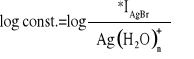
![]()
![]()
logβ=-2,52 +12,27-2,7
logβ=7,05
Wnioski:
Logarytm β tablicowy wynosi 7,4 , a wyznaczony przez nas doświadczalnie 7,05. Nieznaczna różnica w wyniku może być spowodowana niedokładnym odczytem z biurety lub też nie precyzyjnym pobraniem roztworów.
3
VKBr = 1,1*10-3 dm3
CKBr = 0,01 M
n = 1,1*10-5 mol
Vk = 0,1 dm3
Ck = 1,1*10-4 M
VKBr = 4,75*10-3 dm3
CKBr = 0,01 M
n = 4,75*10-5 mol
Vk = 0,1 dm3
Ck = 4,75*10-4 M
VKBr = 0,01 dm3
CKBr = 0,01 M
n = 10-4 mol
Vk = 0,1 dm3
Ck = 10-3 M
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 25, chemia nieorganiczna, zalaczniki2
wstęp, chemia nieorganiczna, zalaczniki2
mangan i chrom poprawione, chemia nieorganiczna, zalaczniki2
Chemia nieorganiczna zadania 12 Nieznany
WF-Irok-Tok-09.12.2013, rok numero uno, chemia nieorganiczna
Chemia nieorganiczna zadania 12
CHEMIA NIEORGANICZNA 2
Chemia nieorganiczna zadania 4 Nieznany
Chemia nieorganiczna zadania 7 Nieznany
KationyV, Farmacja, I rok, Chemia nieorganiczna
egz 2010-pytania spisane(1), Chemia nieorganiczna- egzmain
Tlenowce(1), Chemia, Chemia nieorganiczna
testy chemia2, Biotechnologia PŁ, chemia nieorganiczna
CHEMIA KOSMETYCZNA Chemia nieorganiczna (tlenki, kwasy, sole
Chemia nieorganiczna egzamin
Chemia nieorganiczna sciaga
iloczynrozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
więcej podobnych podstron