Państwowa Wyższa Szkoła Zawodowa
im. Prezydenta Stanisława Wojciechowskiego
w Kaliszu
Laboratorium z Analizy Chemicznej Wody i Ścieków
Analiza ścieków
Oznaczenie kwasowości ścieków
Przygotowali:
Zarys teorii.
Kwasowość wody naturalnej polega na jej zdolności do uwalniania protonów, czyli zobojętniania dodawanych do niej silnych zasad lub węglanów potasowych. Kwasowość wody może być spowodowana przez obecność słabo zjonizowanych kwasów, tj. kwas węglowy i kwas tarninowy oraz ulegających hydrolizie niektórych soli np. siarczanu żelaza(II) lub siarczanu glinu. Poza tym kwasowość wody naturalnej wywołują wolne kwasy nieorganiczne. Czynniki powodujące kwasowość wody naturalnej mogą pochodzić z atmosfery lub gleby (np. CO2), z chemikaliów dodawanych do wody podczas jej uzdatniania (koagulacji) oraz zanieczyszczeń spływami powierzchniowymi z terenów hut i pewnymi ściekami przemysłowymi. Woda pochodząca z terenów bagiennych lub torfowych może zawierać kwasy organiczne(np. kwasy humusowe).
Kwasowość wody do picia bezpośrednie znaczenie ma wtedy, gdy wywołana jest przez wolne kwasy nieorganiczne oraz produkty hydrolizy soli. Taka kwasowość jest w wodzie do picia niepożądana, gdyż woda o niskim pH może rozpuszczać szkodliwe dla zdrowia metale lub nadawać ujemne cechy wodzie np. rozpuszczania rur żelaznych. Z takich samych powodów kwasowość stanowi ujemną cechę wód używanych do celów przemysłowych i technicznych, gdyż wywołuje korozje rur, zbiorników oraz innych urządzeń.
Kwasowość mineralna, Km, jest to kwasowość wobec oranżu metylowego, jeden z podstawowych parametrów badania chemicznego wody. Podaje ilość mocnych kwasów (w mval/dm3) obecnych w badanej próbce wody. Kwasowość mineralna wody nie zanieczyszczonej chemicznie winna być zawsze równa zeru.
Kwasowość ogólna, Kp, jest to kwasowość wobec fenoloftaleiny, jeden z podstawowych parametrów badania fizykochemicznego wody do celów spożywczych i przemysłowych. Oznacza sumę zawartości kwasów mocnych i słabych (oraz ich bezwodników, np. CO2 rozpuszczony) w badanej wodzie (w mval/dm3). Dokładny pomiar kwasowości ogólnej jest czasem utrudniony z uwagi na szybką jej zmienność (np. ulatnianie się CO2 z wód mineralnych).
Cel ćwiczenia.
Celem ćwiczenia jest oznaczenie kwasowości ogólnej i mineralnej próbki ścieków otrzymanej do analizy, metodą miareczkowania potencjometrycznego.
Wykonanie ćwiczenia.
Odmierzamy 60cm3 badanej próbki i wlewamy do zlewki. Następnie badamy pH roztworu. Miareczkujemy roztwór dodając z biurety po 0,5cm3 roztworu 0,05M NaOH oraz mieszamy przez ok. 1,5 minuty i każdorazowo mierzymy pH roztworu. Przy wartościach pH 4,5 oraz 8,3 należy dawki titranta zmniejszyć, aby uzyskać te wartości.
Tabela.
Obliczenia.
Obliczenie kwasowości ogólnej.
Obliczenie kwasowości mineralnej.
Wnioski.
Objętość dodanego roztworu miareczkującego V[ml] |
pH roztworu |
0,0 |
3,23 |
0,5 |
3,41 |
1,0 |
3,67 |
1,5 |
3,87 |
2,0 |
4,02 |
2,5 |
4,18 |
3,0 |
4,35 |
3,1 |
4,36 |
3,2 |
4,41 |
3,3 |
4,43 |
3,5 |
4,45 |
3,6 |
4,47 |
3,7 |
4,50 |
4,0 |
4,54 |
4,5 |
4,65 |
5,0 |
4,76 |
5,5 |
4,87 |
6,0 |
4,98 |
6,5 |
5,12 |
7,0 |
5,21 |
7,5 |
5,42 |
8,0 |
5,56 |
8,5 |
5,90 |
9,0 |
6,74 |
9,5 |
9,30 |
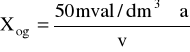
[mval/dm3]
a - objętość roztworu 0,05M NaOH zużytego do zmiareczkowania próbki do pH = 8,3 [cm3]
v - objętość próbki badanej użytej do oznaczenie [cm3]
a = 9,35cm3 = 0,00935dm3
v = 60cm3 = 0,06dm3
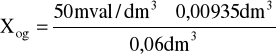
Xog = 7,91mval/dm3
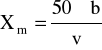
[mval/dm3]
b - objętość roztworu 0,05M NaOH zużytego do zmiareczkowania próbki do pH = 4,5 [cm3]
v - objętość próbki badanej użytej do oznaczenie [cm3]
b = 3,7cm3 = 0,0037dm3
v = 60cm3 = 0,06dm3
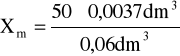
Xm = 3,08 mval/dm3
Na podstawie dokonanego miareczkowanie potencjometrycznego oraz na podstawie obliczeń próbka ścieków otrzymana do analizy posiada kwasowość ogólną na poziomie 7,91mval/dm3 oraz kwasowość mineralną na poziomie 3,08mval/dm3. Oznacza to, że ścieki te są zanieczyszczone i powinny być zneutralizowane w celu usunięcia substancji powodujących kwasowość, np. poprzez dodanie ścieków o odczynie zasadowym lub przez dodanie wapna. Ścieki te mogą mieć zdolność do powodowania korozji, a nawet do rozpuszczania elementów metalowych znajdujących się w oczyszczalni ścieków.
W związku z tym, że punkt, w którym pH roztworu osiągnie wartość 8,3 nie został uchwycony, czego powodem był nagły skoku pH, konieczne było przygotowanie wykresu zależności pH od objętości dodanego roztworu 0,05M NaOH. Z wykresu tego została odczytana objętość dodanego roztworu NaOH, przy której pH wyniosło 8,3.
2
Wyszukiwarka
Podobne podstrony:
Spektrofotometria - oznaczenie miedzi, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody
Spektrofotometria - oznaczenie manganu, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody
Oznaczenie twardości ogólnej metodą werenianową, inżynieria ochrony środowiska kalisz, Analiza Chemi
Refraktometria, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
Pehametria, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
ChZT-Mn, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
Polarymetria, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
Konduktometria, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
Siarczany, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
wersja do nauki, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody i ścieków, P
ogólne informacje o ściekach, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody
dekarbonizacja, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody i ścieków, Pl
Mikroskopowe badanie osadu czynnego, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technolog
Neutralizacja ścieków, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody i ście
wersja do nauki, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody i ścieków, P
pwsz ioś kalisz Ćw. 6 POLARYMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, analiza
pwsz ioś kalisz Ćw 4 Spektrofotometria, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, ana
pwsz ioś kalisz moje sprawozdanie PEHAMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz io
więcej podobnych podstron