Państwowa Wyższa Szkoła Zawodowa
im. Prezydenta Stanisława Wojciechowskiego
w Kaliszu
Laboratorium z Analizy Chemicznej Wody i Ścieków
Konduktometria
Konduktometryczne oznaczenie obecności siarczanów w wodzie wodociągowej
Przygotowali:
Zarys teorii.
Siarczany, które występują w wodach naturalnych mają zróżnicowane stężenia, od kilku do kilku tysięcy mg/dm3. Pochodzą one z gleb, pokładów geologicznych, a także odprowadzane są ze ściekami przemysłowymi. Duże zawartości siarczanów mogą znajdować się w wodach kopalnianych, wskutek zachodzących tam procesów rozkładu pirytu. Piryt pod wpływem wody, tlenu lub azotanów ulega rozkładowi do siarczanu żelaza(II) i kwasu siarkowego. Powstały w ten sposób kwas siarkowy działa rozpuszczająco na złoża naturalne, dając odpowiednie siarczany.
Dopuszczalna zawartość siarczanów w wodzie do picia, z punktu widzenia sanitarno - higienicznego, wynosi 200 mg SO4/dm3. Maksymalne, dopuszczalne stężenie siarczanów w wodach powierzchniowych wynosi dla I klasy - 150 mg SO4/dm3, dla II klasy - 200 mg SO4/dm3 i dla III klasy - 250 mg SO4/dm3.
Siarczany magnezu i sodu występujące w dużych stężeniach, powyżej 250 mg SO4/dm3, nadają wodzie gorzkawy smak. W pewnych przypadkach, zwłaszcza w początkowym okresie używania, woda taka może mieć działanie przeczyszczające.
Do oznaczania siarczanów stosuje się następujące metody:
wagową,
miareczkową,
nefelometryczną,
chromatografię jonową,
miareczkowanie konduktometryczne,
Metoda miareczkowania konduktometrycznego polega na obserwacji zmian przewodnictwa roztworu miareczkowanego. Zmiany te wynikają ze zmian stężenia jonów badanych oraz zmiany jonów o określonej ruchliwości na jony o ruchliwości innej niż jony pierwotnie obecne w roztworze. Punkt końcowy wyznacza się z załamania krzywej wykreślonej w układzie: przewodnictwo λ - objętość V mianowanego roztworu miareczkującego. Metoda ta jest przydatna, gdy wyznaczenie PK miareczkowania za pomocą wskaźników jest niemożliwe np. w przypadku roztworów silnie zabarwionych, mętnych. Najczęściej miareczkowanie konduktometryczne stosuje się w przypadku reakcji strącania, zobojętniania i kompleksowania.
Cel ćwiczenia.
Celem ćwiczenia jest ilościowe oznaczenie siarczanów w wodzie wodociągowej metodą miareczkowania konduktometrycznego.
Wykonanie ćwiczenia.
Po odmierzeniu 150cm3 wody wodociągowej, przelaniu do zlewki oraz zmierzeniu przewodnictwa, gotujemy ją przez 15 minut. Następnie chłodzimy wodę do temperatury pokojowej. Odmierzamy 60cm3 i wlewamy do zlewki o pojemności 100cm3. mierzymy przewodnictwo wody wodociągowej po zagotowaniu. Następnie dodajemy z biurety po 0,5cm3 ca(NO3)2 o stężeniu 0,01mol/dm3, mieszamy roztwór 2 minuty. Po każdym mieszaniu mierzymy przewodnictwo roztworu.
Tabela.
Wykres.
Obliczenie ilości mg SO42- zawartych w próbce badanej wody wodociągowej.
Wnioski.
Objętość dodanego roztworu miareczkującego V [ml] |
Przewodnictwo λ [μS] |
0,0 |
606 |
0,0 |
658 |
0,5 |
710 |
1,0 |
721 |
1,5 |
732 |
2,0 |
746 |
2,5 |
752 |
3,0 |
758 |
3,5 |
772 |
4,0 |
781 |
4,5 |
789 |
5,0 |
797 |
5,5 |
806 |
6,0 |
809 |
6,5 |
838 |
7,0 |
855 |
7,5 |
866 |
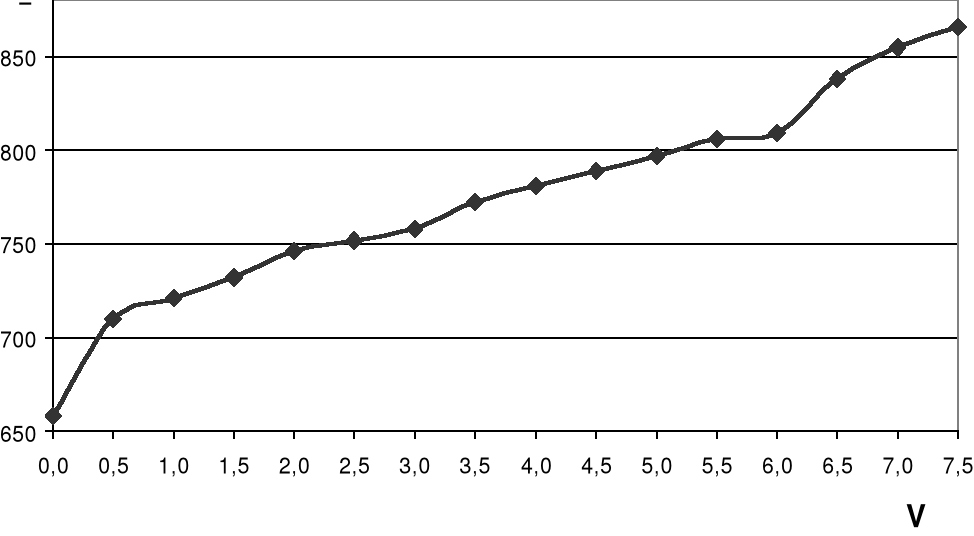
Wykres 1. Zależność przewodnictwa roztworu od objętości dodanego roztworu miareczkującego Ca(NO3)2.
VI. Obliczenia.
![]()
[mol]
n - liczba moli [mol]
Vk - objętość titranta zużytego do miareczkowania w punkcie końcowym
[dm3]
Cm - stężenie molowe roztworu Ca(NO3)2 [mol/dm3]
![]()
n = 0,00006 mola
![]()
[g]
n - liczba moli [mol]
M - 1 mol SO42- - 96g
![]()
![]()
m --- V
![]()
---- 1dm3
![]()
[g]
V - objętość pobranej próbki wody wodociągowej [dm3]
![]()
![]()
Na podstawie dokonanych pomiarów przewodnictwa roztworu, wykresu zależności przewodnictwa roztworu od objętości dodanego Ca(NO3)2 oraz na podstawie dokonanych obliczeń stwierdzono zawartość siarczanów w pobranej próbce wody wodociągowej na poziomie 96mg SO42-/dm3. Wartość ta spełnia wymagania sanitarno - higieniczne stawiane wodzie do picia, które wynoszą 200 mg SO42-/dm3. Oznacza to, że woda ta nadaje się do spożycia i nie powinna stanowić zagrożenia dla zdrowia ludzkiego ani nie powinna powodować różnych innych zagrożeń w przemyśle, takich jak korozja elementów i konstrukcji betonowych.
Z dokonanych pomiarów przewodnictwa dla wody przed gotowaniem wyniosło 606μS, natomiast przewodnictwo wody po gotowaniu i oziębieniu wyniosło 658μS. Wynika z tych wartości, że przewodnictwo tej samej próbki po gotowaniu wzrosło. Może być to spowodowane zwiększeniem ruchliwości jonów lub rozpadem niektórych jonów pod wpływem wysokiej temperatury. Po ogrzaniu badanej próbki konieczne było jej ochłodzenie, ponieważ przewodnictwo roztworu zależy od temperatury tegoż roztworu.
2
λ [μS]
V Ca(NO3)2 [ml]
Wyszukiwarka
Podobne podstrony:
Oznaczenie twardości ogólnej metodą werenianową, inżynieria ochrony środowiska kalisz, Analiza Chemi
Spektrofotometria - oznaczenie miedzi, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody
Refraktometria, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
Pehametria, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
ChZT-Mn, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
Polarymetria, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
Spektrofotometria - oznaczenie manganu, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody
Konduktometria, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
Oznaczenie kwasowości, inżynieria ochrony środowiska kalisz, Analiza Chemiczna Wody i Ścieków
wersja do nauki, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody i ścieków, P
ogólne informacje o ściekach, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody
dekarbonizacja, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody i ścieków, Pl
Mikroskopowe badanie osadu czynnego, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technolog
Neutralizacja ścieków, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody i ście
wersja do nauki, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technologie wody i ścieków, P
pwsz ioś kalisz Ćw. 6 POLARYMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, analiza
pwsz ioś kalisz Ćw 4 Spektrofotometria, inżynieria ochrony środowiska kalisz, a pwsz kalisz ioś, ana
pwsz ioś kalisz moje sprawozdanie PEHAMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz io
więcej podobnych podstron