Trening 6
Materiał ćwiczeniowy (będzie zadanie na kolokwium z wydajności reakcji)
W reakcji 100 g acetonu i 200 g alkoholu metylowego powstało 100 g 2,2-di-metoksypropanu. Oblicz wydajność tej reakcji.
Masy molowe:.aceton 58 g/mol, metanol 32 g/mol, produkt 104 g/mol.
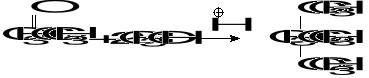
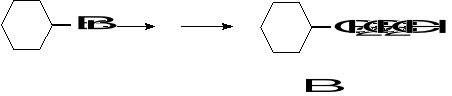
Wiedząc ,że wydajność poniższej syntezy wynosi 55% , oblicz , z jakiej ilości bromocykloheksanu należy wyjść, aby otrzymać 200 g alkoholu B.
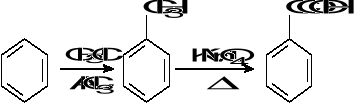
Oblicz, ile benzenu trzeba użyć do dwuetapowej syntezy prowadzącej przez toluen do kwasu benzoesowego, w celu otrzymania 200 kg kwasu benzoesowego. Wydajność pierwszego etapu wynosi 70% a drugiego 90%.
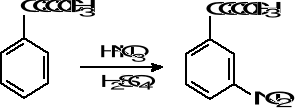
Oblicz ile meta-nitrobenzoesanu metylu otrzymano w reakcji syntezy tego związku, jeżeli do reakcji użyto 6,3 cm3 benzoesanu metylu o gęstości 1,08 g/cm3, a reakcja przebiegła z 75% wydajnością. Odczynniki nieorganiczne zastosowano w nadmiarze.
W wyniku reakcji 100 g kwasu benzoesowego C6H5COOH i 200 cm3 etanolu C2H5OH o gęstości 0,78 g/cm3 otrzymano 110 cm3 benzoesanu etylu C6H5COOC2H5 (d = 0,87 g/cm3). Oblicz jej wydajność.
Wiedząc, że najwyższą wydajność podanej reakcji (90%) uzyskuje się przy użyciu dwukrotnego nadmiaru kwasu octowego, oblicz, ile należy użyć kwasu oraz 1-butanolu, aby otrzymać 200 g estru.
Masy molowe: kwas 60 g/mol, alkohol 74 g/mol, ester 116 g/mol.
![]()
Ile kilogramów kwasu salicylowego (kwasu 2-hydroksybenzoesowego) należy użyć do wyprodukowania 5 ton aspiryny (kwas acetylosalicylowy) jeżeli wiadomo, że synteza przebiega z wydajnością 85% a krystalizacja surowego produktu z 80% wydajnością.
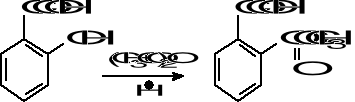
Ile cm3 nitrobenzenu (d = 1,20 g/cm3) trzeba użyć w celu otrzymania 120 g „surowej” aniliny, jeżeli reakcja redukcji przebiega z wydajnością 75%, a niezbędne odczynniki nieorganiczne (żelazo i kwas solny) zastosowano w nadmiarze.

Przeprowadzono następujący ciąg reakcji:
![]()
Każdy z etapów przebiegał z wydajnością 70%. Ile m3 butenu należy użyć do tej reakcji, aby otrzymać 3 dm3 ketonu (d = 0,81 g/cm3).
W reakcji kwasu 5,00 g kwasu salicylowego i 100 cm3 metanolu (d=0,79 g/cm3) powstało 3,30 cm3 estru metylowego kwasu benzoesowego (d= 1,17 g/cm3). Oblicz wydajność tej syntezy.
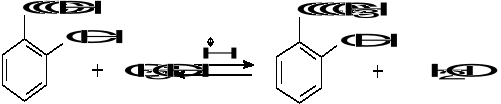
W reakcja kwasu 10 g kwasu salicylowego i 200 cm3 metanolu (d=0,79 g/cm3) przebiegła z wydajnością 70% Oblicz, ile cm3 estru metylowego kwasu salicylowego otrzymano (gęstość estru d= 1,17 g/cm3).
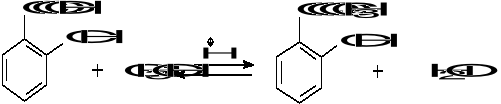
Cykloheksyloaminę otrzymano z cykloheksanolu w dwuetapowej syntezie. Wydajność pierwszego etapu wynosiła 85% a drugiego 70%. Do reakcji użyto 200 g cykloheksanolu. Ile gramów produktu otrzymano?
![]()
Trening z materiału wykładowego
Podaj przykład reakcji:
a) addycji elektrofilowej AE (patrz wykład 5 otrzymywanie halogenopochodnych z alkenów, addycja wody do alkenów, addycja bromu do alkenów),
b) substytucji nukleofilowej SN (patrz wykład 5 reakcje halogenopochodnych)
c) reakcji substytucji elektrofilowej aromatycznej (patrz reakcje węglowodorów aromatycznych wykład 3)
d) reakcji eliminacji (patrz wykład 5 reakcje halogenopochodnych)
2. Odpowiednim przykładem zilustruj:
a) reakcję dehydrohalogenacji
b) dehydratacji
3. Podaj reakcję otrzymywania alkoholu etylowego z:
a) etenu i wody (w obecności mocnego kwasu)
b) z bromku etylu i NaOH
c) redukcji etanalu
d) redukcji etaninanu etylu (octanu etylu)
e) reakcji Grignarda (metanal + bromek metylomagnezowy)
d) hydrolizy estru (etanianu etylu- octanu etylu)
4.Z 1-propanolu ( propan-1-olu) i innych potrzebnych odczynników otrzymaj:
a) eter dipropylowy
b) etanian propylu (octan propylu)
c) 1-bromopropan
d) propanal
e) kwas propanowy
f) 1-propen
5. Porównaj kwasowość alkoholi i fenoli , napisz odpowiednie reakcje wykazujące, że fenole są mocniejszymi kwasami od alkoholi
6. Podaj reakcje utleniania alkoholi
7. Podaj metody określania rzędowości alkoholi (próba Lucasa i próba Jonesa)
8. Podaj różnice w określaniu rzędowości alkoholi i amin
9.Podaj przykład otrzymywania alkoholu, aminy i halogenopochodnej
10. Narysuj wszystkie wiązania wodorowe , które mogą być utworzone w:
a) roztworze wodnym etanolu i 1,2-dihydroksybenzenu
b) roztworze wodnym etyloaminy i alkoholu metylowego
c) w roztworze wodnym trietyloaminy i etanolu
Wyszukiwarka
Podobne podstrony:
Teoria i metodyka treningu zdrowotnego WYKŁAD (1)
Trening zdrowotny wykład (1)
Leki z koł wykladowych 08 2009
PROGRAMOWANIE I REALIZACJA TRENINGU ZDROWOTNEGO (wykład)
pytania treningowe, pytania treningowe do wykładu VIII 2013, 1
Komunikacja i trening interpersonalny wyklady
kol wykład
Wykład Ch F wielkości kol
Trening 5 do kol5, wykłady
ptsis wykład kol 1
Trening 3 do kol3, wykłady
pytania treningowe, pytania tren wykład VII 2013
Wykład 3 Wentylacja efekt treningu
pytania treningowe wykład II 2015, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizy
2)WYKŁAD 6 EUROPEJSKIE AKTY PRAWNE DOT OCHR ŚR W TR KOL ŚRODL MORSKIM
ZASADY FIZJOLOGICZNE WARUNKUJACE EFEKT TRENINGOWY, Wykłady-Ronikier, Ronikier2
więcej podobnych podstron