Wykonał: Jacek Cebulski Szczecin 06.11.01r.
Bartłomiej Biba
POLITECHNIKA SZCZECIŃSKA
ZAKŁAD CHEMII FIZYCZNEJ
Laboratorium studenckie

Sprawozdanie z wykonania ćwiczenia nr 9:
„Wyznaczanie ciepła parowania heksanu z pomiaru zależności prężności pary od temperatury.”
Teoria:
Efekty cieplne towarzyszą nie tylko reakcjom chemicznym, również takie procesy jak zmiana stanu skupienia (parowanie, kondensacja, topnienie, krystalizacja) czy proces rozpuszczania substancji chemicznych, związane są ze znacznymi efektami cieplnymi.
W procesie parowania cząsteczki cieczy znajdują się w równowadze termodynamicznej z cząsteczkami pary nasyconej o ciśnieniu p i temperaturze T.
Jeżeli przez G(c) oznaczymy entalpię swobodną molową substancji w fazie ciekłej, zaś przez G(g) w fazie gazowej, to zgodnie z druga zasada termodynamiki różniczki zupełne rozważanych entalpii swobodnych wynoszą:
dG(c) = -S(c)dT + V(c)dp
dG(g) = -S(g)dT + V(g)dp
gdzie S(c) i S(g) oznaczają entropię molową cieczy i pary, zaś V(c) i V(g) ich objętości molowe.
W stanie równowagi G(c) =G(g) i wobec tego
-S(c)dT+V(c)dp= -S(g)dT+V(g)dp
Po przekształceniu otrzymujemy równanie Clasiusa
![]()
gdzie ΔS=S(g) - S(c) oznacza entropię parowania, zaś ΔV=V(g) - V(c) zmianę objętości w procesie parowania.
Ponieważ parowanie jest procesem równowagowym, a stąd także odwracalnym, możemy entropię procesu wyrazić za pomocą ciepła parowania Lp w temperaturze T:
![]()
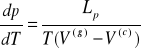
Dla równowagi ciecz-para, można przyjąć że, ciepło parowania nie zależy od temperatury, co jest w przybliżeniu słuszne dla małego przedziału temperatur. W dużym oddaleniu od punktu krytycznego V(g) >>V(c) , także objętość cieczy jest do zaniedbania w stosunku do objętości gazu, a para w tych warunkach spełnia w przybliżeniu równanie stanu gazu doskonałego. Przyjmując te założenia otrzymujemy równanie Clausiusa-Clapeyrona:
![]()
Lub
![]()
Po scałkowaniu, przy założeniu niezależności ciepła parowania od temperatury otrzymujemy:
![]()
Wykonanie pomiarów:
T [0C] |
T [K] |
1/T =xi
*10-3 |
h1 [mmHg]
|
h2 [mmHg]
|
Δh [mmHg] |
p=patm-Δh |
lgp=yi |
xiyi
*10-3 |
xi2
*10-5 |
23 |
296 |
3,378 |
685 |
86 |
599 |
169 |
2,228 |
7,527 |
1,141 |
27 |
300 |
3,333 |
644 |
100 |
544 |
224 |
2,350 |
7,834 |
1,111 |
31 |
304 |
3,289 |
662 |
115 |
547 |
221 |
2,344 |
7,712 |
1,082 |
35 |
308 |
3,247 |
651 |
130 |
521 |
247 |
2,393 |
7,768 |
1,054 |
39 |
312 |
3,205 |
640 |
144 |
496 |
272 |
2,435 |
7,803 |
1,027 |
43 |
316 |
3,165 |
620 |
166 |
454 |
314 |
2,497 |
7,902 |
1,001 |
Przykładowe obliczenia dla T=230C
Ciśnienie odczytane na barometrze w laboratorium wynosi: 768mmHg
xi =1/T
xi=1/296=3,378*10-3 [1/K]
Wysokość słupków cieczy manometrycznej przy pomiarach wynosi:
h1=685mmHg
h2=86mmHg
Δh=h1-h2=589-86=599mmHg
p=patm-Δh
p=768-599=169mmHg
yi=lgp
yi=lg169=2,228
xiyi=3,378*10-3 *2,228=7,527*10-3
xi2=(3,378*10-3 )2=1,141*10-5[1/K2]
Wyliczam współczynnik a:
Wyszukiwarka
Podobne podstrony:
SPRAWOZDANIE nr 6, Studia, Politechnika
Sprawozdanie nr 7, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, sprawozdania fiza
SPRAWOZDANIE nr 2, Studia, Fizjologia roślin
Sprawozdanie nr 3 niwelator, Politechnika Wrocławska
Sprawozdanie nr 3 niwelator, Politechnika Wrocławska
SPRAWO~1(10), Studia, Politechnika
Sprawozdanie - Projekt 2, Studia, Politechnika Opolska, Semestr V, [P] Grafika komputerowa II (K. Wr
Geodezja sprawozdanie nr 6, Studia, 1 rok, od Magdy, geodezja 1, Geodezja II, Geodezja (Kuba)
sprawozdanie cw 2, Studia - Politechnika Opolska, Semestr 6, NSI
seminarium nr 2, Studia - Politechnika Śląska, Zarządzanie, I STOPIEŃ, Podstawy zarządzania, Seminar
seminarium nr 3, Studia - Politechnika Śląska, Zarządzanie, I STOPIEŃ, Podstawy zarządzania, Seminar
201 sprawozdanie-fizyka, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WS
Sprawozdanie nr 6, Studia, Chemia, chemia7
Sprawozdanie nr 8, Studia, Chemia, chemia7
Sprawozdanie nr 3, Studia, I semestr II rok, Biochemia, Różne
więcej podobnych podstron