FIZ.WŁAŚC.WODY-1-obj.właśc-od 0-4C;w temp.4Cobj.właśc.osiąga wartość minim; Dalsze podwyższanie temp. powod. wzrost obj. na skutek rozpadów asocjatów; 2-gęstość wody-zależy;.od temp.przy czym max. gęstość wody przy 4C,poniżej i powyżej 4C gęstość maleje; 3-ciepło właśc-woda ma duże ciepło właśc.; b.wolno się nagrzewa i wolno studzi; działa jak regulator ciepła; 4-napięcie powierzch-woda charakt. się znacznym napięciem pow. które spowod. jest wyst. wiązań wodorowych wyst. w asocjatach Ze wzrostem temp. nap. pow. maleje; 5-lepkość-woda charakt.się małą lepk.i ze wzrostem temp.lepk.wody maleje,a ze wzrostem ciś.rośnie;Max.lepk.w temp0C; 6-stała dielektr-woda ma dużą s.diele. co tłumaczy wyjątkową zdol.wody do rozpuszczania innych subst.Dzięki tej właśc.woda charakt.się silnymi właśc.dysocjacyjnymi;Ze wzrostem temp.stał diel.ulega zmniejszeniu; 7-adsorpcja promieniow.widzialnego-woda w stanie chem.czystym charakt.się zdol. pochłaniania z widma elektrycz.pro- mieniow. czerwonego o dł.fali 0,61-0,76μm,co powod.że obserwujemy niebieskie-tzw.zabarwienie dopełniające;8-przewodzenie prądu elekt-woda w postaci czystej jest b.słabym przewodnikiem prądu;Przewodność elekt.jest funkcją stęż.jonów zaw.w wodzie i jonów pochodz. z dysocjacji czystej wody;Zal.od temp-wraz ze wzro- stem przewodność zwiększa się,rośnie również stopien dysocjacji;
Wody NATURALNE-źródła zanieczyszcz-wymywanie i infiltracja z wylewisk śc;-wycieki z instalacji przemysł;-odcieki ze składowisk odpadów stałych;-lotniska; -aglomeracje miej;ODCZYN wód nat.zal.od:-układu węglowego CO2;-podłoża z kt.mogą być wymywane skł.;-rodzju gl.w zlewni;-doprowadzanych zanieczyszcz;
Wody atmosferyczne: •forma gazowa - para wodna, •forma ciekła - deszcz, rosa, •forma stała - grad, szron, •forma koloidalna - chmury, mgły.
Wody PODZ.-ich skład chem.uzalezniony jest od;-miejsca wyst.tych wód;-jakości wód infiltracyj;-ośrodka skalnego i czasu przebywania w tym ośrodku;-proc.fizyko-chem.i biogeochem.zachodz.w warstwie wodonośnej;Na jakość wód podz.wpływają:-proc.ługowania zw.min;-degradacja mikrobiolog.subst.org;-dyspersja rozprosze -nia subst.chem;-sorpcja i wymiana jonowa;-proc.rozcieńczenia i wymiana gazowa;
Gazy rozpuszczone w wodach nat.--N;-CO2;-O2;-H2S;-CH4 -NH3;-SO2;-H2;-CO;-He;-Ar; Przedostają się do wód:-z pow.atmosf.-w wyniku proc.chem.i biochem.zach w środ.zew.z kt.pochodzi woda;-w wyniku proc.zach.w wodach; CO2-pochodzi z tlenowych i beztl. proc.rozkładu zw.org;-wietrzenia i wymywania min.węglowych; -proc. metabolicz.org.żywych;-w wyn.rozpu szczenia CO2w powietrzu;-uwolnienie z wodorowęglanów;CO2 w wodach pozd.pochodzi z:-infiltrujących wód pow;-proc.przemian bioch.zach. w strefie areacji i saturacji;-wietrzenia min.węglowych(FeCO3+H2O→Fe(OH)2+CO2 ;-reakcji redukcji w obecności Corg.-diageneza i meta- morfizm min.węglowych;-utlenienie zw.org; O2-zaw.w wodach rośnie ze wzrostem ciś.atmosf,maleje ze wzrostem temp.i zasolenia; Źródła:-rozpuszczanieO2 atmosf; -powst.O2 w wynuku proc.fotosynt; Do wód podz.O2rozp.przenika wraz z wodami opadow.lub pow. Może przenikać na drodze dyfuzji ze strefy areacji; Siarkowodór H2S -w wodach pow. może być pochodzenia:-mech-wyst.w wodach w obecności CO2 i zw.Fe na skutek rozkładu siarczków met.pod wpł.H2CO3-organicz-anaerobowy rozkład zw.org. zaw.siarkę;-biologicz-powstaje z siarczanów na skutek redukcji przez bakteriw siarkowe-proc.zach.w war.beztl.w wodach zaw.siarczany; Formy występowania zależą od pH. Przy pH 5-7 - gazowy siarkowodór, jon HS-. Źródła:-kontakt z gazami wulkanicznymi;-dopływające ścieki przemysł.(z gazowni,koksowni,przeróbki ropy naft) Azot Formy azotu w wodach: a)azotany, b)azotyny, c)azot amonowy (kation).
Do głównych źródeł azotanów: spływy powierzchniowe, zanieczyszczenia obszarowe, dopływające ścieki, opady atm., procesy nitryfikacji. Azotany do wód podziemnych mogą przenikać w sposób naturalny i działalności człowieka - przenawożenie gleb nawozami naturalnymi, naw. mineralnymi, niewłaściwe przechowywanie nawozów, odcieki z wysypisk odpadów, opady atm.
Proces amonifikacji: R-NH2-OH → R-OH + NH3 + Q
Powstawanie kwaśnych deszczy: SO2+H2O→H2SO3 H2SO3+ H2O2→ H2SO4 SO2+ H2O2→SO3 SO3+ H2O→ H2SO4 W 60-70% odczyn wód opadowych spowodowany jest obecnością H2SO4. W 30-40% odczyn wód opadowych spowodowany jest obecnością HNO3. 2NO+2O2→NO2 2NO2+H2O→HNO2+HNO3.
Rodzaje zanieczyszczeń w wodach opadowych. I grupa: rozpuszczone gazy, II grupa: zanieczyszczenia stałe: - rozpuszczone, - silnie zdyspergowane, III grupa: zan. bakteriologiczne.
Wody podziemne. Skład uzależniony od miejsca występowania, od jakości wód infiltrujących, od natury ośrodka skalnego, w którym one występują, od zachodzących procesów fizyko - chemicznych, od procesów biogeochemicznych.
Podział: -wody podpowierzchniowe (zaskórne, hipodermiczne), -wody gruntowe (freatyczne) - najbardziej dostępne, -wody wgłębne - większe głębokości, odizolowane utworami nieprzepuszczalnymi - lita skała, glina, -wody głębinowe - są odizolowane od pow. Ziemi, silnie zmineralizowane.
Rodzaje skażeń wód: 1.Zanieczyszczenia geogeniczne (naturalne), 2.Zanieczyszczenia antropogeniczne (wywołane przez człowieka): chemiczne, biologiczne, radioaktywne. Wg zasięgu oddziaływania: 1.Ogniska punktowe (szambo, magazyny). 2.Ogniska liniowe (drogi, ciągi komunikacyjne). 3.Ogniska małopowierzchniowe (duże osadniki, pola filtracyjne). 4.Ogniska wielkoprzetrzeniowe (tereny intensywnego nawożenia).
Strefa saturacji - położona jest poniżej strefy aeracji, jest ona częścią warstwy wodonośnej, w której wszelkie przestrzenie otwarte są wodą. Strefa aeracji - oprócz wody występuje faza gazowa (powietrze i inne). Granicę pomiędzy strefami tworzy zwierciadło wody podziemnej. Czas przemieszczania wody przez st. aeracji - od kilku m-cy do kilku lat.
Wody mineralne 1. wody wodorowęglanowe (zaw. Ca i Mg), 2.wody solankowe (NaCl i KCl), 3wody wodorowęglanowosiarczanowe (CaHCO3, MgHCO3, MgSO4), 4wody żelaziste ( Fe(HCO3)2 ), 5wody siarczanowo - siarkowodorowe (CaSO4, MgSO4, H2S), 6wody radoczynne ( Ra i V w bardzo małych ilościach). Na jakość wód podziemnych wpływają: a)procesy ługowania (wymywania) sub. mineralnych, b)procesy degradacji mikrobiologicznej sub. organicznych, c)procesy dyspersji, d)procesy sorbcji i wymiany jonowej, e)wymiana gazowa powietrze - grunt, f)procesy rozcieńczania,
Wody powierzchniowe: 1.oceaniczne, 2.morskie, 3.śródlądowe (płynące, stojące)
Wody powierzchniowe płynące. Zanieczyszczenia w wodach: a)mineralne, b)biogenne, c)zw. organiczne, d)gazy rozpuszczone, e)zan. bakteriologiczne. Procesy chemiczne wpływające na jakość wód: 1.reakcje utleniania i redukcji, 2reakcje kwas + zasada, 3reakcje wymiany pomiędzy atmosferą i wodą, 4wytrącanie, 5rozpuszczanie ciał stałych,6 reakcje kompleksowania, 7adsorpcji i desorpcji. Zanieczyszczenia w wodach: mineralne, biogenne, zw. organiczne, gazy rozpuszczone, zan. bakteriologiczne.
Wody pow. stojące dzielimy na: małe zbiorniki (stawy, jeziora), duże zbiorniki (średnie, duże jeziora).
Skład wody uzależniony od podłoża i warunków atmosferycznych. Silne opady powodują rozcieńczenie zanieczyszczeń.
W średnich i dużych jeziorach koncentracja zan zależy od: 1.ilości, jakości dopływających zanieczyszczeń, 2.rodzaju podłoża, 3.rodzaju gleb zlewni. Pr. chem. wpływające na jakość wód: 1.reakcje utleniania i redukcji, 2.reakcje kwas + zasada, 3.reakcje wymiany pomiędzy atmosferą i wodą, 4.wytrącanie, 5.rozpuszczanie ciał stałych, 6.reakcje kompleksowania, 7.adsorpcji i desorpcji.
Samooczyszczanie zależy:
a)biodegradacja zw org, b)sedymentacja c)adsorpcja d)fotoliza e)ewaporacja
Skład wód naturalnych.
1.odczyn wód naturalnych zależy od: a)tzw. układu węglanowego, b)rodzaju podłoża, c)rodzaju gleb w zlewni (lub warstwy wodonośnej), d)doprowadzanych zanieczyszczeń.
Układ węglanowy. CO2 gazowy, CO2 rozpuszczony w wodzie, kwas węglowy, kwaśne węglany, węglany nierozpuszczalne w wodzie, Układ węglanowy powoduje buforowanie wód naturalnych.
Poszczególne formy u.w. uczestniczą w; reakcjach zachodzących w procesie fotosyntezy, reakcjach zachodzących w procesie respiracji, przy rozpuszczaniu ciał stałych, przy wytrącaniu ciał stałych, w procesach biochemicznego rozkładu zw. organicznych.
Nitryfikacja: I etap (bakterie nitrosomonas) :15CO2+13NH4+=10NO2-+3C2H7O2N+23H++4H2O+energia
II etap (bakterie nitrobacter): 5CO2+NH4++10NO2+2H2O=10NO3-+C2H7O2N+energia Nitryfikacja zalezy: a)zawartosc O2, b)temp c)pH d)steż substratów i produktów e)ilosc bakterii f) Wzrost mat.org.znacznie obniża efektywność proc.nitryfik;g)dostepność światla h) Wartość krytyczna w okolicy kt.proc. nitryf.ulega zahamowaniu-0,8mgO2/l; Temp.optymalna-25-36C;Min.temp- 8C-później ulega zatrzymaniu; pH optymalne-7,6; Liczba bak.-1000-10000w ml
Denitryfikacja I typ- heterotroficzna (bakterie heterotroficzne) substancje potrzebne :wegiel org przyswajalny, azotany (V) fosforany
II typ- autotroficzna (rozne bakterie) Przebieg zalezy od: a)minimalna ilosc tlenu >0,1-0,2 b)stezenie głuchych substratów c)stez √ odzywczych Na, Ca, Fe d)pH e)temp
Siarczany Pochodzenie: a)wskutek wymywania skał, b)wymywanie gleb, c)opady atmosferyczne, d)biochemiczne utlenianie innych form siarki, e)ścieki. Siarka może być z :a)procesów spalania paliw kopalnianych, b)emisja SO2 do atmosfery, c)składowanie odpadów górniczych, d)utlenianie siarki organicznej (gleba i ścieki), e)składowiska odpadów komunalnych.
Siarczany wapnia i magnezu nadają wodzie gorzki smak.
Krzemiany Źródła: a)wietrzenie skał, b)wymywanie minerałów (albit NaAlSi3O8),
Formy: a)koloidalna, b)zawiesina (krzemionka, glinokrzemiany), c)roztwory rzeczywiste.
Formy chemiczne w wodzie: a)niezdysocjowana krzemionka - SiO2, b)niezdysocjowany kwas metakrzemowy - SiO2xH2O (H2SiO3), c)niezdysocjowany kwas polikrzemowy - X SiO2 Y H2O,
Fosforany Żródła: a)wietrzenie i rozpuszczanie skał b)splywy powierzchniowe c)opady atmos d)ścieki e)erozja gleby
Fosforany: polifosforany, tripolifosrorany, metafosforany
Organiczne: fosfolipidy, fosfoamidy, nukteotydy
Postać kwasu |
pH |
|||||
|
5 |
6 |
7 |
8 |
10 |
11 |
H3PO4 |
+ |
+ |
- |
- |
- |
- |
H2PO4- |
+ |
+ |
+ |
+ |
+ |
- |
HPO42- |
+ |
+ |
+ |
+ |
+ |
+ |
PO43- |
- |
- |
- |
- |
+ |
+ |
Kationy Amonowy NH4+
Zawartość azotu amonowego uzależniona jest od: a)dopływu amoniaku ze źródeł punktowych i obszarowych, b)potencjału redoks, c)wartości temperatury, d)rozwoju roślinności wodnej.
Magnez Postać: a)w postaci Mg2+ (siarczany, kwaśne węglany), b)w w. powierzchniowych stężenie <40 mg/dm3, c)w w. rzecznych Ca : Mg = 4 : 1 (2 : 1). Wody podziemne 0,5 ÷ 50 mg/dm3. Żródła: a)ługowanie skal np. dolomitow b)ze ścieków c)skladowiska odpadów komunal, przemyslo
Wapń Formy: a)Ca2+, b)CaSO4, c)CaHCO3, d)ługowanie skał (kalcyt, dolomit), e)stężenie zależy od pH i od zawartości CO2, f)aktywny w procesach sorpcji i wymiany jonowej, g)składowiska popiołów, odpadów komunalnych, odpadów przemysłowych (górnictwo), h)największy emiter wapnia - białe morza - odpady z przemysłu sodowego,
Sód Formy: a)kation Na+, b)kwaśny węglan NaHCO3, c)węglany, d)siarczany. Źródła: a)ługowanie ze skał (wietrzenie skaleni) b)z obaszarow rolniczych c)składowiska Naturalne przyczyny wysokich stężeń: a)naturalne występowanie wód słonych, b)ługowanie złóż soli kamiennej, c)zanieczyszczenia antropogeniczne sodem (odprowadzenie wód kopalnianych, eksploatacja złóż ropy i gazu, przecieki z rur transportujących solankę, odpady z przemysłu chemicznego, ścieki komunalne, odcieki ze składowisk odpadów komunalnych, zimowe utrzymanie dróg),
Potas Źródła: a)ługowanie ze skał (wietrzenie skaleni) b)z obaszarow rolniczych c)składowiska
Ocena jakości wody dokonuje się przez okreslenie sumy równowaznikó kationow z anionami obliczonych na podst analiz. Powinno się uwzglednic w analizie: Cl, SO42-, HCO3-, K+, Na+, Mg2+,Ca2+.
mg przelicza się na mval: (stez * wartosciowosc)/masa molowa
Bledy grube: a)podczas przekazywania wynikow b)przy ustalenieu zakresu aparatury c)przy pochyleniu proby d)przypadkowe zanieczyszczenie probki
Precyzja - rozrzut pomiarów w stosunku do średniej z tych pomiarów.
Analizy wzajemnie się wykluczające - jeżeli w analizie oznaczono kilka głównych kationów: Na+, Mg2+, Ca2+, to suma tych jonów wyrażona w mval/dm3 pomnożona przez 100 i podzielona przez przewodność elektryczną właściwą (μs/cm3) powinna mieścić się w granicach 0,92 ÷ 1,24.
Jeżeli oznaczano aniony: HCO3-, CO3-, SO42-, Cl-, to suma tych jonów w mval/dm3 pomnożona przez 100 i podzielona przez przewodność elektryczną właściwą (μs/cm3) powinna mieścić się w granicach 0,92 ÷ 1,24.
Jeżeli oznaczono substancje rozpuszczone mineralne, to ich zawartość w mg/dm3 i podzielona przez przewodność elektryczną właściwą (μs/cm3) powinna mieścić się w granicach 0,55 ÷ 0,96.
Twardość ogólna wody po przeliczeniu na mval/dm3 musi być równa sumie mval/dm3 Ca, Mg, Sr, Ba.
Wybrane parametry organiczne wskaźniki organiczne ogólne (ChZT, BZT, OWO, ogólne zap. tlenu, straty przy prażeniu, absorbancja w nadfiolecie, ekstrakt węglowo - chloroformowy.); wskaźniki organiczne specyficzne,
a) RWO - ogólna zawartość węgla związanego w sub. organicznych,
Zanieczyszczenia pochodzenia sztucznego - składowiska odp. komunalnych, rafinerie ropy naftowej, drogi, linie kolejowe, lotniska, aglomeracje miejskie, przemysłowe.
Zanieczyszczenia pochodzenia naturalnego - torfowiska, bagna, formacje burowęglowe.
b)OWO - oznaczenie wszystkich zw. zawierających węgiel (RWO(rozpuszczony), NWO(nierozpuszczony), LWO (lotny)).
c) ChZT-utlen zw orga silnymi utleniaczami
d)BZT -ilosc tlenu potrzebnego na utlen zw org na drodze biochemicznej
e)Współczynnik absorbcji w nadfiolecie Wykorzystuje się fakt pochłaniania promieni UV przez większość związków rozpuszczonych w wodzie. Pomiar dokonuje się na próbce przefiltrowanej (długość fali λ=254 nm, grubość warstwy wody 5 cm).
Absorbancja: ekstynkcja E Transmitancja - procent pochłaniania A = log (100/T) -uzyskuje się oznaczenie tylko części zw. organicznych (benzen, toluen, fenol (pierścieniowych)).
f)Azot organiczny Azot ogólny = wszystkie zw. organiczne zawierające azot (naturalne i sztuczne) - białka, aminokwasy, mocznik, pirydyna. Źródła azotu: a)szczątki roślin i zwierząt, b)nawozy amidowe (gł. skł. moczniku), c)ścieki związane z rolnictwem, d)odpady z przetwórstwa rolnego, e)ścieki bytowe, f)składowiska odp. stałych zawierające materię organiczną
g) Ogólne zap. tlenu - zużycie tlenu na utlenienie wszystkich zw. organicznych znajdujących się w wodach.
Rozpuszczony chlor organiczny Suma wszystkich zw. zawierających chlor nazywamy chlorowymi zw. organicznymi.
Wskaźniki ogólne: a)AOX - suma zw. org. zaw. chlor, które zostały wydzielone na węgiel organiczny w drodze sorpcji, b)EOX - ekstrakcja rozpuszczalnikami organicznymi. Mogą być pochodzenia naturalnego, ale większość stanowią zw. syntetyczne:a)chlorowcopochodne węglowodorów - alifatyczne rozpuszczalniki chloroorganiczne np.: chloroform, tetrachlorek etylu, tetrachlorek węgla, trichloroetan, substancje tworzące się podczas chlorowania wody pitnej; THM, b)pestycydy chloroorganiczne, c)chlorofenole - trichlorofenol, pentachlorofenol, d)chlorobenzeny - heksachlorobenzen, polichlorowane bifenyle, e)dioksyny np.: TCDD
Chloroform CHCl3 Zródła :a)chlorowania wód zawierających sub. organiczne (zw. humusowe) b)infiltracji ścieków poddanych „obróbce chlorem” d)ścieki z przemysłu chemicznego, tekstylnego, papierniczego. d)opady atmo Ewaporacja (utlenianie) jest najistotniejszym czynnikiem eliminującym CHCl3 z wody. (inne:fotoliza, hydroliza, biodegradacja).
Tetrachloroetan C2Cl4 Należy on do org. substancji lotnych, używany jako rozpuszczalnik. Ciecz o słodkawo - eterycznym zapachu. Rozpuszczalność w wodzie 150 mg/dm3 w 20°C. Związek lotny. Źródła: wylewiska ścieków, wycieki z instalacji, odcieki ze skł. odpadów. Może ulegać powolnej biodegradacji. Ewaporacja - czynnik eliminujący.
Trichloroetan C2HCl3 Związek lotny, używany jako rozpuszczalnik. Ciecz bezbarwna o zapachu chloroformu. Rozpuszczalność w wodzie 1100 mg/dm3. Ulega sorpcji, biodegradacji (przy obecności metanu).
Wielopierścieniowe węglowodory aromatyczne WWA. benzo(a)piren - silnie kancerogenny, benzo(b)fluoraten, benzo(ghi)perylen, indeno(1,2,3,-cd.)piren, substancje stałe, ulegają sublimacji. WWA powstają w wyniku przemian materii organicznej. Rozpuszczalność węglowodorów aromatycznych rośnie w obecności detergentów. WWA ulegają fotolizie, utlenianiu. W dużym procencie ulegają sorpcji. Ulegają biodegradacji - powstają zw. fenolowe i kwasy organiczne (T1/2 = kilka dni, miesiecy). Pochodzenie: a)naturalne -WWA systezowane przez wiele mikroorganizmow i roslin -jako produkt przemiany materii -z paliw kopalnianych, z pożarów lasów, traw
b)antropogeniczne: -spalanie paliw kopalnianych -spalanie odpadów przmyslo, -scieranie powierzchni asfaltowych -z samochodow -z odciekow wysypiskowych
Fenole -zw aromatyczne które zawieraja 1 lub wiecej grup wodorotlenowych Postacie: fenol, krezol (o-krezol, m.-krezol, p.-krezol), ksylenol (dwie CH3) (2,3-ksylenol; 2,4: 2,5; 2,6; 3,4; 3,5), Żródła a)produkty przemiany mateii b)wchodza w sklad materii roslinnej c)produkty rozkladu naturalnego zw humusowych i lignin d)duzo w zywicach naturalnych, ropie naftowej e)scieki z koksowni i gazowni f)zakladow przerobki ropy naftowej, tworzyw sztucznych g)fabryk farbnikow i srodkow ochrony roslin
Substancje humusowe składa się z: lignina, celuloza, białka, chemiceluloza oraz z wlasciwych substancji humusowych i substancji tworzacych się w skutek procesow biochem Zródła: a)gleba b)torf c)ściółka leśna d)szczatki roślin Do subst humusowych zalicza się 3 kwasy: a)kw humusowe b)kw fulwowe c)kw hematomelanowe Kw humusowe daja się rozpuszczac w zasadach i nastepnie stracac kwasami Różnice: a)fulwokwasy maja mniejsza czasteczke a)dobrze rozpuszczaja się w wodzie c)w roztw wodnych ulegaja dysocjacji d)wykazuja właściwości kompleksotworcze Zawartosc kw humusowych zalezy: a)od rodzaju gleby b)od czasu kontaktu wod z podlozem c)skladu chem wod d)pH Obecnosc kw humus wplywa na: a)barwe, b)ChZT c)odczyn d)smak e)wiążą Fe, Mn
Detergenty: Mydla, srodki powierzchniowo czynne Sklada się z 2 czesci a)z czesci nie polarnej lub b malo polarnej b)z czesci silnie polarnej Podzial: 1.jonowe: a) anionowe - środki piorące, czyszczące, mydła, b)kationowe - śr. dezynfekujące, ihibitory korozji, śr. flotujące, c)amfoteryczne - kosmetyki, 2.niejonowe - śr. piorące, czyszczące. Produkcja: 60% anionowe, 30% niejonowe, 10% pozostałe.
Układy koloidalne - nazywamy uklady mikro niejednorodne w których wymiary czasteczki fazy rozproszonej mieszcza się w granicach 10-4-10-5cm Podzial: a)monodyspersyjne -czastki fazy rozproszonej maja taka sama wielkosc b)polidyspersyjne- rozna wielkosc czastek
Solwatacja -zjawisko łączenia czastek fazy rozproszonej o osrodkiem dyspersyjnym
Miareczkowanie -oznaczanie subst A poprzez dodawanie subst B o znanym stezeniu w warunkach umozliwiajacych...
Warunki: a)reakcja miedzy A i B powinna przebiegac stechiometrycznie zgodnie z reakcja b)przebieg reakcji powinien być szybki c)dodawany titrant nie może wchodzic w reakcje z innymi skladnikami z roztworu d)stwierdzenie PK który powinien być zgodny z punktem równoważności W zaleznosci od reakcji wyroznia się a)alkacymetria: (reakcje kw-zas) obejmuje:-alkalimetria (miareczko zasadą) -acydymetria (miarecz kwasem) b)redoksymetria (reakcje utlen i redukcji): -oksydymetria (miareczkowanie roztworami silnych utleniaczy) -reduktometria (miarecz roztworem reduktorow) c)wytraceniowe (reakcje wytracania trudno rozpuszcz osadow) d)kompleksometryczne (tworzenie rozpuszczalnych zw kompleksometrycznych- oznacz twardosci) Wedlug sposobu prowadzenia oznaczenia 1)miareczkowanie bezposrednie- oznaczana subst reaguje bezposrednio z dodawanym titrantem 2)posrednie -nie reaguje bezposrednio z titrantem lecz posrednio z inna substancje która się miareczkuje: a)odwrotne -dodaje się wiadoma ilosc w nadmiarze a pozniej się nadmiar odmiareczkowuje b)podstawieniowe- oznaczany skladnik A uwalnia z odpowiedniego zwiazku rownowazna ilosc skaladnika B który nastepnie jest bezposrednio miareczkowany
Punkt Rownowaznosci -punkt w którym dodana jest teoretyczna ilosc odczynnika wynikajaca ze stechiometrii reakcji.
PK -moment miarecz w którym jakas wlasciwosc roztworu wskazuje na koniec miareczkowania
Błąd miarecz -roznica miedzy objetoscia titranta zuzyta do osiagniecia PK a objetoscia potrzebna do osiagniecia PR
Jeżeli PK wystepuje przed PR to blad miarecz jest ujemny a wyniki sa za male
Bledy przypadkowe -zwiazane z technika pomiarow objetosci roztworow, oraz przy sporzadzeniu roztw wzorcowych
Blad kropli- wynika z tego ze PK można wyznaczyc tylko z dokladnoscia 1 kropli
Blad splywu- glowna masa roztworu splywa z wieksza predkoscia niz przy sciankach
Błąd odczytu- niewlasciwe ustalenie polozenia menisku cieczy
POTENCJAŁ REDOX-wyraża zdolność roztw.do migracji elektronów;Głównymi czynnikami potencjałotwórczymi są:-O2 rozpuszcz;-subst.org.kt spełniają rolę reduktorów; Jeżeli stęż.zw.org.maleje na skutek utleniania to malej również potencjał a rośnie pE;Przy dużej wartości pE aktywność elektronów jest mała i system ma właśc.utleniające;Przy małej wart.pE system ma charakter redukcyjny;
Elektroobojętna cząsteczka-ma nagromadzone w okolicy tlenu dużo ładunków ujem.a w okolicy wodoru-dodatnich;Jest to wiązanie spolaryzow.powst.w przypadku atomów o znacznej różnicy elektroujemności;Wiązania spolaryz.prowadzą do charakteru dipolowego; Temp.p-ktu potrójnego-temp.topnienia lodu pod ciś.jego pary nasyconej;
BROMKI-bogatew Br są wody sąsiadujące z pokładami subst.ropopochod. Formy występ.-bromki(Br);-bromiany (BrO3-); -jony bromianowe(BrO2-); FLUORKI-wzrost stęż.w zimie; Fluor-pierw.życia; Nadmiar:-fluoroza; Źródła-składowisko odpadów przem;-śc.przemysł;JODKI-J- niezbędny mikroelement;-wyst.w wodach w niewielkich ilośc;-gl.próchniczne podwyższają przedostanie się jonów jodkowych do wód;-odpowiedzialne za powst.hormonu tarczycy;-nadmiar jest toksyczny
Współczynnik absorbcji w nadfiolecie Wykorzystuje się fakt pochłaniania promieni UV przez większość związków rozpuszczonych w wodzie. Pomiaru dokonuje się na próbce przefiltrowanej (długość fali λ=254 nm, grubość warstwy wody 5 cm). Absorbancja: ekstynkcja E Transmitancja - procent pochłaniania A = log (100/T) -uzyskuje się oznaczenie tylko części zw. organicznych (benzen, toluen, fenol (pierścieniowych)).
CO2 **pow- tlen i beztl proc rozkł zw org/ wietrze i wymyw minerałów węglanowych/ ropuszczalność CO2 z pow atm/ proc metaboliczne org żywych/ uwalniane z wodorowęglanów **podz- infiltrujące wody pow i opadowe/ proc przemian biochem zach w strefie aeracji i saturacji/ proc wietrz min węgl/ redukcja siarczanów w obecności węgla org/ diageneza i metamorfizm miner węglanowych/ utlen zw org Siarkowodór **miner-w podz w obecn CO2 i zw żelaza na skutek rozkł siarczków metali **org- rozkł beztl zw org zawier siarkę **biol- beztl reduk siarczanów przez bakt siarkowe **pow -gazy wulkaniczne **pow-śc przem (chem, ropa naft) Azotyny NO3 **pow- spływ pow/ zan obszarowe/ śc miej i przem/ opad atm/ proc nitryfikacji/ rozkł zw org zawier N// **podz- przenawożenie gleb nawozami miner (saletra amonowa, saletrzak) i org (gnoj i obor)/ odciek ze skł komun i przem/ nieodpow przechowyw nawozy/ nitryfikacja w warst wodonoś Chlorki- ść kom/ nawozy nat/ odciek ze skład kom i przem Siarczany- wymyw skał (anhydryt, epsonit, mirabilid) i gleb/ utlen biochem siarczków lub innych form siarki/ dopł ść/ opad atm/ utl siarki wprowadzonej przez człow (spal paliw kop/ skład odpadów górn/ utlen Sorg zawart w glebie i skałd odpadów kom) Fosforany- wietrz i rozpusz miner fosforanowych/ erozja gleby/ spływ pow z ter nawoż/ opad atm/ ść byt-gos i przem Kat amonowy **nat -rozkł materii org **Antropol- nawozy org/ ść byt i z roln/ odpady z przetwór roln/ skład odp stałych i odp przem zawier materie org Sód **nat- ługow, wymyw i wietrz skaleni **antr- eksp złóż ropy naft i gazu/ odp z przem chem/ ść kom/ odprow wód kopaln/ zimowe utrzym dróg Potas- ługow ze skaleni i biotytu/ wymywanie z nawozów org i sztucz/ odciek ze skła kom
Wapń i mag- ługow/ ść przem/ skład kom i przem (popioły, opd z górnictwa węglowego, przem sodowego)/ skład odp poflotacyjnych Met cięż- antr- rolnict (pestycydy/ zaprawy rtęciowe do rośl/ nawozy min i nat/ środ suszące)/ Kompostownia (ołó kad rtę mie nik cynk ars bizmut)/ przem metarulg- specjal stopy i stale(oło kad molib nik cynk cyna chr ars bizm antymon)/ do prod półprzew i elem elektrotech/ spal paliw kopal i C ropa naft/ ogniwa bater akumul/ farby i pigm/ środki konser żywn/ katalizatory/ śc komunal/ wysyp odp kom i przem Azot org- szcząt rośl i zw/ mocznik/ nawozy/ śc związane z roln (obor i gnoj)/ odpz przetwórst rolnego i przem spożyw/ ść byt-gos/ odciek ze skł komi przem/ opad atm(mało) **zanicz obszar- ieregulow gospodarka ść teren rol/ roln wykorz ść/ nadmiar stos nawoz org/ **mało, śr- skł odp kom i przem (rolno-spoży) Chlor org- subst syntetycz- chlorowcopochodne węglowodorów (ropuszcz alifatyczne chloroorg/ chloroform/ tetrachlorek węgla) i THM-y/ pestycydy chloroorg/ chlorofenole/ PCB/ tetrafenyle/ dioksyny/ chlorowane zw humusowe/ halogenowe węglowodory wielocząst Chloroform zrzut lub infiltr śc przem oraz chlorowanych ść pochłodniczych Tetrachloroeten wymywanie i infiltr z wylewisk ść/ wycieki z inst przem i z kanaliz/ odciek ze skład odp stałych/ lotniska/ opad atm z aglomeracji miejsko-przem Fenole **nat- produkt przemian materii zw i człow/ składnik materii rośl/ z rozkł zw humusowych lignin/ bodegr WWA/ żywice naturalne/ ropa naft// **antr- śc z gazowni i koksowni/ śc z zakładów (przeróbki ropy naft/ tworzyw sztucz/ barwników/ środków ochr rośl) WWA **nat- przemiany materii org/ w paliwach kopal/ pożary lasów i erupcje wulk// **antr- spal ropy naft i paliw kopal/ spal odp/ zmywanie ścierającej się powierzchni asfaltowej i opon/ emisja spalin/ ść komi przem/ skład odp stałych/ detergenty
Jakość wód podziemnych? procesy ługowania, zw. mineralne, degradacja mikrobilogiczna subst. organicznych, dyspersja rozproszona, na substancje chemiczne, sorpcja i wymiana jonowa, procesy rozcieńczenia i wymiana gazowa Układ węglanowy? CO2 gazowy + CO2 rozpuszczony w wodzie + kwaśne węglany + węglany rozpuszczone w wodzie Wyst CO2 pH≤4,3- post wyłącz gazowa / 4≤pH≥8- jako H2CO3 i HCO3- / pH=8,3-wyłacznie HCO3- Jakie jony mamy? 2Zp <Zm: CO3 2- + HCO3- //2Zp = Zm: CO3 2- // 2Zp >Zm: OH + CO3 2- //Zp=Zm: OH Formy zw. krzemu zależne od pH? w typowych wodach natężenie pH<8, większość SiO2 w formie niezdysocjowanej; pH>9 - formy zdysocjowane HsiO3-, Si4O6(OH)62-, w wodach o wysokiej zawartości zw. org. tworzą się krzemionki ze zw. org - zw. kompleksowe SiF6. Zawartośc krzemu powoduje powstawanie węgla kamiennego Występowanie krzemu w wodach naturalnych? w postaci roztworu rzeczywistego, zawiesiny, roztworu koloidalnego, Związki krzemu niezdysocjowana krzemionka SiO2, niezdysocjowany SiO4 * H2O, kwas ortokrzemowy, kwas polikrzemianowy Źródła antropogeniczne RWO? zakłady przeróbki ropy naftowej i gazu ziemnego, stacje paliw, lotnisko, drogi, linie kolejowe, cmentarze, składowisko odpadów komun. Źródła naturalne RWO? tenery bagniste i torfowisk, naturalne pokłady ropy naftowej i gazu ziemnego, formacje geologiczne Procesy degradacji chloformu? fotoliza, biodegradacja, hydroliza Od czego zależą parametry denitryfikacji? od stężenia głównych substratów, stężenia pierwiastków mineralnych, odczyn (optymalne pH od 7 do 8), temperatury (optymalna 25 - 370C ) Przebieg procesu nitryfikacji zależy od następujących czynników: temperatury, od dostępności telnu, pH, stężenia substratów i produktów reakcji, ilości bakterii nitryfikacyjnych, dostępności światła, turbulencji, zawartości materii organicznej Procesy przy kwasowości H+ + OH-⇒H2O // H2CO3 + 2OH ⇒CO3 2- +2H2O // HCO3- + OH⇒CO3 2- +H2O Procesy przy zasadowości Zp OH+H⇒H2O // CO3 2- + H⇒HCO3- // Zm HCO3- +H⇒CO2+H2O Wyst S <5-HS-- nie wyst/ =7-głóna postać to HS/ 5<pH<7-sa HS i H2S/ >9-H2S brak/ >10-wyst S2+ Kat amonowy pot redoks/ temp/ ilość dopł zaniecz/ rozwój rośl wodnej Sole wapna *rozp w H2O CaCl2/ Ca(NO3)2 *słabo rozp Ca(OH)2/ CaO/ CaSO4×2H2O/ Ca(HCO3)2 *nierozp CaCO3/ Ca(PO4)2/ CaF2/ CaSiO3 Sole magnezu *rozp MgCl2/ MgSO4 *trudno rozp MgF2/ MgCO3/ MgSiO3/ Mg3(PO4)2/ Mg(OH)2 Metale cięż łatwo ulegaja *utlenialnośc *tworzenie trudno rozp soli i siarczany *łatwo ulegaja sorpcji na pow koloidów *łatwo ulegaja sedymentacji Sorbenty metali cięż minerały ilaste/ tlenki Fe i Mn/ subst org i zw humusowe
Jakośc wody A - Cl/ SO42- / HCO3 K - K/ Na/ Mg/ Ca Wybrane parametry organiczne wskaźniki organiczne ogólne⇒ChZT, BZT, OWO, ogólne zap. tlenu, straty przy prażeniu, absorbancja w nadfiolecie, ekstrakt węglowo - chloroformowy Czynniki wpływ na BTZ temp 20÷30/ subst pozywkowa BTZ:N:P=100;5;1/ pH 7÷8/ wpływ subst toksycznych THM rosna ze wzrostem dawki chloru/ temp/ pH/ zawart subst org tzw,prekursorem chloroformu Ewaporyzacja -eliminacja chloroformu na drodze: fotolizy/ hydrolizy/biodegradacji Subst humusowe wartość zależy od rodzaju gleby w podłożu i w zlewni/ czasu kontaktu wód z glebą/ składu chemicz wód/ pH Zawartość wpływa na smak/ barwę/ odczyn/ wzrost ChZT/ wzrost zawart Fe Mn i kationu amonowego Indeks fenolowy fenol/ krezole (meta orot i para)/ ksylenol (2,3-kylenol) WWA- banzo(a)piren/ banzo(b)fluoranten/ benzo(q)perylen/ fluoraten Migracja WWA ogranicza sorpcja/ utlenianie/ fotoliza/ biodegradacja przez mikroorg Pojemność buforowa? - jest to liczba moli mocnej zasady lub kwasu, która musi być dodana do 1 litra roztworu, aby spowodować zmianę pH o jednostkę. Alkacymetria- chemiczna analiza objętościowa, wykorzystująca reakcje zobojętniania do oznaczeń kwasów i zasad (acydymetria). Obejmuje:-alkalimetria (miareczko zasadą) -acydymetria (miarecz kwasem) Licz masowa - określa liczbę protonów i neutronów czyli nukleonów w jądrze atomowym danego izotopu pierwiastka. W przybliżeniu mówi ona o tym, ile razy masa danego atomu jest większa od masy atomu wodoru. Różnice między kwasami huminowymi a fulwowymi - •znacznie mniejsza masa cząsteczkowa, •lepsza rozpuszczalność w wodzie, •silne właściwości kompleksotwórcze, •łatwiej dysocjuje w wodzie, •złocista barwa, •przyczyniają się do kompl. Fe, Mn i Al. hymtamelanów od kw. huminowych - •rozpuszczalnością w alkoholu i znacznie mniejszą masą cząsteczek; •wolne kw. hymatom. są słabo rozpuszczane w wodzie i wyst. w postaci roztworów koloidalnych. Na co rozpadają się zw. zawierające H, C, O, P, S, N w war. tlenowych i beztlenowych? - •Tlenowe: (C)CO2, (H)H2O, (O)-, (N)NO2, NO3, N2O5, (S)SO2, SO3, (P)PO43-, P2O5; •Beztlenowa: (C)CH4, (O)H2O, (N)NH3, (S)H2S, (P)PH3.
Co to jest pojemność buforowa? - jest to liczba moli mocnej zasady lub kwasu, która musi być dodana do 1 litra roztworu, aby spowodować zmianę pH o jednostkę.
Co to jest alkacymetria, jakie działy w nią wchodzą? - chemiczna analiza objętościowa, wykorzystująca reakcje zobojętniania do oznaczeń kwasów i zasad (acydymetria). Obejmuje:-alkalimetria (miareczko zasadą) -acydymetria (miarecz kwasem)
Co to jest liczba masowa? - określa liczbę protonów i neutronów czyli nukleonów w jądrze atomowym danego izotopu pierwiastka. W przybliżeniu mówi ona o tym, ile razy masa danego atomu jest większa od masy atomu wodoru.
Wymienić 8 wskaźników org. - ogólne zapotrz. tlenu; straty przy prażeniu; węgiel org.; absorbancja w nadfiolecie; CHZT; BZT; azot org., ekstrakt węglowo-chloroformowy i węglowo-alkoholowy.
Wypisz 8 właściwości wody, które zależą od temperatury - gęstość wody + objętość + ciepło właściwe + napięcie powierzchniowe + adsorpcja promieniowania widzialnego + przewodzenie prądu elektrycznego.
Wzór na stałą dysocjacji i ile wynosi - K=[H+]·[OH-]/[H2O] [H2O] - można przyjąć wartość stałą, gdyż liczba nie- jest znikomo mała w stosunku do liczby zdysocjowanych.
Metody miareczkowania - •bezpośrednie: oznaczana subst. reaguje bezpośrednio z dodawanym titrantem; •pośrednie: subst. miareczkowana nie reaguje bezpośrednio z titrantem, lecz pośrednio z inną substancją, którą się miareczkuje: MET. odwrotne (odmiareczkowywanie nadmiaru); podstawieniowe (substytucyjne).
Jak oznaczamy straty przy prażeniu? - oznacza się przez odparowanie określonej objętości próby wody lub ścieków w parownicy do sucha, ostudzoną parownicę waży się a następnie suchą pozostałość się wypraża w temp. 55ºC. w tej temp. zw. org. ulegają spaleniu lub utlenieniu. Powoduje to obniżenie ciężaru ostudzonej parownicy. Jest to jednak przybliżona metoda oznaczania ogólnej zawartości zw. org. próby.
Co to jest asocjacja? - zjawisko łączenia się cząst. wody w duże zespoły lub grupy cząstek, przyczyną tego jest biegunowość cząstek elektrycznie obojętnych. Dipole wody przyciągają się różnoimiennymi biegunami a następnie łączą się wiązaniem wodorowym.
Wymień 6 gazów rozpuszczanych w wodzie - N + CO2 + O2 + H2S + CH4 + NH3 + SO2 + H2 + CO + He + Ar
Jak się dzieli wody mineralne? - •chlorkowe; •węglanowe; •siarczanowe; •kwaśne.
Podstawowe aniony i kationy podczas oznaczania zan. wody - •KATIONY: amonowy, sodowy, potasowy, Mg+Ca, metale ciężkie; •ANIONY: HCO3-, CO3-, SO42-, Cl-
Jakie jony występują w wodzie zależnie od pH? •2Zp <Zm: CO3 2- + HCO3-; •2Zp = Zm: CO3 2- ; •2Zp >Zm: OH + CO3 2-; •Zp=Zm: OH.
Jakie jony są w wodzie jeżeli badana próba wobec fenoloftaleiny nie zabarwi się na różowo? - są to jony CO32- i tworzą one zasadowość ogólną.
Co wpływa na jakość wód podziemnych? - procesy ługowania, zw. mineralne, degradacja mikrobilogiczna subst. organicznych, dyspersja rozproszona, na substancje chemiczne, sorpcja i wymiana jonowa, procesy rozcieńczenia i wymiana gazowa
Dlaczego w wodach podziemnych oznaczana jest mniejsza ilość fosforanów niż w powierzchniowych? - bo w wodach podziemnych fosforany są wiązane przez glinokrzemiany i ich zawartość jest bardzo niewielka, albo w ogóle ich nie ma.
Źródła sodu i chlorków w wodach podziemnych - ługowanie nat. pokładów soli kamiennej, z naturalnyh pokładów chlorkowych, wyniku ługowań skał, wietrzenia skaleni.
Antropogeniczne źródła sodu - •eksploatacja złóż ropy naftowej; •odpady z przem. chem.; •ścieki komun; •odcieki ze składowisk komun.; •odprowadzenie wód kopalnianych; •zimowe utrzymywanie dróg.
Dlaczego chlor jest ważnym wskaźnikiem zanieczyszczenia wód? - jego obecność w wodzie należy ocenić ze względu na pochodz. (geol. czy z zan.). Obecność Cl- wskazuje na zaniecz. przez: •bakterie poch. ze ścieków byt-gosp.; •ścieki miejskie i przem.; •odcieki ze składowisk odpadów komun.; •nawozy naturalne (gnojowica, obornik)
Metody oznaczania chloru organicznego (AOX, EOX) - •AOX: suma zw. org. zawierających Cl wydzielony na drodze sorpcji na węglu aktywnym; •EOX: suma zw. org. zawierających Cl wydzielony na drodze ekstrakcji rozpuszczalnikami org.
Co wpływa na jakość wód podziemnych? - procesy ługowania, zw. mineralne, degradacja mikrobilogiczna subst. organicznych, dyspersja rozproszona, na substancje chemiczne, sorpcja i wymiana jonowa, procesy rozcieńczenia i wymiana gazowa.
Żródła CO2 w wodach podziemnych - z infiltrujących w wód pow. procesów przemian biochemicznych zachodzących w strefie areacji i saturacji, wietrzenia min. węglowych, reakcji redukcji w obecności Corg, diageneza i metamorfizm min. węglowych, utlenienie zw. organicznych.
Źródła CO2 w wodach powierzchniowych - z powietrza atm., z tlenowych i beztlenowych procesów rozkładu związków organicznych, z procesów geochemicznych, metabolicznych organizmów żywych, uwalniany z węglanów zawartych w wodzie.
W wyniku zmniejszenia zawartości CO2 zachodzi reakcja: CO32- + H2O ↔ CO2 + 2OH-
W wyniku wzrostu zawartości CO2 zachodzi reakcja: H2O + CO2 ↔ H2CO3 ↔ H+ + HCO3- ↔ 2H+ + CO32-
Źródła H2S w wodach naturalnych? - kontakt z gazami wulkanicznymi + dopływające ścieki przemysłowe (z gazowni, koksowni, przeróbki ropy naftowej) HS- ↔ H+ + S2-
Układ węglanowy - w jego skład wchodzą: CO2gazowy, CO2rozpuszcz., kwaśne węglany, węglany nierozp. w wodzie; buforuje odczyn wód nat., bo poszczególne formy uczestniczą w: •procesach biochem. rozkładu zw. org.; •reakcji fotosyntezy; •reakcji respiracji; •reakcji rozpuszcz. ciał stałych; •procesach wytrącania ciał st.
Źródła siarczanów - •wymywanie skał (antracyt CaSO4, epsomit MgSO4·7H2O, mirabilit); •wyługowanie gleby; •utlenianie siarczków metali ciężkich; •ścieki miejskie lub przem.; •z produktów utleniania siarczków i siarki z rozkładu białka roślinnego lub zw.; •z gazów wulkanicznych; •wprow. do środ. przez człowieka: spalanie paliw kopalnianych (kw. deszcze); składowanie odpadów górniczych; utlenienie siarki org. zawartej w glebie; składowania odpadów komun.
Źródła fosforanów - •wietrzenie i rozpuszczanie minerałów fosf.; •erozja gleby; •spływy powierzchniowe z terenów nawożonych nawozami; •opad atmosf.; •ze śc. byt-gosp. i przem.
Źródła azotanów - •WODY POWIERZCHNIOWE: spływy powierzch.; zan. obszarowe; ze śc. miejskich i przem.; opady atm; proces nitryfikacji w wodach; rozkład zw. org. zawierających azot. •WODY PODZIEMNE: przenawożenie gleb nawozami min. i org. oraz ich niewłaściwe przechowywanie; odcieki ze składowisk odp. komun.; nitryfikacja w warst. wodonośnych.
Źródła azotu amonowego - WODY POWIERZCHNIOWE •biochem. rozkład org. zw. azotowych roślinnych i zw.; •zrzut śc. przem. i miejskich; WODY PODZIEMNE - NATUR.; ANTROPOG. •redukcja azotanów i azotynów przez siarkowodór; •nawozy org. (obornik gnojowica), •ścieki byt-gosp.; •ścieki rolnicze; •odpady z przetwórstwa rolniczego; •składowisko odpadów stałych oraz przem. zawier. mat. org.
Oznaczanie azotu og. metodą Kiejdahla - polega na mineralizacji zw. org. stężonym kw. siarkowym w obecności katalizatora (CuSO4, HgSO4). Przebieg przykładowej reakcji:
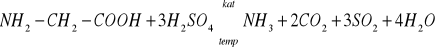
Zw. org. utleniane są do CO2, siarki, wody itp., zaś azot org. przechodzi w amoniak, który reaguje z kw. siarkowym tw. siarczan amonowy: 2NH3+H2SO4→(NH4)2SO4 Proces utleniania prowadzony w temp. 613÷643K.Trudno rozpuszczalne zw. magnezu - krzemian MgSiO3, fosforan Mg3(PO4)2, MgOH2, MgF2, MgCO3.
Rozpuszczalne zw. magnezu - CaCl2, Ca(NO3)2.
Form metali ciężkich w zależności od środ - •w wodach zawierających tlen rozpuszcz. (aerobowe) o odczynie kwaśnym, przeważa na ogół postać jonowa i rozpuszczalne w wodzie oraz nieorg. kompleksy metali; •przy odczynie alkalicznym powst. trudno rozpuszcz. wodorotlenki metali, nadmiar OH- powoduje tworzenie hydrokompleksów metali; •przy odczynie obojętny najczęściej obecne są węglany metali ciężkich.
Kationowe środki powierzchniowe - śr. dezynfekujące, ihibitory korozji, śr. flotujące, c)amfoteryczne - kosmetyki, 2.niejonowe - śr. piorące, czyszczące.
Źródła zanieczyszczenia RWO - ANTROPOG. zakłady przeróbki ropy naftowej i gazu ziemnego, stacje paliw, lotnisko, drogi, linie kolejowe, cmentarze, składowisko odpadów komun. NATURALNE - tereny bagniste i torfowisk, naturalne pokłady ropy naftowej i gazu ziemnego, formacje geologiczne.
Czym charakteryzuje się strefa aeracji? - oprócz wody występuje faza gazowa (powietrze i inne). Granicę pomiędzy strefami aeracji i saturacji tworzy zwierciadło wody podziemnej. Czas przemieszczania wody przez st. aeracji - od kilku m-cy do kilku lat.
Jakie są wody mineralne w zależności od składu? - 1.wody wodorowęglanowe (zaw. Ca i Mg), 2.wody solankowe (NaCl i KCl), 3.wody wodorowęglanowosiarczanowe (CaHCO3, MgHCO3, MgSO4), 4.wody żelaziste ( Fe(HCO3)2 ), 5.wody siarczanowo - siarkowodorowe (CaSO4, MgSO4, H2S), 6.wody radoczynne ( Ra i V w bardzo małych ilościach).
Źródła THMY w wodach: - procesów chlorowania wód zawierających substancje organiczne, głównie związki humusowe, infiltracja ścieków, ścieki zaw. chlor, opady atmosferyczne.
Co to jest amonifikacja? - hydrolityczny rozkład substancji azotowych przez drobnoustroje. Procesowi ulegają nie tylko subst. białkowe, ale i niektóre składniki moczu, jak mocznik (rozkłada się na amoniak i CO2).
Przebieg procesu nitryfikacji zależy od następujących czynników: temperatury, od dostępności telnu, pH, stężenia substratów i produktów reakcji, ilości bakterii nitryfikacyjnych, dostępności światła, turbulencji, zawartości materii organicznej
Co wpływa na proces denitryfikacji? - •zawartość O2 rozpuszcz., który ma działanie inhibitujące, optymalne stęż. 0,1÷0,2mg/l; •stężenie głównych substratów; •stężenie tzw. pierwiastków odżywczych: K, Ca, Na, Mn, Fe, Mg; •wartość pH, optymalna 7÷8; •temp., optymalna 25÷37ºC.
Określenie bilansu - na podstawie sumy równoważników kationów i anionów z wyników analizy. Min. ilość oznaczanych jonów, która uprawnia w typowej analizie oceny na podstawie bilansu to: ANIONY: siarczany SO43-, kwaśny węglan HCO3-, Cl-. KATIONY: K+, Na+, Mg2+, Ca2+.
Na czym polega metoda bilansu? - polega na przeliczeniu stężenia danego jonu oznaczanego analitycznie na ogół mg/l na mval/l
Dokładność met. analitycznej - miara zgodności pomiarów dokonanych przy zastosowaniu określonej metody z wartością prawdziwą. Dokładność pomiaru dokonuje się na podst. metod referencyjnych (ściśle określone stężenia określonego, badanego składnika).
Do wskaźników ogólnych zaliczamy - ChZT, BZT, OWO, ogólne zap. tlenu, straty przy prażeniu, absorbancja w nadfiolecie, ekstrakt węglowo - chloroformowy.
Kiedy trzeba oznaczać CHZT a nie tylko BZT5? - oznaczanie CHZT jest konieczne, gdy woda zawiera zw. org. nierozkładalne przez mikroorg. Lub substancje toksyczne dla drobnoustrojów. Wartość BZT są zaniżone w stosunku do CHZT.
Silne utleniacze CHZT - KMnO4, nadjodan, podbromian.
Różnice między kwasami huminowymi a fulwowymi - •znacznie mniejsza masa cząsteczkowa, •lepsza rozpuszczalność w wodzie, •silne właściwości kompleksotwórcze, •łatwiej dysocjuje w wodzie, •złocista barwa, •przyczyniają się do kompl. Fe, Mn i Al.
Różnice hymtamelanów od kw. huminowych - •rozpuszczalnością w alkoholu i znacznie mniejszą masą cząsteczek; •wolne kw. hymatom. są słabo rozpuszczane w wodzie i wyst. w postaci roztworów koloidalnych.
Na co rozpadają się zw. zawierające H, C, O, P, S, N w war. tlenowych i beztlenowych? - •Tlenowe: (C)CO2, (H)H2O, (O)-, (N)NO2, NO3, N2O5, (S)SO2, SO3, (P)PO43-, P2O5; •Beztlenowa: (C)CH4, (O)H2O, (N)NH3, (S)H2S, (P)PH3.
Absorbancja UV - polega na pochłanianiu światła przez większość związków org. wyst. w środ. nat. Pomiaru dokonuje się tylko w próbie przefiltrowanej, bo zawiesina powoduje błędy pomiarów. Pomiar dokonywany w ściśle określonych długościach fali i grubości warstwy badanej. Oznaczamy głównie zw. aromatyczne (toluen, benzen, fenol). Nie obejmuje ona zw. alifatycznych.
Iloczyn jonowy wody - kw=[H+][OH-] zależy od temp i zwiększa się z jej wzrostem.
Procesy fiz-chem zachodzące w wodach podziemnych (parametry wpływające na jakość) - a)procesy ługowania (wymywania) sub. mineralnych, b)procesy degradacji mikrobiologicznej sub. organicznych, c)procesy dyspersji, d)procesy sorbcji i wymiany jonowej, e)wymiana gazowa powietrze - grunt, f)procesy rozcieńczania,
Co to jest ewaporacja? - (utlenianie) jest najistotniejszym czynnikiem eliminującym CHCl3 z wody. (inne: fotoliza, hydroliza, biodegradacja).
Czynniki w potencjale redoks - •tlen rozpuszczony; •subst. org.
Jak mierzymy potencjał redoks? - wyraża zdolność roztworu do migracji elektronów. Podczas procesu redox elektrony migrują pod wpływem różnicy potencjałów. Pomiar polega na zanurzeniu elektrody (najcz. grafitowej lub platynowej) w badanej próbie i zmierzeniu jej potencjału względem elektrody wodorowej lub innej.
Wpływ temp. na BZT - •wzrost temp. przyśpiesza przebieg procesu; •największe zużycie tlenu w temp. 20÷30ºC; •zahamowanie procesu w temp. 40ºC; •w 10ºC lega spowolnieniu; •w 4ºC proces nie zachodzi.
Przesycenie wody tlenem - •gwałtowny wzrost temp.; •gwałtowny spadek ciśn..; •bardzo intensywnie przebiegające procesy fotosyntezy.
Występowanie krzemianów w zależności od pH - •w postaci roztworu rzeczywistego, zawiesiny, roztworu koloidalnego •pH<8 większość kw. krzemianowych występuje w formie niezdysocjowanej, niezdysocjowana krzemionka SiO2, niezdysocjowany SiO4 * H2O, kwas ortokrzemowy, kwas polikrzemianow;.•pH>9 duży udział form dysocjowanych H2SiO3-, H2SiO4-; •wody o odczynie kwaśnym + fluor = tworzą się zw. kompleksowe fluorokrzemiany; •duże stężenie zw. org. = krzemionki zw. kompleksowe SiF6. Zawartość krzemu powoduje powst. węgla kamiennego.
Postacie koloidalne krzemianów - •niezdysocjowana krzemionka SiO2; •Niezdysocjowany kwas metakrzemowy SiO2·H2O; •kwas ortokrzemowy H4SiO4(SiO4·2H2O); •kwas polikrzemowy o ogólnym wzorze xSiO2·yH2O
Omówić krótko RWO - przeprowadzenie wszystkich zw. węgla w próbie przefiltrowanej przez filtr membranowy do CO2. następnie oznacza się zawartość wydzielonego CO2 odejmując od tej wartości udział CO2 pochodzącego ze zw. nieorg. głównie kwaśnych węglanów. Minus: stosunkowo mała czułość, gdyż zbyt szeroki zakres stosowalności. Odzwierciedla tylko silne zanieczyszczenia.
Dlaczego ciężko oznacza się RWO? - RWO charakteryzuje się małą czułością, gdyż metoda odznacza się szerokim zakresem ozn.
Biodegradacja WWA - •produktami biodegradacji są fenole i zw. org.; •czas T ½ w war. tlenowych od kilku dni do kilkunastu m-cy; •drobne rozp. się w tłuszczach, co powoduje możliwość ich akumulacji oraz zwiększenie zagrożenia dla czł.
Czym ograniczona jest migracja WWA? - •sorpcją; •fotolizą; •utlenianiem się; •biodegradacja przez mikrorg.
Oznaczanie EWA, EWCH - •EWA (ekstrakt węglowo-alkoholowy) •EWCH (ekstrakt węglowo-chloroformowy). Oznacza się w wyniku przepuszczenia określonej próbki przez filtr z węglem aktywnym. Zw. org. zaadsorbowane na węglu akt. ekstrahuje się alkoholem (chloroformem) a następnie odparowuje i waży.
Co to jest precyzja metody? - stopień rozrzutu pomiarów wyk. określoną metodą w stosunku do wartości śr. z uzyskanych pomiarów. Pozwala określić wpływ błędów grubych na wyniki analizy.
Definicja punktu potrójnego - określa warunki współistnienia 3 faz: ciekłej, stałej i gazowej w stanie równowagi. Prężności par nad cieczą i nad ciałem stałym są równe. Jego temp. to temperatura topnienia lodu pod ciśnieniem jego własnej pary nasyconej.
Właśc. fizyczne trichloroetenu - •ciecz bezbarwna; •duża gęstość; •rozp. 150mg/l; •toksyczny; •wolnodegradalny (T ½ = 6 lat); •w war. tlen. uznawany za subst. trwałą; eliminowany przez ewaporację; •rakotwórczy (wchłaniany przez skórę).
Narysować i podać nazw 2 przedst. indeksu fenolowego - indeks fenolowy oznacza się w celu oznaczenia poszczególnych form fenoli. Obejmuje on fenole 1-wodorotlenowe lotne z parą wodną: KREZOLE KSYLENOLE
Na co ulegają biodegradacji ligniny? - to związki aromatyczne i są odporne na biodegradację, pośrednie produkty: pirokafeina, pirogalowe.
Napisz nazwy układów przy despersyjnym ciecz dla faz rozproszonych? - •ciecz - emulsja - mleko; •ciało stałe - żele - wodortlenki metali rozproszonych w H2O; •gaz - piany - roztwór mydła
Napisz nazwy układów przy despersyjnym ciało stałe dla faz rozproszonych? - •ciecz - piany stale - pumeks; •ciało stałe - żele stałe - szkło i minerały; •gaz - piany stałe - kszyształy H2O hydratacyjne.
Napisz nazwy układów przy despersyjnym gazu stałe dla faz rozproszonych? - •ciecz - gazolej, mgły - pumeks; •ciało stałe - pyły - kurz, dym; •gaz - mieszaniny gazów - powietrze.
Współczynnik absorpcji UV - pomiar dokonuje się na próbce wcześniej przefiltrowanej wody, gdyż zawiesina powoduje uzyskiwanie błędnych rezultatów. Pomiar absorpcji dokonuje się przy długości 254 nm i grubości warstwy wody 5cm.
Procesy degradacji chloformu? - fotoliza, biodegradacja, hydroliza.
Podział tenzydów? - tenzydy niejednorodne, amfolityczne.
Warunki reakcji miereczkowania? - alkometra, redosksymetria, metody wytrącania, mieroczkowanie kompleksometryczne.
Wyszukiwarka
Podobne podstrony:
CHEMIA SANITARNA szczykowska ~$EMIA wszystko
CHEMIA SANITARNA - szczykowska, referat -KOLEJNOSC WYKONYWANIA OZNACZEŃ I SPOSÓB PODAWANIA WYNIKÓW,
CHEMIA SANITARNA - szczykowska, sciaga, BARWA
CHEMIA SANITARNA - szczykowska, pytania z chemii szcykowska, 1
CHEMIA SANITARNA - szczykowska, sprawozdanie- Ćwiczenia organizacyjne i szkolenie w zakresie przepis
CHEMIA SANITARNA - szczykowska, sprawozdanie - sporządzanie roztw mianoanych do oznaczenia fosforu o
CHEMIA SANITARNA - szczykowska, sprawozdanie - sporządzanie roztw mianoanych do oznaczenia fosforu o
CHEMIA SANITARNA - szczykowska, EZGAMIN Z CHEMII, 1
Chemia - Etanol i metanol - wszystko w jednym(1), Szkoła, Chemia
Moje sprawozdanie chemia nr 3, Studia budownictwo pierwszy rok, Chemia budowlana, Chemia budowlana,
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
chemia poprawka wszystkie zestawy odpowiedzi
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
Egzamin - chemia fizyczna (2), Egzamin chem.fiz
Fizjologia zwierząt wszystkie opracowania, chemia organiczna, biologia ewolucyjna-wykłady, genetyka,
Chemia fiz - spr2 - seria 2, 1
Chemia fiz - spr12 - seria 2, 1
chemia fizyczna laboratoria, iwona chem. fiz. ćw. 91
więcej podobnych podstron