Ćwiczenie 91, 92, 93
POMIAR NAPIĘCIA POWIERZCHNIOWEGO METODĄ STALAGMOMETRYCZNĄ
Cel ćwiczenia: zbadanie wpływu rodzaju i stężenia substancji rozpuszczonej na napięcie powierzchniowe wody i wyznaczenie nadmiaru powierzchniowego Gibbsa.
Napięciem powierzchniowym б nazywamy pracę potrzebną do zwiększenia powierzchni cieczy o 1 m2.
Zjawisko napięcia powierzchniowego związane jest z oddziaływaniami międzycząsteczkowymi. Siły oddziaływań międzycząsteczkowych działających na cząsteczkę znajdującą się w głębi cieczy znoszą się wzajemnie. Natomiast na cząsteczki znajdujące się na granicy faz, ciecz - gaz, ciecz - ciecz lub ciało stałe - ciecz, działa wypadkowa, niezerowa siła, styczna do powierzchni międzyfazowej, która dąży do zmniejszania tej powierzchni.
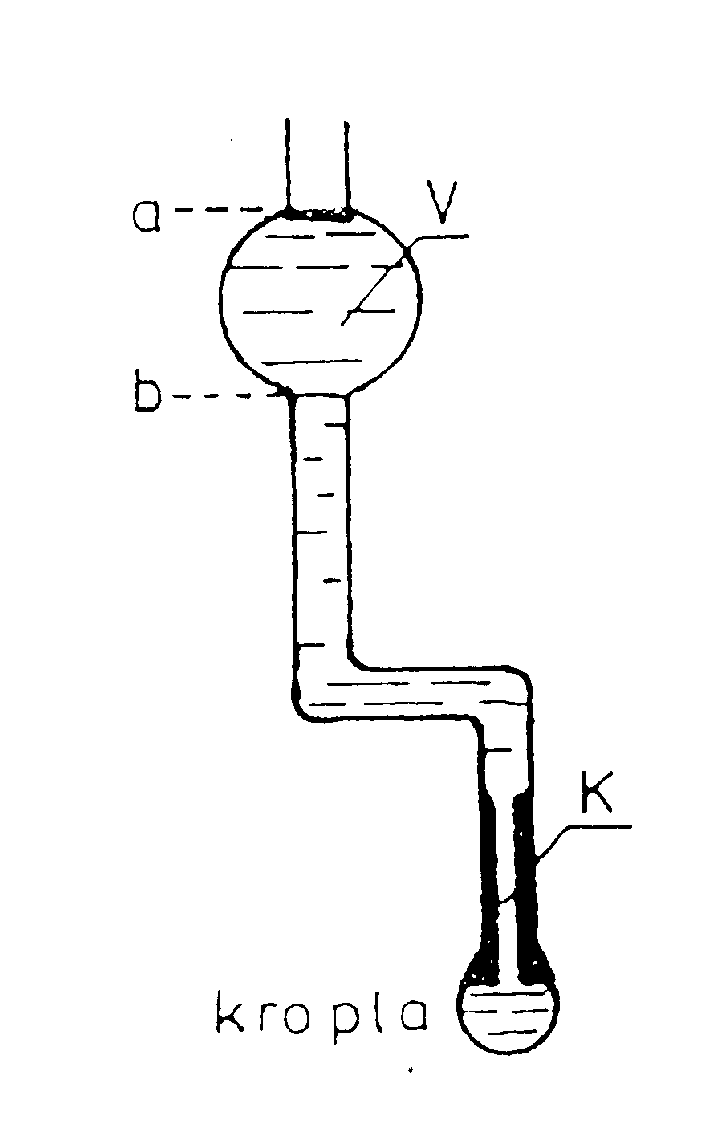
Oznaczenie napięcia powierzchniowego б metodą stalagmometryczną polega na określeniu liczby n kropli cieczy, wypływających z określonej objętości V przez rurkę kapilarną o promieniu r. Na kroplę wypływającą
z kapilary działają dwie siły, siła ciężkości Fg i siła napięcia powierzchniowego Fσ
Siła napięcia powierzchniowego Fσ = 2 π r б
Siła ciężkości ![]()
M jest masą kropli, ρ oznacza gęstość cieczy,
g jest przyśpieszeniem ziemskiem
Kropla oderwie się od kapilary, gdy siły Fg i Fσ zrównoważą się. Stąd napięcie powierzchniowe można obliczyć ze wzoru:
![]()
(1)
Aby uniknąć wyznaczania objętości zbiornika V i promienia kapilary r
w metodzie stalagmometrycznej stosuje się ciecz wzorcową o znanym napięciu powierzchniowym, σw i znanej gęstości ρw, dla której określić należy liczbę kropli nw wypływającą ze zbiornika. Napięcie powierzchniowe cieczy badanej oblicza się ze wzoru:
![]()
(2)
Cieczą wzorcową jest woda, której napięcie powierzchniowe σw, wyrażone w N/m, w danej temperaturze t, w oC, można obliczyć
z empirycznego wzoru:
σw = [72,9 - 0,155 (t - 18)] ⋅ 10-3 (3)
Substancja rozpuszczona w cieczy zmienia jej napięcie powierzchniowe. W zależności od właściwości dodany składnik może zwiększać lub zmniejszać napięcie powierzchniowe. Wielkość tych zmian uzależniona jest od stężenia roztworu.
Skutkiem zmian napięcia powierzchniowego jest zmiana składu warstwy cieczy na granicy faz. Zmianę składu warstwy powierzchniowej określa wielkość nazwana nadmiarem powierzchniowym Gibbsa Γi:
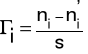
(4)
Nadmiar powierzchniowy Gibbsa jest stosunkiem różnicy liczby moli ni substancji rozpuszczonej w warstwie powierzchniowej i liczby moli ni' w głębi fazy, do powierzchni międzyfazowej s.
Nadmiar powierzchniowy Gibbsa Γ zależy od zmian napięcia powierzchniowego spowodowanych zmianą potencjału chemicznego μi substancji rozpuszczonej:
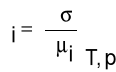
(5)
Potencjał chemiczny składnika μi zależy od aktywności termodynamicznej składnika ai, co pozwala przekształcić równanie (5) do zależności (6)
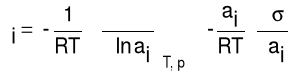
(6)
Dla roztworów rozcieńczonych, gdy współczynnik aktywności termodynamicznej jest równy 1, termodynamiczną aktywność składnika można zastąpić stężeniem roztworu i zależność (6) przyjmuje postać:
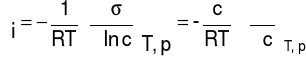
(7)
II. Wykonanie ćwiczenia:
Przygotować, metodą rozcieńczeń, roztwory o stężeniach podanych przez prowadzącego zajęcia.
Starannie przepłukać stalagmometr wodą destylowaną i umocować go pionowo w uchwycie na statywie.
Uwaga: przy każdej zmianie badanego roztworu koniecznie przepłukać stalagmometr małą ilością tego roztworu.
Posługując się rurką gumową naciągnąć badaną ciecz do stalagmometru powyżej górnej kreski (przewężenia). W momencie, gdy menisk wypływającej cieczy znajdzie się na poziomie górnej kreski rozpocząć liczenie kropli. Liczenie zakończyć gdy menisk osiągnie poziom dolnej kreski (przewężenia). Pomiar powtórzyć trzy razy. Wyniki zanotować w tabelce.
Obliczyć napięcie powierzchniowe dla każdej cieczy (roztworu).
Gęstości roztworów zastosowanych w doświadczeniu odczytujemy z pomocniczych wykresów sporządzonych w oparciu o wyniki gęstości zawarte w tabelach.
Sporządzić wykres zależności napięcia od stężenia w układzie
σ = f(ln c) i z nachylenia uzyskanej prostej obliczyć wartość nadmiaru powierzchniowego (nachylenie = dσ/dlnc ≈ Δσ/Δlnc). Skomentować otrzymane wyniki.Po zakończeniu ćwiczenia wymyć starannie używany sprzęt
i posprzątać.
Wyszukiwarka
Podobne podstrony:
7, Technologia chemiczna, Chemia fizyczna, 3 semestr, laboratorium
Pomiar napięcia powierzchniowego cieczy metodą stalagmomet, Technologia chemiczna, Chemia fizyczna
Parachora 1, Technologia chemiczna, Chemia fizyczna, 3 semestr, laboratorium
8.3 wykres', Technologia chemiczna, Chemia fizyczna, 3 semestr, laboratorium
Parachora 2, Technologia chemiczna, Chemia fizyczna, 3 semestr, laboratorium
Wyznaczanie napięcia powierzchniowego cieczy metodą stalagmometryczną, Technologia chemiczna, Chemia
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
Labolatoria (semestr III), Technologia chemiczna, Chemia organiczna, 4 semestr, ćwiczenia
Kolokwium zaliczeniowe 1, Technologia chemiczna, Chemia fizyczna, Ćwiczenia
Przykładowe zadania z równowagi chemicznej CD CH 2010 2011, Technologia chemiczna, Chemia fizyczna,
Kolokwium zaliczeniowe, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium nr 1
Kolokwium nr 2, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium nr 1
cwiczenie 34, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, chemia fizyczna
Przykl Zad Koll 3-cie sem3 HD CD 2010, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium
więcej podobnych podstron