Definicje Kryształu:
1.Definicja fenomenologiczna - kryształem nazywamy substancję stałą, która wykazuje anizotropię przynajmniej jednej jego właściwości fizycznej.
2.Definicja strukturalna - kryształ to substancja stała zbudowana z atomów, jonów lub cząsteczek uporządkowanych w czasie i przestrzeni.
3. Definicja morfologiczna - kryształ to ciało stałe posiadające swój własny kształt (postać).
4.Definicja rentgenostrukturalna - każda substancja, na której ugięciu ulega promieniowanie rentgenowskie (promieniowanie X) jest kryształem.
5. Definicja genetyczna - kryształ to substancja, dla której przejście od stanu stałego do ciekłego (lub odwrotnie) jest przemianą fazową zachodzącą w ściśle określonej temperaturze zwanej temperaturą topienia (krzepnięcia).
Prawa Krystalochemi:
1.Budowa kryształu jest uwarunkowana przez stosunek ilości, stosunek wielkości i przez stan polaryzacji elementów budowy kryształu tj. atomów, jonów oraz grup atomów (jony kompleksowe, rodniki, cząsteczki).
2.Różne struktury kryształów można połączyć w jedną grupę struktur porównywalnych, jeżeli atomy w nich występujące znajdują się w takim samym stanie: atomowym, jonowym lub metalicznym.
3.Jeżeli atomy z których są zbudowane kryształy znajdują się w różnych stanach, to typy struktur krystalicznych należą do grup nieporównywalnych.
Pozycje Wyckoffa-to oznaczone alfabetycznie literami pozycje atomów (jonów) w komórce elementarnej o lokalnej symetrii punktowej stanowiącej podgrupę symetrii przestrzennej kryształu.
Intensywność refleksu zależy od: Intensywność wiązki padającej, rozmieszczenie atomów w komórce elementarnej - czynnik strukturalny Fhkl ,rodzaj atomów w komórce elementarnej - czynnik atomowy f ,temperatura T,absorpcja A, czynnik polaryzacyjny PL i Lorentza L, liczebność płaszczyzn p(hkl).
![]()
![]()
Czynnik strukturalny Fhkl;
Jakich informacji dostarcza nam dyfraktogram? Pozycja refleksów-Grupa symetrii przestrzennej, Parametry komórki elementarnej, Naprężenia wewnętrzne (jednorodne) - ciśnienie .Intensywność- Rozmieszczenie jonów w komórce elementarnej, Tekstura, Ilość materiału w substancjach wielofazowych. Szerokość połówkowa-Naprężenia wewnętrzne (niejednorodne), Wielkość krystalitów.
Analiza fazowa ilościowa-
![]()
Grupy struktur porównywalnych-kryształy kowalencyjne charakteryzują się występowaniem „czystego” wiązania kowalencyjnego pomiędzy wszystkimi atomami tworzącymi sieć krystaliczną. Kryształ kowalencyjny można traktować jako jedną gigantyczną molekułę, charakteryzują się wysokimi temperaturami topienia i wysoką twardością, przykładem takiej struktury jest diament.kryształy jonowe zbudowane są atomów obdarzonych ładunkiem elektrostatycznym (jonów) spajanych w sieć kryształu poprzez oddziaływania kulombowskie. Kryształy jonowe maja zwykle wysokie temperatury topienia, są rozpuszczalne w roztworach wodnych (rozpuszczalnikach polarnych) a ich typowym przykładem są kryształy NaCl kryształy metaliczne tworzą sieć zbudowaną z węzłów obsadzonych, dodatnio naładowanymi atomami pierwiastków metalicznych (kationów), których elektrony walencyjne są na tyle swobodne, że mogą wypełniać przestrzeń między nimi („gaz elektronowy”). Metale charakteryzują się gęstym upakowaniem (wysoka gęstość), plastycznością i przewodnictwem elektrycznym np. miedź, srebro. kryształy molekularne jako elementy przestrzennej sieci zawierają wyraźnie rozpoznawalne, posiadające własną strukturę cząsteczki wewnątrz, których dominują wiązania kowalencyjne lub kowalencyjne spolaryzowane. Cząsteczki połączone są w sieć za pomocą słabych oddziaływań van der Waalsa (niepolarne) lub poprzez oddziaływania dipol-dipol lub wiązanie wodorowe (czasteczki polarne). Kryształy molekularne są na ogół miękkie i topią się w stosunkowo niskich temperaturach, do tej grupy struktur należą kryształy związków organicznych np. cukier (sacharoza).
Elektroujemność wg Paulinga-Elektroujemność jest to właściwość atomu w wiązaniu chemicznym określona
jako siła atrakcji elektronu przez atom tworzący wiązanie.
Elektroujemność wg Gorlicha- Elektroujemność rdzeni atomowych lub kationów jest równoważna odpowiedniemu ładunkowi efektywnemu Zef wyrażonemu w jednostkach e+.
Model kryształów jonowych-
1.Jony w strukturach kryształu są naładowanymi, sztywnymi nie polaryzowalnymi sferami, których promień nie przenikalności określamy jako promień jonowy.
2.Jony jednego znaku są otoczone jonami przeciwnego znaku (ligandami) tak aby ich liczba (liczba koordynacyjna) była możliwie największa.
3.Jony tego samego znaku układają się tak aby energia ich odpychania elektrostatycznego była możliwie najmniejsza.
4.Układ jonów jednego znaku wokół jonów znaku przeciwnego jest trwały wówczas gdy jon centralny styka się z jonami otaczającymi (gęste upakowanie).
Metody wyznaczania promieni jnowych-1.Metoda Goldschmidta (1926) polegająca na zależności promienia od refrakcji jonowej (R ~ r4j),2.Metoda Landego (1920), który założył, że w miarę wzrostu liczby porządkowej anionu w szeregu np. MgO. MgS, MgSe jego promień osiągnie taką wartość, że zetkną się nie tylko anion z kationem co anion z anionem a luka miedzy nimi akurat pomieści kation i wówczas z prostych zależności geometrycznej można wyznaczyć dodatkowe równanie a tym samym wszystkie promienie jonowe dla danego szeregu,3.Metoda Pulinga (1927), który na podstawie zależności podanej przez Bohra, że promień orbity elektronu jest odwrotnie proporcjonalny do ładunku jądra zaproponował odwrotną proporcjonalność promieni jonowych od ładunków efektywnych tych jonów (przy jednakowej ich konfiguracji elektronowej) np. rNa/rF = ZefF/ZefNa,4.Metoda Ahrensa (1952) polegająca na znalezieniu dodatkowego równania z odwrotnej zależności promieni jonowych od potencjału jonizacji.
Czynniki wpływające na wielkośc promieni jonowych-1.Ładunek jonu (stopień utlenienia), kationy są tym mniejsze im większy ładunek kationu zaś aniony są znacznie większe od kationów o tej samej konfiguracji
elektronowej.2. Liczba atomowa pierwiastka, im większa tym większy promień.3.Polaryzowalność jonu.
4. Liczba koordynacyjna, im większa tym większy promień.
Krzemiany-to krystaliczne lub amorficzne związki w strukturach których wystepują tetraedry SiO4, tetraedry mogą poprzez wspólne naroże łączyć się tworząc złożone aniony krzemotlenowe w tych strukturach.
Szkło:1.Definicja fenomenologiczna-Szkło wykazuje izotropię wszystkich właściwości. 2.Definicja morfologiczna-Szkło jest amorficzne czyli nie posiada wykształconej postaci przyjmuje zaś kształt naczynia w którym zastygło.3.Definicja strukturalna-Strukturę szkła charakteryzuje brak uporządkowania dalekiego zasięgu i w konsekwencji brak refleksów na dyfraktogramach rtg.4.Definicja genetyczna (Definicja Maxwella)-Szkło powstaje podczas chłodzenia faza ciekłej, w temperaturze zwanej temperaturą witryfikacji, gdy lepkość fazy ciekłej osiąga lepkość 1013 puaza.
Równoważność teorii Lauego i Bragga
H2 + K2 + L2
4 sin2ၱ = ၬ2 ႾႾႾႾႾႾႾ
a2
1 h2 k2 l2 h2 + k2 + l2
Ⴞ = Ⴞ + Ⴞ + Ⴞ Ⴎ
d2hkl a2 b2 c2 a2
![]()
![]()
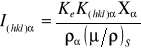
Wyszukiwarka
Podobne podstrony:
Wyklad-10, II Rok WIMiC inżynieria materiałowa AGH, Krystalografia i krystalochemia, krystalo
grupyprzestrzenne, II Rok WIMiC inżynieria materiałowa AGH, Krystalografia i krystalochemia, krystal
Krystalografia i Krystalochemia C3, II Rok WIMiC inżynieria materiałowa AGH, Krystalografia i krysta
chemia sciaga egzamin, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki,
Wyklad-6, II Rok WIMiC inżynieria materiałowa AGH, Krystalografia i krystalochemia, krystalo
Zagadnienia do egzaminu KiK zaoczne 2013 2014, II Rok WIMiC inżynieria materiałowa AGH, Krystalograf
Reakcje Hydrolizy, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki
Sprawozdanie 5 GIG B, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki, S
czesc2.1, II Rok WIMiC inżynieria materiałowa AGH, Obierak, mechanika
iloslab, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, laborki
Sprawozdanie 4 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
pkmy, II Rok WIMiC inżynieria materiałowa AGH, Obierak, mechanika, PKM, PKM
Sprawozdanie 6 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
SPRAWOZDANIE NR 3, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki, redo
Sprawozdanie 3 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
Sprawozdanie I GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
Labor Mechanika Tch, II Rok WIMiC inżynieria materiałowa AGH, Obierak, mechanika
Sprawozdanie1 I GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemi
więcej podobnych podstron