Wykład 10
Roztwory stałe, stopy i związki niestechiometryczne
Zastosowanie czystych metalów w postaci konstrukcyjnych materiałów nie jest możliwe, ponieważ większość z metalów ma dość niską wytrzymałość mechaniczną. W związku z tym w praktyce szerokie zastosowanie znajdują roztwory stałe i stopy.
Roztwory stałe to są materiały powstające wskutek mieszaniny kilku substancji, które po stopnieniu i zmieszaniu, a następnie ochłodzeniu rekrystalizują się. Cechą charakterystyczna roztworu stałego jest zachowanie w powstałej nowej strukturze sieci krystalicznej jednego ze składników roztworu, który odgrywa rolę rozpuszczalnika. Atomy drugich (rozpuszczonych) składników rozmieszczają się w sieci rozpuszczalnika na ogół losowo, deformując ją i tym samym psując symetrię translacyjną całego kryształu.
Rozróżniają roztwory stałe podstawieniowe (substytucyjne), międzywęzłowe (addycyjne) oraz pustowęzłowe (substrakcyjne).
Rys.10.1. Sieć krystaliczna centrowana powierzchniowo roztworu podstawieniowego (z lewej strony); roztworu międzywęzłowego (w środku) i roztworu pustowęzłowego - pusty węzeł oznaczony kreską (z prawej strony)
Roztworem stałym podstawieniowym jest roztwór w którym część atomów rozpuszczalnika jest zamieszczona przez atomy rozpuszczonych składników (rys.10.1).
Roztwory międzywęzłowe powstają gdy atomy rozpuszczone zajmują położenia międzywęzłowe sieci krystalicznej rozpuszczalnika (rys.10.1). Powstawanie roztworów międzywęzłowych zwykle doprowadza do zwiększenia stałych sieci krystalicznej i jej deformacji.
Roztwory stałe pustowęzłowe powstają na podstawie związków chemicznych w przypadku braku atomów w ich sieciach krystalicznych (rys.10.1).
Istnieją tzw. roztwory ciągłe w których koncentracja rozpuszczalnych składników jest prawie nieograniczona. Warunki powstawania takiego roztworu stałego w przypadku dwóch składników ![]()
i ![]()
były sformułowane przez Hume'a i Rothery'ego:
składniki
i
muszą mieć taką samą strukturę krystaliczną;promieni atomów
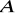
i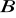
muszą różnić się od siebie o mniej niż 15%;jony
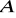
i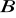
muszą mieć taką samą wartościowość;składniki
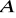
i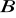
muszą mieć zbliżoną elektroujemność (zdolność do przyłączania elektronów).
Roztwory ciągłe są możliwe tylko w przypadku roztworów podstawieniowych. W przypadku roztworów międzywęzłowych zakres rozpuszczalności jest ograniczony, co jest związane z dużymi naprężeniami w sieci krystalicznej i związaną z tym niestabilnością strukturalną.
Warunki Hume - Rothey'ego powstawania roztworów podstawieniowych obowiązują także w odniesieniu do roztworów utworzonych nie przez atomy, a przez związki chemiczne (na przykład roztwór podstawieniowy ![]()
w ![]()
).
Rys.10.2. Przejście fazowe porządek - nieporządek w roztworze stałym |
Zwykle atomy składniku rozpuszczanego zajmują przypadkowo położenia w sieci rozpuszczalnika. Jednak w niektórych roztworach stałych przy powolnym ochładzaniu roztworu zachodzi uporządkowanie w rozmieszczeniu atomów składnika rozpuszczanego. Przejście to - porządek - nieporządek, ma charakter przemiany fazowej. Na rys.10.2 przedstawiono przemianę fazowe w roztworze stałym |
W roztworach stałych typu ![]()
miarą uporządkowania dalekiego zasięgu jest parametr ![]()
(![]()
), który określa liczbę atomów ![]()
, zajmujących położenia w podsieci ![]()
![]()
,
gdzie ![]()
oznacza liczbę węzłów podsieci ![]()
. W stanie uporządkowanym ![]()
![]()
oraz w stanie braku uporządkowania ![]()
![]()
.
W roztworach stałych, które nazywają stopami jako podstawowy składnik musi występować metal. Rozróżniają stopy żelaza oraz stopy metali nieżelaznych. Spośród stopów metali nieżelaznych praktyczne znaczenie mają stopy pierwiastków: ![]()
oraz ![]()
. Żelazo tworzy głownie stopy podstawieniowe. Stopy międzywęzłowe żelazo z pierwiastkami ![]()
oraz ![]()
. Stopy żelaza zawierające do 2,11% atomów węgla nazywają stopami stałymi, natomiast jeżeli zawartość węgla znajduje się w zakresie od 2,11% do 3,8% stop nazywa się żeliwem.
Zagadnienia związane z badaniem i zastosowaniem stop i innych związków metalicznych stanowią obszerny dział inżynierii materiałowej i oczywiście nie jesteśmy w stanie przedstawić tutaj nawet podstawy tej nauki. Rozważmy jako przykład tzw. fazy pośrednie albo związki międzymetaliczne, które mają inne struktury krystaliczne niż ich składniki. Spośród faz tych związków metalicznych wyróżniają: związki elektronowe albo fazy Hume'a Rothey'ego, fazy Lavesa (![]()
,![]()
,![]()
), fazy metali przejściowych i inne. Na typ struktury fazy pośredniej wpływają zasadniczo trzy czynniki: 1) czynnik geometryczny, 2) stężenie elektronów, 3) różnica elektroujemności (zdolność atomów do przyciągania elektronów) składników.
W fazach Hume-Rothey'ego głównym czynnikiem decydującym o rodzaju struktury jest stosunek liczby elektronów walencyjnych do liczby atomów. Związkami elektronowymi są, na przykład, fazy systemy |
Rys.10.3. Komórka elementarna fazy Lavesa typu |
Fazy Lavesa tworzą największą klasę związków międzymetalicznych. Większość związków z fazy Lavesa to są stabilne chemiczne związki stworzone z dwóch rodzajów atomów ![]()
i ![]()
ze wzorem chemicznym ![]()
. Między promieniami atomów ![]()
i ![]()
w idealnej strukturze istnieje uniwersalny stosunek: ![]()
. W większości kryształów z fazy Lavesa ten stosunek znajduje się w zakresie 1,1 - 1,6.
Fazy Lavesa można spotkać w różnych stopach i obecnie wiadomo więcej 1000 związków międzymetalicznych. Fazy Lavesa są bardzo twardymi związkami. Dzięki osobliwościom ich budowy krystalicznej one są w stanie zmieścić w swojej strukturze atomy wodoru: na jedną jednostkę chemiczną związku może przypadać do czterech atomów wodoru. To powoduje, że fazy Lavesa są rozważane jako jednym z możliwych kandydatów na zbiornik atomów wodoru w energetyce wodorodowej.
W przypadku dużej różnicy elektroujemności składników metalicznych powstają struktury o wiązaniu jonowo-metalicznym.
Spośród związków międzymetalicznych są nadprzewodniki (![]()
,![]()
,![]()
i inne), półprzewodniki i półmetali (![]()
,![]()
,![]()
,![]()
,![]()
i inne), ferromagnetyki (![]()
,![]()
i inne), kryształy z wysokimi właściwościami termoemisyjnymi ![]()
. Niektóre międzymetaliczne związki mają wysoką twardość (![]()
,![]()
,![]()
), wytrzymałość temperaturową (![]()
,![]()
), wysoką temperaturę topnienia (![]()
).
Jednym z wielu przykładów zastosowania stopów są ich złącza, które wykorzystują się jako termopary do pomiaru różnicy temperatur. Działają one na zasadzie zjawiska termoelektrycznego Seebecka. Zjawisko to polega na powstawaniu siły elektromotorycznej w obwodzie zawierającym dwa stopy, gdy ich złącza znajdują się w różnych temperaturach (rys.10.4).
Rys.10.4. Schemat obserwacji zjawiska Seebecha |
W przedstawionym na rys.10.4 obwodzie
gdzie |
W zależności od wybranych stopów ![]()
i ![]()
napięcie zmienia się od kilku do kilkudziesięciu mikrowoltów na stopień Celsjusza.
Zjawisko Seebecka łatwo zrozumieć opierając na elektronową budowę metali. Jak wiemy metal składa się z jonów dodatnich tworzących sieć krystaliczną i swobodnych elektronów poruszających się pomiędzy jonami. Koncentracja elektronów swobodnych jest różna w różnych metalach i zależy od temperatury. Na styku dwóch metali przeskakują elektrony z metalu o większej koncentracji do metalu o mniejszej koncentracji w skutek czego jeden z metali ładuje się dodatnio, a drugi ujemnie. Powstające pole elektryczne przeciwdziała przepływowi ładunku, a zatem ustala się stan równowagi dynamicznej. Różnica potencjałów powstająca na styku metali nazywana jest kontaktową różnicą potencjałów, a jej wartość zależy od rodzaju stykających się metali oraz temperatury złącza.
W przypadku obwodu zamkniętego złożonego z dwóch różnych metali, w których temperatury złącz są jednakowe, napięcie ![]()
powstające na jednym ze złącz jest kompensowane przez napięcie ![]()
na drugim złączu. W obwodzie prąd nie płynie. Natomiast jeżeli temperatury złącz ![]()
i ![]()
są różne to ![]()
jest różne od ![]()
i w obwodzie pojawi się siła termoelektryczna ![]()
powodująca przepływ prądu.
Do powszechnie używanych termoelementów używają pary: żelazo - konstantan (stop ![]()
); chromel (stop ![]()
) - alumel (stop ![]()
) i inne stopy. W wysokotemperaturowych piecach, w których otrzymują się monokryształy i ceramikę, często stosują stopy: kanthal (stop ![]()
) oraz superkanthal (stop o podstawowym składniku ![]()
).
Szczególnym przypadkiem roztworów stałych są związki niestechiometryczne. Związki niestechiometryczne to są związki, w których część pozycji węzłowych nie są obsadzone albo odwrotnie w krysztale występują nadmiarowe atomy w położeniach międzywęzłowych. Niestechiometria nie może być sprzeczna z zasadą zachowania ładunku (całkowity ładunek kryształu musi być równy zero). A więc, żeby elektryczna obojętność kryształu była zachowana muszą zajść zmiany w strukturze elektronowej kryształu, które nieuchronnie prowadzą do zmian we właściwościach fizycznych kryształu (w przewodności elektrycznej itd.). Na przykład zwykle w związku ![]()
cześć położeń w sieci krystalicznej, w których powinny być jony ![]()
nie są obsadzony. Niedomiar dodatniego ładunku, spowodowany brakiem jonów ![]()
, może być kompensowany przejściem ![]()
, co powoduje zmiany budowy elektronowej kryształu.
Materiały interkalowane
Interkalowanymi materiałami albo klatratami (z łaciny clathratus - „chroniony siecią”), albo materiałami typu „gospodarz -gość” nazywają struktury krystaliczne zawierające obszary w które mogą być wprowadzone w sposób odwracalny różne obce atomy lub cząsteczki. Proces wprowadzenia obcych atomów lub cząsteczek nazywa się interkalacją. Z tego właśnie pochodzi nazwa tych materiałów. Materiały interkalowane są szczególnym przypadkiem roztworów stałych. Warto podkreślić, że w procesie interkalacji struktura materiału (typ i stałe sieci krystalicznej), mimo że koncentracja wprowadzonych atomów lub cząstek może być dość znaczna, zmienia się nieznacznie. Rozróżniają struktury kanałowe, warstwowe oraz szkieletowe (rys.10.5)
Interkalacja może zachodzić z fazy gazowej, ciekłej lub stałej. Szeroko stosowaną techniką interkalowania jest metoda elektrochemiczna. W tym przypadku konstruuje się ogniwo elektrochemiczne, którego katodą jest materiał interkalowany. Pod wpływem przyłożonego do katody napięcia elektrycznego do materiału zostają wprowadzone z obszaru elektrolitu jony danego pierwiastka chemicznego.
Rys.10.5. Schemat budowy struktury materiałów interkalowanych: a) - kanałowa; b) - warstwowa; c) - szkieletowa
Typowymi związkami warstwowymi interkanalowanymi są związki ![]()
(gdzie ![]()
- metal przejściowy i ![]()
- tlen, selen lub siarkę) (rys.10.6).
Warstwa kationów ![]()
w tych związkach znajduje się między dwoma warstwami anionowymi z ![]()
, tworząc układ trzech warstw połączonych silnymi wiązaniami jonowego typu. Takie warstwy łączą się ze sobą za pomocą słabych sił van der Waalsa dając kryształ makroskopowy. Pomiędzy warstwami stosunkowo łatwo mogą wchodzić jony metali alkaicznych. Przykładem związku interkalowanego jest ![]()
(![]()
), powstający w wyniku interkalacji litem dwusiarczku tytanu, zgodnie z reakcją
![]()
.
Reakcję te można przeprowadzić elektrochemiczne lub umieszczając próbkę w cieczy zawierającej jony litu.
Rys.10.6. Wpływ interkalowanych jonów litu na stała sieci struktury warstwowej ![]()
Dość słabe wiązania jonów ![]()
z siecią krystaliczną powodują że kationy ![]()
pod wpływem zewnętrznego pola elektrycznego zaczynają uczestniczyć w przewodnictwie prądu elektrycznego. Takie superjonowe przewodniki (o nich będzie mowa później) znajdują szerokie zastosowanie w ogniwach elektrochemicznych nowej generacji. Interkalowane materiały, na przykład ![]()
, mogą być wykorzystywane do magazynowania wodoru, w których wodór jest ciaśniej upakowany niż w ciekłym wodorze ![]()
.
Do struktur szkieletowych typu „gospodarz - gość” odnoszą się kryształy zeolity. Nazwa pochodzi z języka greckiego i oznacza „wrzące kamienie”: przy ogrzewaniu zeolitów zawarta w nich woda uwalnia się pokrywając powierzchnie zeolitu pęcherzykami, co kojarzy się z efektem wrzenia wody.
Zeolity - to jest dość obszerna grupa naturalnych i sztucznych kryształów glinokrzemianowych, których struktura jest zbudowana z połączonych ze sobą tetraedrów ![]()
i ![]()
. Połączone tetraedry tworzą wtórną strukturę w postaci pierścieni różnego kształtu. Szkielety zeolitów zawierają połączone między sobą puste kanały o średnice ![]()
nm (rys.10.7). W pustoty struktury wchodzą molekuły wody, oraz kationy jedno lub dwuwartościowe (![]()
itd.). Ogólny wzór zeolitu można przedstawić jako: ![]()
, gdzie ![]()
; ![]()
w proporcji od ![]()
do ![]()
.
Molekuły wody i kationy znajdujące się w lukach mogą opuszczać strukturę zeolitu, co tworzy możliwość wykonania zawartości kanałów zeolitów na inne jony bez zniszczenia struktury zeolitu. Ta unikalna zdolność zeolitów absorbować cząsteczki jednych substancji i nie absorbować cząsteczki rozmiary których nie są zgodne z rozmiarami kanałów zeolitów (rys.10.7) wykorzystywane są w charakterze sit molekularnych, umożliwiających osuszanie rozpuszczalników oraz rozdział różnych mieszanin i substancji.
Rys.10.7. Z lewej strony - schemat budowy luk przestrzennych w strukturze zeolitu; z prawej strony - ilustracja „działania” sita molekularnego |
Zeolity znajdują szerokie zastosowania w różnych gałęziach przemysłu:
Stosowane są jako substancja osuszająca, mają zastosowanie do oczyszczania gazów i ścieków - doskonale wychwytują jony ołowiu, cynku, miedzi, rtęci oraz promieniotwórcze izotopy strontu i cezu.
Mają zastosowanie w różnych działach przemysłu chemicznego - przy produkcji proszków do prania (jako składnik zmiękczający wodę), przy produkcji nawozów mineralnych.
Stosowane są również do zmiękczania wody wodociągowej.
W przemyśle spożywczym wykorzystują się jako dodatek do paszy dla zwierząt.
W petrochemii stanowią doskonały surowiec do wyrobu cementu, lekkich kruszyw i papieru.
Używane jako wkład filtracyjny w filtrach akwariowych, ze względu na neutralizowanie szkodliwego amoniaku i fosforanów.
Nowe materiały interkalowany i samoorganizacja supramolekularna
Proces samoorganizacji czyli proces spontanicznego tworzenia struktur uporządkowanych, w której biorą udział molekuły nazywa się samoorganizacją supramolekularną. Polega ona na spontanicznym łączeniu się cząsteczek w agregaty o ściśle określonej przestrzennej strukturze, za którą odpowiedzialne są słabe oddziaływania typu wiązania wodorowego, czy siły van der Waalsa. Z przybliżeniu mechanizm samoorganizacji supramolekularnej jest podobny do zasady działania pary „zamek - klucz”: dla każdego zamka musi być swój klucz i odwrotnie. Wyżej widzieliśmy, że materiały interkalowane również posiadają własność selektywnego oddziaływania z cząsteczkami „gośćmi”, czyli posiadają zdolność do samoorganizacji i „rozpoznawania gości”.
Okazuje się, że na analogiczną zasadę opiera się zdolność poszczególnych molekuł ku samoorganizacji i selektywnemu oddziaływaniu z innymi cząsteczkami, która nazywa się molekularnym rozpoznawaniem. Tylko dzięki tej zdolności istnieje możliwość stworzenia, na przykład, podwójnych spirali DNA (deoxyribonucleic acid) oraz powstawania, przy wchodzeniu „cudzych ciał” w organizm, reakcji immunologicznej, wskutek której powstaje synteza specjalnych białek dla neutralizacji „niechcianych gości”.
Dla układów supramolekularnych ważniejszą jest zasada komplementarności: geometryczna, topologiczna i ładunkowa zgodność „zamka” i „klucza” („gościa” i „gospodarza”). Im większa jest ta zgodność tym wyżej jest stabilność układu.
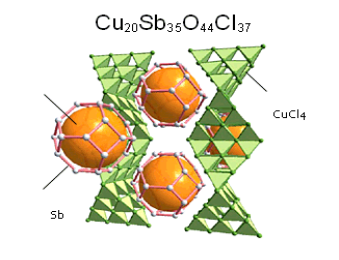
Obecnie supramolekularna chemia organicznych i nieorganicznych związków jest aktywnie rozwijającą się dziedziną chemii fizycznej. Już dzisiaj struktury supramolekularne znajdują szerokie zastosowania w katalizie i syntezie nowych materiałów, nowych leków i jadów również. Na rys.10.8 jako przykład nowego supramolekularnego materiału jest przed- |
Rys.10.8. Przykład supramolekularnego związku |
stawiony klatrat ![]()
, który jest zbudowany z sieci połączonych między sobą tetraedrów ![]()
. „Klatki” z atomów ![]()
wykonują rolę magazynów różnych pierwiastków i związków chemicznych, co pozwala wykorzystywanie tych materiałów do magazynowania wodoru (energetyka wodorowa), promieniotwórczych (energetyka jądrowa) i szkodliwych pierwiastków albo związków.
Obecnie, spośród wielu projektów naukowych związanych z praktycznym zastosowaniem nowych supramolekularnych materiałów, jedno z czołowych miejsc zajmują projekty związane z wytworzeniem materiału, który byłby dobrym przewodnikiem prądu elektrycznego i jednocześnie złym przewodnikiem ciepła. Takie materiały noszą nazwę szkła fononowego albo kryształu elektronowego. Zwykle materiały posiadające duże przewodnictwo cieplne są dobrymi przewodnikami prądu elektrycznego (prawo Wiedemana-Franza). Związane to jest z tym, że energię cieplną w ciele stałym przekazują drgania sieci krystalicznej i właśnie charakter rozpraszania tej energii na drganiach sieci (fononach) określa właściwości cieplne ciała stałego. Im większe jest to rozpraszanie (czyli większe jest pochłanianie energii cieplnej), tym mniej jest przewodnictwo cieplne materiału. Przewodnictwo elektryczne materiału też związane jest z rozpraszaniem energii kinetycznej elektronów na drganiach sieci krystalicznej i na różnego rodzaju defektach tej sieci. A wiec kryształy elektronowe muszą być tak zbudowane, żeby mechanizmy określające przewodnictwo elektryczne i przewodnictwo cieplne były przestrzennie rozdzielone. Dla realizacji tej idei dobrym kandydatem jest supramolekularny kanałowy materiał, w którym kowalencyjne związane atomy szkieletu wypełniałyby rolę dobrego przewodnika, a sieć atomów, znajdujących się w kanałach dobrze pochłaniałaby ciepło.
115
Wyszukiwarka
Podobne podstrony:
Wyklad-6, II Rok WIMiC inżynieria materiałowa AGH, Krystalografia i krystalochemia, krystalo
grupyprzestrzenne, II Rok WIMiC inżynieria materiałowa AGH, Krystalografia i krystalochemia, krystal
Krystalografia i Krystalochemia C3, II Rok WIMiC inżynieria materiałowa AGH, Krystalografia i krysta
krystalo sciaga(2), II Rok WIMiC inżynieria materiałowa AGH, Krystalografia i krystalochemia, krysta
Zagadnienia do egzaminu KiK zaoczne 2013 2014, II Rok WIMiC inżynieria materiałowa AGH, Krystalograf
Reakcje Hydrolizy, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki
Sprawozdanie 5 GIG B, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki, S
czesc2.1, II Rok WIMiC inżynieria materiałowa AGH, Obierak, mechanika
iloslab, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, laborki
Sprawozdanie 4 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
pkmy, II Rok WIMiC inżynieria materiałowa AGH, Obierak, mechanika, PKM, PKM
Sprawozdanie 6 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
SPRAWOZDANIE NR 3, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki, redo
Sprawozdanie 3 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
Sprawozdanie I GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
Labor Mechanika Tch, II Rok WIMiC inżynieria materiałowa AGH, Obierak, mechanika
Sprawozdanie1 I GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemi
chemia sciaga egzamin, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki,
więcej podobnych podstron