13.Podział aminokwasów Wzór ogólny 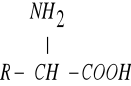
Pod względem budowy reszty aminokwasowej związki te dzieli się na pięć grup:
I z resztą alifotyczną, niepolarną, z hydrofobowością wzrastającą, z długością łańcucha Gly, Ala, Vod, Leu, Ile i w pewnym stopniu Pro
II z resztą zawierającą grupy alkoholowe OH lub siarkę, należą tu aminokwasy o małej polarności Ser, Thu
III z resztą zawierającą pierścień aromatyczny należy tu Phe o własnościach hydrofobowych, Grp o małej polarności oraz Tyr której grupa fendowa może dysocjować w wyższym pH
IV z resztą zasadową: grupą aminową -Lgs, guanidynową-Aug, z silnie zasodowym pierścieniem imidazydowym His, są one silnie polarne i powodują znaczne uwodnienie białek
V z resztą kwasową w postaci dodatkowej grupy karboksylowej -Asp, Glu, są silnie polarne i dysocjujące w wyższym pH: należą tu także Asni, Gln, które są silnie hydrodilne i uczestniczą w uwodnianiu białek
VI z resztą zawierającą siarkę: Cys, Met.
Podział aminokwasów na rodziny biologiczne. Jest to podział najbardziej prawidłowy z biologicznego punktu widzenia, gdyż opiera się wspólnotę dróg biosyntezy oraz składników wyjściowych.
Rodzina
Glutaminowa, asparoginowa, pirogronowa, szkimiaszowa,serynowa.
13 Podział aminokwasów
HYDROFILOWE polarne(arginina, asparagina, kw. asparaginowy, kw. glutaminowy, cysteina), HYDROFOBOWE niepolarne (alanina, fenyloalanina, leucyna, izoleucyna, merionina, prolina, tryptofan, walina), OBOJĘTNE
AMINOKWASY: białkowe, niebiałkowe (wyst. w białku sporadycznie): hydroksylizyna, ornityna, cytrulina, B-alanina
AMINOKWASY: Endogenne (wytw. w organizmie), Egzogenne (dost. z pożywieniem): walina, leucyna, izoleucyna(rozgał. łańcuch-wytw. przez rośliny i drobnoustroje); fenyloalanina, tyrozyna, tryptofan(aromatyczne); lizyna, merianina, treanina.
14.Punkt izoelektryczny aminokwasów. Podstawową właściwością białek jest ich charakter amfoteryczny, tj. możliwość tworzenia jonów obojnaczych. Wymagania jonowe w białkach pochodzą od niezwiązanych grup - NH2 i -COOH w resztach aminokwasów wchodzących w skład białka. Ładunek dodatni pochodzi do grup -NH3+, a ładunek ujemny od zdysocjowanych grup COO-. Ładunek elektryczny zależy od pH roztworu. Wartość pH roztworu, przy którym w przewadze występuje forma obojnaczego jonu a pozostałe formy są w równowadze to punkt izoelektryczny aminokwasu. Punkt izoel. To wartość elektronów, gdzie w przeważającej formie występuje jon obojnaczy.
15. Biosynteza aminokwasów
1.Synteza aminokwasów aromatycznych (rośliny): Phe, Tyr, Trp. Kw. dehydrochinonowy→kw. szikiminowy→kw. 5-fosfoszikiminowy:
kw. antranilowy (+PRPP,+seryna)→Trp
kw. prefenowy→Phe→hydroksylacja→Tyr
kw. prefenowy→Tyr.
2.Synteza aminokwasów o rozgałęzionych łańcuchach (rośliny/drobnoustroje): Val, Leu. Ile, 2xkw. pirogronowy→α-acetylomleczan→kw.α-keroizowalerianowy→transaminacja z kw.glutaminowym:
Val
kwas α-ketoizokapronowy→Leu
3.Synteza, Lys, Met, Thr. Kw. asparaginowy→kw. α-amino - β-formylopropilonowy→układy pierścieniowe piperydeinowe→kw. dwuaminopimelinowy→Lys, Met, Thr.
16.Aminokwasy siarkowe i ich rola w tworzeniu III-rzędowej struktury. Struktura III-rzędowa dotyczy głównie białek globularnych. Do aminokwasów siarkowych należą: Cys i Met. Cysteina ze swoją dimetryczną formą utlenioną cystyną odgrywa ważną rolę w tworzeniu struktury białek, dzięki zdolności tworzenia trwałych wiązań disulfidowych - S-S między poszczególnymi skrętami łańcucha peptydowego lub między oddzielnymi łańcuchami. Grupa -SH cysteiny ma istotne znaczenie w budowie centrum aktywnego licznych enzymów.
Metionina, która jest S-metylową pochodną homocysteiny ma istotne znaczenie jako dawca grup metylowych w licznych przemianach metabolicznych.
Grupa -SH łatwo ulega odwodorowaniu. Wiązanie disiarczkowe jest b. trwałe, utrzymuje przestrzenną strukturę białek, jest odporne na hydrolizę, ale nie w 100%.
17. Peptydy naturalne. Rola glutationu. Peptydy pełnią w organizmach różnorodne funkcje, takie jak koenzymatyczna hormonalna i inne. Także wiele antybiotyków i trucizn roślinnych ma chrakter peptydów. Najbardziej znanym peptydem jest glutation (G-SH)-trójpeptyd. Zbudowany jest z kw. glutaninowego, cysteiny i glicyny. Glutatio dzięki zaartości grupy tiolowej pochodzącej z cysteiny, łatwo ulga odwodorowaniu, przy czym dwie cząsteczki związku zredukowanego łączą się w cząsteczkę glutationu utlenionenego:
2G-SHG-S-S-G+2H++2e-
Reakcja ta jest łatwo odwracalna i dlatego, glutationowi przypisuje się rolę jednego z układów utrzymujących w komórce stały potencjał oksydoredukcyjny. Ponadto glutation współdziała w chrarakterze koenzymu z glioksylazą, czyli enzymem katalizującym przemianę metyloglioksylu do kwasu mlekowego.
Rola glutationu:-utrzymuje w komórce stały potencjał oksydo-redukcyjny,- jest to koenzym współdziałający z glikoksylazą rozkładającą metyloglioksyl do kwasu mlekowego.
Peptydy o funkcji hormonów i antybiotyków: wiele hormonów ma budowe peptydową. Hormony przysadki mózgowej:oksytocyna, kortykotropina, melanotropina. Hormon trzustki: insulina, zbudowana jest z 51 aminokwasów, stosowana w leczeniu cukrzycy. Protaminy- są to związki silnie zasadowe, ze względu na znaczną zawartość arginin, lizyny, histydyny. Występują one w jądrach komórkowych, gdzie obok histonów towarzyszą kw nukleinowym. Wiele antybiotyków np. polimyksyny, produkowane przez pleśnie są również peptydami. W ich skład wchodzą D-aminokwasy, co jest przypuszczalnie jedną z przyczyn ich antybiotykowego charakteru.
20.wiązanie azotu atmosferycznego - reakcje zachodzące w tym procesie. Wszystkie bakterie zdolne do wiązania N2 a więc zarówno wolno bytujące, jak i symbiotyczne, zawierają kompleks nitrogenazy, którą najbardziej poznano u Rhizobium na korzeniach roślin motylkowych. Informacja genetyczna do syntezy leghemoglobiny pochodzi od rośliny, ale związek nie tworzy się bez jej zainfekowania. Z kolei bakteroidy uzyskują od rośliny energię, która jest potrzebna do wiązania i redukcji N2. Źródłem jej jest pirogronian, który dostarcza ATP jak i równoważnik redukcyjny.
Pierwsza z reakcji jest katalizowana przez liazę pirogronowo-mrówczanową, a druga przez kinazę octanową. W ostatniej reakcji wydzielany wodór redukuje ferredoksynę Fd, czyli białko żelazowo-siarkowe o małej masie cząsteczkowej 6 kDa stanowiącą przenośnik elektronów w bardzo niskim potencjale oksydoredukcyjnym.
Nirogenaza jest białkiem kompleksowym, na którym odbywa się wiązanie i redukcja azotu do amoniaku. ![]()
Reakcja jest kosztowna energetycznie i wymaga na jedną parę elektronów 4-5 ATP.
21.Przemiany azotanów w roślinach i mikroorganizmach. Rośliny i drobnoustroje glebowe są przystosowane do użytkowania azotu zawartego w glebie do budowy wszystkich niezbędnych substancji azotowych. Jedyną formą, która może być bezpośrednio włączona do związków org. Jest jon amonowy. Dlatego pobrane jony azotowe muszą być z powrotem przekształcone w tę przyswajalną formę azotu +5 do -3. redukcja azotu przy kolejno działających reduktorach: azotowej i azotynowej, które są enzymami charakterystycznymi dla roślin zielonych, grzybów i promieniowców. Reakcja redukcji NO3- do NH3.
![]()
Etap działania reduktazy azotowej:
![]()
Reduktaza azotynowa jest enzymem kompleksowym, katalizującym redukcję NO2- do NH3. U organizmów zdolnych do fotosyntezy jest ona zlokalizowana w chloroplastach. Bezpośrednim czynnikiem redukującym w poszczególnych etapach jest feredoksyna Fd (red.), która czerpie protony i elektrony z NAD(P)H. Nie zawsze proces redukcji jonu azotowego jest korzystny dla rolnictwa. Znane są tzw. Bakterie denitryfikacyjne, które prowadzą redukcję azotu nie do NH3, ale do wolnego azotu, który jest wydzielany do atmosfery. Proces denitryfikacji jako beztlenowy przebiega w glebach słabo przewietrzanych, a więc niewłaściwej uprawie.
22.Nitryfikacja i denitryfikacja. Nitryfikacja - przekształcanie jonów amonowych do azotanowych przez bakterie nitryfikacyjne. Nitrosomonas - prowadzą utlenienie jonu amonowego do azotynowego:![]()
Nitrosobacter - utleniają azotyny do azotanów:
Oba rodzaje bakterii są antrofami, pobierają węgiel i azot z prostych związków mineralnych.
Denityfikacja stanowi ostatnie ogniwo cyklu azotowego, umożliwiające powrót chemicznie związanego azotu do atmosfery. Proces ten jako beztlenowy, przebiega w glebach słabo przewietrzanych w więc o nieprawidłowej uprawie.
23. Cykl mocznika Proces jako całość jest endoergiczny i wymaga dostarczenia w warunkach fizjologicznych energii swobodnej ok. 58 kJ/mol. Dlatego w tym procesie niezbędny jest udział ATP i karbomylofosforanu.
Cykl mocznikowy lub ornitynowy jest to cykl przemian trzech aminokwasów, w których po przyłączeniu cząsteczki NH3 powstaje mocznik. Jest to związek mniej toksyczny od amoniaku, a jego stężenie w moczu może być większe, co daje oszczędność wody.
Synteza mocznika odbywa się w mitochondriach dlatego, że tu zlokalizowane są enzymy cyklu mocznikowego, który zazębia się częściowo z cyklem kwasu cytrynowego.
Przemianom ulegają aminokwasy i kwasy organiczne. Polegają one na na przyłączaniu lub odłączaniu od nich cząsteczek grupy aminowej.
Powstały w tym procesie alfa-ketokwas jest „szkieletem” węglowym aminokwasu i może być poddany przemianom. Mogą być z niego syntezowane cukry, tłuszcze lub ciała ketonowe lub może być przekształcony do acetylo-CoA. Powstaje też amoniak (oprócz alfa-ketokwasu), który przy udziale energii łączy się z CO2 w wyniku czego powstaje karbonylofosforan, który zostaje włączony do cyklu mocznikowego.
Karbonylofosforan+ornityna (pod wpływem enzymu I) cytrulina (pod wpływem enzymu II) arginina (rozkład) mocznik(do płynów ciała do narządów wydalniczych)(pod wpływem enzymu III) + ornityna.
Cytrulina pobiera grupę NH od kwasu asparginowego + ATP i powstaje arginina.
Enzym I - karbamoilotransferaza,
enzym III - arginaza,
enzym II - synteza arginobursztynianowa, liaza L-arginioburszyn.
24,25. Przemiany aminokwasu (katalityczne i anaboliczne)
Przemiany kataboliczne
Białko jest rozkładane do polipeptydów, aligopeptydów, dipeptydów, wreszcie do aminokwasów, które zostają zużyte do biosyntezy. Niezbędna część białek ulega w wątrobie premianom (procesom):
Deaminacji, dekarboksylacji. Obok biosyntezy białek zachodzi też proces wydalania zbędnych aminokwasów.
Aminokwasy posiadają grupę aminową i karboksylową. Proces degradacji zachodzi w etapach. Najpierw deaminacja( usunięcie grupy aminowej). Dochodzi do deaminacji oksydacyjnej grupa aminowa zostaje usunięta i utleniona. Proces ten jest katalizowany przez oksydoreduktory, które współdziałają z FAD i powstaje iminokwas. W środowisku kwaśnym powstaje oksokwas. Protony ze zredukow. FAD zostają przeniesione na O2 . Powstaje FAD utlenione i H2O2. H2O2 jest rozkładany przez katalizę do H2O i O2. Enzym, który powoduje deaminację oksydacyjną z NAD.
Kwas glutaminowy, po odłączeniu protonów przechodzi w iminoglutanowy kwas, a ten w kwas 2-oksoglutaminowy.
Protony z NAD są przenoszone w łańcuchu komórkowym przez przenoścniki na tlen. W organizmach wyższych zachodzi deaminacja oksyd. W niższych inne rodzaje deaminacji: Desaturacyjna, redukcyjna, hydrolityczna.
D. desatusaturacyjna- prowadzi do powst. Kwasów nienasyconych przez odłączenie NH3.
D. redukcyjna- zachodzi w obecności zw. redukujących odpowiednich bakterii. Prowadzi do powstawania kw. org. Nasyconych.
D. hydrolityczna- zachodzi w obecności H2O, odłącza się NH3 i powstają hydroksykwasy.
Deaminacja aminokwasów w roślinach wyższych przebiega w małych ilościach , bo aminokw. są włączane od razu do biosyntezy białka. W org. zwierzęcych nadmiar białka musi być usunięty. Aminokwasy są wykorzystywane do biosyntezy białka, a zbędne ulegają katabolicznym reakcjom.
Dekarboksylacja aminokwasów- enzymatyczne odczepienie CO2. Grupa karboksylowa jest połączona z C. Rozkładane jest wiązanie -C—C— bez udziału wody (dzięki liazom). Usuwanie grupy karboksylowej odbywa się dzięki karboksyliazom. Grupa prostetyczną jest fosforan pirodoksanu.
W procesie transaminacji fosforan łączy się z aminokwasem tworząc zasadę SCHIFFA, pod działaniem karboksyliaz następuje odłączenie CO2 i powstaje aminaza z zasady Schiffa uwalnia się fosforan pirodosanu.
Procesy dekarboksylacji prowadzą do powstawania amin, które są często toksyczne (putrescyna). Produktami dekarboksylacji są aminy biogenne, które uczestniczą w biosyntezie alkalidów, posiadają właściwości hormonów np. cysteina przechodzi w cysteaminę. (skł.. CoA).
Wyszukiwarka
Podobne podstrony:
BIAŁKA DO 10, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty
ENZYMY OD33 DO 42, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty
CUKRY OD54 DO 58e, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty
GENY OD43 DO 53, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty
BIAŁKA DO 10, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty
zmiany klimatu Cwicz do dania, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Zagrożenia cywiliz
Odcieki. Dopuszczenie do składowania, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Technologie
Obszary ekol zagroz do dania, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Zagrożenia cywiliza
zmiany klimatu Cwicz do dania, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Zagrożenia cywiliz
aga1, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty, Do uporządkowania
ww, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty, Do uporządkowania
questy, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty, Do uporządkowania
biochemia cz 1, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty
OSADY ŚCIEKOWE, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty
GEODEZJA I KARTOGRAFIA, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty
GISY-EGZAMIN POPRAWKOWY, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty
ekologia-sciaga2, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Magdy
cw3kolorymetr, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Magdy
Pismo do studentów stud. niest. Ochrona Śro dowiska, Studia, 1-stopień, inżynierka, Ochrona Środowis
więcej podobnych podstron