Egzamin 2007-01-22
Struktura elektronowa atomów (6 pkt)
Struktura elektronowa ![]()
przedstawia się następująco ...................................................................................................................................... .
Na podstawie zapisu struktury elektronowej można stwierdzić, iż atom kadmu posiada............. elektronów walencyjnych, z których.........znajdują/e się na orbitalu/ach..................... . Kadm leży w grupie ......... , okresie .........., w bloku ........ układu okresowego pierwiastków.
Zakaz Pauliego (2 pkt)
Zgodnie z zakazem Pauliego, dany orbital mogą zajmować maksymalnie ............ elektrony, a jeżeli ............ elektrony zajmują jeden orbital, to ich ....................... muszą być ................. .
Elektroujemność (2 pkt)
Zestawiając wartości elektroujemności atomów pierwiastków z ich położeniem w układzie okresowym pierwiastków można stwierdzić następujące właściwości:
- elektroujemność ....................... w okresie wraz ze zwiększaniem liczby atomowej pierwiastka,
- elektroujemność ....................... w grupach wraz ze zwiększaniem liczby powłok elektronowych.
Roztworu buforowe (3 pkt)
Roztwory buforowe charakteryzują się zachowaniem stałego .................... roztworu przy rozcieńczaniu roztworu i po dodaniu niewielkich ilości kwasu lub zasady. Jony H3O+ i OH- są wiązane w postać niezdysocjowanych cząsteczek słabego kwasu lub słabej zasady. Napisz reakcję, jaka zachodzi po dodaniu niewielkiej ilości kwasu solnego do roztworu buforu octanowego.
............................................................................................................................
Reakcje dysocjacji (3 pkt)
Dysocjacja kwasu chlorowego (VII) HClO4 w roztworze wodnym
......................................................................................................................................
Na przykładzie drugiej reakcji zgodnie z teorią Brönsteda-Lowry'ego można stwierdzić, iż.....................................jest kwasem, ponieważ .................................... proton, czyli jest ................................... . Wzór na stałą dysocjacji dla drugiej reakcji przedstawia się następująco..................................... .
Procesy redoks (6 pkt)
Uzgodnij współczynniki stechiometryczne równania. Napisz równania połówkowe.
KOH + Br2 → KBrO3 + KBr + H2O
Procesowi utleniania towarzyszy ................... elektronów przez reagent ulegający utlenieniu nazywany ........................... , którym w przypadku powyższej reakcji jest................................ . Natomiast w reakcji redukcji elektrony są ................... przez reagent ulegający redukcji nazywany .........................., którym w przypadku powyższej reakcji jest................................. .
Reakcje rodnikowe (3 pkt)
Nazwij kolejne etapy poniższej reakcji rodnikowej
Etap .............................. Cl2 + hν → 2Cl*
Etapy ............................ Cl* + CH4 → HCl + CH3*
CH3* + Cl2 → CH3Cl + Cl*
Etapy ........................... Cl* + *Cl → Cl2
CH3* + *CH3 → CH3CH3
CH3* + *Cl → CH3Cl
Ogniwa elektrochemiczne (4 pkt)
Zbudowano ogniwo z dwóch półogniw. Roztwór jednego półogniwa zawierał jony Fe3+ i Fe2+, a drugiego Sn4+ i Sn2+. Potencjał elektrody żelazowo-żelazawej wynosi +0,77 V, a elektrody cynowo-cynawej +0,15 V.
Na schemacie ogniwa proszę popisać które półogniwo jest katodą, a które anodą:
Pt | Sn4+, Sn2+ || Fe2+, Fe3+| Pt
................................ .................................
Na katodzie ................................... ulega ....................................................... . Natomiast na anodzie ............................................. ulega.......................................... .
Nazewnictwo węglowodorów (4 pkt)
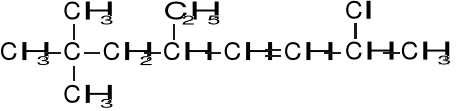
Proszę podać poprawną nazwę związku.......................................................................
Wyszukiwarka
Podobne podstrony:
13. egzamin 17 09 04, Inżynieria Środowiska PW semestr I, chemia, sesja
Chemia egzamin 2004(2005-06), Inżynieria Środowiska PW semestr I, chemia, sesja
egzamin test v3, Inżynieria Środowiska PW semestr I, chemia, sesja
egzamin 2004sciaga, Inżynieria Środowiska PW semestr I, chemia, sesja
2. egzamin 9 2 2006, Inżynieria Środowiska PW semestr I, chemia, sesja
16. egzamin test 1rok, Inżynieria Środowiska PW semestr I, chemia, sesja
egzamin test v2, Inżynieria Środowiska PW semestr I, chemia, sesja
7. egzamin test v1, Inżynieria Środowiska PW semestr I, chemia, sesja
1. egzamin 2 2 2006, Inżynieria Środowiska PW semestr I, chemia, sesja
SESJA ZIMOWA 2006, Inżynieria Środowiska PW semestr I, chemia, sesja
zestawy 28 pyt Ai B mini, Inżynieria Środowiska PW semestr I, chemia, sesja
testy 1rok egz2, Inżynieria Środowiska PW semestr I, chemia, sesja
11. testy 1rok v4, Inżynieria Środowiska PW semestr I, chemia, sesja
wszystkie pytania - ciąg - sciąga - długopisy, Inżynieria Środowiska PW semestr I, chemia, sesja
sciaga chemia, Inżynieria Środowiska PW semestr I, chemia, sesja
więcej podobnych podstron