|
Bartosz Żychowski Marcin Żurek |
Rok: II |
Grupa: 6 |
Zespół: 5 |
|||
|
Nr ćwiczenia: 35 |
||||||
|
Data wykonania: 18.03.2008 |
Data oddania:
|
Data zaliczenia: |
Ocena:
|
|||
Cel ćwiczenia:
Wyznaczanie równoważnika elektrochemicznego miedzi oraz stałej Faradaya w doświadczeniu z elektrolizą wodnego roztworu CuSO4 oraz zapoznanie się ze sposobem precyzyjnego pomiaru masy na wadze analitycznej.
Wstęp teoretyczny:
Charakterystyczna grupę przewodników prądu elektrycznego stanowią elektrolity. Są to przeważnie wodne roztwory kwasów, zasad i soli, czyli substancji krystalicznych o wiązaniu jonowym. Przy rozpuszczaniu kryształu wiązania miedzy jonami zostają zerwane i większa część atomów przechodzi do roztworu w postaci jonów, poruszających się bezładnie w roztworze. Rozpad na jony przy rozpuszczaniu nazywamy dysocjacja elektrolityczna, a otrzymany roztwór - elektrolitem.
Zjawisko dysocjacji zachodzi również w innych niż woda środowiskach, np. w alkoholach. Jednak ze względu na bardzo dużą stałą dielektryczna wody (ε = 81) stopień dysocjacji elektrolitycznej w roztworach wodnych jest znacznie większy.
Gdy do roztworu elektrolitu wstawimy elektrody i dołączymy je do zewnętrznego
źródła prądu stałego o różnicy potencjałów U, to ruch jonów staje się uporządkowany. Kationy dążą do ujemnej katody, aniony do anody, czyli przez elektrolit płynie prąd. Na elektrodach jony zostają zobojętnione i staja się zwykłymi atomami lub zgrupowaniami atomów. Przepływowi prądu towarzyszy wiec wydzielanie się substancji na elektrodach. Proces ten nazywamy elektroliza. Aby naładowany elektrycznie jon mógł zmienić się na elektrodzie na obojętny atom, musi przepłynąć ładunek równy ne, gdzie e jest ładunkiem elementarnym elektronu, natomiast n wartościowością:
n = 1 dla jonów typu Na+, Cl−,H+
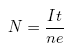
n = 2 dla jonów typu Cu++, SO4−−, Ca++ itd.
Liczba atomów wydzielonych na elektrodzie jest stosunkiem ładunku całkowitego (czyli iloczynu prądu I i czasu t) do ładunku pojedynczego jonu:
![]()
Masę powstałych atomów można obliczyć mnożąc liczbę atomów N przez masę pojedynczego atomu równą stosunkowi masy gramoatomu A do liczby Avogadra NA, czyli:
Powyższy wzór obejmuje dwa prawa elektrolizy Faradaya, które zostały sformułowane
oddzielnie na drodze eksperymentalnej:
I. Masa m substancji wydzielonej na elektrodzie jest proporcjonalna do natężenia prądu I oraz czasu jego przepływu t (lub po prostu do ładunku Q):
![]()
![]()
Porównując oba wzory widać, że współczynnik proporcjonalności wynosi:
Nazywamy go elektrochemicznym równoważnikiem substancji.
II. Równoważniki elektrochemiczne k pierwiastków są proporcjonalne do ich równoważników chemicznych A/n . Iloczyn eNA wyraża ładunek potrzebny do wydzielania
jednego gramorównoważnika chemicznego substancji. Oznacza się go zwykle literą F i nazywa stałą Faradaya - eNA = F = 96500 C.
Dzieląc stałą Faradaya przez liczbą Avogadra otrzymujemy wartość ładunku elementarnego.
Rezultatem elektrolizy roztworu siarczanu miedzi CuSO4, przy użyciu elektrod
miedzianych, jest wydzielanie się miedzi na katodzie i ubytek takiej samej masy elektrody
dodatniej (anody). Równoważnik elektrochemiczny k wyznacza się przez pomiar masy wydzielonej na katodzie, natężenia prądu oraz czasu jego przepływu (I prawo Faradaya). Znając k, stałą Faradaya F, oblicza się korzystając ze wzoru na k i związku F = eNA.
Aparatura:
Elektrolizę siarczanu miedzi CuSO4 przeprowadza się w naczyniu z miedzianymi
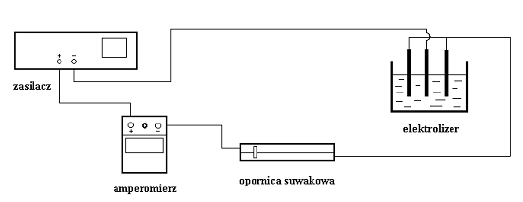
elektrodami w kształcie równoległych płyt, oddalonych od siebie o kilka centymetrów. Natężenie przepływającego prądu odczytuje się na amperomierzu. Pomiaru przyrostu masy miedzi na katodzie, wymagającego dużej precyzji, dokonuje się na wadze analitycznej. Aparaturę należy podłączyć według podanego niżej schematu:
Opracowanie wyników i pomiarów:
Czas elektrolizy t = 30 min = 1800 s
Natężenie prądu I = 0,5 A
Klasa amperomierza - 0,5
Używany zakres amperomierza - 0,75 A
Pomiar mas katody i anod |
||
m1 [g] |
M1 [g] |
M2 [g] |
61,014 |
54,622 |
112,290 |
Pomiar mas katody i anod po elektrolizie |
||
mk1 [g] |
Mk1 [g] |
Mk2 [g] |
61,315 |
54,454 |
112,163 |
Obliczanie masy miedzi wydzielonej na katodzie:
mkat = m1 - mk1 = (61,315-61,014) = 0,301 g
Obliczanie zmiany masy anod podczas elektrolizy:
Mand = (M1 - Mk1)+(M2 - Mk2) = (54,622 - 54,454) + (112,290 - 112,163) = 0.295 g
![]()
Obliczanie wartości współczynnika elektrochemicznego miedzi przy wykorzystaniu
I prawa Faradaya:
![]()
Obliczanie stałej Faradaya korzystając z wyliczonego wcześniej k:
![]()
Za pomocą wyznaczonej stałej Faradaya obliczamy wielkość ładunku elementarnego:
![]()
Obliczanie niepewności pomiarowej:
Niepewność pomiaru przyjmujemy jako
u(m) = 10-6 kg
u(M) = 10-6 kg
u(I) = (klasa amperomierza ∙ zakres) / 100 = (0,5 ∙ 0,75 A) / 100 = 0,00375 A
u(Q) = 6,75 C
u(t) = 1,8 s
Niepewność procentowa pomiaru czasu równa się 0,1 %. Jest to wielkość zaniedbywalnie mała, która w dalszych obliczeniach pomijamy.
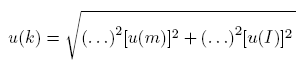
Korzystając z prawa przenoszenia niepewności (z uwzględnieniem pominiętej niepewności pomiarowej czasu):
Po podstawieniu wcześniej określonych niepewności pomiarowych otrzymujemy wynik:
u(k) = 1,1196 ∙10-9 kg / C = 1,1196 ∙10-3 mg / C
Obliczanie niepewności pomiarowej stałej Faradaya:
u(F) = [A ∙ u(k)] / (n ∙ k2)
u(F) = 283,3779 C
Obliczanie niepewności pomiarowej ładunku elementarnego:
u(e) = u(F) / NA
u(e) = 283,3779 / 6,02 ∙ 1023 = 4,7072 ∙ 10-22 C
Uzyskane wyniki |
|||||
|
Wartość tablicowa |
Wartość wyznaczona w doświadczeniu |
Różnica |
Niepewność |
Niepewność względna [%] |
k [kg/C] |
0,3294 ∙10-6 |
0,3444 ∙10-6 |
1,5 ∙ 10-8 |
1,1196 ∙ 10-9 |
7,59 |
F [C] |
96500 |
92305.459 |
4194.541 |
283,3779 |
7,10 |
e [C] |
1,6020 ∙10-19 |
1,489 ∙10-19 |
1,13 ∙ 10-20 |
4,7072 ∙10-22 |
7,05 |
Wyszukiwarka
Podobne podstrony:
Lepkość-sciaga, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
Nr ćwiczenia5 moje, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
[4]tabelka, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, labo
[8]konspekt new, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
FIZYK~47, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, Fizyka
3 W LEPKO CIECZY, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
[3]opracowanie v1.0, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labo
kospekt12, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, 12 Wyznaczanie
PUZON, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, Laborki s
cw8 wyniki, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, labo
[4]opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
mostek Wheatstone'a(1), Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, l
za, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, laborki fizy
konspekt nr8, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, Fi
[7]opracowanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
konspekt 8, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, Fizy
konspekt 9, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, Fizy
więcej podobnych podstron