Laboratorium Chemii Fizycznej
Laboratorium Studenckie
Sprawozdanie z ćwiczenia nr 12.
Temat ćwiczenia: Równowaga fazowa ciecz-ciecz w układzie
trójskładnikowym
Cel ćwiczenia:
1. Wyznaczanie izotermy rozpuszczalności w układzie
Chloroform-woda-kwas octowy.
2.Wyznaczanie cięciwy równowagi.
Aparatura(I ćwiczenie):
10 kolb stożkowych
3 biurety
termometr
Odczynniki:woda destylowana
chloroform kwas octowy 100%
Aparatura(II ćwiczenie):
Wkraplacz
2 naczynia wagowe
2 pipety 5 cm3
2 kolbki miarowe 250 cm3
Odczynniki:0.05 m NaOH
fenoloftaleina roztwór 1-owy
Wykonali:
Roman Jędrzejewski
Emil Langiewicz
Teoria
Trójkąt równoboczny dzięki swym własnościom nadaje się doskonale do przedstawienia składu układu trójskładnikowego. Zasadnicze cechy diagramu trójkątnego (tzw. Trójkąt Gibbsa) są następujące:
każdy wierzchołek trójkąta przedstawia jeden czysty składnik,
punkty leżące na bokach trójkąta przedstawiają mieszaniny dwuskładnikowe,
punkty leżące wewnątrz trójkąta przedstawiają mieszaniny trójskładnikowe,
linia równoległa do jednego boku przedstawia mieszaniny zawierające stały ułamek składnika leżącego naprzeciw tego boku,
aby wyznaczyć punkt o współczynnikach XA, XB,XC, na bokach AC i BC wyznaczamy punkty odpowiadające XC i łączymy je a na bokach AB i AC odkładamy punkty odpowiadające XA i łączymy je, punkt przecięcia tych dwu prostych wyznacza poszukiwany skład,
linia przechodząca przez jeden z wierzchołków przedstawia mieszaniny zawierające dwa pozostałe składniki w stałym stosunku,
gdy miesza się różne ilości dwu mieszanin o składach P i Q otrzymuje się mieszaniny, których składy leżą na linii PQ wewnątrz trójkąta Gibbsa.
W układach 3 cieczy wszystkie składniki mogą być całkowicie mieszalne, bądź też układ może zawierać jedną, dwie lub trzy pary cieczy częściowo mieszalnych.
Na rys. 1 przedstawiono diagram równowagi ciecz-ciecz w układzie trójskładnikowym z jedną parą cieczy częściowo mieszalnych.
A
B C
Powierzchnia ponad krzywą binoidalną (DQE) odpowiada układowi jednofazowemu, powierzchnia pod binodą układowi złożonemu z dwóch faz ciekłych. Układ taki ma jeden stopień swobody, a więc danemu składowi jednej fazy odpowiada określony skład drugiej fazy.
Krzywa DQ przedstawia składy fazy bogatej w składnik B, a krzywa EQ - składy fazy bogatej w C. Obie krzywe zbiegają się w punkcie splotu Q. W tym punkcie składy obu faz stają się identyczne. Linia wiążąca DE (cięciwa równowagi) łączy składy faz pozostających ze sobą w równowadze. Linie wiążące z reguły nie są równoległe do żadnego z boków trójkąta ani nie są równoległe do siebie; niekiedy przecinają się w jednym punkcie.
Trójkąt Gibbsa: reguła faz przewiduje, że w układach trójskładnikowych suma liczby stopni swobody i liczby faz równa jest 5
λ+ϕ=3+2=5
Zatem maksymalna liczba stopni swobody wynosić może 4; w układzie jednofazowym zmieniać się mogą niezależnie temperatura, ciśnienie i stężenia dwóch składników. Ułamek molowy lub wagowy trzeciego jest automatycznie ustalony, bo x1+x2+x3=1 lub w1+w2+w3=1. Ponieważ relacji między czterema zmiennymi nie daje się przedstawić graficznie, trzeba wprowadzić jakieś uproszczenia. Zazwyczaj przyjmuje się, że ciśnienie jest ustalone i wynosi 1 atm. W ten sposób liczba stopni swobody zmniejsza się di trzech. Pozostałe trzy zmienne przedstawia się na wykresie trójwymiarowym, podstawą jest trójkąt równoboczny. Zmienne wyrażające skład odkłada się na osiach trójkąta, a temperaturę na osi pionowej.
CEL ĆWICZENIA
W układzie trójskładnikowym chloroform-kwas octowy- woda obserwuje się
zakres ograniczonej rozpuszczalności. Celem ćwiczenia jest określenie zakresu stężeń, w którym to zjawisko występuje, czyli wyznaczenie izotermy rozpuszczalności oraz cięciwy równowagi.
Wzajemna rozpuszczalność dwu częściowo nie mieszających się cieczy ulega znacznym zmianom pod wpływem dodania trzeciego składnika. Jeżeli ten trzeci składnik jest rozpuszczalny tylko w jednej z dwu cieczy to wzajemna rozpuszczalność maleje. Dodanie zaś składnika dobrze rozpuszczającego się w obu cieczach zwiększa ich wzajemną rozpuszczalność. Zjawiska te są doskonale ilustrowane w układzie CHCL3-CH3COOH-H20. Gdy dodamy w określonej temperaturze CH3COOH do mieszaniny wody c CHCL3 to wzrasta wzajemna rozpuszczalność wody i CHCL3 przy określonej ilości CH3COOH mieszanina staje się jednorodna.
WYKONANIE ĆWICZENIA
W kolbach stożkowych ze szlifem sporządza się mieszaniny chloroformu i
lodowatego kwasu octowego o składzie podanym w tabeli. Ciecz odmierza się biuretą. Próbki (w kolejności od 1 do 10) miareczkuje się z biurety, ciągle mieszając, wodą destylowaną aż do zmętnienia. Wyniki miareczkowań notuje się w tabeli. Z otrzymanych wyników należy wykreślić izotermę ograniczającą zakres częściowej rozpuszczalności w układzie chloroform-woda-kwas octowy na wykresie trójkątnym Gibbsa.
Tabela wyników:
Nr pr. |
Objętość w cm3 |
% wag. w roztworze |
% molowy w roztworze |
||||||
|
H2O |
CH3COOH |
CHCl3 |
H2O |
CH3COOH |
CHCl3 |
H2O |
CH3COOH |
CHCl3 |
1 |
0,7 |
5 |
30 |
1,3820 |
10,3653 |
88,2527 |
8,658076 |
17,316152 |
74,025772 |
2 |
1,1 |
7 |
20 |
2,8758 |
19,2157 |
77,9085 |
15,602929 |
27,801583 |
56,595487 |
3 |
1,45 |
8 |
14 |
4,7216 |
27,3527 |
67,9258 |
22,366290 |
34,552061 |
43,081649 |
4 |
3,05 |
11 |
10 |
10,3390 |
39,1525 |
50,5085 |
37,538558 |
37,907790 |
24,553652 |
5 |
5,45 |
14 |
10 |
15,5492 |
41,9401 |
42,5107 |
47,954334 |
34,491924 |
17,553742 |
6 |
5,65 |
12,5 |
6 |
20,3861 |
47,3570 |
32,2569 |
54,605266 |
33,826271 |
11,568463 |
7 |
7,75 |
13 |
4 |
28,3260 |
49,8904 |
21,7836 |
63,587179 |
29,865462 |
6,547360 |
8 |
11,5 |
14 |
2 |
39,4106 |
50,3770 |
10,2125 |
72,697408 |
24,780334 |
2,522258 |
9 |
16,3 |
14 |
1,5 |
49,0447 |
44,2305 |
6,7248 |
79,437613 |
19,104015 |
1,458372 |
10 |
18,5 |
14 |
1 |
53,3295 |
42,3753 |
4,2952 |
81,787845 |
17,330181 |
0,881973 |
a)obliczanie % wagowego w roztworze
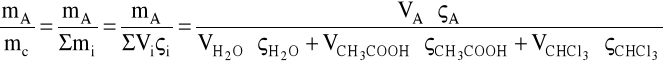
np.
VH2O = 0,7 cm3
ςH2O = 1 g/cm3
VCH3COOH = 5 cm3
ςCH3COOH = 1,0498 g/cm3
VCHCl3 = 30 cm3
ςCHCl3 = 1,4904 g/cm3

b) obliczanie % molowego w roztworze
% molowy A
![]()
![]()
![]()
np.
mH2O = 1,3820 g
MH2O = 16 g/mol
∑V = 35,7 dm3
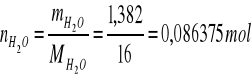
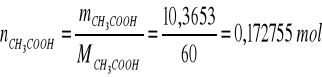
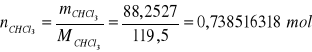
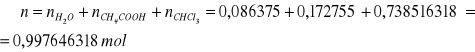
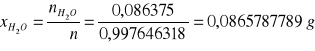
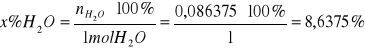
W oparciu o powyższą tabelę sporządza się wykres ograniczonej mieszalności dla układu CHCl3- H2O- CH3COOH wyrażając stężenie w % molowych:
WYKONANIE CZĘŚCI II ĆWICZENIA
Do suchego rozdzielacza wprowadzić następujące objętości poszczególnych
cieczy:
kwas octowy 15 ml
chloroform 30 ml
woda 12 ml
Zawartość rozdzielacza energicznie wstrząsać przez około 10 minut, po czym odstawić w celu rozdzielenia warstw.
Otworzyć korek rozdzielacza i do dwóch odważonych naczynek wagowych wprowadzić próbki po około 5 gram każdej z faz. Próbki dokładnie zważyć, przenieść do kolbek miarowych o pojemności 250 cm3 i dopełnić wodą do kreski.
W celu oznaczenia zawartości kwasu octowego z każdej z faz, pobrać z kolbek próbki 5 cm3 i zmiareczkować 0,05 molowym NaOH wobec fenoloftaleiny do uzyskania lekko różowego zabarwienia. Obliczyć zawartość CH3COOH w warstwie chloroformowej (faza I) i warstwie wodnej (faza II). Otrzymane wyniki nanieść na izotermę rozpuszczalności, punkty połączyć cięciwą równowagi.
OBLICZENIA
Zawartość CH3COOH w warstwie chloroformowej (1) i w warstwie wodnej (2) oblicza się ze wzoru:
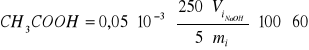
% wag
gdzie: Vi NaOH - objętość 0,05 m NaOH zużyta na miareczkowanie próbki fazy i [cm3]
mi - naważka próbki fazy i [g]
i = 1,2 nr fazy
Zawartość CH3COOH w warstwie chloroformowej (1):
gdzie: V1 = 4 cm3
m1 = 5,4783 g
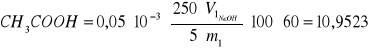
% wag
Zawartość CH3COOH w warstwie wodnej (2):
gdzie: V2 = 12,4 cm3
m2 = 4,7194 g
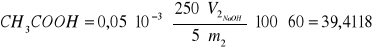
% wag
Wyszukiwarka
Podobne podstrony:
Lab 9 12, Studia - Politechnika Opolska, Semestr 2, Informatyka
Lab 7 12, Studia - Politechnika Opolska, Semestr 2, Informatyka
Lab 8 12, Studia - Politechnika Opolska, Semestr 2, Informatyka
12(1), Studia, Politechnika
materiaB do 12, Studia, Politechnika
fiza 12 odpowiedzi, Politechnika Slaska, studia zaoczne, rybnik, wydzial gornictwo i geologia, semes
O.12.3P, Politechnika Lubelska, Studia, Studia, fizyka
12. szlif, Politechnika Lubelska, Studia, Studia, Sprawka 5 semestr, technologia maszyn tuleja, BOCI
Sprawfiz14, Studia, Politechnika
W 4 - 26.10.12, Studia, Praca Socjalna, Semestr 5, Rynek pracy
petrologia8 2.12, Studia (Geologia,GZMIW UAM), II rok, Petrologia, Wykłady, Wykłady
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Ch w9 8.12, Studia (Geologia,GZMIW UAM), I rok, Chemia
Testy biodegradacji, Studia, Politechnika
Norek7-12, studia, Etyka
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
Kresowa księga sprawiedliwych T 12 Studia i materiały Warszawa 2007 ISBN 978 83 60464 61 8
CH.F.L9, Studia, Politechnika
więcej podobnych podstron