Zakład Chemii Fizycznej
Laboratorium Studenckie
SPRAWOZDANIE
ĆWICZENIE 14
WYZNACZANIE STAŁEJ RÓWNOWAGI REAKCJI
J2 + J - = J3 -
WYKONALI:
Kozieł Urszula
Piotr Gawroński
Technologia Chemiczna
rok III grupa II
SZCZECIN 2002
CEL ĆWICZENIA:
Celem ćwiczenia jest wyznaczenie stałej równowagi reakcji:
J2 + J - = J3 -
a także wykazanie, że wielkość ta nie zależy od stężeń reagentów w roztworze.
WSTĘP:
Jeżeli rozpatrujemy układ zamknięty, to układ ten znajduje się w równowadze termodynamicznej, jeżeli jego stan termodynamiczny nie zmienia się w czasie.
Równowaga reakcji chemicznej jest stanem końcowym po zajściu reakcji chemmicznej, gdzie w jednostce czasu powstaje tyle samo produktów z substratów, co substratów z produktów.
W rozpatrywanym układzie znajdującym się w warunkach stałego ciśnienia i temperatury T,p=const warunkiem ustalenia się stanu równowagi reakcji jset równanie:
![]()
Ponieważ potencjały chemicznne wyraża wzór:
![]()
Więc powyższy wzór można przedstawić:
![]()
Skąd warunek ten można przedstawić następująco:
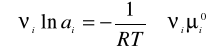
czyli:
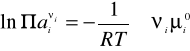
Jeżeli prawa strona równania jest funkcją wyłącznie T i p to można zapisać:
![]()
Tak zapisane równanie definiuje prawo działania mas, a wielkość K(T,p) nazywa się termodynamiczną stałą równowagi.
Wielkość tę obliczono dla dwóch roztworów,
Rozdzielacz 1- 20 cm3 nasyconego r-ru J2 w CCl4
100 cm3 0,1m KJ
Rozdzielacz 2- 10 cm3 nasyconego r-ru J2 w CCl4
10 cm3 CCl4
100 cm3 0,1m KJ
w których stężenia jodu są różne, a które oznaczano za pomocą miareczkowania r-rem tiosiarczau sodu. W taki sposób oznaczono stężenie jodu (J2+J3-) w roztworze wodnym zgodnie z równaniami reakcji:
![]()
oraz
![]()
Jony ![]()
są nietrwałe i rozpadają się w czasie miareczkowania. Otóż stężenie jonu w mieszaninie reakcyjnej można wyznaczyć na podstawie prawa podziału Nernsta, stąd wynika nazwa metody - metoda podziału. W tym celu wodny roztwór, w którym zachodzi reakcja chemiczna, wytrząsa się z czterochlorkiem węgla. Praktycznie tylko J2 rozpuszcza się CCl4 i przechodzi do warstwy organicznej w takich ilościach , że stosunek jego stężeń w obu warstwach równa się współczynnikowi podziału. Ustala się równowaga dwóch procesów : równowaga reakcji chemicznej l. w roztworze wodnym oraz równowaga podziału J2 pomiędzy wodą i CCl4. Stężenie J2 w CCl4 w stanie równowagi obu procesów oznacza się również za pomocą miareczkowania roztworem Na2S2O3. Znając współczynnik podziału J2 pomiędzy CCl4 i wodą oraz stężenie J2 w warstwie czterochlorkowej oblicza się stężenie wolnego J2 w warstwie wodnej. Na tej podstawie można już obliczyć stężenia poszczególnych reagentów oraz stałą równowagi.
OBLICZENIA:
1. Stężenie molowe jodu w warstwie CCl4 rozdzielaczy:
R1=18,16
![]()
= 0,5*18,16*0,01*10-3*200=1,816*10-2
R2=9,13
![]()
=0,5*9,13*0,01*10-3*200=9,13*10-3
2. Suma stężeń molowych jodu J2 i jonów J3- w warstwach wodnych rozdzielaczy:
Rw1=13,2
![]()
=0,5*13,2*0,01*10-3*200=1,32*10-2 [mol/dm3]
Rw2=7,1
![]()
=0,5*7,1*0,01*10-3*200=7,1*10-3 [mol/dm3]
3. Stężenie wolnego jodu J2 w warstwach wodnych obliczonych na podstawie prawa podziału Nernsta
dla k=0,01:
![]()
=k*![]()
=0,01*1,816*10-2=1,816*10-4 [mol/dm3]
![]()
=k*![]()
=0,01*9,13*10-3=9,13*10-5 [mol/dm3]
4. Stężenie molowe jonów J3- w warstwie wodnej rozdzielaczy:
![]()
=![]()
-![]()
=1,32*10-2 - 1,816*10-4=1,30184*10-2 [mol/dm3]
![]()
=![]()
-![]()
=7,1*10-3 - 9,13*10-5=7,0087*10-3 [mol/dm3]
5. Stężenie molowe jonów J- w warstwach wodnych:
![]()
![]()
=0,1-1,30184*10-2=8,69816*10-2 [mol/dm3]
![]()
![]()
=0,1-7,0087*10-3=9,29913*10-2 [mol/dm3]
6. Stała równowagi reakcji:
K1=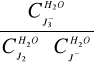
=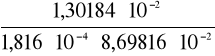
=824,21019
K2=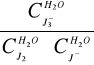
=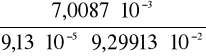
=825,52414
7. Tabela wyników:
|
ROZDZIELACZ 1 |
ROZDZIELACZ 2 |
WYNIK MIARECZKOWANIA [ml/5ml] |
1. 18,1 |
1. 9,2 |
|
2. 18,2 |
2. 9,1 |
|
3. 18,2 |
3. 9,1 |
WYNIK UŚREDNIONY |
18,16 |
9,13 |
WARSTWA WODNA[ml/5ml] |
13,2 |
7,1 |
|
1,816*10-2
|
9,13*10-3
|
|
1,32*10-2
|
7,1*10-3
|
|
1,816*10-4 |
9,13*10-5
|
|
1,30184*10-2 |
7,0087*10-3
|
|
8,69816*10-2
|
9,29913*10-2
|
K |
8,2421019*102 |
8,2552414*102 |
8. Wnioski
Na podstawie wykonanych pomiarów i obliczeń - uwzględniając błędy pomiarowe a także błędy czynnika ludzkiego, wykazano niezależność stałej równowagi od stężeń reagentów w roztworze. ![]()
![]()
Wyszukiwarka
Podobne podstrony:
SprawfizRE.-12-, Studia, Politechnika
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
CH.F.L9, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
Sprawko spawalnictwo 1, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 semestr, obro
dziadek25, Studia, Politechnika
4 2 vademecum echosondy (w tym przykładzie wodnej), studia, studia Politechnika Poznańska - BMiZ - M
LABORKA7, Studia, Politechnika
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
deacon1, Studia, Politechnika
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
Liczby przenoszenia jonów, Studia, Politechnika
103, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE, FIZYKA 2, F
poprawione7, Studia, Politechnika
więcej podobnych podstron