I zasada termodynamiki (ukł. zamknięty) :
Zmiana energii wewnętrznej równa jest sumie algebraicznej pracy oraz,ciepła,wymienionego z otoczeniem jeśli nie występuje zmiana energii kinetycznej oraz energii położenia układu . dU=dQ-dL ; ΔL=pdV ;
Druga postać I zasady termodynamiki; di=dq+Vdp;
I zasada termodynamiki (ukł. otwarty)
dU=dQ+idm-pdV; i-entalpia; i=u+pϑ;
Zerowa zasada termodynamiki - jeżeli dwa układy są w równowadze cieplnej z trzecim układem, to są one również w równowadze ze sobą.
I zasada termodynamiki - zmiana energii wewnętrznej układu równa jest zmianie ciepła układu i pracy wykonanej nad układem lub przez układ,nad,otoczeniem
dU= dQ - dL ; dL = pdV .
druga postać di = dq + vdp .
II zasada termodynamiki;
Nie istnieje maszyna cieplna pracująca cyklicznie,wykonująca pracę bez zmian w otoczeniu;;w dowolnym procesie termodynamicznym entropialwszechświata może wzrastać lub pozostać stała, ale nigdy nie może maleć
ds=dQ/T
III zasada termodynamiki - zmiana entropii związana z dowolnym odwracalnym procesem izotermicznym układu skondensowanego dąży do zera, gdy temperatura układu dąży do zera.; W temperaturze zera bezwzględnego entropia układu skondensowanego dąży do zera.
Równanie ciepła wg II zasady termodynamiki
1) w procesie odwracalnym Tds = cvdT + T(∂p/∂T)vdV
2) Tds = cpdT - T(∂V/∂T)pdp
I równanie Maxwella;
Du=Tds-pdϑ-Σ(y)(α=1)(Fα*dxα); a) xα=const; du=Tds-pdϑ; (diT/diϑ)s=-(dip/dis)ϑ; b) ϑ=const; du=Tds+Σ(y)(α=1)(Fα*dxα);
(diT/dixα)s; ϑ=(diFα/diS)xα, ϑ;
II równanie Maxwella;
di*=Tds+Jdp-Σ(y)(α=1)(xα*dtα); a) Fα-const; (diT/dip)s=(diϑ/dis)p; b) Fi=/α=const; (diT/diFα)s; p=(dixα/dis)p
III równanie Maxwella![]()
df=sdT+pdϑ+Σ(y)(α=1)(Fα*dxα); f=u-Ts; a) xα=const; (dis/diϑ)T=(dip/dif)ϑ; b) xi=/α=const; -(dis/dixα)T, ϑ=(dis/dip)xα,ϑ;
IV równanie Maxwella;
dg*=-sdT+ϑdp-Σ(y)(α=1)(xα*dFα); a) Fα=const; (diϑ/diT)p=(dis/dip)T; b) Fi=/α=const; (dis/diFα)T, p=(dixα/diT)Fα, p;
Dławienie;
Jest to przemiana nieodwracalna polegająca na spadku ciśnienia bez wykonania pracy.
Efektywna sprawność termiczna;
Nazywamy stosunek masowej gęstości zasobu pracy efektywnej do wartości opałowej paliwa ηet=le/Wu=ηm*ηt.
Efekt zjawiska Joule'a - Thomsona;
Zjawisko to wiąże się z odstępstwem gazu rzeczywistego od praw obowiązujących dla gazu doskonałego;
u=(diT/dip)i=((dii/dip)T)/(dii/diT)p=-1/Cp(diu/dip)T+(dipϑ/dip)T
Energia wewnętrzna gazu doskonałego;
u=CϑT+a; a=-CϑTo; półdoskonałego: u=∫(całka w granicach od To do T)CϑdT=Cϑ(T-To);
Cϑ- średnie ciepło właściwe przy stałej objętości.
Emisyjność ε;
Nazywamy stosunek gęstości strumienia emisji zasobu energii promieniowania ciała RT do gęstości strat emisji zasobu m promieniowania ciała doskonale czarnego RTo:ε=RT/RTo
Podaj definicję objętościowej gęstości zasobu skł. mieszaniny
Przechodząc od średniej wartości objętości gęstości zasobu (Ws), masowej gęstości zasobu(Wϑ) oraz parcjalnej gęstości zasobu (WK) do granicy pozornej limf otrzymujemy objętościową gęstośc zasobu: 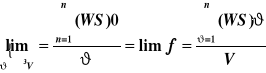
Bilans energii wewnętrznej dla układu zamkniętego
I zas. term. jest substancjalnym bilansem energii wewnetrznej przeprow. w warunkach odwracalności procesu termodynamicznego, czyli w warunkach równowagi termodynamicznej procesu przebiegającego bez tarcia. Innymi słowy I zas. term. jest substancjalnym bilansem energii wewnętrznej dla procesów kwazistatycznych przebiegających bez tarcia. dU=dQ-dL; di=dq+Vdp
Wyprowadzić II równ. Maxwella
di*=tds+ϑds-Σ(xα*dtα) stąd mamy
(∂T/∂p)s=(∂
Wymień punkty jaki powinien spełniać gaz doskonały
1)cząsteczki gazu mają rozmiar punktów materialnych 2) objetość zajmowana przez cząsteczki gazu jest pomijalnie mała 3) cząsteczki gazu wykazują cechy doskonale sprężystych kulek znajdujących się w ciągłym przypadkowym chaotycznym ruchu powodującym zderzenia między sobą 4) między cząsteczkami gazu nie występują żadne inne oddziaływania poza zderzeniami 5) bezpośrednią miarą temperatury gazu jest średnia energia kinetyczna jego cząsteczki
Entalpia gazów rzeczywistych
![]()
Kinetyczna teoria promieniowania
Każda powierzchnia zewnętrzna czoła o temperaturze wyższej od temperatury czoła bezwzględnego wypromieniuje ciepło w postaci fal elektromagnetycznych. Główna część promieniowania przypada na podczerwień tzn. na długość fal leżącą w zakresie 0,7-100 μm
Koncentracja składnika mieszaniny
Definiujemy jako stosunek objętościowej gęstości zasobu masy składnika mieszaniny do objętościowej gęstości zasobu masy mieszaniny Ci=pi/p
Koncentracja molowa składnika mieszaniny
Cni=pni/pn ; Suma wszystkich objętościowych gęstości zasobu ilości moli składu mieszaniny równa jest objętościowej gęstości zasobu ilości moi mieszaniny
Kwantowa hipoteza PLANCA
Średnia energia promieniowania En modułu promieniowania o częstotliwości v ( długość fal λ ) przypadająca na poziom energetyczny En przyjmuje wartość En=f(En)En=EnBexp(-En/kT)
Prawo AVOGADRA
W jednakowych objętościach znajduje się taka sama liczba cząstek dowolnego gazu doskonałego jeśli ciśnienia i temperatury tych gazów,są,jednakowe. M1=n1M1; m2=n2M2; n-liczba cząstek gazu; M-masa cząsteczkowa; m-masa; MR=B - uniwersalna stała gazowa
Prawo przesunięć VIENNA
λmT=hc/k4,965=σw; Prawo to głosi, iż odwrotnie proporcjonalna zależność długości fali λm od temperatury T opisuje ilościowo mechanizm przesunięcia się maksimum rozkładu widmowego objętościowej gęstości zasobu energii monochromatycznego promieniowania elektromagnetycznego ελ(λ) w miarę wzrostu temperatury w stanie fal krótszych
Prawo przesunięć VIENNA
Vienn wykazał że funkcja rozkładu widmowego objętościowej gęstości zasobu energii promieniowania elektromagnetycznego w modalnym polu długości fal εr(λ) powinna mieć postać εr(λ)=(1/λ5)f(λT) ; εr(λ)=(c1/λ5)exp(-c2/λT)
Prawo LAMBERTA
Intensywność promieniowania Ig (światłość) w kierunku tworzących kąt α z normalną do płaszczyzny promieniującej jest równa intensywności promieniowania w kierunku normalnych do promieniującej pomnożonych przez cosα ; Iα/Io=cosα. Jeżeli RTα- gęstość strumienia energii tworzy z kierunkiem tworzącym kąt α z normalną do promieniującej powierzchni d∧2S1 to możemy wyrazić że Iα=d2RT1/d2w; gdy α=0 to Io=d2RT1/d2w
Prawo STANÓW ODPOWIEDNICH
Jeżeli dwa czynniki różne mają dwa parametry zredukowane to trzeci ich parametr zredukowany musi być taki sam
Prawo BOYE'MARIOTTEA'A
Prawo to mówi, że przy stałej temperaturze iloczyn ciśnienia przez objętość właściwą jest wielkością stałą, tzn p1V1=p2V2 jeśli p1 i V1 oznaczają parametry w stanie 1, a p2,V2 w stanie 2, przy czym temperatura w obu tych stanach jest taka sama
Prawo DALTONA
Ciśnienie całkowite p fazy gazowej wieloskładnikowej badanej mieszaniny gazów doskonałych jest ciśnieniem jakie wywierałby gaz doskonały jednoskładnikowy mający następujące parametry : temperatura T równej temperaturze fazy gazowej wieloskładnikowej nazywaną objętościową gęstością zasobu ilości moli ρn równa sumie objętościowej gęstości zasobu ilości moli składników mieszaniny ρni ; p=Σ(i=1)ρniBT
Prawo PROMIENIOWANIA PLANCA
dε(λ)=8Phcdλ/(λ(exp(hc/λkt)-1))
Praca internijna Li
Jest to ta część pracy wykonanej wewnątrz układu ograniczonego osłoną poprowadzoną wzdłuż ścian wewnętrznych maszyny, która przekazywana jest na zewnątrz układu.
Li=Lwo-Lfwir ; Li=Lwk-Lfti ; Li=L-Lf ; Le=Li-Lm
Przemiana izentropowa
s=const; q=0; q'=0; dq'=0; ds.=(dq+dq')/T=0, całkując otrzymujemy że: s2-s1=0.
Urządzenie przepływowe
dU=-dQfot + dLt + (id-iw)dm-dl lub dU'=-dQf+(id - iw)dm - d(l-lf)
dU=-dQot + (id-iw)dm-dli
Praca obiegu odwracalnego i nieodwracalnego
Odwracalny prawo bieżny : Lob =Lex-Lk
Odwracalny lewo bieżny : Lob =Lk-Lex
Nieodwracalny prawo bieżny : Lobn=Lob-Lfob
Nieodwracalny lewo bieżny : Lobn=Lob+Lfob
Energia wewnętrzna gazu doskonałego
dqv=du=cvdT ; u=cv(T-T0) ; u=cvT+a ; a=-cvT0
Energia wewnętrzna gazu półdoskonałego
cv'=(∫(oznaczona od T0 do T)cvdT0)/T-T0 ; dqv=du=cvdT
Prawo Bouguera-Lamberta.
Prawo to dotyczy ośrodków częściowo przeźroczystych i jest wynikiem zbilansowania strumienia emisji zasobu energii promieniowania Q' w obszarze elementarnego przyrostu trzeciego rzędu objętości d3V ośrodka częściowo przeźroczystego oddalonego od elementarnego przyrostu drugiego rzędu objętości d2A powierzchni emitującej A o odległości r.
Sprężarka idelna
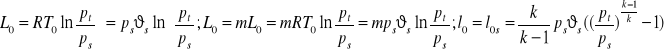
Przemiana adiabatyczna
q=0; q'≠0; p1V1k=p2V2k=const. CrdT+pdV=0 Δl=u1-u2=cv(T1-T2)=[1/(k-1)] R(T1-T2)=[1/(k-1)](p1V1-p2V2)
(p2V2)/(p1V1)=RT2/RT1=T2/T1=(p2/p1)^(k-1)/1;Δl=(p1V1)/(k-1)[1-(p2/p1)^(k+1)/1]=RT1/(k-1)[1-(p2/p1)^(k-1)/k
Δlt/Δl=(l1-l2)/(u1-u2)=[cp(T2-T1)]/[cv(T2-T1)]= cp/cv=k ; Δlt=(kRT1)/(k-1)[1-(p2/p1)^(k-1)/1]
Przemiana politropowa
![]()
p1V1n=p2V2n=const ; c=dq/dT = const; cdT-cvdT-pdV=0 ; dq= cvdT+pdV
Przemiana izochoryczna
V=const,dv=0,qv2-qv1=u2-u1=Cv(T2-T1), ds.=dqv/T=du/T=VdT/T
p1/p2=T2/T1 ,S2-S1=Cvln(T2/T1)
Przemiana izobaryczna
p=const, dp=0,dl-pdV, qv1-qv2=i2-i1=Cv(T2-T1)
L2-L1=p(V2-V1) , dLT=-Vdp=0, ds.=dqp/T=di/T=CpdT/T, S2-S1=Cpln(T2/T1)
Przemiana izotermiczna
T=const ,dT=0 ∇L=∫v2v1pdV=∫v2v1P1V1dV/V= P1V1ln(V2/V1)=RTln(V2/V1)
ds=dqT/T , S2-S1=RTln(V2/V1)
Ciepło reakcji
-Qr=U2-U1; F=U-Ts; dF=dU-TdS-SdT=dU=TdS-pdV; dF=-pdV-SdT; Lvmax=-Qr+T((δF2/δT)v-(δF1/δT)v);
![]()
Sprawność sprężarki
ηv=a/b ; ηsc=To/Tb ; ηi=(Lo/Li) ; ηis=(Los/Li) ; ηiT=(Lot/Li) ; ηiT=0.6÷0.75
Model doskonały tłoczni przepływowej
Skład się maszyny a się z : cylindra zaopatrzonego w 2 zawory diw, tłoka, mechanizmu korkowego, 2 przewodów przez które dopływa czynnik.
Lin=Lwk=Pwk*∇sk
Pwk Lk/Nk
Wielkość ekstensywna- wielkość geometryczna lub fizyczna, której zasób w obszarze złożonym z sumy podobszarów, równy jest zasobom we wszystkich podobszarach. Wyróżnia się podzbiór wielkości substancjalnej (WS) oraz podzbiór wielkości kompensacyjnej ( WK).
Obszar substancjalny - obszar zawierający stale te same elementy substancji ( w sensie fenomenologicznym); brak przepływu masy przez granice.
Obszar komponencjalny - obszar pokrywający się z obszarem substancjalnym zawierający mieszaninę jako całość, w którym prędkość refencjalna zastępuje prędkość komponencjalną ( obszarów komponencjalnych jest tyle ile składników). WS lub WK, która wypełnia obszar objętości V jest sumą dyskretnego zbioru najmniejszych porcji tychże wielkości.
Przemiany quasistatyczne - przemiany graniczne, w których temperatury i siły zewnętrzne są mało różne od temperatur i sił własnych układu.
Masowa gęstość zasobu entalpii i = u + pV
Zależność na ciepło właściwe cv( T, v) = cv( t) + Tsλ ' |( δ2p/δT2)vdV
Równanie Bernouliego - całkowity bilans energii poruszającego się gazu z prędkością substancjalną ![]()
εI + psυ + (u2/α) = const , εI - masowa gęstość zasobu energii wewnętrznej gazu
Prawo izobary Gay-Lussaca - określa ilość gazu znajdującego się pod stałym ciśnieniem rozszerzającym się przy każdym wzroście temperatury o 1°C i tę samą objętość
ρ,m = const , V/V
Prawo izochory G.-L. - ciśnienie pewnej ilości gazu znajdującego się w stałej objętości przy zmianie temperatury o 1° ulega zmianie w temp. 0°C
pv,m = p0 + βp0T ( β - term. współczynnik prężności)
Prawo Avogadra -jednakowa objętość różnych gazów w tej samej temperaturze i pod tym samym ciśnieniem zawierają tą sama liczbę cząstek
Prawo Daltona -ciśnienie wywierane przez mieszaninę gazu = sumie ciśnień
cząstkowych jakie wywierałyby poszczególne składniki mieszaniny gdyby
osobno zajmowały ta samą objętość
![]()
Zasada Cartheodory'ego -substancjalny bilans masowej gęstości zasobu energii wewnętrznej dla przemiany quasistatycznej
dq=du+pdv=pdv+Σ(Fαdxα)
dla procesu nieodwracalnego
du = dq + dqp= pdV + Σ( Fαdxα)
Równanie Gibsa - du = Tds - pdV + Σ( Fαdxα)
Równanie Gibsa-Helmholtza![]()
- wiąże ciepło reakcji z pracą maksymalną reakcji chem.
Lmax = Fα-F1= u2-u1-T(s2-s1)
Równanie stanu Dieteredego - P(V-α) = Rt exp(-Q/RTυ)α = υu/2
Postać zredukowana π(2ϕ-1) = t exp2(1-1/ϕτ)
Równanie Berthelota - RT = (p+a/Tυ2)(υ-α) , α=Vk/3 ; Postać zredukowana (π+16/3Tϕ3)(ϕ-0.25)=32t/9
Równanie Mayera - Ciśnienia cp-cv = T(R/ν)(R/p)=R , k=cp/cv
psr=ps+po; pc=ps+pd; pca=psa+pd pd=(U2/α)ρ
Teromat
Lmax=-Q+T(dLmax- LmaxdT)/dt (TdLmax-LmaxdT)/T2 =Q/T2 d(Lmax/t)=QdT/T2
Lmax/T=∫(QdT+C)/T2 -(dQ/dT)T→0=(dLmax/dT)T→0
LimT→0(Lmax/dT)=Lim(Lmax+Q0)/q
Ciepło właściwe gazów rzeczywistych przy
Stała objętość du=(∂u/∂T)vdT+(∂u/∂v)TdV , dq=(∂u/∂T)vdT+((∂u/∂T)T+p)dv
C=dq/dT=TdS/dT=(du+pd)/dT, Cv=Cv(T,V)=dqv/dT=(∂u/∂T)V
ds=CvdT/T+(∂p/∂T)VdV
stałe ciśnienie C=Cp(T,p)=dqp/dT=T(∂S/∂T)p (∂S/∂T)p=Cp/T
Entropia gazów rzeczywistych
ds=CpdT-(∂V/dT)pdp ,S(T,p)=S(T0,p0)T+∫TTo CpdT/T-∫PP0(∂S/∂T)dp
S(T,p)= S(T0,p0)T+∫TTo CpdT/T-Rln(p/p0)
Energia wewn gazów rzeczywistych
du=Tds-pdV dS=CvdT/T+(∂p/∂T)VdV, ,du= Cv(T,V)dT+(T(∂p/∂T)V-p)dv
T(∂p/∂T)V=(RT/v)-p , u(T,V)=u(T0+∫TToCv(T)dT
Entalpia gazów rzeczywistych
di=Tds+Vdp ds.=CpdT/T-((∂V/∂T)pdp di=Cp(T,p)dT-T-(∂V/∂T)p-V)dp
i(T,p)=i(To) +∫TTo Cp(T)dT
Efekt zjawiska Joula'e-Thomsona
μ=(∂T/∂p)i=-(∂i/∂p)T/(∂i/∂T)p=-((∂u/∂p)T+(∂(pv)/∂p))T/Cp
![]()
![]()
![]()
Wyszukiwarka
Podobne podstrony:
Studia slajdy1
Studia slaidy
oszustwa studia cywilne
Mazowieckie Studia Humanistyczn Nieznany (11)
Mazowieckie Studia Humanistyczne r2001 t7 n2 s157 160
Mazowieckie Studia Humanistyczne r1996 t2 n1 s165 173
Mazowieckie Studia Humanistyczne r1998 t4 n1 s79 101
Mazowieckie Studia Humanistyczn Nieznany (14)
Mazowieckie Studia Humanistyczne r1997 t3 n1 s290 292
Mazowieckie Studia Humanistyczne r1996 t2 n1 s113 126
Mazowieckie Studia Humanistyczne r2002 t8 n2 s109 114
eis 2002 10 adaptacja akustyczna domowego studia
Krwawienie, studia pielęgniarstwo
fotosynteza i metabolizm-ściąga, Pomoce naukowe, studia, biologia
akademia dobrych manier scen, Studia PO i PR, przedszkolaki, scenariusze konspekty
piacent pliocen Neogen, StUdiA
czad, studia I i II stopnia, ochrona środowiska
więcej podobnych podstron