Nr ćwicz. 1
|
07.03.07 |
|
Wydział Technologii Chemicznej |
Semestr II |
Grupa D |
||
|
|
Dr Z. Świt
|
przygotowanie |
wykonanie |
Ocena ostatecz. |
||
SKALA PH
1. Do kolbki miarowej o pojemności 25 cm3 wprowadzono pipetą 2,5 cm3 1 M roztworu
HCl i dopełniono wodą destylowaną do kreski i po wymieszaniu roztwór wylano do zlewki na 25 cm3. Z tak przygotowanego 0,1 M roztworu HCl pobrano 2,5 cm3 i przeniesiono roztwór do kolbki miarowej na 25 cm3 i uzupełniono wodą destylowaną do kreski; otrzymano roztwór o stężeniu 0,01 M. W ten sam sposób przygotowano roztwory o następujących stężeniach 0,001 M; 0,0001 M; 0,00001 M HCl.
Przed przystąpieniem do pomiarów skalibrowano pH-metr .
Te same czynności powtórzono z roztworem 1 M NaOH .
W ten sam sposób przygotowano i zmierzono pH dla roztworu 0,1 M CH3COOH i roztworów o następujących stężeniach 0,001 M; 0,0001 M; 0,00001 M.
Do dwóch zlewek o pojemności 50 cm3 wprowadzono po 10 cm3 roztworu 0,1 M HCl i 5 kropli wskaźnika (błękitu bromotymolowego, do drugiej fenoloftaleiny). Następnie mieszając dodawano powoli roztwór 0,1 NaOH początkowo po 2 cm3, później mniejsze porcje jednocześnie mierząc pH roztworu w pobliżu punktu zmiany barwy wskaźnika. Dla usprawnienia wykonania ćwiczenia, przeprowadzono próbę wstępną, dodając wodorotlenek sodu w sposób ciągły kroplami i odczytano objętość wodorotlenku przy której nastąpiła zmiana barwy wskaźnika.
Opracowanie wyników
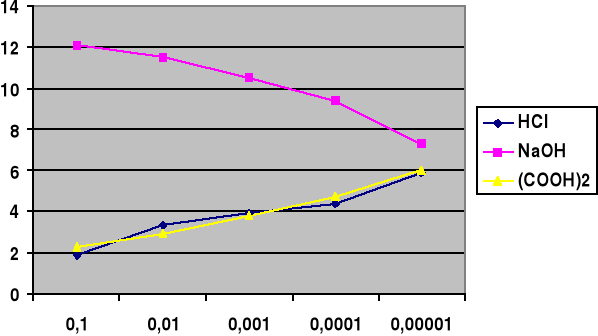
Stężenie molowe kwasu: |
0,1 |
0,01 |
0,001 |
0,0001 |
0,00001 |
|
pH |
1,85 |
3,32 |
3,91 |
4,36 |
5,92 |
|
Stężenie molowe zasady: |
0,1 |
0,01 |
0,001 |
0,0001 |
0,00001 |
|
pH |
12,1 |
11,5 |
10,5 |
9,4 |
7,3 |
|
Stężenie molowe kwasu: CH3COOH |
0,1 |
0,01 |
0,001 |
0,0001 |
0,00001 |
|
pH |
2,25 |
2,9 |
3,8 |
4,7 |
6 |
|
Nazwa wskaźnika |
Barwa w roztworze |
Barwa w roztworze |
Przedział pH zmiany |
Błękit bromotymolowy |
żółty |
niebieski |
3,23-10,87 |
Fenoloftaleina |
Bezbarwny |
malinowy |
3,10-8,82 |
Brönsteda teoria kwasów i zasad, teoria sformułowana w 1923 w myśl, której kwasem jest substancja mogąca oddawać protony, natomiast zasadą - substancja, która ma zdolność przyłączania protonów.
Kwas oddając proton, przechodzi w sprzężoną z nim zasadę. Reakcja przeniesienia protonu wymaga obecności w układzie dwóch par sprzężonych kwasów i zasad, jedną z nich może stanowić kwasowa i zasadowa forma rozpuszczalnika protolitycznego.
Właściwości rozpuszczalnika wpływają na moc rozpuszczonego kwasu lub zasady. Teoria ta upraszcza i ujednolica opis wszelkich reakcji związanych z przeniesieniem protonu.
Wnioskując, mocne kwasy dysocjują całkowicie, dlatego w roztworze znajdują się różne aniony reszt kwasowych zdolne do przyjęcia protonów.
Wykres do polecenia 1.1:
Stężenie molowe kwasu: |
0,1 |
0,01 |
0,001 |
0,0001 |
0,00001 |
|
pH |
1,85 |
3,32 |
3,91 |
4,36 |
5,92 |
|
Stężenie molowe zasady: |
0,1 |
0,01 |
0,001 |
0,0001 |
0,00001 |
|
pH |
12,1 |
11,5 |
10,5 |
9,4 |
7,3 |
|
Stężenie molowe kwasu: CH3COOH |
0,1 |
0,01 |
0,001 |
0,0001 |
0,00001 |
|
pH |
2,25 |
2,9 |
3,8 |
4,7 |
6 |
|
Wyszukiwarka
Podobne podstrony:
Skala pH, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Cw1 Skala pH, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
Hydroliza soli i pH roztworów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
sciaga na egzmin, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki
sprawko z osadów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organic
6!!!!!!!!!, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
hydroliza, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemia - I
sprawko cw1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
sprawozdanie z cw 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
Odczyn roztworów wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
redoksy part1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Badanie substancji błonotwórczych, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.che
Cw12 Rozdzial przez stracanie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
ćw.5 Ania, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
więcej podobnych podstron