grupa 6
Bartłomiej Pająk,
Mateusz Wiechetek,
Maciej Korkuć,
Łukasz Szarek,
Maciej Biedruna,
Michał Birek
Temat: Analiza wybranych grup mikroorganizmów występujących w powietrzu. Analiza mikrobiologiczna wody.
Cel: Celem doświadczenia było przeprowadzenie oceny stopnia zanieczyszczenia powietrza (w sali oraz na korytarzu pod względem mikrobiologicznym) oraz wody (poprzez zbadanie ogólnej liczby bakterii mezofilnych i psychrofilnych oraz wskaźników zanieczyszczenia kałowego - bakterii Escherichia coli).
Sposób wykonania:
Powietrze było badane w sali oraz na korytarzu. Doświadczenie przeprowadziliśmy dwoma metodami:
a)
Metoda sedymentacyjna polega na opadaniu z powietrza mikroorganizmów na podłoże stałe w określonym czasie.
Szalki położyliśmy w odpowiednim miejscu do badania i zdjęliśmy wieczka. Pozostawiliśmy na okres 10 minut szalki z agarem odżywczym oraz na 30 minut pozostałe płytki. Następnie szalki te zostały poddane inkubacji.
b)
Metoda zderzeniowa polega na wychwytywaniu mikroorganizmów w wyniku działania siły uderzeniowej określonej objętości powietrza, skierowanej na podłoże.
W naszym przypadku użyliśmy 100 l powietrza w ciągu 60 sekund. Szalki zostały później poddane inkubacji.
bakterie |
temeperatura |
podłoże |
czas hodowli |
psychrofilne |
20-22˚C |
agar odżywczy |
3 dni |
mezofilne |
37˚C |
agar odżywczy |
1 dzień |
gronkowce |
37˚C |
Chapmana |
1-2 dni |
grzyby |
26˚C |
Sabouraud |
6 dni |
promieniowce |
26˚C |
Pochona |
6 dni |
Nasza analiza obejmowała wodę powierzchniową, którą pobrano wcześniej z zalewu w Skierniewicach. Badanie ogólnej liczby bakterii psychrofilnych i mezofilnych przeprowadziliśmy, stosując posiew głębinowy. Wykonaliśmy szereg rozcieńczeń od 10-3 do 10-6. Pozostawiliśmy bakterie do inkubacji (bakterie psychrofilne - temp. 20°C, 72 h; mezofilne - temp. 37°C, 24 h).
Do badania występowania bakterii grupy coli sporządziliśmy podwójny szereg rozcieńczeń badanej wody (10-1 - 10-6), a następnie wykonaliśmy posiew na podłoże laktozowe z purpurą bromokrezolową. Zaszczepione podłoże postawiono do inkubacji w temp. 37°C.
Zestawienie i omówienie wyników:
Tydzień po przeprowadzonej analizie powietrza obejrzeliśmy otrzymane wyniki. Policzyliśmy ilość powstałych kolonii. W przypadku metody zderzeniowej poprawiliśmy otrzymane wyniki, zgodnie z tabelą, dołączoną do aparatu Mercka. Następnie zamieściliśmy otrzymane ilości kolonii bakterii w tabeli:
|
sala |
korytarz |
||
metoda |
sedymentacyjna |
zderzeniowa |
sedymentacyjna |
zderzeniowa |
ogólna liczba bakterii |
37 |
439 |
46 |
1187 |
psychrofilne |
26 |
151 |
25 |
191 |
-sporowe |
4 |
4 |
1 |
6 |
-pigmentowe |
13 |
127 |
14 |
151 |
mezofilne |
11 |
174 |
21 |
337 |
gronkowce |
20 |
25 |
10 |
25 |
promieniowce |
5 |
0 |
1 |
2 |
pleśnie |
9 |
61 |
5 |
22 |
drożdże |
1 |
3 |
10 |
5 |
Następnie zajęliśmy się obliczeniem ilości mikroorganizmów w 1 m3 badanego powietrza. Dla metody sedymentacyjnej policzyliśmy ją według wzoru:
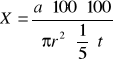
gdzie:
X - ilość mikroorganizmów w 1m3 powietrza,
a - średnia ilość kolonii na powierzchni podłoża,
![]()
-powierzchnia płytki płytki Petriego w cm2,
![]()
=3,14*(4,5)2=63,585cm2
t - czas ekspozycji w minutach
Oto otrzymane końcowe wyniki ilości mikroorganizmów w 1 m3 powietrza:
|
sala |
korytarz |
||
metoda |
sedymentacyjna |
zderzeniowa |
sedymentacyjna |
zderzeniowa |
ogólna liczba bakterii |
2909 jtk/m3 |
4390 jtk/m3 |
3617 jtk/m3 |
11870 jtk/m3 |
psychrofilne |
2045 jtk/m3 |
1510 jtk/m3 |
1966 jtk/m3 |
1910 jtk/m3 |
-sporowe |
315 jtk/m3 |
40 jtk/m3 |
79 jtk/m3 |
60 jtk/m3 |
-pigmentowe |
1022 jtk/m3 |
1270 jtk/m3 |
1101 jtk/m3 |
1510 jtk/m3 |
mezofilne |
865 jtk/m3 |
1740 jtk/m3 |
1651 jtk/m3 |
3370 jtk/m3 |
gronkowce |
524 jtk/m3 |
250 jtk/m3 |
262 jtk/m3 |
250 jtk/m3 |
promieniowce |
131 jtk/m3 |
0 jtk/m3 |
26 jtk/m3 |
20 jtk/m3 |
pleśnie |
236 jtk/m3 |
610 jtk/m3 |
131 jtk/m3 |
220 jtk/m3 |
drożdże |
26 jtk/m3 |
30 jtk/m3 |
262 jtk/m3 |
50 jtk/m3 |
Na kolejnych zajęciach po wykonaniu doświadczenia zliczyliśmy ilość kolonii bakterii
na szalkach:
rozcieńczenie |
10-6 |
10-5 |
10-4 |
10-3 |
|
Ogólna liczba bakterii |
psychrofilne |
5 |
2 |
9 |
7 |
|
mezofilne |
0 |
0 |
0 |
2 |
Możemy zauważyć, że w wynikach wykonania posiewu nie został zachowany właściwy stosunek pomiędzy ilością bakterii na kolejnych posiewach. Mogło to być spowodowane błędem przy odmierzaniu pobieranej cieczy lub złym zliczaniem. Do obliczania ilości mikroorganizmów w 1 ml skorzystałem ze średniej wartości przy rozcieńczeniu 10-5 i 10-4 dla bakterii psychrofilnych i ilości kolonii bakterii przy rozcieńczeniu 10-3 dla bakterii mezofilnych.
ilość bakterii psychrofilnych: (200000+90000)/2= 1,45*105 jtk/ml
ilość bakterii mezofilnych: 2*103 jtk/ml
W przypadku badania występowania bakterii grupy coli za wynik pozytywny uznawaliśmy pojawienie się gazu w rurce Durhama oraz zmianę barwy z fioletowej na żółtą, będącą wynikiem zakwaszenia. Oto otrzymane wyniki:
Rozcieńczenie |
10-1 |
10-2 |
10-3 |
Wynik w 1 szeregu rozc. |
+ |
- |
- |
Wynik w 2 szeregu rozc. |
+ |
- |
- |
Następnie dokonaliśmy odczytu ( 2-0-0) NPL w 100 cm3 i miana coli:
NPL = 23*100=2300
Miano coli =4
Wykonaliśmy również test szybki w temp. 44°C dla próbki z wynikiem pozytywnym i pierwszej z wynikiem negatywnym w celu wykrycia bakterii coli typu kałowego (Escherichia coli) . Materiał z wyżej wymienionych hodowli przesialiśmy na podłoże płynne z zielenią brylantową oraz na wodę peptonową z tryptofanem. Do hodowli dodaliśmy po ściance próbówki kilka kropel odczynnika Ehrlicha-Böhme'a. Po chwili w próbówce o wyniku pozytywnym zaobserwowaliśmy pojawienie się na granicy płynów czerwonego zabarwienia, co świadczyło o obecności indolu.
Wynik NPL oraz miana coli jest identyczny, w przypadku bakterii grupy coli, jak i bakterii grupy coli typu kałowego.
Wnioski i uwagi:
Stężenie zsumowanych bakterii i grzybów w sali metodą sedymentacyjną wynosi 3,826*103 jtk/m3, metodą zderzeniową 5,280*103 jtk/m3, natomiast na korytarzu metodą sedymentacyjną 4,298*103 jtk/m3 i zderzeniową 1,241*104 jtk/m3. Łatwo możemy zauważyć, że metoda zderzeniowa jest dużo dokładniejsza niż sedymentacyjna, ponieważ potrafi wykryć więcej mikroorganizmów. Stężenie mikroorganizmów chorobotwórczych na korytarzu jest większe niż w sali. Porównując nasze wyniki z normą Krzysztofika 1992, w której ogólna liczba mikroorganizmów MPA wynosi 2,0*103, zauważymy, że nasze wartości są od niej większe. Podobnie dla normy Topley'a 1955 (najwyższe dopuszczalne stężenie w szkołach powinno wynosić 2,825*103 CFU/m3) nasze wyniki są za duże. Jednak nasze wartości znajdują się w przedziale 1,0*103 do 1,0*104 CFU/m3, zgodnie z normą Lucey'a 1988 o powietrzu niezanieczyszczonym. Jedynie stężenie na korytarzu liczone metodą zderzeniową jest minimalnie zawyżone. Jak widzimy, wszystko zależy od interpretacji zanieczyszczenia przez autorów norm.
Wartość dopuszczalna liczby bakterii Escherichia coli na 100 ml w zbiornikach wodnych wynosi 1000. Określona przez nas wartość NLP = 2300 przekracza tą wartość, co oznacza, że nie wolno nam się kąpać w tym zbiorniku.
4
Wyszukiwarka
Podobne podstrony:
1 sprawko, IŚ Tokarzewski 27.06.2016, III semestr, Biologia i ekologia, Biologia - lab, Biologia
opory, IŚ Tokarzewski 27.06.2016, III semestr, Mechanika płynów, mechanika plynow XYZ, MOJE, poprawi
sprawko metacentrum, IŚ Tokarzewski 27.06.2016, III semestr, Mechanika płynów, mechanika plynow XYZ,
sowa odp, IŚ Tokarzewski 27.06.2016, III semestr magister, Realizacja wymaganej jakości powietrza w
Wszystkie pytania - Wasikowski, IŚ Tokarzewski 27.06.2016, III semestr, Meteorologia, Zaliczenie
Rachunek błędów, IŚ Tokarzewski 27.06.2016, III semestr, Mechanika płynów, Laboratoria (sprawozdania
Projekt numeryczny, IŚ Tokarzewski 27.06.2016, III semestr, Informatyka (Matlab), Projekty, Matlab -
Zespol pomp final, IŚ Tokarzewski 27.06.2016, III semestr, Mechanika płynów, Laboratoria (sprawozdan
Zespol pomp, IŚ Tokarzewski 27.06.2016, III semestr, Mechanika płynów, Laboratoria (sprawozdania), L
Filtrowanko, IŚ Tokarzewski 27.06.2016, III semestr, Mechanika płynów, Laboratoria (sprawozdania), L
2014.11.12 stowarzyszenie i fundacja, IŚ Tokarzewski 27.06.2016, III semestr, Hes (Podstawy prawodaw
Sprawozdanie 1 mechanika, IŚ Tokarzewski 27.06.2016, III semestr, Mechanika płynów, Laboratoria (spr
filtracja moja, IŚ Tokarzewski 27.06.2016, III semestr, Mechanika płynów, Laboratoria (sprawozdania)
hydrologia kolos, IŚ Tokarzewski 27.06.2016, III semestr, Hydrologia, Nieposegregowane, Hydro ściąga
Reynolds Sprawozdanie 1, IŚ Tokarzewski 27.06.2016, III semestr, Mechanika płynów, Laboratoria (spra
mp pytania, IŚ Tokarzewski 27.06.2016, III semestr, Mechanika płynów, Wykłady, Egzamin, Pytania
więcej podobnych podstron